地高辛标记探针的Southern 杂交
地高辛标记探针在Southern杂交分析中的技术要点

地高辛标记探针在Southern杂交分析中的技术要点地高辛标记探针在Sou thern杂交分析中的技术要点陆小平周文军(苏州大学生命科学学院江苏苏州215006)小岛峰雄(日本信州大学纤维学部)外源基因是否成功导入受体材料的基因组中,必须从转化植株中找到分子生物学的检测证据。
目前,PCR、Southern杂交等作为常用检测手段而被广泛采用。
虽然PCR技术可以快速得到结果,但是,以农杆菌介导的材料必须慎重这一结论,以免由于农杆菌污染造成假阳性。
而Southern分析由于操作程序繁琐,对植物基因组DNA的提取、纯化、酶切等技术要求较高,有时使杂交结果不甚理想。
我们在植物基因转化的研究中,对荞麦,桑树,紫景天,洋麻等基因组DNA的提取、纯化、酶切进行了探讨,对流程中的有关步骤进行技术改良,使酶切后的PNA在凝胶板上是涂布状完全达到了Southern杂交的技术要求,并用地高辛(D ig)标记探针对外源DNA进行分析,取到了较好的效果。
现简述如下∶1 植物基因组D NA的提取及纯化1)提取高纯度的DNA是Southern杂交的关键, DNA的粗提物中,往往含有大量的蛋白质、多糖、单宁、色素等大分子杂质。
这些杂质通常与DNA共同沉淀或与DNA聚合成大分子复合物。
一旦复合物形成,即便在以后的操作中用酚、氯仿多次纯化,也很难将其除去。
我们的经验是:当用液氮破碎新鲜样品的细胞壁后,先用蒸馏水洗脱两次(洗脱温度为42℃),每次5m in。
以达到洗脱多糖的目的。
每次洗脱后离心5m in(13000 r m in),弃去上层液。
该上层液中含有粘度较高的胶状体,其主要成分可能是粘性多糖。
在提取桑树基因组DNA时,最好用叶柄或幼茎、幼叶作提取材料。
在样品有限时,也可用成熟叶甚至老叶代替。
据C lark M S (1998)介绍,取样前对材料进行除淀粉处理(减少光照、黑暗处理24h),可以抑制多糖的污染。
但我们采用除淀粉处理后的实验结果并不理想,其效果远不及用蒸馏水洗脱。
分子生物学综合实验报告

分子生物学综合试验报告综合实验Ⅰ.Southern杂交(质粒DNA提取、PCR技术体外扩增DNA、质粒载体和外源DNA的连接反应、地高辛标记的Southern杂交)一.实验目的1.学习Southern杂交的原理及操作方法。
2.学习碱裂解法提取质粒的原理。
3.学习PCR反应的基本原理和实验技术;了解引物设计的一般要求。
4.掌握DNA体外连接的基本技能,了解连接反应的注意事项。
二.实验原理利用染色体DNA与质粒DNA的变性与复性的差异而达到分离的目的。
在碱变性条件下,染色体DNA的氢键断裂,双螺旋解开而变性,质粒DNA氢键也大部分断裂,双螺旋也有部分解开,但共价闭合环状结构的两条互补链不会完全分离,当pH=的乙酸钠将其pH调到中性时,变性的质粒DNA又恢复到原来的碱裂解法提取质粒的主要原理是:利用染色体DNA与质粒DNA的变性与复性的差异而构型,而染色体DNA不能复性,形成缠绕的致密网状结构,离心后,由于浮力密度不同,染色体DNA与大分子RNA、蛋白质-SDS复合物等一起沉淀下来而被除去。
聚合酶链反应(PCR)是体外酶促合成DNA片段的一种技术,PCR进行的基本条件:DNA模板(在RT-PCR中模板是RNA)、引物、dNTP(dATP、dTTP、dGTP、dCTP)、Taq DNA聚合酶、反应缓冲体系。
PCR循环由三个步骤组成:变性、退火、延伸。
每一个循环的产物可作为下一个循环的模板,通过30个左右循环后,目的片段的扩增可达106倍。
DNA片段之间的连接是通过DNA连接酶的催化实现的。
DNA连接酶催化具有平末端或互补粘性末端的DNA片段间相邻碱基通过3’,5’磷酸二酯键连接起来。
最常用的来源于T4噬菌体的T4DNA连接酶。
对于平末端或互补的粘性末端可直接进行连接反应。
一个片段是平末端,另一片段为粘性末端或两个片段都是粘性末端但不配对,则需要通过各种方式使其可一匹配或通过平末端进行连接。
通常采用末端补平、加同聚物尾、加接头等方式是目的片段之间能够匹配。
地高辛标记探针的Southern杂交
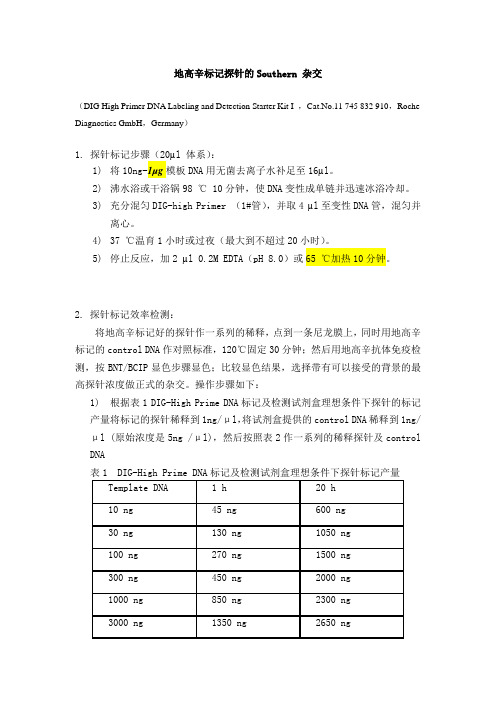
地高辛标记探针的Southern 杂交(DIG High Primer DNA Labeling and Detection Starter Kit I ,Cat.No.11 745 832 910,Roche Diagnostics GmbH,Germany)1. 探针标记步骤(20µl 体系):1)将10ng-1µg模板DNA用无菌去离子水补足至16µl。
2)沸水浴或干浴锅98 ℃ 10分钟,使DNA变性成单链并迅速冰浴冷却。
3)充分混匀DIG-high Primer (1#管),并取4 µl至变性DNA管,混匀并离心。
4)37 ℃温育1小时或过夜(最大到不超过20小时)。
5)停止反应,加2 µl 0.2M EDTA(pH 8.0)或65 ℃加热10分钟。
2. 探针标记效率检测:将地高辛标记好的探针作一系列的稀释,点到一条尼龙膜上,同时用地高辛标记的control DNA作对照标准,120℃固定30分钟;然后用地高辛抗体免疫检测,按BNT/BCIP显色步骤显色;比较显色结果,选择带有可以接受的背景的最高探针浓度做正式的杂交。
操作步骤如下:1)根据表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针的标记产量将标记的探针稀释到1ng/μl,将试剂盒提供的control DNA稀释到1ng/μl (原始浓度是5ng /μl),然后按照表2作一系列的稀释探针及control DNA表1 DIG-High Prime DNA标记及检测试剂盒理想条件下探针标记产量表2)将上述稀释的2-9 号管的control DNA 及探针DNA各取1μl点膜3)120℃固定30分钟或紫外交链3-5分钟4)将膜放入装有20ml Maleic acid buffer 的塑料器皿中,室温振荡2分钟5)将膜放入10ml Blocking solution中室温温育30分钟6)将膜放入10ml Antibody solution 中室温温育30分钟7)用10ml Washing buffer 洗2次,每次15分钟8)在10ml Detection buffer 平衡2-5分钟9)将膜放入2ml 新配制的Color substrate solution 中暗室条件下显色。
southern杂交原理

southern杂交原理Southern杂交原理是一种分子生物学技术,常用于研究DNA序列。
它是由爱德华·南方(Edwin Southern)于1975年提出的,被广泛应用于DNA杂交等领域。
Southern杂交原理主要是通过将DNA样品与DNA探针杂交,然后用放射性同位素或化学荧光等方法检测杂交的情况,从而确定目标DNA序列的存在与否。
这一原理的核心是通过互补配对的碱基间形成稳定的双链结构,从而实现DNA的特异性识别与检测。
在Southern杂交实验中,首先需要提取待检测的DNA样品。
这可以通过细胞裂解、DNA纯化等方法来完成。
然后,将目标DNA序列与DNA探针进行杂交反应。
DNA探针是一段已知序列的DNA 片段,通常是标记有放射性同位素或荧光染料的单链DNA。
在杂交反应中,目标DNA序列与DNA探针通过互补配对的碱基结合在一起形成双链结构。
通过探针的标记物可以追踪杂交的情况。
放射性同位素通常用于探测杂交产物,而化学荧光则常用于非放射性检测。
完成杂交反应后,需要进行杂交产物的检测与分析。
对于放射性同位素标记的探针,可以通过放射性测量仪来检测杂交产物的放射性信号强度。
而对于化学荧光标记的探针,可以通过荧光显微镜或荧光成像仪来观察和记录荧光信号。
Southern杂交原理的应用非常广泛。
例如,它可以用于检测特定基因的存在与表达情况,研究基因组结构与功能,鉴定DNA的来源,进行亲缘关系分析等。
此外,Southern杂交还可以与其他分子生物学技术相结合,如聚合酶链反应(PCR),构建DNA文库等,进一步拓展其应用范围。
Southern杂交原理是一种重要的分子生物学技术,通过DNA的互补配对和标记物的检测,实现了对目标DNA序列的高度特异性识别与检测。
它在基础研究、临床诊断、法医学等领域具有广泛的应用前景,为科学研究和医学诊断提供了有力的工具和方法。
southern印迹杂交名词解释

southern印迹杂交名词解释Southern印迹杂交是生物学中一个重要的术语,它来源于美国生物学家Edwin Southern所发明的南方杂交技术。
这种技术通常用于DNA分子的检测与分析,在生命科学研究领域具有重要的应用价值。
1.什么是Southern印迹?Southern印迹,又称Southern blot,是一种通过琼脂糖凝胶电泳和酶解技术,将筛选出的DNA样本在膜上进行定向转移,并与特定探针杂交的技术,可以用于检测和分析目标DNA序列。
2.什么是杂交?杂交是指在DNA的两条链之间发生的配对作用。
它是生物学中基本的遗传现象,决定了每个个体的基因型和表型。
3.什么是南方杂交技术?南方杂交技术是一种高效的分子生物学技术,广泛用于分析DNA序列、检测特定基因等方面。
它利用核酸探针与目标DNA的互补配对关系,识别目标DNA序列。
在使用Southern blot技术时,DNA样品首先通过电泳将不同长度的DNA分离出来,然后将其转移到琼脂膜上。
接着,利用探针特异性杂交,标记目标DNA的特定区段。
最后,利用探针上的标记(如酶或荧光)将目标DNA区段从杂交物质中分离出来并检测,以获取样品的DNA序列和长度信息。
4. Southern印迹与Northern印迹、Western印迹有什么不同?Southern印迹用于检测已知DNA序列,与之对应的Northern印迹用于检测RNA序列,而Western印迹则是用来检测蛋白质。
三种印迹技术都是利用探针与目标分子的互补配对关系,识别目标分子,并将其从杂交物质中分离出来以便检测。
5. Southern印迹技术的应用Southern印迹技术具有广泛的应用价值。
它可以用于检测和鉴定病菌、遗传疾病、肿瘤等疾病相关基因,进行生物工程和基因工程的基因克隆和筛选,进行DNA序列测定和鉴定等。
不仅如此,该技术也可以应用于无机化学、有机化学、分析化学等领域。
总之,Southern印迹技术的出现和发展,促进了生命科学、医学和生物工程等领域的发展,也推动了DNA以及其他分子的检测和分析研究。
southern杂交

Southern杂交概述Southern杂交是一种常用于分析DNA序列和判定基因组结构的实验技术。
该技术由英国分子生物学家爱德华·南方于1975年首次提出,并以他的名字命名。
Southern杂交操作简单,适用于各种生物材料,被广泛应用于基因组学和分子生物学研究领域。
原理Southern杂交的原理基于亲和性结合和DNA互补碱基配对的特性。
该技术通过将待检测的DNA样品与一段标记的DNA探针进行杂交,通过探针与待检测样品DNA的配对形成稳定的双链DNA形式。
随后,通过探针上的标记进行检测,从而确定目标DNA序列的存在与否。
步骤Southern杂交主要包括以下几个步骤:1.DNA提取:从样本中提取待检测的DNA。
2.DNA消解:将DNA样本通过限制性内切酶消解为较小的DNA片段。
3.凝胶电泳:将消解后的DNA片段在琼脂糖凝胶上进行电泳分离,根据DNA片段的大小形成DNA条带。
4.DNA定位:将凝胶中的DNA片段转移到薄膜或膜纸上。
5.杂交处理:将转移到膜上的DNA片段与一段标记的DNA探针进行杂交,探针可以是放射性同位素标记的DNA或荧光标记的DNA等。
6.杂交条件优化:调整温度、盐浓度和杂交时间等条件,以提高杂交效率和特异性。
7.杂交探测:通过探针上的标记进行检测,如放射性同位素检测或荧光检测。
8.数据分析:根据杂交的结果,确定目标DNA序列的存在与否。
应用Southern杂交技术在许多生物学研究中得到广泛应用,主要包括以下几个方面:1.基因型分析:可以通过Southern杂交技术确定目标基因的存在、拷贝数和序列变异等信息。
2.基因组结构研究:可以通过Southern杂交技术确定目标基因组的结构和大小。
3.DNA重组检测:可以通过Southern杂交技术检测DNA重组事件的发生和定位。
4.DNA甲基化分析:可以通过Southern杂交技术研究DNA甲基化修饰的分布和变化。
5.遗传疾病诊断:可以通过Southern杂交技术检测遗传疾病相关基因的缺失、重复或突变等。
具体了解Southern杂交技术

Southern Blotting的过程
1.碱变性的琼脂糖凝胶电泳分离的DNA 2.通过电泳液的移动转移胶中的DNA 3.固定胶中的DNA 4.预杂交、杂交(放射性和荧光检测) 5.结果检测
具体了解Southern杂交技术
四、Southern杂交的应用
– DNA指纹分析
具体了解Southern杂交技术
滤膜(固相)杂交
具体了解Southern杂交技术
一、核酸分子杂交技术
2、核酸分子杂交的分类: ③ 膜 杂 交 : 用 标 记 DNA
或RNA探针检测固定在 硝酸纤维素(NC)膜 上 的 DNA 序 列 。 Brown 等应用这一技术评估 了 爪 蟾 rRNA 基 因 的 拷 贝数。
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
5、探针的制备 ③探针的种类
cDNA 探针、基因组DNA探针、寡 核苷酸探针、RNA探针等。
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
5、探针的制备
④放射性探针标记物
[α-*N]-dNTP 、32p(14d)、35S(87d)、3H(12y)、 125I(60d)、14C、131I
胶电泳 3、凝胶中DNA的变性:碱变性 4、Southern转膜:
–硝酸纤维素膜 (NC) 、尼龙膜 – 毛细管虹吸印迹法、电转印法、真空
转移法
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
4、Southern转膜:
具体了解Southern杂交技术
三、Southern 杂交的主要步骤
第16讲
核酸分子杂交 ------Southern杂交
地高辛标记探针的Southern印迹方案

地高辛标记探针的DNA印迹方案Southern blot using DIG Prober(分子生物学实验室)Step I 采用地高辛高效标记混合物(ROCHE) 标记DNA探针1 以质粒为模板,PCR扩增序列特异性片段,回收片段,并测定浓度浓度测定:将回收产物取1μl稀释5倍,标准分子量的标记物MAKER分别点1μl,2μl,4μl,6μl.然后比较回收产物的条带亮度与MAKER比较后,可以粗略估算浓度。
2 取1μg模板(第1步扩增回收产物)于1.5ml的eppendorf管中,加入灭菌双蒸水至终体积为16μl。
3 沸水浴处理10min后迅速于冰上冷却使DNA变性(1)摇匀DIG-High Prime(vial 1),取4μl加入已热变性的模板DNA中,混匀后,瞬时离心,37℃保温20h,65℃处理10min终止反应。
4取1μl电泳检测,标记后的条带稍大于标记前片断。
5标记好的DNA探针-20℃保存。
Step II 基因组DNA酶切1 提取高质量的基因组DNA,浓度>1μg/μl ; 测定浓度的方法同测定探针浓度方法一样。
2 选择合适的内切酶(酶切的DNA量20μg左右。
注意考虑到纯化的损失,约30%,酶切DNA浓度过大时,可以考虑多做几管做浓缩)。
50μl酶切反应体系:EcoR I (15U/μl ) 5μl10×M buffer 5μlgDNA 10μl(约10-20μg)ddH2O up to 50μl注:有些内切酶需加BSA,请参照内切酶说明(包括最适酶切温度)。
3 37℃酶切12h (电泳检测),视酶切情况可延长酶切时间,直至酶切完全。
65℃保温10min停止酶切反应。
Step III 预电泳和电泳1 配制0.8 %的琼脂糖凝胶(大胶40ml左右,胶薄较好,利于转膜)。
2 加入适量上样缓冲液(Loading Buffer)点样,点上质粒做对照。
注:两边的点样孔尽量空出来;点上marker,再单独一点样孔用溴酚兰做指示,防止跑过。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
地高辛标记探针的Southern杂交1.探针标记(20µL体系):1)将10ng-1µg模板DNA用无菌去离子水补足至16µl。
2)沸水浴或干浴锅98o C10分钟,使DNA变性成单链并迅速冰浴冷却。
3)充分混匀DIG-high Primer(1#管),并取4µl至变性DNA管,混匀并离心;4)37o C温育1小时或过夜(最大到不超过20小时);5)停止反应,加2µL0.2M EDTA(pH8.0)或65o C加热10分钟。
若不用将于-20o C冰箱保存。
2.探针标记效率检测:将地高辛标记好的探针作一系列的稀释,点到一条尼龙膜上,同时用地高辛标记的control DNA作对照标准,120℃固定30分钟;然后用地高辛抗体免疫检测,按BNT/BCIP显色步骤显色;比较显色结果,选择带有可以接受的背景的最高探针浓度做正式的杂交。
操作步骤如下:1)根据表1DIG-High Prime DNA标记及检测试剂盒理想条件下探针的标记产量将标记的探针稀释到1ng/μl,将试剂盒提供的control DNA稀释到1ng/μl(原始浓度是5ng/μl),然后按照表2作一系列的稀释探针及control DNA稀释表1DIG-High Prime DNA标记及检测试剂盒理想条件下探针标记产量Template DNA1h20h10ng45ng600ng30ng130ng1050ng100ng270ng1500ng300ng450ng2000ng1000ng850ng2300ng3000ng1350ng2650ng表2探针DNA及Control DNA系列表Tube DNA(µl)FromTube#DNA dilutionbuffer(μl)Dilution Finalconcentration1Dilutedorginal1ng/µl 2211981:10010pg/µl3152351:3.33pg/µl452451:101pg/µl553451:100.3pg/µl654451:100.1pg/µl755451:100.03pg/µl856451:100.01pg/µl90-50-01)将上述稀释的2-9号管的control DNA及探针DNA各取1μL点膜;2)120o C固定30min或紫外交链3-5min;3)将膜放入装有20mL Maleic acid buffer的塑料器皿中,室温振荡2min;4)将膜放入10mL Blocking solution中室温温育30min;5)将膜放入10mL Antibody solution中室温温育30min;6)用10mL Washing buffer洗2次,每次15min;7)在10mL Detection buffer平衡2-5min;8)将膜放入2mL新配制的Color substrate solution(从试剂5#中取100ul到5mL)中暗室条件下显色。
显色过程中不要摇动或振荡!9)当斑点或带显示出来后,用50ml灭菌的双蒸水洗膜5分钟,照相染色至0.1pg的Control DNA出现斑点,比较标记的探针与Control DNA染色情况计算出地高辛标记的DNA的量:如果0.1pg的探针及对照稀释点都显色,则探针标记理想;如果0.1pg的对照显色,0.1pg的标记探针没显色,但0.3pg 显色,则计算探针浓度(约为理想浓度的1/3)以确定杂交时加多少探针(25ng 探针/ml杂交液);如果0.1pg的对照显色,但标记探针0.3pg的斑点没显色,则应重新标记探针。
3.凝胶处理:1)在琼脂糖凝胶上电泳分离DNA。
取出凝胶,切去边缘多于部分,在紫外灯下照相(放一标尺,可从像片中读出DNA迁移的距离);2)将凝胶置于200mL变性液中,浸泡45分钟(分两次),并温和地不断振荡,使凝胶上的ds-DNA转变为ss-DNA,然后用重蒸水冲洗凝胶几次;3)用中和液浸泡凝胶并不断地振荡45分钟(分两次),将凝胶中和至中性,防止凝胶的碱性破坏硝酸纤维膜;4)取一个瓷盘,在底部放一块玻璃板,使盛器内的20倍SSC转移滤液低于玻板表面,在玻板表面盖4层滤纸,滤纸两边浸没于20倍SSC溶液中,在玻璃和滤纸之间,赶掉所有的气泡;5)取中和后的凝胶,点样孔向下地放在滤纸上,用玻璃棒滚动去除胶与滤纸之间的气泡;6)剪一块与胶大小一致的尼龙膜(带正电荷,比胶大2mm),放在无菌超蒸水表面,使之自然吸水下沉,将膜转入20×SSC中浸泡5min;7)将浸润的膜准确地盖在凝胶上面,膜与凝胶接触后,不再移动;8)将四张与膜大小相同的滤纸置于2×SSC溶液中浸润,盖在膜上,赶走气泡;9)滤纸上放一叠与吸水纸,吸水纸上放一块大小合宜的玻璃板,玻璃板上压0.5kg重物,水平放置,转移4~18h;10)取下吸水纸及滤纸,揭去胶,将尼龙膜于2×SSC中浸泡5min,再置于滤纸上吸干;11)用滤纸包好印迹膜,DNA面朝上,120o C烘烤30min或置于紫外交联仪中紫外照射2min,将DNA交联在尼龙膜上,4o C保存备用。
注意,滤膜以下任何实验中都不应干燥!4.预杂交1)DIG Easy Hyb:将64mL无菌去离子水分两部分倒入试剂7#瓶,37o C摇动溶解5分钟;2)计算杂交温度:通常为37o C-42o C,计算公式为:T m=49.82+0.41(%G+C)-(600/I)(I=length of hybrid in base pairs)T opt.=T m-20to25o CFor sequences that are<80%homologous,the Thyb will be lower than that calculated above (approx.1.4°C lower per1%mismatch).3)预热一定体积的DIG Easy Hyb(10mL/100cm2膜)至杂交温度37-42o C;4)预杂交30分钟。
在不加探针的情况下,仅将膜放在杂交液中下充分润湿;5)变性:DIG标记的探针(约25ng/ml)置98o C干浴锅中5min后迅速放在冰上冷却。
5.杂交1)将变性的探针加入预热的DIG Easy Hyb(3.5mL/100cm2)中,混匀,避免泡沫;2)倒出预杂交液,加入探针和DIG Easy Hyb混合液;3)继续在杂交温度下杂交6h至过夜。
注:含有探针的DIG Easy Hyb杂交液可重复利用,杂交结束后用枪吸出放入1.5mL离心管中于-20o C保存,可重复使用几次,只需在使用前于68o C处理10min即可。
6.洗膜1)用2×SSC,0.1%SDS在15-25o C冷洗2次,每次5~10min,洗涤过程中要轻轻摇动;2)用0.5×SSC,0.1%SDS在65-68o C杂交管中热洗2次,每次15min。
For a probe with the e the following High StringencyHomology to Target GC-content Buffer Temperature 80–100%Average(40%)0.5x SSC+0.1%SDS65°C,if probe is>100bp<80%Average(40%)0.5x SSC+0.1%SDS Approx.60°C*80–100%High(50%)0.1x SSC+0.1%SDS68°C*Exact temperature must be determined empirically.7.检测1)杂交和洗膜后,用Maleic acid buffer浸泡1-5min;2)准备1×Block solution:用Maleic acid buffer10×稀释试剂(6#10×Blockingsolution)成1×的工作液,即每9mL Maleic acid buffer中加入1mL10×Blocking solution混匀,现配现用;3)按1ml/cm2的量取用1×Block solution,处理膜30min;4)将4#试剂离心,按1:5000加入1×Blocking solution,按20ml/100cm2的量用antibody solution处理膜30min;5)每次按1ml/cm2的量用Washing buffer洗膜2次,每次15min;6)按20ml/100cm2的用量,膜在detection buffer中平衡2-5min;7)准备Color-substrate solution(显色液):从试剂5#中取100µL到5mL Detection buffer,要避光,现配现用;8)按10mL/100cm2的量加入新鲜配制的color solution浸润膜,放在塑料袋或塑料盒中,保持黑暗,注意不要在显色过程中摇动!9)颜色沉淀在几分钟内开始出现,在16小时内完成显色反应,在显色过程中膜可在光亮处短暂暴露几次。
当预期的斑点出现时,可在50mL TE buffer 或无菌超纯水中洗膜5分钟中止反应;10)照像记录结果。
