材料科学基础,第2章,材料中的晶体结构
上海交大-材料科学基础-第二章-2

体心立方八面体间隙
体心立方四面体间隙
八面体间隙: 由一个面上四个角和相邻两个晶胞体心共6个原子围成, 位置: 位于晶胞每个面中心和每个棱边的中点;
➢数目:12/4 + 6/2 = 6 ➢大小rB:
4R 3a a 4 R
3
rB 2a/2 - R 0.633R 110
a / 2 - R 0.154R 001
n个。
4)空隙大小 四面体间隙大小:r=0.225R 八面体间隙大小:r=0.414R
n个球作体心立方堆积时,存在3n个八 面体空隙、6n个四面体空隙,空隙较多。
2.2.2 多晶型性
多晶型性指某些金属在不同温度和压力下具有 不同的晶体结构。
多晶型性转变指金属在外部条件 (如 T 和 P) 改变时,其内部从一种晶体结构向另一种晶体结构 的转变,又称同素异构(同素异性)转变,转变的 产物称为同素异构体 例如纯铁:
2R a
rB
3 4
a2 ( 2 a(sin60o ))2 -R 0.225R 3
密排六方晶格八面体间隙
密排六方晶格四面体间隙
空隙分布
每个球周围有8个 四面体空隙;
每个球周围有6个 八面体空隙
空隙数量
n个等径球最紧密堆积时,整个系统四面体空
隙数为
8n 4
2n个,八面体空隙数为
6n 6
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
晶粒
多相合金
本节的基本要求
需掌握如下的概念和术语: ▪ 各向异性、多晶型性,配位数、致密度 ▪ 三种典型晶体结构的特征(包括:原子的排
列方式、点阵参数、晶胞原子数、原子半径、 配位数、致密度、各类间隙尺寸与个数,最 密排面(滑移面)和最密排方向的指数,堆 垛)。 ▪ 多晶体与单晶体、晶粒、晶界;
材料科学基础第2章
可编辑ppt
10
2.3.1 固溶体
固溶体(solid solution) :
合金组元通过溶解形成一种成分和性能均匀的、 且结构与组元之一相同的固相称为固溶体。
➢ 固溶体的最大特点是保持溶剂的晶体结构。
➢ 与固溶体晶格相同的组元为溶剂,一般在合金中 含量较多;另一组元为溶质,含量较少。
✓ 各向异性:由于在不同方向上的原子排列的紧密程 度不同使晶体在不同方向上的物理、化学和力学性 能不同。而一般整个晶体不显示各向异性,称为伪 等向性。
✓ 晶粒:组成晶体的结晶颗粒。 ✓ 多晶体:凡由两颗以上晶粒组成的晶体一般金属都
是多晶体。。
可编辑ppt
4
晶粒
可编辑ppt
5
Байду номын сангаас
多相合金
可编辑ppt
6
可编辑ppt
12
(3)按溶质原子在溶剂中的分布特点分类 无序固溶体:溶质原子在溶剂中任意分布, 无规律性。
有序固溶体:溶质原子按一定比例和有规 律分布在溶剂晶格的点阵或间隙里。
(4)按基体类型分类: 一次固溶体:以纯金属为基形成的固溶体。
二次固溶体:以化合物为基形成的固溶体。
可编辑ppt
13
固溶体的两种类型(置换和间隙)
中间相可以用分子式来大致表示其组成。
合金相的性质由以下三个因素控制: (1)电化学因素(电负性或化学亲和力因素)
电负性—化学亲和力越大越容易形成化合物,电负性 相近的元素容易形成固溶体。
(2)原子尺寸因素 △r=(rA-rB)/rA △r越大,越易形 成中间相。 △r越小,越易形成固溶体
(3)原子价因素(电子浓度因素): C电子=[A(100-x) +Bx]/100 C越大,越易形成
无机材料科学基础___第二章晶体结构

第 2 章结晶结构一、名词解释1.晶体:晶体是内部质点在三维空间内周期性重复排列,具有格子构造的固体2.空间点阵与晶胞:空间点阵是几何点在三维空间内周期性的重复排列晶胞:反应晶体周期性和对称性的最小单元3.配位数与配位多面体:化合物中中心原子周围的配位原子个数成配位关系的原子或离子连线所构成的几何多面体4.离子极化:在离子化合物中,正、负离子的电子云分布在对方离子的电场作用下,发生变形的现象5.同质多晶与类质同晶:同一物质在不同的热力学条件下具有不同的晶体结构化学成分相类似物质的在相同的热力学条件下具有相同的晶体结构6.正尖晶石与反尖晶石:正尖晶石是指2价阳离子全部填充于四面体空隙中,3价阳离子全部填充于八面体空隙中。
反尖晶石是指2价阳离子全部填充于八面体空隙中,3价阳离子一半填充于八面体空隙中,一半填充于四面体空隙。
二、填空与选择1.晶体的基本性质有五种:对称性,异相性,均一性,自限性和稳定性(最小内能性)。
2.空间点阵是由 C 在空间作有规律的重复排列。
( A 原子 B离子 C几何点 D分子)3.在等大球体的最紧密堆积中有面心立方密堆积和六方密堆积二种排列方式,前者的堆积方式是以(111)面进行堆积,后者的堆积方式是以(001)面进行堆积。
4.如晶体按立方紧密堆积,单位晶胞中原子的个数为 4 ,八面体空隙数为 4 ,四面体空隙数为 8 ;如按六方紧密堆积,单位晶胞中原子的个数为 6 ,八面体空隙数为6 ,四面体空隙数为 12 ;如按体心立方近似密堆积,单位晶胞中原子的个数为 2 ,八面体空隙数为 12 ,四面体空隙数为 6 。
5.等径球体最紧密堆积的空隙有两种:四面体空隙和八面体空隙。
一个球的周围有 8个四面体空隙、 6 个八面体空隙;n个等径球体做最紧密堆积时可形成 2n 个四面体空隙、 n 个八面体空隙。
不等径球体进行堆积时,大球做最紧密堆积或近似密堆积,小球填充于空隙中。
6.在离子晶体中,配置于正离子周围的负离子数(即负离子配位数),决定于正、负离子半径比(r +/r -)。
材料科学基础 第二章 固体材料的结构

第二章固体材料的结构固体材料的各种性质主要取决于它的晶体结构。
原子之间的作用结合键与晶体结构密切相关。
通过研究固体材料的结构可以最直接、最有效地确定结合键的类型和特征。
固体材料主要包括:金属、合金、非金属、离子晶体、陶瓷研究方法:X光、电子、中子衍射——最重要、应用最多§2-1 结合键结合键——原子结合成分子或固体的结合键决定了物质的物理、化学、力学性质。
一切原子之间的结合力都起源于原子核与电子间的静电交互作用(库仑力)。
不同的结合键代表了实现结构)的不同方式。
一、离子键典型的金属与典型的非金属元素就是通过离子键而化合的。
从而形成离子化合物或离子晶体由共价键方向性特点决定了的SiO2四面体晶体结构极性共价键非极性共价键五、氢键含有氢的分子都是通过极性共价键结合,极性分子之间结合成晶体时,通过氢键结合。
例如:H 2O ,HF ,NH 3等固态冰液态水§2-2 金属原子间的结合能一、原子作用模型固态金属相邻二个原子之间存在两种相互作用:a) 相互吸引——自由电子吸引金属正离子,长程力;b) 相互排斥——金属正离子之间的相互排斥,短程力。
平衡时这二个力相互抵消,原子受力为0,原子处于能量最低状态。
此时原子间的距离为r0。
§2-3 合金相结构基本概念♦合金——由两种或两种以上的金属或金属非金属元素通过化学键结合而组成的具有金属特性的材料。
♦组元、元——组成合金的元素。
♦相——具有相同的成分或连续变化、结构和性能的区域。
♦组织——合金发生转变(反应)的结果,可以包含若干个不同的相,一般只有一到二个相。
♦合金成分表示法:(1) 重量(质量)百分数A-B二元合金为例m B——元素B的重量(质量m A——元素A的重量(质量合金中的相分为:固溶体,化合物两大类。
固溶体金属晶体(溶剂)中溶入了其它元素(溶质)后,就称为固溶体。
一、固溶体的分类:♦按溶质原子在溶剂中的位置分为:置换固溶体,间隙固溶体♦按溶解度分为:有限固溶体,无限固溶体♦按溶质原子在溶剂中的分布规律分为:有序固溶体,无序固溶体置换固溶体:溶质原子置换了溶剂点阵中部分溶剂原子。
无机材料科学基础第二章-硅酸盐晶体结构-第6节(4)

绿宝石结构分析(Be3Al2[Si6O18] 或 3BeO· 2O3 · 2) (Si : O=1: 3) Al 6SiO 属六方晶系,P6/mcc空间群,a=0.921nm,c=0.917nm,Z=2; 在绿宝石结构中,[SiO4]四面体形成六节环,环与环之间靠[BeO4] 四面体中的Be2+和[AlO6]八面体中的Al3+连接。 如图2-61所示为绿宝石结构在(0001)面上1/2个晶胞的投影。在c 轴高度上还有一半未画出。
双四面体
三元环
四元环
六元环
5
(3) 链状 单链 :[SiO4]彼此共用两个顶点, 在一维方向上连结成无限的长链, 每一四面体仍有2个活性氧,借 此与存在于链间的金属离子相连, Si/O=1:3; 双链 :双链是由两个单链通过共 用氧平行连接而成,或者看成是 单链通过一个镜面反映而得。 Si/O=4:11
22
透辉石CaMg [Si2O6] 的结构(CaO•MgO•2SiO2 ) 属单斜晶系,C2/c空间群,a=0.975nm,b=0.890nm,c=0.525nm,=105°37´ , Z =4;图2-63为透辉石结构在(010)和(001)面的投影。 各硅氧链平行于c轴伸展,沿c轴链中[SiO4]的位置是一个向上一个向下更迭地 排列着,以粗黑线和细黑线分别表示两个重叠的硅氧链(稍有移动)。
[BeO4]与[AlO6]共棱 相连; [BeO4]与 [SiO4]、 [AlO6]与 [SiO4]共顶 相连
19
(4)以标高为50的Si4+和O2-处作一反射面,就可得到晶胞的另一半,即单位晶 胞中有2个绿宝石分子。
绿宝石结构对性能的影响:
由于结构中有较大的环形孔隙, 当有半径小、电价低的离子 (K+,Na+)存在时,呈现出 离子导电。
材料科学基础第2章
晶胞示意图
晶胞大小和形状表示方法
晶胞大小和形状表示方法为:
晶胞的棱边长度a、b、c(称为点阵常数、晶格常 数(lattice constants/parameters)); 棱边的夹角为α、β、γ(称为晶轴间夹角)。 选取晶胞的原则: 1、应反映出点阵的高度对称性 2、棱和角相等的数目最多 3、棱边夹角为直角时,直角数目最多 4、晶胞体积最小
晶面指数(hkil)其中i=-(h+k)
晶向指数 [uvtw] 其中t=-(u+v)
六方晶系按两种晶轴系所得的晶面指数和晶向 指数可相互转化:
六方晶系的晶向(面)指数示意图
六方晶系的一些晶向(面)指数
4.晶带
晶带——所有平行或相交于同一直线的晶面构成一个 晶带,此直线称为晶带轴。属此晶带的晶面称为共 带面。 晶带定理:同一晶带上晶带轴[uvw]和晶带面(hkl) 之间存在以下关系:hu+kv+lw=0 通过晶带定理可以求晶向指数或晶面指数。 a) 求两不平行的晶面(h1k1l1)和(h2k2l2)的晶 带轴。 b) 求两个不平行的晶向[u1v1w1]和[u2v2w2]所决定 的晶面。
面心立方八面体间隙面心立方Biblioteka 面体间隙面心立方四面体间隙
面心立方四面体间隙
面心立方原子堆垛顺序
面心立方晶体的 ABCABC 顺序密堆结构
2.体心立方晶格(特征)
原子排列:晶胞八个顶角和晶胞体心各有一个原子 点阵参数:a=b=c,α=β=γ=90º 晶胞中原子数:n=8×1/8+1=2个 3 原子半径: 4R 3a, R a
三种典型金属晶体结构刚球模型
三种典型金属晶体结构晶胞原子数
原子半径与晶格常数
三种典型金属晶格密排面的堆垛方式
上海交大-材料科学基础-第二章-1

晶面的位向
h : k : l cos : cos : cos
cos2 cos2 cos2 1 立方晶系
晶面间距
dhkl
a h
cos
b h
cos
c h
cos
d
2hkl [(
h a
)2
( h )2 b
( h )2 ] c
cos2
cos2
cos2
式中h、k、l为晶面指数(hkl),a、b、c为 点阵常数,α、β、γ为晶面法线方向与晶轴夹角。
每个原子周围的情况完全相同,则这种原子所组成的
网格称为简单晶格。
复式晶格:如果晶体由两种或两种以上原子组成,同 种原子各构成和格点相同的网格,网格的相对位移而 形成复式晶格。
cc
金刚石结构
2.1.2 晶向指数和晶面指数
晶列:布拉菲格子的格点可以看成是分布在一系列相 互平行的直线上,而无遗漏,这样直线称为晶列;
uvw 放入方括号内,写成[uvw],即为待标定晶向的晶 向指数。若为负值,则在指数上加一负号。(化整数, 列括号)
xa : yb : zc u :v : w abc
立方晶系中一些常用的晶向指数
例:如图在立方体中, a i , b j , c k
方法2
D是BC的中点,求BE,AD的晶列指数
第二章 固体结构
本章主要内容
❖ 2.1晶体学基础 ❖ 2.2金属的晶体结构 ❖ 2.3合金相结构 ❖ 2.4离子晶体结构 ❖ 2.5共价晶体结构
概述
❖ 物质按聚集状态分类: 气态、液态和固态; ❖ 按原子(或分子)排列特征分类:晶体和非晶体。
绝大部分陶瓷、少数高分子材料、金属及合金是晶体; 多数高分子材料、玻璃及结构复杂材料是非晶体。
材料科学基础第2章材料中的晶体结构

材料科学基础第2章材料中的晶体结构晶体是由原子、离子或分子按照一定的规则排列而成的固体。
晶体结构是指晶体中原子,离子或分子的排列方式。
晶体结构的特点是重复性和周期性。
晶体结构可以通过晶体的晶胞来描述,晶胞是晶体中最小重复单元,是由若干个原子,离子或分子组成的。
晶体结构的分类可以根据晶体的对称性进行。
常见的晶体结构类型有立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系、六角晶系和三角晶系。
立方晶系是最常见的晶体结构类型,它具有最高的对称性。
立方晶系包括体心立方晶体、面心立方晶体和简单立方晶体。
体心立方晶体每个晶胞中有一个原子位于立方体的中心,面心立方晶体每个晶胞中有一个原子位于每个立方体的面心,简单立方晶体每个晶胞中只有一个原子。
四方晶系的晶体中,晶胞的底面为矩形,其中一个边与底面垂直。
正交晶系的晶胞基本上和四方晶系相似,但它的底面为正方形。
单斜晶系的晶胞有一个倾斜的边,它是在不同轴上分别有两面成直角。
三斜晶系的晶体是最复杂的结构类型,它的晶胞没有任何对称性。
六角晶系的晶体结构可以看作是体心立方晶体和单斜晶体的组合,晶胞为底面呈六角形的棱柱。
三角晶系的晶体结构最特殊,晶胞为三角形。
晶体结构的研究对于材料科学非常重要。
通过了解晶体结构,我们可以预测和解释材料的物理性质,如硬度、热膨胀系数和电导率等。
晶体结构还对材料的合成和制备起到了指导作用。
例如,通过改变晶体结构,可以改变材料的性质,如增加或减少导电性。
总之,材料中的晶体结构是材料科学基础中的重要内容。
了解晶体结构有助于我们理解材料的性质和行为,并为材料设计和合成提供基础。
晶体结构的研究对于材料科学的发展非常重要,并在材料的合成和制备中起到了指导作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
凡满足此关系的晶面都属于以[u
v w]为 晶带轴的晶带,故此关系式也称晶带定律。
晶带、晶带面和晶带轴
第二节 纯金属的晶体结构
一.典型金属的晶体结构
是指最简单的晶体结构。
由于金属键的性质,使典型金属的晶体
具有高对称性,高密度的特点。
常见的典型金属晶体是面心立方、体心
立方和密排六方三种晶体,其晶胞结构 如图2-10~2-12所示。
3.晶向与晶面的关系
晶面:晶体中
由一系列原子所 组成的平面。
晶向:原子在
空间排列的方向 称为晶向。
1.晶面、晶向及其表征
1)晶面
( 1 )定义:晶体点阵在任何方向上可分 解为相互平行的结点平面,称为晶面。 (2)特征: 晶面上的结点在空间构成一个二维点阵。 同一取向上的晶面,不仅相互平行、间 距相等,而且结点的分布也相同。 不同取向的结点平面其特征各异。
正交 a≠b≠c, α=β=γ=90º
简单正交 底心正交 体心正交 面心正交
立方 Cubic a=b=c, α=β=γ=90º
简单三斜
简单单斜
底心单斜
简单正交
体心正交
底心正交
面心正交
简单立方
体心立方
面心立方
简单六方
简单菱方
简单四方
体心四方
二、晶体结构的定量描述
—晶面指数、晶向指数
1.晶面、晶向及其表征 2.六方晶系的晶面指数和晶向指数
(3)晶面指数:
结晶学中经常用( hkl )来表示一组平
行晶面,称为晶面指数。
数字 hkl 是晶面在三个坐标轴(晶轴)
上截距的倒数的互质整数比。
晶面指数求法:
①在所求晶面外取晶胞的某一顶点 为原点O,三棱边为三坐标轴x,y, z; ②以棱边长a为单位,量出待定晶 面在三个坐标轴上的截距;
1)晶体:晶体是内部质点 在三维空间成周期性重复排列 的固体,即晶体是具有格子构 造的固体。
2)晶体的特征
自范性:晶体具有自发地形成封闭的凸
几何多面体外形能力的性质,又称为自 限性。
金刚石 方解石
均一性:指晶体在任一部位上都具有
相同性质的特征。
各向异性:在晶体的不同方向上具有
不同的性质。
A
A
A
A
ABCABC……层序堆积 —面心立方密堆积A1
ABAB……的层序堆积 —六方密堆积A3
面心立方最紧密堆积
1 6 1 2 3 4 6 5 4
2
3
5
A
1
6 5 4 2 3
B C
面心立方最紧密堆积
A C B A C B A
ABCABC……, 即每三层重复一次
面心立方最紧密堆积
1 6 5
2 3 4
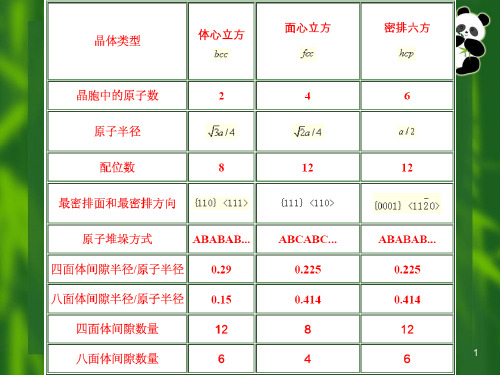
三种典型金属结构的特征
晶体 类型 A1(fcc) 原子 密排面 {111} 原子 密排方向 <110> 晶胞中 的原子数 4 12 配位数CN 致密度
K
0.74
A2(bcc)
A3(hcp)
{110}
{0001}
<111>
<1120>
2
6
8,<8+6>
12
0.68
0.74
2
二、点阵常数
晶胞的棱边长度a,b,c称为点阵常数。
图2-10 面心立方结构 a) 刚性球模型 b) 晶胞模型 c) 晶胞中的原子数
图2-11 体心立方结构 a) 刚性球模型 b) 晶胞模型 c) 晶胞中的原子数
图2-12 密排六方结构 a) 刚性球模型 b) 晶胞模型 c) 晶胞中的原子数
1、体心立方结构(bcc)
具有这种晶体结构的金属有Cr、V 、Mo、W和α-Fe等30多种。
晶面间距与晶面指数的关系:
晶面间距是现代测试中一个重要的 参数。在简单点阵中,通过晶面指数 (hkl)可以方便地计算出相互平行的一 组晶面之间的距离d。
晶系 晶面间距 立方
1 h2 k 2 l 2 d2 a2
正方
1 d2
六方
h2 k 2 a2 l c 2
2
斜方
2
1 d2
h 4 3(
第二章
第一节 第二节 第三节 第四节
材料中的晶体结构
晶体学基础 纯金属的晶体结构 离子晶体的结构 共价晶体的结构
第一节
晶体学基础
晶体结构的定性描述 晶体结构的定量描述 —
晶面指数、晶向指数
一、晶体结构的定性描述
1.晶体及其特征 2.晶体结构与空间点阵 3.晶胞与晶胞参数
4.晶系与点阵类型
1. 晶体及其特征
(2)特征:
故其中任何一直线,可作为直线组的代表。
不同方向的直线组,其质点分布不尽相同。
同一直线组中的各直线,其结点分布完全相同,
(3)晶向指数:
用[uvw]来表示。 其中 u 、 v 、 w 三个数字是晶向矢量
在参考坐标系 X 、 Y 、 Z 轴上的矢量
分量经等比例化简而得出。
晶向指数求法:
如把原子看作半径为r的刚性球,则由 几何学知识可求出a,b,c与 r之间的 关系:
体心立方结构(a=b=c) 面心立方结构(a=b=c) 密排六方结构(a=b≠c)
3 a4 r 3
a 2 2r
a=2r
原子半径r
晶胞中原子密度最大的方向上相邻 两原子之间距离的一半。
①确定坐标系;
②过坐标原点,作直线与待求晶向
平行;
③在该直线上任取一点,并确定该 点的坐标(x,y,z)
④将此值化成最小整数u,v,w并
加以方括号[u v w]即是。
代表一组互相平行,方向一致的
晶向。
例题:立方晶系晶向指数的标注
c
[001] [111]
[010]
b a
[100] [110]
hk k 2 a2
l ) c 2
2
1 d2
h2 a2
k l b 2 2 c
2
2
4.晶带
所有平行或相交于同一直线的这些晶面构
成一个晶轴,此直线称为晶带轴。属此晶 带的晶面称为晶带面。
晶带轴[u
v w]与该晶带的晶面(h k l) 之间存在以下关系: hu + kv + lw = 0
③取截距之倒数,并化为最小 整数h,k,l;
④加以圆括号(h k l)即是。
(111)
(110) (110)
例题:立方晶系晶面指数的标注
c c c
a
b a
b a
b
(100)
(110)
(111)
(4)晶面族:
晶体结构中原子排列状况相同但不平行的两
组以上的晶面,构成一个晶面族。常存在对 称性高的晶体(如立方晶系)中。 c
晶向指数和晶向族指数分别用 [uvtw] 和 〈uvtw〉来表示。其中t=-(u+v)。
c
[0001] [001]
(0001) (001)
d b a
[100] [010]
图2-7 六方晶系的晶面指数和晶向指数
3.晶向与晶面的关系
在立方晶系中,同指数的晶面和晶 向之间有严格的对应关系:
①同指数的晶向与晶面相互垂直; ②也就是说[hkl]晶向是(hkl)晶 面的法向。
对称性:指晶体的物理化学性质能够
在不同方向或位置上有规律地出现, 也称周期性。
最小内能和最大稳定性。
2. 晶体结构与空间点阵
空间点阵:把晶体中质点的中 心用直线联起来构成的空间格 架,简称晶格. 结点:质点的中心位置称为晶 格的结点。结点仅有几何意义, 并不真正代表任何质点。 结构基元:晶体中的质点如原 子或原子集团。 晶体结构:结构基元+空间点阵
同一晶面族各平行晶面的面间距相等。
{110}晶面族
Z (110) (011) (011) (101)
(101) Y (110)
X
2)晶向:
(1)定义:
结点等距离地分布在直线上。位于一条直线上 的结点构成一个晶向。
点阵可在任何方向上分解为相互平行的直线组,
晶体中质点排列具有周期性和对称性。 整个晶体可看作由结点沿三个不同的
方向按一定间距重复出现形成的,结点 间的距离称为该方向上晶体的周期。
同一晶体不同方向的周期不一定相同。
晶胞:
①可以从晶体中取出一个单元,表示
晶体结构的特征。
②取出的最小晶格单元称为晶胞。 ③晶胞是从晶体结构中取出来的反映
简单三斜
晶系
六方 Hexagonal a1=a2=a3≠c,α=β=90º , γ=120º 菱方 Rhombohedral a=b=c, α=β=γ≠90º
四方(正方)Tetragonal a=b≠c, α=β=γ=90º
布拉菲 点阵
简单六方
简单单斜 底心单斜
简单菱方
简单四方 体心四方 简单立方 体心立方 面心立方
(001) (010)
O a
(100)
b
晶面族指数(符号): 通常用晶面族中某个 最简便的晶面指数填 在大括号{ }内,称 为晶面族指数,用符 号{hkl}表示。
将{hkl}中的h、k、l,改变符号和顺
序,进行任意排列组合,就可构成这个 晶面族所包括的所有晶面的指数。
111 (111) (111) (111) (111) (111) (111) (111) (111)
晶体周期性和对称性的重复单元。
3.晶胞与晶胞参数
晶胞:是从晶体结构中取出来的反映晶
体周期性和对称性的最小重复单元。
