gmp供应商审计记录
GMP检查和审计的准备工作

在接受检查和审计时,个人觉得需要提前做好三个方面的准备,主要是参与人员的准备,生产、质检现场的准备以及文件资料的准备。
01参与人员的准备在每次检查前,除了飞行检查不提前通知外,其他的检查基本上都会提前通知到企业,企业就可以根据本次的检查内容提前做好准备。
当接到检查通知时,就可以知道检查人员或者审计人员一行有几人,分别是乘坐哪种交通工具何时能够到达。
这时候企业就要提前开会安排相关的工作人员。
1、后勤保障人员:主要负责检查组和审计组的接送、住宿以及吃喝拉撒等工作,不要认为这是一项可有可无或者可以随便应付的工作。
作为检查人员,可能这是非常重要的一方面,如果这些保障工作做不好,你能想象到后果由多严重。
虽然现在提倡轻车简从,不能吃拿卡要,但是,这是作为对待客人最基本的礼节。
作为后期保障人员,一定要提前安排好接送的车量,及时的接送检查和审计人员。
安排好住宿的房间和吃饭的酒店等。
在公司内部,一定要准备好检查人员和参会人员的桌牌,检查人员需要使用的笔和笔记本,卫生间的擦手纸,水杯茶叶,香烟等物品。
调试好投影等音像设备,不要在用的时候出丑。
中午检查人员一般在公司吃饭,安排好检查人员的用餐,虽然检查人员嘴上说就吃员工餐就可以了,但是真的不能这样做哦,原因你懂的!2、参会人员:每次检查,基本上都会提前知道检查的具体内容,那就要根据检查内容安排好参加首末次会议的相关人员,基本上公司的总经理、生产负责人、质量负责人以及各部门的负责人都应该参加,除非你出差或者有什么重要的事情,不参会的人员在首次会议介绍人员的时候也要跟检查员解释清楚。
参会人员一定要在检查组到之前就要坐在会议室,总经理以及生产、质量负责人应该要到门口迎接检查组的到来。
人员不提前到位会给检查组落下公司不重视本次检查的印象,这对于后续的检查是非常不利的。
3、检查过程中陪同的人员:在检查过程中,要有陪同人员全程跟着检查员。
车间、科室的负责人在参加完首次会议后就可以回到自己的岗位上去,等待检查人员的大驾光临。
GMP质量体系物料供应商审计评估报告

GMP质量体系物料供应商审计评估报告GMP(Good Manufacturing Practice)质量体系是一套用于保证药品和医疗器械生产方面的质量控制准则。
在GMP质量体系中,物料供应商的审计评估是非常重要的环节,旨在确保供应商能够符合GMP的要求,提供高质量的原材料和产品。
本次物料供应商审计评估报告对该供应商的供应链管理、质量体系、员工素质、设备设施等方面进行了全面评估,并给出了评估结果和建议。
1.供应链管理:建议:2.质量体系:供应商的质量体系是评估物料质量的核心要素之一,本次评估发现,供应商的质量体系存在一些问题。
首先,供应商的质量管理人员对GMP质量体系的理解存在一定的局限性,未能深入贯彻执行GMP的要求。
而且,供应商对质量标准的控制不够严格,质量控制手段有待加强。
建议:供应商应加强对质量体系的培训和理解,确保全体员工深入贯彻执行GMP的要求。
同时,供应商应建立起严格的质量管理体系,强化质量控制手段,并完善质量标准的制定和执行。
3.员工素质:供应商的员工素质直接关系到物料质量的稳定性和可靠性,本次评估发现,供应商在员工培训和素质提升方面存在一定的问题。
供应商的员工对GMP质量体系的了解不足,对操作规程和安全要求的认识有待提高。
建议:供应商应加强员工的培训和教育,确保员工对GMP质量体系的理解和执行。
此外,供应商应建立起员工培训档案,定期对员工进行培训和素质提升。
4.设备设施:供应商的设备设施状况直接影响物料的生产质量,本次评估发现,供应商的设备设施存在一些问题。
首先,供应商的设备存在一定的老化现象,维护保养不及时,对设备质量的影响较大。
此外,供应商的设施布局不合理,对物料的生产流程造成了一定的障碍。
建议:供应商应加强设备设施的维护和保养,确保设备的稳定性和可靠性。
同时,供应商应优化设施布局,确保物料的生产流程合理高效。
总结:本次物料供应商审计评估发现供应商在供应链管理、质量体系、员工素质、设备设施等方面存在一定的问题和不足。
GMP 15供应商审计管理规定5
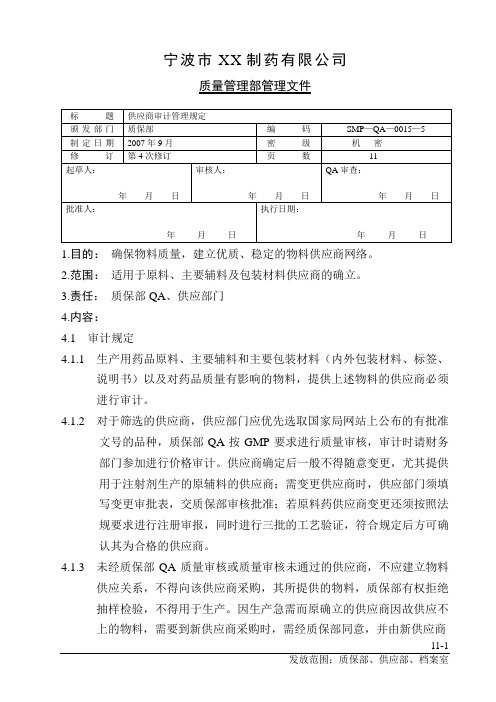
宁波市XX制药有限公司质量管理部管理文件1.目的:确保物料质量,建立优质、稳定的物料供应商网络。
2.范围:适用于原料、主要辅料及包装材料供应商的确立。
3.责任:质保部QA、供应部门4.内容:4.1 审计规定4.1.1 生产用药品原料、主要辅料和主要包装材料(内外包装材料、标签、说明书)以及对药品质量有影响的物料,提供上述物料的供应商必须进行审计。
4.1.2对于筛选的供应商,供应部门应优先选取国家局网站上公布的有批准文号的品种,质保部QA按GMP要求进行质量审核,审计时请财务部门参加进行价格审计。
供应商确定后一般不得随意变更,尤其提供用于注射剂生产的原辅料的供应商;需变更供应商时,供应部门须填写变更审批表,交质保部审核批准;若原料药供应商变更还须按照法规要求进行注册审报,同时进行三批的工艺验证,符合规定后方可确认其为合格的供应商。
4.1.3 未经质保部QA质量审核或质量审核未通过的供应商,不应建立物料供应关系,不得向该供应商采购,其所提供的物料,质保部有权拒绝抽样检验,不得用于生产。
因生产急需而原确立的供应商因故供应不上的物料,需要到新供应商采购时,需经质保部同意,并由新供应商11-1提供样品分析,必要时,进行小试生产,合格后方可采购。
4.1.4 不直接从生产厂家购入辅料,应对生产厂家和供应商家分别进行审计,因故更改供应商,或新增物料的采购,需要重新进行审计;正常情况下每年审查一次,如遇特殊情况及时重新审查。
4.1.5物料第一次进货,应在到货检验合格后,建立物料档案。
4.2 一般物料的审核办法4.2.1 供应商填写调查表同时提供营业执照和药品生产许可证及相关资料(见附件)。
4.2.2 对于年使用量在500公斤以上,或年发生金额在10万元人民币以上,或同一家供应商采购品种在3个以上,或风险大的物料,应到现场对供应商进行评估,了解其设备、设施、生产组织、质量管理等情况,并做好详细的现场评估报告。
其他物料视情况决定是否到现场审计。
化学原料药供应商审计内容

化学原料药供应商审计内容一、供应商审计概念:审计是一项有计划性、用文件形式记录,用来判定生产行为是否严格遵循已经建立的标准以及其遵守规范的程度的活动。
一、供应商审计内容1、资质的符合性●药用物料-原料药:药品生产许可证/药品经营许可证,产品注册证/经营范围,GMP证书/GSP证书,原料药生产批件-中国药典辅料:生产许可证,生产批件●药包材-已有国家标准的:《药包材注册证》-未有国家标准的:国家食品包装标准●进口药品-质量评估的符合性-物料质量的符合性质量评估的符合性2、供应商系统评估-厂房、设施、设备的条件-质量保证体系(文件/质量标准/检验仪器)-人员及培训-产品质量-供货能力-企业信誉-协作态度3、物料质量与标准的符合性•供应商供货标准与验收要求标准•实物与标准的符合性-小样检验-试机-工艺试验-批量检验-批量工艺验证三、供应商动态管理(一)物料部、QA建立与供应商的信息联系1、在所供物料出现任何质量问题时及时向供应商信息反馈,便于协同查处理和制定防范措施。
2、在供应商生产条件、质量标准以及其它注册证照发生变更时,能及时获得信息,达到更新供应资料或采取其它相应措施。
3、供应商供货产品年度质量回顾:由QA在每年的1月份对供应商上一年的供货质量进行统计,内容包括:产品名称、供货批次、数量、交货时间准确度、检验合格率、质量差错情况、售后服务等。
4、召开年度供应商交流会:质量评估,培训等。
(二)供应商的变更管理1、供应商因多种原因已失去所供应物料的生产经营资格;2、供应商停止所供应物料的生产或停止供货;3、经留样考察,所提供的物料不能满足我公司产品的稳定性要求或其佗要求;4、所生产的物料连续出现质量问题并经现场评审不合格的供应商;5、供应商的变更程序:供应商的变更程序执行(变更处理程序),由要求变更的部门提出。
四、基本内容介绍A、检查的文件• 1. 药品主文件•主文件:设施•主文件:产品•审核信函•修正案• 2. 工艺流程图• 3. 开发报告/验证报告B、审查的数据和过程• 4. 组织和人员• 5. 设施• 6. 批记录审核•7. 设备校准/确认•8. 工艺改变控制•9. 稳定性数据•10. 辅助系统C、失败的调查•11. 投诉•12. 返工批•13. 拒绝批•14. 退货/收回二、具体内容1. 药品主文件–申报日期–是否有对主文件答复的函件?答复日期:说明:–是否有针对答复函件的修正案?日期:说明:–是否有对主文件的补充/更新文件?日期:说明:–是否有关于在药品主文件,规格,接受标准或生产工艺方式改变后通知公司的程序? 核对前两年的年度审计报告.生产工艺是否有显著改变?2. 工艺流程图–是否有详细的工艺流程图:•图纸标明:–操作单元?–所用的设备?–加料步骤?–工艺的关键步骤?–关键参数?–监控点?•图纸是否经QA部门批准?•图纸是否能正确反映生产工艺?3. 开发报告/验证报告–是否能提供认可的原料药生产工艺开发报告?–是否能提供认可的原料药生产工艺验证方案?–是否能提供生产工艺验证报告:•是否包括下列数据:–中间品-来源及规格标准;–工艺步骤和限度;–返工,母液。
中药材、中药饮片供应商审计、评估报告

中药材(中药饮片)供应商现场审计、评估报告第一部分: 供应商基本资料供应商名称供应物料名称(详细信息见附表)供应商地址联系人联系电话质量负责人联系电话供应商性质GMP○ GSP○合作社○其他○()证件及资料名称营业执照○生产许可证○经营许可证○开户许可证○GMP证书合规性检查结果通知单○ GSP证书或合规性检查结果通知单○产品质量标准○供应商检验报告书○企业组织机构图○质量管理组织机构图○检验仪器清单○生产设备清单○产品生产工艺流程○人员配备情况清单○法人授权委托书○质量保证协议○是否清楚《中药材(中药饮片)质量保证协议书》条款非常清楚□不清楚□根本不清楚□首次审计□再次审计□符合规定□不符合规定□(以上资质真实、准确、符合要求方可进行下一步审计工作)第二部分: 供应商审核评估表评估项目考察方法评分标准评分结果机构与人员应建立与产品生产(经营)相适应的管理机构, 有组织机构图。
查公司组织机构图3有健全的质量管理体系, 并有组织机构图。
查质量管理体系机构3 配备足够数量并具有适当资质的管理和操作人员(有健全的人事档案)查人事档案 3 质量管理负责人和生产管理负责人不能互相兼任。
查人事档案 3应当指定部门或专人负责培训管理工作,培训的内容应包括中药专业知识、岗位技能和药品GMP相关法规知识,应当有培训方案或计划, 定期培训并评估培训的实际效果, 培训记录应当予以保存。
查培训记录 3质量保证和质量控制人员应具备中药材和中药饮片质量控制的实际能力, 具备鉴别中药材和中药饮片真伪优劣的能力查培训记录 3中药材炮制操作人员应具有中药炮制专业知识和实际操作技能查培训记录 3 毒性中药材等有特殊要求的生产操作人员, 应具有相关专业知识和技能, 并熟知相关的劳动保护要求。
查培训记录 3中药材采购及验收的人员应具备鉴别中药材真伪优劣的能力查培训记录 3 养护、仓储保管人员应掌握中药材、中药饮片贮存养护知识与技能查培训记录 3 人员进入生产区更衣洗手是否规范现场及指导更衣情况3 炮制毒性药材等专用工作服与其他操作人员的工作服应分别洗涤、整理, 并避免交叉污染。
GMP供应商审计

2019/1/28 供应商审计 4
供应商审计的职责
department responsible to the vendor audit
2019/1/28
供应商审计
8
供应商审计的频率 audit frequency
• 关键供应商:现场审计,每两年一次,key vendor: in site audit, once each two years, • 非关键供应商:每两年一次书面审计,配合 3-4年现场审计一次,nokey vendor: written audit once each two years and in site audit, once each 3-4 years, • 一般供应商书面审计:每两年一次书面审计, general vendor written audit : written audit once each two years
– WHO GMP第8.9条:对供应商的评估特别要重视供应商的历史和 所供应物料的性质,在审计时,首先要确定供应商符合GMP的能 力。 WHO GMP item 8.9: The assess to vendor should pay attention on the
history and material characteristics, and verify the ability of the vendor about they perform the GMP.
• 供应商审计与以下部门密切有关:
原料药供应商审计报告

√
有效期至2011年6月5日
2
组织与人员
2.1
公司员工培训管理程序
√
审查2008年公司培训计划,抽查纯化操作者岗位操作、法规及文件培训,考核成绩合格。
2.2
关键职能人员介绍:
A.生产负责人
B.质量负责人
C.放行负责人
√
A.生物制药本科有相关工作经验
B.化学分析专业高级工程师
C.质量负责人负责产品放行
√
是否所有的产品在有效期内是稳定的有没有关于如果不稳定该如何去做的SOP
√
按偏差处理
与稳定性样品直接接触的包装材料是否上市品相同?
√
稳定性储存区温湿度如何要求?
√
与药品要求一致
13
物料控制
是否有已批准的原料供应商名单?
√
有QA经理审批,未加盖受控红章。
原料供应商是否经过审核如有,SOP如何规定是否有审核记录
5.10
标识管理
√
厂房、设施设备标识清晰。但精分用层析柱处理后只标记为醋酸奥曲肽,无其他状态标识。
5.11
不同洁净区之间压差
√
物流第一层缓冲与一般走廊之间压差为8Pa
6
包装及贴签控制
是否有包材和标签的接受和检验的SOP
√
标签为企业自制。
是否同一时间进行不同品种或同一品种不同规格的包装工作?SOP如何规定
3.2
厂房设施布局是否合理?
√
3. 3
是否有去除厂区内害虫的设施
√
有纱窗、灭蚊灯等设施,但是缺少相关文件支持,预计在新文件中调整。
3. 4
人、物流走向的合理性
√
3. 5
附厂区及车间平面图
04-Basic GMP Audit Check List

Women's and
18.休息区、储物区和厕所有当地语言标注的洗手和消毒的标识.
Signs for
washing and sanitizing hands are present in break areas, locker areas and restrooms as appropriate and in the language(s) of the
quality of product.
3.是否有清洁用化学品清单.这些用来清洁的化学品应该有合适的批准程序批准,有MSDS数据.
Is there a list
of approved chemicals for maintaining the sanitation of the facility?Chemicals used for any of the above activities should be defined
Are there
adequate environmental controls for the building? If the product under assessment requires environmental controls, ensure that the
supplier has controlled and verified temperature at critical areas.
certificates of insurance for the pest control company and current license for inspectors. Review a representative sample of inspection
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
10.是否确定对物料供应商的评估周期?
11.如物料出现质量问题或出现可能影响产品质量的关键因素(如粒度改变),是否及时与供应商沟通并采取相应措施?
12.是否对关键物料有备用的合格供应商?
13.与供应商的购货合同中是否有质量保证协议?
7.1供货商的资格确认
7.2人员机构
7.3厂房设施及设备
7.4物料管理
7.5生产工艺流程和生产管理
7.6质量管理
7.7质检实验室的设施设备
7.8文件
8.物料管理部门是否获得质量管理部门批准的合格供应商名单,供应商名单是否及时更新?
9.合格供应商名单是否包含如下内容:
9.1物料名称
9商审计项目
Yes
No
1.质量管理部门是否对所有生产用物料的供应商进行质量评估?
2.质量管理部门是否负责主要物料供应商质量体系的现场审计?
3.是否由质量管理部门独立负责批准或否决所有生产用物料的供应商?
4.是否有审计及批准物料供应商的书面规程?
4.1供应商选择的原则
4.2审计内容
4.3认可标准
4.4审计人员的组成及资格
4.5现场审计的原则
4.6审计周期
4.7批准程序
5.是否建立供应商档案并由专人负责管理?
6.供应商档案是否包含如下内容:
6.1供应商的资质证明文件
6.2质量标准
6.3样品检验数据和报告
6.4供应商的检验报告
6.5现场审计记录
6.6定期的质量回顾审核报告
7.现场审计是否制定了审核表,该表是否全面地包含了如下各部分的详细审核项目(参见附件)?
