最新西北大学生物化学
2022年西北大学生物科学专业《微生物学》期末试卷A(有答案)

2022年西北大学生物科学专业《微生物学》期末试卷A(有答案)一、填空题1、蓝细菌是一类______、______、______和______的大型原核生物。
2、典型的类病毒是由美国学者______于1971年发现的______,它的成分是一种______分子。
3、目前知道的所有固氮微生物都属______生物和______菌类,在分类地位上隶属于______菌科、______菌科、______菌目、______菌科、______细菌以及______属和______属中的部分菌种。
4、摇床振荡培养通常用来培养______微生物,享格特的厌氧操作方法通常用来培养______菌。
5、原核细胞的核区内含有______个染色体,其细胞膜以大量折皱陷入细胞质里面去,称这些管状或囊状的结构为______,其核糖体的大小为 ______;而真核细胞的核含有______个染色体,还含有______,其核糖体的大小为______。
6、由科赫提出的确证某病原体为某传染病病因的学说称为______,它的主要内容有:① ______,② ______,③ ______,④ ______。
7、测微生物大小使用的主要工具是______、______和______。
8、微生物在自然环境中广泛存在的原因在于______、______、______、______和______等。
9、当细菌处于一种氨基酸全面匮乏的“氨基酸饥饿”状态时,细菌会采取一种应急反应以求生存,实施这一应急反应的信号,大量合成两种物质,它们是:______和______。
10、有两个系统和五种成分参与补体结合反应中,包括______系统的______和______成分,______系统的______和______成分;此外还有一个______成分。
若反应后出现溶血现象,则可说明补体结合反应为______。
二、判断题11、细菌的芽孢和孢囊都是休眠细胞,都具有相同的抗热性、抗辐射、抗干燥能力。
生物化学与分子生物专业学院校排名
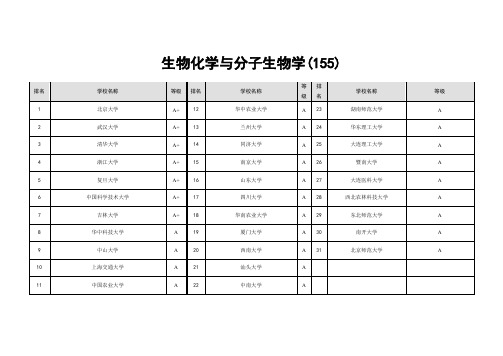
B+等(46 个): 南京农业大学、西安交通大学、南方医科大学、四川农业大学、东北农业大学、河北医科大学、山西大学、山东农业大学、华东师范大学、哈尔滨医科大学、东北林业大学、 福建农林大学、湖北大学、北京林业大学、南京医科大学、云南大学、内蒙古大学、东南大学、石河子大学、西南交通大学、天津大学、江南大学、南京林业大学、上海大学、哈尔滨工业 大学、南昌大学、华南热带农业大学、徐州医学院、黑龙江大学、广东医学院、湖南农业大学、云南农业大学、南京师范大学、西北大学、东华大学、湖南大学、苏州大学、江苏大学、陕 西师范大学、广西医科大学、北京理工大学、天津医科大学、华南理工大学、四川师范大学、山西农业大学、华中师范大学
生物化学与分子生物学(155)
排名 1 2 3 4 5 6 7 8 9 10 11 学校名称 北京大学 武汉大学 清华大学 浙江大学 复旦大学 中国科学技术大学 吉林大学 华中科技大学 中山大学 上海交通大学 中国农业大学 等级 A+ A+ A+ A+ A+ A+ A+ A A A A 排名 12 13 14 15 16 17 18 19 20 21 22 学校名称 华中农业大学 兰州大学 同济大学 南京大学 山东大学 四川大学 华南农业大学 厦门大学 西南大学 汕头大学 中南大学 等 级 A A A A A A A A A A A 排 名 23 24 25 26 27 28 29 30 31 学校名称 湖南师范大学 华东理工大学 大连理工大学 暨南大学 大连医科大学 西北农林科技大学 东北师范大学 南开大学 北京师范大学 等级 A A A A A A A A A
西北大学课程表

生物工程下游技术(选)边六交6402
三
新药研究与申报(选)
赵晔6402
四
听说(前半学期)高月荣
8514
会译(前半学期)外教
8515
药物代谢与分析(选)
郑晓晖等6402
五
写作(后半学期)外教 6401
口译10(后半学期)成昱6405
现代仪器分析(选)
赵新峰8201
六
西北大学2014——2015学年度第二学期研究生课程表
张亚军6101
三
新药研究与申报(选)
赵晔6402
四
药物代谢与分析(选)
郑晓晖等6402
五
现代仪器分析(选)
赵新峰8201
六
西北大学2014——2015学年度第二学期研究生课程表
中药学专业
星期
1—2
3—4
5—6
7—8
晚上
一
中药生物工程(选)
陈千良6402
中药药理(平台课)
张宁6401
二
现代中药制剂(平台课)
刘文哲(科研12层)
分子生物学(平台课)
步怀宇、赵宇伟8201
二
生物信息学(选)
杨进、董靖6401
细胞工程(选)
付爱根6103
现代细胞生物学(平台课)
付爱根等7205
三
分子免疫学(选)
黄建新6402
生物芯片(选)
李铮6401
遗传统计分析(选)
张科进6101
分子遗传学(选)
王玉华(科研12层)
四
会议(前半学期)外教8515
文献检索及SCI论文写作(选)朱宏莉6103
五
写作(前半学期)外教6405
西北大学化学考研专业

西北大学化学考研专业
西北大学化学考研专业简介
西北大学化学考研专业是一个为了培养拥有化学理论与实践研究能力的高级化学人才的学科专业。
该专业注重培养学生的科学思维和创新能力,并提供专业化的知识和技能。
学生在专业课程中将学习有机化学、无机化学、物理化学、分析化学等各个领域的基础知识,并深入研究其中的理论和实践应用。
专业课程中也包括实验室工作和科研项目,使学生能够熟悉实验操作和科学研究方法。
西北大学化学考研专业的研究方向主要包括有机合成与反应机理、催化与材料化学、生物化学与药物化学、分析化学与环境监测等。
在这些研究方向中,学生将有机会深入探索化学领域的热点问题,并参与相关研究项目。
通过参与科学研究,学生将能够提高自己的科学研究能力,并为科学界的发展做出贡献。
西北大学化学考研专业的培养目标是使学生具备良好的科学素养和综合能力,以及独立从事科学研究工作的能力。
在学习期间,学生将接受系统的理论培训,同时也会进行一系列实验和研究工作,培养实践能力和科研能力。
毕业后,学生可以选择继续深造攻读博士学位,也可以选择从事科研工作、教育工作或工业界的相关工作。
西北大学化学考研专业以其严谨的教学体系和优秀的师资队伍吸引了众多化学爱好者的关注。
学校还注重国际交流与合作,为学生提供与国内外知名大学和科研机构交流合作的机会。
这
些交流合作项目为学生提供了更广阔的学术视野和科研机遇。
总之,西北大学化学考研专业是一个提供优质化学教育和研究机会的专业。
通过这一专业的学习和训练,学生将能够在化学领域取得卓越的成就,为推动科学进步和社会发展做出贡献。
生物化学试题_3

此反应的酶为( )酶。
6、每分子乙酰CoA进入三羧酸循环共形成( )分子ATP。那么,软脂
酰CoA经彻底氧化共生成( )分子ATP。
7、联合脱氨基作用有两个内容:氨基酸的α-氨基先借助( )作用转
移到( )分子上,生成相应的α-酮酸和( );后者在( )酶的
催化下,脱氨基生成( ),同时释放出氨。
8、Jacob和Monod提出的操纵子模型说明,酶的诱导和阻遏是在( )
号①、②……来表示)。
西北大学一九九○年攻读硕士研究生试题
考试科目:生物化学
共1页
报考专业:植物学、微生物学
一、计算题:(每小题各占5分,共10分)
1、试计算一条约105个氨基酸残基的多肽链长度。(nm)
(1) 它完全以α-螺旋形式存在。
(2) 它的主链充分伸展,似β-折迭型。
2、根据Watson-Crick模型,计算每一微米DNN双螺旋核苷酸对的平均
蛋白质 A B C D 某电点 8.0 4.5 10.0 5.5 3、什么是激素?激素作用的原理何在? 4、简述五种维生素与辅酶的关系(要求写出①维生素与辅酶的名称及英 文缩写;②与哪种酶有关③在代谢中的作用) 5、蛋白质生物合成中哪些反应需要高能磷酸键?钛链每延长一个AA残 基需消耗几个高耗磷酸键?
5、某蛋白质分子,当其酸性氨基酸数目等于碱性氨基酸数目时的某电
点为7。( )
6、限制性核酸内切酶是专一性水解DNA的酶。( )
7、酶促化的反应,温度愈高,反应速度愈快。( ) 8、酮体在肝脏中产生,要在肝外组织利用,它是脂肪酸彻底氧化的 最终产物。 ( ) 9、酶促反应的未氏常数Km值愈小,则酶和底物间的视合力愈小。( ) 10、某一生物样品,与茚三酮反应呈阴性,用羧肽酶A和B作用后测不 出游离AA,用胰凝乳蛋白酶作用后也不失活,因此,可以断定它属 非肽类物质。( ) 三、解释名词(每个2分,共20分) 1、膜内在蛋白 2、疏水键 3、酶的转换数 4、SOD酶 5、有意义链 6-7转录与转译 8、糖异生 9、β-氧化 10、核酸的增色效应 四、简答题(每题5分,共25分) 1、DNA双螺旋结 有哪些最基本的特点?这些特点能解释哪些最重要 的生命现象? 2、某样品中含有四种蛋白质,它们的某电点各不相同,如下表所示, 如用PH8.0的缓冲液进行纸电泳所得的电泳图谱是怎样的?并说明理 由。
西北师范大学2024年硕士研究生招生考试自命题科目参考大纲 338生物化学初试科目考试大纲

硕士研究生招生考试《生物化学》考试大纲(科目代码:338)学院名称(盖章):生命科学学院学院负责人(签字):编制时间:2023年6月12日西北师范大学硕士研究生入学考试初试科目《生物化学》考试大纲(科目代码:338)一、考核要求《生物化学》是为生物与医药专业学位硕士研究生设置的具有选拔性质的初试考试科目。
其目的是科学、公平、有效地测试考生掌握《生物化学》课程的基础知识、基本理论、基本方法的水平和分析问题、解决问题的能力,为择优录取、确保专业学位硕士研究生的入学质量。
在考试形式和试卷结构等方面有如下要求:(一)试卷满分及考试时间试卷满分为150分,考试时间为180分钟。
(二)答题方式答题方式为闭卷、笔试。
(三)试卷内容结构题型:名词解释、选择题、判断题、填空题、问答题、计算题和论述题。
二、评价目标《生物化学》在考查考生对生物化学基础知识、基本理论理解的基础上,注重考查理论联系实际的能力,说明、提出、分析和解决这些学科中出现的现象和问题。
正确地理解和掌握有关的基本概念、理论、假说、规律和论断;运用掌握的基础理论知识和原理,可以就某一问题设计出实验方案;准确、恰当地使用专业术语,文字通顺、层次清楚、有论有据、合乎逻辑地表述。
三、参考书1. 魏民等主编,《生物化学简明教程》,高等教育出版社(第六版),2020。
2. 朱圣庚徐长法主编,《生物化学》,高等教育出版社(第四版),2017年。
四、考核内容第1章氨基酸、肽和蛋白质考核要点:氨基酸的结构、酸碱性质及氨基酸的化学反应,氨基酸的光学活性;氨基酸混合物分析分离的原理及技术。
肽的结构、蛋白质的一级结构及其测定方法。
主要考核内容:1.氨基酸—蛋白质的单体亚基蛋白质的水解;α-氨基酸的一般结构2.氨基酸的酸碱性质氨基酸的解离;氨基酸的等电点3.氨基酸的化学反应α-羧基参加的反应;α-氨基参加的反应;α-氨基和羧基共同参加的反应4.氨基酸的旋光性和光谱性质氨基酸的旋光性和立体化学;氨基酸的光谱性质6. 氨基酸混合物的分析和分离分配层析法的一般原理;分配柱层析;纸层析;薄层层析;离子交换层析7. 肽肽和肽键的结构;肽的物理和化学性质8. 蛋白质的组成、分类、分子大小和结构层次蛋白质的化学组成和分类;蛋白质分子的形状和大小;蛋白质分子结构的组织层次9. 蛋白质的一级结构蛋白质的氨基酸序列决定蛋白质的功能;蛋白质化学测序的策略10. 蛋白质测序的一些常用方法末端残基分析;二硫键的断裂;氨基酸组成的分析;多肽链的部分裂解;肽段氨基酸序列的测定;肽段在原多肽链中的次序的确定;二硫键位置的确定11. 氨基酸序列与生物进化序列的同源性、同源蛋白质和蛋白质家族;同源蛋白质氨基酸序列的物种差异;同源蛋白质具有共同的进化起源第2章蛋白质的三维结构考核要点:肽键的性质、蛋白质的二级结构、超二级结构、结构域、三级结构、四级结构和亚基缔合;蛋白质的变性主要考核内容:1.蛋白质三维结构的概述蛋白质构象主要由弱相互作用稳定;肽键具有刚性和平面的性质;多肽主链的折叠受到空间位阻的限制2.蛋白质的二级结构α螺旋;氨基酸序列影响α螺旋的稳定性;β构象;β转角和Ω环;无规卷曲3.纤维状蛋白质α-角蛋白;丝心蛋白和β-角蛋白:胶原蛋白;弹性蛋白4.蛋白质超二级结构和结构域超二级结构;结构域5.球状蛋白质与三级结构三级结构的形成;球状蛋白质三级结构的特征;球状蛋白质三级结构/结构域的类型6.四级结构和亚基缔合有关四级结构的一些概念;四级缔合的驱动力;亚基相互作用的方式7.蛋白质的变性、折叠和结构预测蛋白质的变性;氨基酸序列规定蛋白质的三维结构;蛋白质肽链折叠的动力学和蛋白质结构的预测第3章蛋白质的生物学功能考核要点:通过学习血红蛋白、肌红蛋白结构与功能的关系,理解蛋白质结构与功能的关系主要考核内容:1. 蛋白质功能的多样性2. 氧结合蛋白质—肌红蛋白:贮存氧肌红蛋白的三级结构;辅基血红素;O2与肌红蛋白的结合;O2的结合改变肌红蛋白的构象3. 氧结合蛋白质—血红蛋白:转运氧血红蛋白的结构;氧结合引起的血红蛋白构象变化;血红蛋白的协同性氧结合(Hb氧结合曲线);H+、CO2和BPG对血红蛋白结合氧的影响4. 血红蛋白分子病分子病是遗传的;镰刀状细胞贫血病第4章蛋白质的性质、分离纯化和鉴定考核要点:蛋白质酸碱性质、胶体性质和蛋白质沉淀,蛋白质分离纯化的方法与原理主要考核内容:1.蛋白质在水溶液中的行为蛋白质的酸碱性质;蛋白质的胶体性质和蛋白质沉淀2. 蛋白质分离纯化的一般程序3. 蛋白质分离纯化的方法等电点沉淀和盐析、有机溶剂分级分离、透析和超滤、密度梯度超速离心、凝胶过滤、凝胶电泳、等电聚焦和双向电泳、离子交换层析、疏水相互作用层析、亲和层析和高效液相层析4. 蛋白质相对分子质量的测定凝胶过滤法测定相对分子质量、SDS-PAGE测定相对分子质量和沉降速度法测定相对分子质量5. 蛋白质的含量测定与纯度鉴定第5章酶的催化作用考核要点:酶的化学本质及其分类和命名;酶的专一性;酶的活力测定;核酶的概念主要考核内容:1.酶是生物催化剂酶与一般催化剂的共同点;酶作为生物催化剂的特点2.酶的化学本质及其组成酶的化学本质;酶的化学组成;单体酶、寡聚酶、多酶复合物3.酶的命名和分类习惯命名法;国际系统命名法;国际系统分类法及酶的编号;六大类酶的特征和举例4.酶的专一性酶的专一性;有关酶作用的专一性的假说5.酶的活力测定和分离纯化酶活力的测定;酶的分离纯化6. 非蛋白质生物催化剂—核酶核酶(ribozyme)的概念;核酶的种类;核酶的研究意义及应用前景第6章酶动力学考核要点:米氏方程和米氏常数的意义;酶的抑制作用;温度、PH及激活剂对酶促反应的影响主要考核内容:1.化学动力学基础化学反应速率及其测定;反应分子数和反应级数;各级反应特征2.底物浓度对酶促反应速率的影响中间复合物学说;酶促反应的动力学方程式;多底物的酶促反应动力学3.酶的抑制作用抑制程度的表示方法;抑制作用的类型;可逆抑制作用和不可逆抑制作用的鉴别;可逆抑制作用动力学;一些重要的抑制剂4.温度对酶促反应的影响5.PH对酶促反应的影响6.激活剂对酶促反应的影响第7章酶作用机制和酶活性调节考核要点:酶活性部位的概念和特点;酶促反应机制及酶活性的别构调节;酶活性的共价调节;同工酶的概念主要考核内容:1.酶的活性部位酶活性部位的特点;研究酶活性部位的方法2.酶催化反应的独特性质3.酶促反应机制酸碱催化;共价催化;金属离子催化;底物和酶的邻近效应与定向效应;底物的形变和诱导契合;多元催化和协同效应;活性部位微环境的影响4.酶活性的别构调节酶的别构效应和别构酶的性质5.酶活性的共价调节酶的可逆共价修饰类型;酶的不可逆共价调节—酶原的激活6.同工酶第8章核酸的结构和功能考核要点:核酸和核苷酸的组成和结构;DNA的结构和功能;RNA的结构与功能主要考核内容:1.核酸的发现2.核酸的种类和分布3.核酸的化学组成4.DNA的结构和功能5.RNA的结构与功能第9章核酸的物理化学性质和研究方法考核要点:核酸的水解;核酸的紫外吸收;核酸的变性、复性及杂交;核酸的分离纯化主要考核内容:1.核酸的水解2.核酸的酸碱性质3.核酸的紫外吸收4.核酸的变性、复性和杂交5.核酸的分离和纯化第10章维生素和辅酶考核要点:维生素的概念、分类及生物学功能;B族维生素与其相应辅酶的关系主要考核内容:1.维生素概论2.脂溶性维生素维生素A;维生素D;维生素E;维生素K3.水溶性维生素维生素B1和硫胺素焦磷酸;维生素PP和烟酰胺辅酶;维生素B2和黄素辅酶;泛酸和辅酶A;维生素B6和磷酸吡哆醛、磷酸吡哆胺;维生素B12(氰钴胺素)及其辅酶;生物素;叶酸和四氢叶酸;硫辛酸;维生素C第11章新陈代谢总论考核要点:新陈代谢的基本概念和原理;新陈代谢的研究方法主要考核内容:1. 新陈代谢的基本概念和原理2. 新陈代谢的研究方法第12章生物能学考核要点:自由能的概念和标准自由能,生物体内ATP与磷酰基转移主要考核内容:1. 自由能的概念2. 标准自由能变化3. ATP与磷酰基转移第13章六碳糖的分解和糖酵解作用考核要点:糖酵解作用的反应机制及能量转变;丙酮酸的去路及糖酵解作用的调节主要考核内容:1. 糖酵解过程概述2. 糖酵解第一阶段的反应机制葡萄糖的磷酸化;葡萄糖-6-磷酸异构化形成果糖-6-磷酸;果糖-6-磷酸形成果糖-1,6-二磷酸;果糖-1,6-二磷酸转变成甘油醛-3-磷酸和二羟丙酮磷酸;二羟丙酮磷酸转变为甘油醛-3-磷酸3. 糖酵解第二阶段的反应机制甘油醛-3-磷酸氧化成1,3-二磷酸甘油酸;1,3-二磷酸甘油酸转移高能磷酸键基团形成ATP;3-磷酸甘油酸转变为2-二磷酸甘油酸;2-二磷酸甘油酸脱水生成磷酸烯醇式丙酮酸;磷酸烯醇式丙酮酸转变成丙酮酸并产生一个ATP分子4. 由葡萄糖转变为两分子丙酮酸能量转变的估算5. 丙酮酸的去路6. 糖酵解作用的调节磷酸果糖激酶是关键酶;2,6-二磷酸果糖对酵解的调节作用;己糖激酶和丙酮酸激酶对糖酵解的调节作用第14章柠檬酸循环考核要点:丙酮酸的脱氢脱羧过程及柠檬酸循环过程;能量转换及调控主要考核内容:1. 丙酮酸转化成乙酰辅酶A的过程2. 柠檬酸循环草酰乙酸与乙酰-CoA缩合形成柠檬酸;柠檬酸异构化形成异柠檬酸;异柠檬酸氧化形成α-酮戊二酸;α-酮戊二酸氧化脱羧形成琥珀酰-CoA;琥珀酰-CoA 转化成琥珀酸并产生一个高能磷酸键;琥珀酸脱氢形成延胡索酸;延胡索酸水合形成L-苹果酸;L-苹果酸脱氢形成草酰乙酸3. 柠檬酸循环的化学总结算4. 柠檬酸循环的调控5. 柠檬酸循环在代谢中的双重角色6. 乙醛酸途径第15章氧化磷酸化作用考核要点:电子传递和氧化磷酸化作用主要考核内容:1.氧化还原电势氧化-还原电势;生物体中某些重要的氧化-还原电势;电势和自由能的关系;标准电动势和平衡常数的关系2.电子传递和氧化呼吸链呼吸链概念的建立;电子传递链;电子传递过程;电子传递的抑制剂3. 氧化磷酸化作用氧化磷酸化作用机制;质子梯度的形成;ATP合成机制;氧化磷酸化的解偶联和抑制;细胞溶胶内NADH的再氧化;氧化磷酸化的调控;一个葡萄糖分子彻底氧化产生ATP分子数的总结算第16章戊糖磷酸途径考核要点:戊糖磷酸途径及其生物需意义主要考核内容:1.戊糖磷酸途径的主要反应2.戊糖磷酸途径反应速率的调控3.戊糖磷酸途径的生物学意义第17章糖异生和糖的其他代谢途径考核要点:糖异生作用的途径及其调控主要考核内容:1.糖异生作用糖异生作用的途径;糖异生途径总览;由丙酮酸形成葡萄糖的能量消耗及意义;糖异生作用的调节;乳酸的再利用和可立氏循环2.乙醛酸途径第18章糖原的分解和生物合成考核要点:糖原的降解和合成过程主要考核内容:1.糖原的生物学意义2.糖原的降解糖原磷酸化酶;糖原脱支酶;磷酸葡萄糖变位酶的作用;6-磷酸葡糖磷酸酶3.糖原的生物合成催化糖原合成的三种酶4.糖原代谢的调控糖原磷酸化酶的调节机制;糖原合酶的调节机制;G蛋白及其对激素信号的传递作用第19章脂质的代谢考核要点:脂肪酸的氧化;不饱和脂肪酸的氧化;酮体的生成;脂质的生物合成主要考核内容:1.脂肪酸的氧化脂肪酸的活化;脂肪酸转入线粒体;β-氧化;脂肪酸氧化是高度放能过程2.不饱和脂肪酸的氧化不饱和脂肪酸的氧化;奇数碳原子脂肪酸的氧化生成丙酰-CoA;脂肪酸还可发生α-或ω-氧化3.酮体乙酰-CoA的代谢结局;肝中酮体的形成;肝外组织使用酮体作为燃料4.脂肪酸代谢的调节5.脂质的生物合成贮存脂肪;脂肪酸的生物合成;脂酰甘油的生物合成;磷脂类的生物合成;其他脂类的生物合成第20章蛋白质降解和氨基酸的分解代谢考核要点:蛋白质的降解,氨基酸的分解代谢、尿素的形成过程;氨基酸碳骨架的氧化途径;生糖氨基酸和生酮氨基酸;氨基酸与一碳单位主要考核内容:1.蛋白质降解蛋白质降解的特性;蛋白质的降解的反应机制;机体对外源蛋白质的需要及其消化作用2.氨基酸的分解代谢氨基酸的脱氨基作用;氧化脱氨基作用:其他的脱氨基作用;联合脱氨基作用;氨基酸的脱羧基作用;氨的命运3.尿素的形成尿素循环的发现;尿素循环;尿素循环的调节4.氨基酸碳骨架的氧化途径形成乙酰-CoA的途径;α-酮戊二酸途径;形成琥珀酰-CoA的途径;形成延胡索酸途径;形成草酰乙酸途径5.生糖氨基酸和生酮氨基酸6.由氨基酸衍生的其他重要物质氨基酸与一碳单位;氨基酸与生物活性物质第21章氨基酸的生物合成和生物固氮考核要点:氨基酸的生物合成主要考核内容:1.氨的同化作用—氨通过谷氨酸和谷氨酰胺掺入生物分子2.氨基酸的生物合成由α-酮戊二酸形成的氨基酸—谷氨酸、谷氨酰胺、脯氨酸、精氨酸、赖氨酸;由草酰乙酸形成的氨基酸—天冬氨酸、天冬酰胺、甲硫氨酸、苏氨酸、赖氨酸;由丙酮酸族的氨基酸—丙氨酸、缬氨酸、亮氨酸;丝氨酸族的氨基酸—丝氨酸、甘氨酸、半胱氨酸;芳香族氨基酸及组氨酸的生物合成3.氨基酸生物合成的调节第22章核酸的降解和核苷酸代谢考核要点:核酸和核苷酸的分解代谢,核苷酸的生物合成主要考核内容:1.核酸和核苷酸的分解代谢核酸的降解;核苷酸的分解;嘌呤碱的分解;嘧啶碱的分解2.核苷酸的生物合成嘌呤核糖核苷酸的合成;嘧啶核糖核苷酸的合成;核苷一磷酸转变成核苷三磷酸;脱氧核糖核苷酸的合成。
西北大学生物无机化学第1章绪论PPT课件
随着分子生物学、结构生物学和计算化学等学科的交叉融合,生物无机化学的 研究手段和方法不断创新,为解决生命科学领域中的重大问题提供了有力支持。
未来的生物无机化学
未来展望
随着科技的不断进步和生命科学领域的需求日益增长,生物无机化学将进一步拓 展研究领域,深入探索生物分子间的相互作用机制和调控规律。
学习方法
认真听讲
在课堂上认真听讲,紧跟老师 思路,理解基本概念和原理。
记笔记
及时记录课堂上的重点和难点 ,便于课后复习巩固。
多做练习
通过课后习题和实验操作,加 深对知识的理解和掌握。
参加学术讨论
积极参加学术讨论和交流,拓 宽视野,提高自己的科学素养
。
02
生物无机化学的发展历程
早期的生物无机化学
农产品质量与安全
生物无机化学在农产品质量与安 全领域的应用涉及重金属污染、 农药残留等方面的研究,为保障 食品安全提供科学依据。
在环境保护中的应用
1 2 3
环境污染治理
生物无机化学在环境污染治理领域的应用涉及重 金属污染、有机污染物的降解等方面,为环境修 复和治理提供技术支持。
生态毒理学
通过研究金属离子和有毒化学物质对生物体的毒 理作用,揭示其生态风险和健康危害,为环境质 量和健康评估提供依据。
西北大学生物无机化学第 1章绪论ppt课件
• 绪论 • 生物无机化学的发展历程 • 生物无机化学的研究内容 • 生物无机化学的应用 • 总结与展望
01
绪论
课程简介
生物无机化学
课程内容
是一门交叉学科,主要研究无机物质 与生物大分子的相互作用以及无机物 质在生物体内的代谢过程。
介绍生物无机化学的基本概念、研究 方法、重要元素在生物体内的存在形 式和功能等。
西北大学生物化学试题
西北大学生物化学试题西北大学2004年招收攻读硕士学位研究生试题科目名称:生物化学科目代码:461适用专业:微生物学、细胞生物学、中药学、生态学、生物化学与分子生物学共4页一、将下列描述生物化学概念的句子翻译成中文(每小题1.5分,共15分)1. The aim of biochemistry is to understand life in molecular terms.2. The major biopolymers included the nucleic acids, the proteins, andthe polysaccharides. All are polymers made up of one or more kinds of monomer units.3. Most of the unique properties of water are due to its hydrogen bondingpotential and its polar nature.4. Many biological molecules are weak acids or weak bases.5. The Watson-Crick model for DNA was a two-strand, antiparalleldouble helix with 10 base pairs per turn. Pairing was A-T and G-C. 6. Protein molecules have four levels of structural organization: primary,secondary, tertiary, and quaternary structure.7. The major lipid components of biological membranes areglycerophospholipids, sphingolipids, glycolipids, and glycoglycerolipids.8. Sugar phosphates are important intermediates in metabolism,functioning as activated compounds in syntheses.9. The Michaelis constant, K M, measures the substrate concentration atwhich the reaction rate s V max/2.10. ATP is synthesized by three major routes-substrate-levelphosphorylation, oxidative phosphorylation, andphotophosphorylation.二、名词解释:(每小题2分,共20分)1.酸性氨基酸 2.Sanger反应 3.蛋白质变性与复性4.酶的活性中心 5.氧化磷酸化 6.脂肪酸的β-氧化7.限制性内切酶 8.单顺反子 9.联合脱氨基作用10.第二信使三、填空题(每空1分,共25分,请将答案写在答题纸上)1.三羧酸循环中有()次脱氢反应,脱下的氢以()和()形式进入呼吸链。
西北大学考研真题生化演示教学
4、上述9肽中含有的碱性氨基酸是:________。
A.组氨酸,精氨酸B.精氨酸,赖氨酸C.谷氨酸,赖氨酸D.丝氨酸,酪氨酸
5、下列哪组的物质与颜色反应的组合是错误的?______。
A. Arg-坂口反应B.多肽-双缩脲反应C.氨基酸-茚三酮反应D. Phe-偶氮反应
2、Diabetes, the inability to assimilate and metabolize blood glucose, afflicts millions of people. People with type 1 diabetes are unable to synthesize and secrete insulin. On the other hand, people with type 2 diabetes make sufficient insulin, but the molecular pathways that respond to insulin are defective. Many type 2 diabetic people exhibit a condition termed “insulin resistance”before the onset of diabetes. Gluconeogenesis inhibitors may be the next wave in type 2 diabetes therapy. Drugs targeting one of the enzyme unique to gluconeogenesis can blocks this pathway without affecting glycolysis.
西北大学《338生物化学》考研练习题库
西北大学《338生物化学》考研练习题库2021年西北大学生命科学学院《338生物化学》考研全套目录•[预售]全国名校工程硕士《338生物化学》考研真题精选及详解•[预售]工程硕士《338生物化学》名校考研真题汇编说明:本科目考研真题不对外公布(暂时难以获得),通过分析参考教材知识点,精选了有类似考点的其他院校相关考研真题,部分真题提供了答案详解。
2.教材教辅•王镜岩《生物化学》(第3版)(上册)配套题库【考研真题精选+章节题库】•王镜岩《生物化学》(第3版)(下册)配套题库【考研真题精选+章节题库】•王镜岩《生物化学》(第3版)网授精讲班【52课时】说明:以上为本科目参考教材配套的辅导资料。
•试看部分内容考研真题精选一、选择题1下列哪种糖无还原性?()[暨南大学2019研]A.麦芽糖B.蔗糖C.阿拉伯糖D.木糖【答案】B查看答案【解析】B项,蔗糖由一分子葡萄糖与一分子果糖缩合而成,不具游离异头碳,没有醛基而无还原性;A项,麦芽糖由两分子葡萄糖缩合而成,具游离异头碳,有醛基而有还原性;CD两项,阿拉伯糖和木糖有醛基而有还原性。
2下列关于葡萄糖的陈述,正确的是()。
[厦门大学2014研]A.由于葡萄糖分子中有醛基,所以它能与Schiff试剂起加成反应B.醛式葡萄糖转变成环状后就失去了还原性C.葡萄糖形成葡萄糖甲基苷后,仍然具有还原性D.葡萄糖和甘露糖是差向异构体【答案】D查看答案【解析】A项,葡萄糖分子中的醛基在环状结构中变成了半缩醛基,所以其醛基不如一般醛类的醛基活泼,不能和Schiff试剂反应。
BC两项,糖的还原性是因为含有还原性基团(如游离醛基或游离酮基)。
D项,与葡萄糖互为差向异构体的有:甘露糖,阿洛糖,半乳糖。
3磷脂酰肌醇分子中的磷酸肌醇部分是这种膜脂的哪个部分?()[暨南大学2019研]A.亲水尾部B.疏水头部C.极性头部D.非极性尾部【答案】C查看答案【解析】磷脂酰肌醇具有一个与磷酸基团相结合的极性头和两个非极性的尾,其中磷酸肌醇是极性头部,两个非极性的尾为脂肪酸链。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a.恶性贫血b.坏血病c.糙皮病d.佝偻病e.脚气病
13.与视蛋白结合构成视紫红质的物质是:
a.全反式视黄醛b.全反式视黄醇c.11—顺式视黄醛
d.11—顺式视黄醇e.以上都不是
14.腺苷酸环化酶存在于:
a.内质网系膜b.细胞核c.质膜
d.线粒体e.核糖体
如不考虑次要因素,它们在葡聚糖凝胶G-75柱上分离时,流出的先后次序将是:()最先,(),()其次,最后流出的蛋白质将是()。
如选用羧甲基纤维素柱分离上面四种蛋白质,并用盐浓度梯度洗脱,则流出的先后次序将是:(),(),()和()。
4.许多核酸酶活性能被螯合剂()所抑制,是因为()。
5.生物体内有一些核苷酸衍生物可作为辅酶而起作用,如()、()、()、()等。
13.某些酶的Km值可能由于结构上与底物无关的代谢物的存在而改变。
14.3ˊ,5ˊ一环化腺苷酸(cAMP)是一切激素的第二信使。
15.Southern印迹法、Northern印迹法和Western印迹法是分别用于研究DNA、RNA和蛋白质转移的有关技术。
二.填空题(每空一分,共25分)
1.茚三酮与脯氨酸反应时,在滤纸层析谱上呈现()色斑点。
9.对于一个符合米氏方程的酶来说,当[S]=Km;[I]=KI时,I为竞争性抑制剂,则V为:
a.Vmax×2/3 b.Vmax×1/3 c.Vmax×1/2
d.Vmax×1/4 e.Vmax×1/6
10.下列哪一股RNA能够形成局部双螺旋?
a.AACCGACGUACACGACUGAA b.AACCGUCCAGCACUGGACGC
2.两条相当伸展的肽链或同一条肽链的两个伸展的片段之间形成氢键的结构单元称为()。
3.现欲分离某蛋白质溶液中的四个蛋白质成分,它们的分子量和等电点如下:
A M.W=12,000 pI=10.0
B M.W=62,000 pI=4.0
C M.W=28,000 pI=7.0
D M.W=9,000 pI=5.0
3.提高盐浓度可以使DNA分子的溶点(Tm)升高。
4.各种激素都需通过细胞膜表面受体的结合才能产生生物效应。
5.内部氢键的形成是驱动蛋白质折叠的主要相互作用。
6.蛋白质生物合成之后的共价修饰,都属于不可逆的共价修饰。
7.增强子可以远距离和无方向性地增强基因的表达。
8.逆流分溶和纸层析,这两个分离氨基酸的方法是基于同一原理。
18.关于有氧条件下,NADH从胞液进入线体氧化的机制,下列哪项描述是正确的?
a.NADH直接穿过线粒体膜而进入
b.磷酸二羟丙酮被NADH还原成3-磷酸甘油进入线粒体,在内膜上又被氧化成磷酸二羟丙酮同时生成NADH
c.草酰乙酸被还原称苹果酸,进入线粒体后再被氧化成草酰乙酸,停留于线粒体内
d.草酰乙酸被还原成苹果酸进入线粒体,然后再被氧化成草酰乙酸,再通过转氨基作用生成天冬氨酸,最后转移到线粒体外
c.GUCCAGUCCAGUCCAGUCCA d.UGGACUGGACUGGACUGGAC
e.AACCGUCCAAAACCGUCAAC
11.下列哪一种化合物的名称与所给出的维生素名称不符?
a.α-生育粉酚—维生素Eb.硫胺素—维生素B1
c.抗坏血酸—维生素C d.氰钴胺素—维生素B12
e.吡哆醛—维生素B2
a.2ˊ-5ˊb.3ˊ-5ˊc.3ˊ-3ˊd.5ˊ-5ˊe.3ˊ-3ˊ
7.DNA与RNA两类核酸分类的主要依据是:
a.空间结构不同b.所含碱基不同c.核苷酸之间连接方式不同
d.所含戊糖不同e.在细胞中存在的部位不同
8.SnRNA的功能是:
a.作为mRNA的前身物b.促进DNA合成c.催化RNA合成
d.使RNA的碱基甲基化e.促进mRNA的成熟
4.维持蛋白质三级结构主要靠:
a.疏水相互作用b.氨键c.盐键d.三硫键e.范德华力
5.前胰岛素原信号肽的主要特征是富含下列哪种氨基酸残基?
a.碱性氨基酸残基b.酸性氨基酸残基c.羟氨基酸残基
d.疏水氨基酸残基e.亲水性氨基酸残基
6.真核生物mRNA的帽子结构中,m7G与多核苷酸链通过三个磷酸基连接,连接方式是:
9.一般讲,从DNA分子的三联体密码中可以推定氨基酸的顺序;相反从氨基酸的顺序也可以推定DNA的顺序。
10.转录时,大肠杆菌RNA聚合酶核心酶(α2ββˊ)能专一识别DNA的启始信号。
11.在完整的偶联线粒体中,NADH氧化时能生成ATP,反过来ATP能使NAD+还原。
12.氨基酸的分解代谢总是先脱去氨基,非氧化脱氨基作用普遍存在于动植物中。
15.基因工程技术的创建是由于发现:
a.反转录酶b.末端连接酶c.DNA连接酶
d.Ⅱ型限制性内切酶e.Taq酶
16.测定酶活力时,下列条件哪个不对?
a.[S]>>[E] b.[S]=[Et] c.[P]→0 d.测初速度e.最适pH
17.肌肉中能量的主要储存形式是下列那一种?
a.ADP b.磷酸烯醇式丙酮酸c.cAMP d.ATP e.磷酸肌酸
三.选择题(选择一个最佳答案,每题一分,共30分)
1.下列氨基酸中,哪一种含氮量最高?
a.Arg b.His c.Gln d.Lys e.Pro
2.甲状腺素是哪一种物质的衍生物?
a.Thr b.Trp c.Tyr d.硫胺素e.酪胺
3.在一个肽平面中,能自由旋转的价键有几个?
a.2 b.3 c.4 d.5 e.6
西北大学2001年攻读硕士学位研究生试题
科目名称:生物化学科目代码:
适用专业:微生物学、动物学、植物学共6页
注意:答案请写在答题纸上,否则无效。
一.判别正误(正确的画+,错误的画—;15分)
1.蛋白质分子中个别氨基酸的取代未必会引起蛋白质活性的改变。
2.凡速度(V)对底物浓度([S])作图有S形曲线的酶都是别构酶。
e.通过肉毒碱进行转运ຫໍສະໝຸດ 入线粒体6.大肠杆菌生长在乳糖培养基上时,乳糖与()结合而使其失活,结构基因开放,合成出三种诱导酶。
7.大肠杆菌色氨酸操纵子的转录受()和()两种机制的控制,前者通过()控制转录的起始,后者通过()控制转录起始后是否进行下去。
8.细胞色素是一类(),在线粒体内膜上起()作用。
9.蛋白激酶对糖代谢的调节在于调节()酶和()酶。
