第九单元课题3《溶质的质量分数》(第一课时)课件
合集下载
课题3_溶质的质量分数

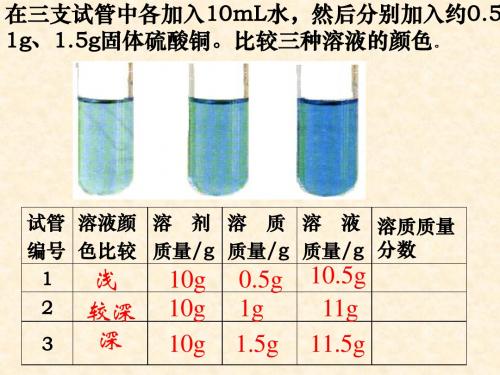
2 10 12 16.7% 规律: 有色溶液来说 来说, 规律:对有色溶液来说,溶液中溶质的质量分数 越大,溶液的颜色就越深。 越大,溶液的颜色就越深。
实验 9-6
讨论: 讨论:按下表所定的量配制氯化钠溶液
溶质质量/g 溶质质量/g
10 20
溶剂( 溶剂(水)质量/g 质量/g
90 80
溶液中溶质质量分数 10% 20%
例3、在农业上,常需要用质量分数为16%的 在农业上,常需要用质量分数为16%的 16% 氯化钠溶液来选种。配制150kg这种溶液, 150kg这种溶液 氯化钠溶液来选种。配制150kg这种溶液, 需要氯化钠和水的质量各是多少? 需要氯化钠和水的质量各是多少? 解:氯化钠: 150kg×16%=24kg 氯化钠: 150kg× 150kg水: 150kg-24kg=126kg 答:需食盐24kg,水126kg。 需食盐24kg,水126kg。 24kg, 练习: 4.5g食盐可配制0.9%的生理食盐水多 练习:用4.5g食盐可配制0.9%的生理食盐水多 食盐可配制0.9% 少克? 少克?
设蒸发水的质量为χ χ 40gX5%=(40g- χ )X10%
方法三: 方法三:加入更浓的溶液
如果加入20%的氯化钙溶液,需加多少克? 设加入20%的氯化钙溶液的质量为χ χ 40gX5%+ χ ·20% =(40g+ χ )X10%
6、饱和溶液溶质质量分数的计算
溶质的质量分数 是指: 溶液中含有 溶质的质量分数36% 是指:100g溶液中含有 质量分数 溶液 36g溶质。 溶质。 溶质 溶质T 时溶解度36g是指:在T0C 时,100g 是指: 溶质 0C时溶解度 是指 溶剂中最多溶解该溶质 。 中最多溶解该溶质36g。 溶剂中最多溶解该溶质 T0C时饱和溶液 时 的溶质质量分数 =
《溶质的质量分数》(化学精品课件)
投入49克稀硫酸中,恰好完全反应,生成0.2克氢 气,试求: (1)黄铜中锌的质量分数是多少? (2)反应后所得溶液的溶质的质量分数是多少?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
6、根据图示回答下列问题 溶 解 度
30
N
0
.t
.
.
A B C
M
1
t2 t3
温度(℃)
4、将三种物质的饱和溶液由t3℃降低到t1℃时, 1、将t3℃时三种物质的饱和溶液降低温度至 2.在t3℃时,将100克A、B、C三物质的饱和溶液 所得溶液中溶质的质量分数由大到小顺序为 5.若想分离A、B两物质,应该用 法。 t1℃,有晶体析出的是 ,析出晶体质量最多 3、t3℃时,将接近饱和的C物质溶液变成饱 ____________. 分别蒸发10克水,析出晶体的质量关系是____. 若从A溶液中得到全部的A,宜采用的方法是__ 的是 。 和溶液,可采用的方法是_________.
饱和溶液的
溶解度
溶质质量分数=
100g+溶解度
S>A 则S与A的大小关系是_____________.
想一想,练一练:
1. 10℃时硝酸钾的溶解度为ag,其饱和溶液的溶 质质量分数为b%,60℃时硝酸钾的溶解度为 cg,下列数值关系正确的是 ( C )
A. a=b, a<c B. a<b < c C. b<a <c D. c<a <b
六朝古都南京的一些古代建筑保存完好,这与所用 的建筑材料有关。该小组从某古代建筑维修现场搜 集了一些旧墙灰进行研究。取12.O g旧墙灰(主要 成分是碳酸钙)放入烧杯中,并加入足量稀盐酸(假 设其他杂质不参加反应,不考虑H20、HCl逸出)。 反应开始时,烧杯及所盛物质的总质量为300.0 g。 实验数据记录如下:
现有石灰石22.2克加到盛有146克稀盐酸 的烧杯中,恰好完全反应,反应后烧杯中的物质 质量为159.4克. (杂质不与盐酸反应)求: (1)、生成二氧化碳多少克? (2)、稀盐酸的质量分数? (3)、石灰石中碳酸钙的质量分数? (4)、反应后所得溶液的质量分数?
【核心素养】课题3《溶质的质量分数》课件

二氧化碳的体积 = 8.8g÷1.977g/L = 4.5L
答:CO2的质量为8.8g;CO2的体验室用100g稀硫酸和多少g锌恰好完全反应可制得0.8g氢气。
A解:设所需锌的质量为 X
H2SO4 + Zn = ZnSO4 + H2↑ 98 65
100g X
(人教版)九年级化学 下
第九单元 课题3
溶质的质量分数
内容总览
01 学习目标 02 新知导入 03 探究新知
04 课堂练习 05 课堂总结 06 分层作业
核心素养教学目标
01
掌握一种溶液组成 的表示方法——溶质的 质量分数,并能进行溶 质质量分数的简单计算。
02
掌握溶液稀释的方 法和计算。
03
掌握有关化学反应方程 式与溶质质量分数相结 合的计算。
溶质的质量分数
溶质的质量 溶液的质量
× 100%
溶质的质量 溶质质量+溶剂质量
×100%
探究新知 二、溶质的质量分数
在三支试管中各加入20mL水,然后分别加入约0.1g、0.5g 、 2g固体硫酸铜。 计算并比较三种溶液的溶质质量分数。
试管编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质质量分数
×100%
100g+溶解度
探究新知 三、溶质的质量分数的计算
1.计算溶液中溶质和溶剂的质量 【例题1】在农业生产中,常需要用质量分数为16%的氯化钠溶液来选种。现要配 制150kg这种溶液,需要氯化钠和水的质量各是多少?
【解】 溶质的质量分数
溶质质量 溶液质量
100%
溶质质量
溶液质量 ×溶质的质量分数
【解】 1.溶质的质量分数 = 7g × 100% = 20% 35g
人教版九年级下册化学 第九单元 溶液 课题3 第1课时 溶液的溶质质量分数

(1) 10
90
100
(2) 20
80
100
(3) 50
100
150
(4) 40
10
50
溶质的质量分数 10%
20% 33.3% 80%
知识点 2:溶液的稀释
4.如果将 100 g 溶质质量分数为 20%的硝酸钾溶液稀释成溶质质量分数
为 10%的硝酸钾溶液,需加水的质量为
(C )
A.50 g
B.90 g
C.100 g
D.200 g
5.在 200 g 16%的 KNO3 溶液中加入 8 g KNO3,全部溶解后所得溶液的质 量为 22008 8g,其中 KNO3 的质量为 440 0g,溶剂的质量为 11668 8g,溶质的 质量分数为 1199..2%2%。
6.某食盐溶液中,溶质的质量分数为 20%,它表示 A.100 g 水中溶解 20 g 食盐 B.食盐溶液中食盐与水的质量比为 1∶5 C.100 mL 食盐溶液中含有 20 mL 食盐 D.每 100 g 溶液中含有 20 g 食盐
C.蒸发掉 50 g 水
D.加入 100 g 10%的 NaCl 溶液
11.现有一杯 20 ℃恰好饱和的硝酸钾溶液,欲改变其溶质质量分数。下
列方法可行的是
(D )
A.加入一定量的硝酸钾
B.恒温蒸发水分
C.升温到 60 ℃
D.加入一定量的水
12.20 ℃时 KCl 的溶解度是 34 g。取 65 g KCl 溶液放入甲烧杯中,按 如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是( D ) A.甲烧杯中是 KCl 的饱和溶液 B.乙和丙烧杯中 KCl 的质量分数相等 C.丁烧杯中 KCl 的质量分数为 34% D.若乙烧杯中溶液恰好饱和,则 40 ℃时 KCl 的溶解度为 40 g
课题3 溶质的质量分数 课时1 (2012新版教材同步课件)

0.1g硫酸铜 0.5g硫酸铜 2g硫酸铜
1
2
3
【实验9-5】哪种溶液浓
试管 溶液颜 溶 剂 溶 质 溶 液
编号 色比较 质量/g 质量/g 质量/g 1 2 3
浅
较深
20g
20g
0.1g
0.5g
20.1g
20.5g
深
20g
2g
22g
归纳:对有色溶液来说,根据颜色深 浅可以区分溶液是浓还是稀。
一.溶质的质量分数
⑵相同温度下,同种物质的饱和溶液 比不饱和溶液浓。
【实验9-8】按下表所定的量配制氯化钠溶液。
溶质质量/g 溶剂(水)质量/g 溶质质量分数
10 20
90 80
10%
20%
二、溶质质量分数的有关计算
例1:20g食盐溶液中含有 2g食盐,求: 该溶液的溶质质量分数。 2g 解: ×100% =10% 20g
一、溶质的质量分数 1、溶质的质量分数
溶质质量(g) 100% 溶液质量(g) 溶质质量(g) 溶质质量(g)+溶剂质量(g)
100%
溶质质量 = 溶液质量×溶质的质量分数 2、溶液稀释前后,溶质的质量不变
3、t℃时,某物质的溶解度为S,则t℃,该物质饱和溶液中 S 100% 溶质的质量分数 S +100g
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水? 解: 含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g 答:含食盐0.8克,含水39.2克。
二、溶质质量分数的有关计算
例题3(教材例1)在农业生产上,常需要用质量分 数为16%的氯化钠溶液来选种。现要配制150kg 这种溶液,需要氯化钠和水的质量各是多少? 解: 溶质的质量分数=
1
2
3
【实验9-5】哪种溶液浓
试管 溶液颜 溶 剂 溶 质 溶 液
编号 色比较 质量/g 质量/g 质量/g 1 2 3
浅
较深
20g
20g
0.1g
0.5g
20.1g
20.5g
深
20g
2g
22g
归纳:对有色溶液来说,根据颜色深 浅可以区分溶液是浓还是稀。
一.溶质的质量分数
⑵相同温度下,同种物质的饱和溶液 比不饱和溶液浓。
【实验9-8】按下表所定的量配制氯化钠溶液。
溶质质量/g 溶剂(水)质量/g 溶质质量分数
10 20
90 80
10%
20%
二、溶质质量分数的有关计算
例1:20g食盐溶液中含有 2g食盐,求: 该溶液的溶质质量分数。 2g 解: ×100% =10% 20g
一、溶质的质量分数 1、溶质的质量分数
溶质质量(g) 100% 溶液质量(g) 溶质质量(g) 溶质质量(g)+溶剂质量(g)
100%
溶质质量 = 溶液质量×溶质的质量分数 2、溶液稀释前后,溶质的质量不变
3、t℃时,某物质的溶解度为S,则t℃,该物质饱和溶液中 S 100% 溶质的质量分数 S +100g
答:该溶液的质量分数是10%。
例2:40g 2%的食盐溶液中含有多少g 食盐和水? 解: 含食盐: 40g × 2% = 0.8 g 含 水: 40 g – 0.8g = 39.2 g 答:含食盐0.8克,含水39.2克。
二、溶质质量分数的有关计算
例题3(教材例1)在农业生产上,常需要用质量分 数为16%的氯化钠溶液来选种。现要配制150kg 这种溶液,需要氯化钠和水的质量各是多少? 解: 溶质的质量分数=
人教版-九年级化学课件-【第1课时 溶质的质量分数】

(3)溶质只能是已经溶解的那一部分,如20℃时, NaCl的溶 解度为36g,40gNaCl投入到100g水中,最多只能溶解 36gNaCl。
课堂教学展示 课堂小结
课题3 溶液的浓度
第1课时 溶质质量分数
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式: 溶质的质量分数
溶质质量 溶液质量
(2)饱和溶液变为不饱和溶液,溶质的质量分数 不一定变小,不饱和溶液变为饱和溶液,溶 质的质量分数不一定变大。
练习 有100g10%的盐酸溶液,要使其溶质质量 分数增大一倍,应采取的方法是( C ) ×A.把溶液的量倒掉一半 不变 ×B.溶质的质量增大一倍 不到一倍 C√ .将100g10%的盐酸与200g25%的盐酸混合 ×D.蒸发掉溶剂的质量是原溶液质量的一半
100%
课堂教学展示 课堂小结
二、溶质质量分数的计算
1.已知溶质、溶剂的质量,求溶质的质量分数。
2.已知溶液的质量分数和溶液的质量,求溶质、
溶剂的质量。
3.一定温度下的饱和溶液中:
溶质的质量分数
溶解度 100g 溶解度
100%
课堂教学展示 课后作业
1.从课后习题中选取; 2.完成练习册本课时的习题。
答:配制这样的氯化钠溶液需要氯化钠24kg,水126kg。 这是已知溶液的质量和溶质的质量分数求溶质
和溶剂的质量。
练习 下列几种硝酸钾溶液中溶质的质
量分数最大的是( D )
A.150g水溶解30g硝酸钾;
A.
30g 150g 30g
100%
B.15g硝酸钾溶解在85g水中; B.15g15g85g 100%
R·九年级化学下册
第九单元 溶液
课堂教学展示 课堂小结
课题3 溶液的浓度
第1课时 溶质质量分数
一、溶质的质量分数
1.定义:溶质的质量与溶液的质量之比。
2.公式: 溶质的质量分数
溶质质量 溶液质量
(2)饱和溶液变为不饱和溶液,溶质的质量分数 不一定变小,不饱和溶液变为饱和溶液,溶 质的质量分数不一定变大。
练习 有100g10%的盐酸溶液,要使其溶质质量 分数增大一倍,应采取的方法是( C ) ×A.把溶液的量倒掉一半 不变 ×B.溶质的质量增大一倍 不到一倍 C√ .将100g10%的盐酸与200g25%的盐酸混合 ×D.蒸发掉溶剂的质量是原溶液质量的一半
100%
课堂教学展示 课堂小结
二、溶质质量分数的计算
1.已知溶质、溶剂的质量,求溶质的质量分数。
2.已知溶液的质量分数和溶液的质量,求溶质、
溶剂的质量。
3.一定温度下的饱和溶液中:
溶质的质量分数
溶解度 100g 溶解度
100%
课堂教学展示 课后作业
1.从课后习题中选取; 2.完成练习册本课时的习题。
答:配制这样的氯化钠溶液需要氯化钠24kg,水126kg。 这是已知溶液的质量和溶质的质量分数求溶质
和溶剂的质量。
练习 下列几种硝酸钾溶液中溶质的质
量分数最大的是( D )
A.150g水溶解30g硝酸钾;
A.
30g 150g 30g
100%
B.15g硝酸钾溶解在85g水中; B.15g15g85g 100%
R·九年级化学下册
第九单元 溶液
溶质的质量分数课件(上课用)
例1、在农业上,常需要用质量分数 为16%的氯化钠溶液来选种。配制 150kg这种溶液,需要氯化钠和水 的质量各是多少?
解:需氯化钠的质量为:
150kg× 16%=24kg
需水的质量为:
150kg - 24kg=126kg
答:需NaCl的质量是24kg,水的质量是 126kg
练习: 1、100克10%的NaCl溶液,进行如下处理: (1)加入2g NaCl (2)蒸发10g水 (3)加入2g NaCl和10g水 求得到三份溶液的质量分数各是多少?
溶质T0C时溶解度36g是指: 在T0C 时,100g水最多溶解该溶质36g。
饱和溶液的
溶质质量分数=
溶解度
100g+溶解度
例1、已知20℃时食盐的溶解度为36g,求 20℃时食盐饱和溶液的溶质质量分数。
解:20℃时食盐饱和溶液的溶质质 量分数为 36g 100g+36g
答:略
=26.5%
填表二:
计算的依据 :
稀释前溶质质量 = 稀释后溶质质量
公式: m浓×c浓%= m稀×c稀%
浓缩前溶质质量 = 浓缩后溶质质量
例题2:化学实验室现有98%的浓硫酸,但在实 验中常需要用较稀的硫酸溶液。要把50g质量分 数为98%的浓硫酸稀释为质量分数为20%的 硫 酸溶液需要多少克水?
解:设稀释后溶液的质量为x
4:将25g石灰石(主要成份是CaCO3) 放入73 g稀盐酸中(石灰石中的杂质 不跟盐酸反应,也不溶于水)恰好完 全反应,生成8.8g二氧化碳气体求: (1).石灰石中碳酸钙的质量分数; (2).稀盐酸中溶质的质量分数;
三、配制一定溶质质量分数 的溶液
• 1、计算:溶质和溶剂的质量 • 2、称量和量取 • 3、溶解:搅拌至充分溶解 • 4、装瓶 • 配制溶液时常用仪器: • 托盘天平、量筒、烧杯、玻璃棒
2024-2025学年九年级化学人教版(2024)下册+9.3 溶质质量分数课件
课堂练习
3.在农业生产中,常需要用质量分数为 16% 的氯化钠溶液来选种。现要配制 150 kg 这种溶液,需要氯化钠和水的质量各是多少?
解:需要氯化钠的质量为150 kg ×16% =24 kg, 水的质量为150 kg -24 kg =126 kg。
答:需要氯化钠 24 kg,水 126 kg。
课堂练习
2.配制一定溶质质量分数的氯化钠溶液的过程如图所示:
(1)写出图中标号a仪器的名称: 量筒 。 (2)配制 50 g 质量分数为 15% 的氯化钠溶液,所需水的体积为 42.5 mL。 (水的密度为1 g/cm3)
课堂练习
(3)对配制的溶液进行检测,发现溶质质量分数偏小,其原因可能有 ABC 。 A.称量时,药品与砝码放反了 B.量取水的体积时,仰视读数 C.烧杯用水润湿内壁 D.装瓶时,有少量溶液洒出 (4)把 50 g 15% 的氯化钠溶液稀释成 5% 的氯化钠溶液,需加水 100 g。
第九单元 溶液
课题3 溶质质量分数
新课导入
如何判断溶液的浓稀? 能定量表示吗?
喷农药时,溶液太稀无法杀死 害虫和病菌;溶液太浓则对农 作物有害。
学习目标
1.认识溶质质量分数的含义,能进行有关溶质质量分数的简单计算。 2. 熟悉配制一定溶质质量分数溶液的步骤,能根据需要进行有关溶液的配 制。
知识全解
溶液质量 增加 减少 增加 减少
溶质质量分数 减小 增大 增大 减小
知识全解
溶液的稀释:加水稀释前后,溶液中溶质的质量不变。
知识全解
【实验】配制一定溶质质量分数的氯化钠溶液
【实验用品】 天平、称量纸、烧杯、玻璃棒、药匙、量简、胶头滴管、 空试剂瓶、空白标签。 氯化钠、蒸馏水。
9.3溶质的质量分数(第1课时溶质的质量分数)课件 2024-2025学年九年级化学人教版下册
20%
。60 ℃时,将
15 g甲加入50 g水中,充分溶解后,溶液中的溶质质量分数为
20% 。
(3)将60 ℃甲、乙的饱和溶液分别降温至 t ℃,有晶体析出的
是
甲
(选填“甲”或“乙”,下同),溶质质量分数减小的
是
甲
,溶质质量分数不变的是
量分数大小关系为
甲>乙
1
乙
,此时甲、乙溶液中的溶质质
。
2
3
溶质的质量分数
随堂检测
3. 海水淡化可采用膜分离技术,如图所示。对淡化膜右侧的海水加压,
水分子可以透过淡化膜进入左侧淡水池,而海水中的各种离子不能透过
淡化膜,从而得到淡水。对加压后右侧海水成分进行分析,正确的是
(
B )
A. 溶质质量减少
B. 溶剂质量减少
C. 溶液质量不变
D. 溶质质量分数减小
1
2
3
溶液浓。
第1课时
溶质的质量分数
课堂导学
知识点3:溶液配制计算
1. 用固体试剂配制一定浓度的溶液。
计算公式:溶质质量= 溶液质量
溶剂质量=
溶液质量
-
×
溶质质量
溶质的质量分数
。
自主学习:下册课本P48“例题1”
在实验室中用固体配制一定溶质质量分数溶液的步骤:
①计算所需固体和水的质量;
②用天平称量固体、量筒量取水;
稀释前溶液
质量。
第1课时
易错
提醒
溶质的质量分数
课堂导学
1.溶液稀释前后溶质质量不变。
2.如果已知溶液的体积,需要把体积换算成质量再代入公式进
9.3《溶质的质量分数》教学课件(第一课时)
[讨论 、20g 10%的盐水中 讨论] 讨论 的盐水中
求: 溶液的溶质的质量分数。 溶液的溶质的质量分数。
,
剩余溶液的溶质质量分数不变,仍 剩余溶液的溶质质量质的质量分数计算
例1:20℃时,食盐的溶解度为36克, 20℃时 食盐的溶解度为36克 36 (1)计算此温度下饱和食盐水的食盐的 (1)计算此温度下饱和食盐水的食盐的 质量分数? 质量分数? 36克 36克 =26.5% P%= P%= 100克 36克 100克+36克
2.配制 千克的生理盐水,需要氯 配制2千克的生理盐水 配制 千克的生理盐水, 化钠和水各多少克? 化钠和水各多少克?
(生理盐水为0.9%的氯化钠溶液) 生理盐水为 %的氯化钠溶液)
溶 质 质 量 分 数 计 算
[练习] 、20g 10%的盐水中放入 2g水或 2g食盐,求:所得溶液的溶质质量分数。 解: 20g X10% 加水: 9.1% 20g 2g 20g X10% 2g 加盐: 20g 2g 18.2%
【思考】从溶质质量分数 思考】从溶质质量分数20%的100克 的 克
食盐水中取出10克 食盐水中取出 克,这10克食盐水中溶 克食盐水中溶 质的质量分数为多少? 质的质量分数为多少?其中含多少克溶 含多少克溶剂?若取出20克 质?含多少克溶剂?若取出 克,其溶 质、溶剂又分别为多少? 溶剂又分别为多少? 【规律小结】
④将食盐与水按1:10的质量比配 将食盐与水按 : 的质量比配 成溶液
2.现有12g硝酸钾,要配制成15%的硝酸钾溶液,需 2.现有 现有12g硝酸钾 要配制成15%的硝酸钾溶液 硝酸钾, 的硝酸钾溶液, 要水的质量为多少? 要水的质量为多少?
【解】 设需要水的质量为X 设需要水的质量为X 12g 12g+X
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一组最稀,第三组最浓;依 据是溶液的颜色的深浅。
动动脑筋
能否直接判断前面实验中四组食盐溶液 的浓稀关系?如颜色?可以怎么表示?
不能;颜色不能,因为它们无色;
10克食盐/100克水,26克食盐/100克水, 30克食盐/100克水
听老师说
我们还可以用溶质的质量比溶液的质量, 就是溶质的质量分数。
36 解:溶质质量分数= ×100% 分析:20 ℃时氯化钠的溶解度是36 100+36
克,所以题目中36克食盐不能完全 溶解在50克水中,是饱和溶液,该 怎么做呢?
我会归纳
饱和溶液的质量分数=
S ×100% 100+S
我会归纳
质量分数计算的公式:
1、A%=
溶质质量 ×100% 溶液质量
2、m稀溶液溶液=m浓溶液+m水
溶质质量=溶液质量×A%
溶液的质量=
溶质质量 A%
课题3 课题3
溶质质量分数
普钱教育集团第二中学 郑羽
我会观察
组 别 1 2 3 4 水的 未加食盐鸡蛋 加入食盐 质量 沉浮情况 的质量 100 10
沉 在 底 部
加食盐后鸡蛋 的沉浮情况
沉 浮 浮 浮
100 100 100
26 30 40
我会思考!
溶液的组成:溶液的质量=溶质的质量+溶剂的质量 鸡蛋为什么会出现不同的情况?
相同的水中食盐的质量不同,即溶液的 组成不同,即浓稀不同。
我会观察
编号 溶液颜色 1 2 3 加水量 硫酸铜质量 溶液质量
浅蓝色 10mL
0.5克 1.0克 1.5克
10.5克 11.0克 11.5克
蓝色
10mL
深蓝色 10mL
我会思考
上述硫酸铜溶液中哪一组最浓,哪一 组最稀?判断的依据是什么?
溶质的质量分数 A%=
溶质质量 溶液质量
×100%
注意:一定是溶解的溶质质量
讨论与辨析
溶质质量分数和饱和溶液概念的区别及关系:
溶质质量分数表达溶液的浓稀,饱和和不饱和表 达的是溶解的程度; 浓溶液不一定是饱和溶液,稀溶液不一定是不 饱和溶液,
但是条件相同,溶质溶剂相同时,饱和溶溶解度是36克。在20℃时, 在50克水中加入36克食盐,充分溶解。计算溶 液的溶质质量分数。
