生物化学七版本科大纲
《生物化学》教学大纲

内吞和外排作用在细胞信号传导中的意义
03
通过调节膜受体的数量和分布,影响细胞对信号的响应和传递
。
信号传导异常与疾病关系
01
信号传导异常与肿瘤发生
肿瘤细胞中常出现信号传导通路的异常激活或抑制,导致细胞增殖失控
和凋亡受阻。
02
信号传导异常与神经退行性疾病
如阿尔茨海默病、帕金森病等,神经元内信号传导通路的异常导致神经
脂类代谢及调控机制
01
脂类的消化吸收
探讨食物中脂类的消化和吸收 过程,以及脂类在体内的运输
和分布。
02
脂肪酸氧化
详细阐述脂肪酸氧化的过程、 关键酶和调控机制,以及脂肪 酸氧化在能量供应中的作用。
03
脂肪合成
介绍脂肪合成的途径、关键酶 和调控机制,以及脂肪在能量
储存和释放中的意义。
04
胆固醇代谢
阐述胆固醇的合成、转运、转 化和排泄过程,以及胆固醇在 生理和病理状态下的作用。
检查中的转氨酶测定。
代谢物检测
通过检测体液中代谢产物的异常变 化来推断疾病的发生和发展,如血 糖、血脂等生化指标的检测。
免疫学诊断
应用生物化学技术检测体内特异性 抗体或抗原,以诊断感染性疾病、 自身免疫病等,如ELISA、Western blot等方法。
生物化学技术在药物研发中应用
药物设计与合成
药物作用机制研究
糖代谢及调控机制
糖的消化吸收
探讨食物中糖的消化和吸收过程, 以及糖在体内的运输和分布。
糖酵解
详细阐述糖酵解的过程、关键酶和 调控机制,以及糖酵解在能量供应
中的作用。
糖异生
介绍糖异生的途径、关键酶和调控 机制,以及糖异生在维持血糖平衡 中的意义。
701生物化学参考书目

701生物化学参考书目
(原创版)
目录
1.701 生物化学参考书目概述
2.具体参考书目列表
3.参考书目特点及适用对象
正文
【701 生物化学参考书目概述】
701 生物化学是研究生物化学领域的一门重要课程,其参考书目主要涵盖了生物化学的基本理论、实验技术以及研究方法等方面的内容。
本文将为您提供一份详细的 701 生物化学参考书目,以帮助您更好地学习和掌握生物化学知识。
【具体参考书目列表】
以下是一些建议的 701 生物化学参考书目,这些书籍内容详实、逻辑清晰,对于学习生物化学课程具有很好的指导作用:
1.《生物化学》(第七版),作者:吴建中、张玉红
2.《生物化学与分子生物学》(第二版),作者:陈宏、黄辰
3.《生物化学原理》(第三版),作者:阿尔伯特·莱维特
4.《生物化学实验技术》(第四版),作者:张永平、李娜
5.《生物化学与分子生物学实验教程》(第二版),作者:杨荣武、黄辰
【参考书目特点及适用对象】
以上参考书目有以下特点:
1.系统性强:这些书籍从生物化学的基本概念、原理出发,逐步介绍了实验技术和研究方法,体系完整,有助于全面掌握生物化学知识。
2.适用对象广泛:这些参考书目既适用于生物化学专业本科生、研究生,也适用于从事生物化学相关研究的科研人员。
3.实践性强:部分书籍结合实验教程,让读者在学习理论知识的同时,能够动手实践,提高实验技能。
第七版 生物化学(要点)
4. 氨基酸活化的概念,氨基酰tRNA合成酶的特点。
5. 核糖体的组成及作用特点。
6. 原核生物蛋白质合成的过程
7. 蛋白质合成后的加工。
26
翻译(translation):
指把核酸中由四种符号(A、G、C、T/U)组成的 遗传信息,破译为蛋白质分子中氨基酸的排列顺序。 即把mRNA中核苷酸的排列顺序转变成蛋白质分子 中20种氨基酸的排列顺序。
相同点
新链合成方向都是5´ →3´ 都遵守碱基配对规律
聚合过程都生成磷酸二酯键
产物都是很长的多核苷酸链
18
转录和复制的区别
模板
复制 两股链均复制
(半保留复制)
原料
dNTP
碱基配对 A-T,G-C
酶
DNA聚合酶
产物
子代双链DNA
引物
需要
转录 模板链转录 (不对称转录)
NTP A-U,T-A,G-C
RNA聚合酶 mRNA,tRNA,rRNA等
23
11、RNA的生物合成
Key Points
1.转录、原始模板、直接模板、结构基因、模板链、 编码链、不对称转录、启动子、断裂基因、外显子、 内含子及核酶的概念。 2.参与RNA转录的主要物质。 3.大肠杆菌RNA聚合酶的组成及主要功能。 4.转录的过程。 5.转录起始复合物(RNApol 全酶-DNA-pppGpN-OH) 6.转录复合物(RNApol核心酶-DNA-RNA)
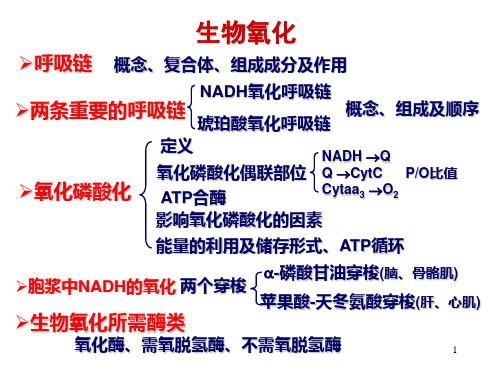
生物氧化
➢呼吸链 概念、复合体、组成成分及作用
NADH氧化呼吸链
➢两条重要的呼吸链
概念、组成及顺序
琥珀酸氧化呼吸链
➢氧化磷酸化
定义 氧化磷酸化偶联部位 ATP合酶
NADH Q Q CytC P/O比值 Cytaa3 O2
《生物化学》课程教学大纲

《生物化学》课程教学大纲《生物化学》课程教学大纲一、课程概述《生物化学》是生物学、医学、农学等专业的重要基础课程,它主要涵盖了生命体内化学物质的合成、分解、代谢以及分子机制等方面的知识。
通过本课程的学习,学生将了解生物体内的化学变化过程,为进一步学习相关专业的核心课程奠定基础。
二、课程目标本课程的目标是使学生掌握生物化学的基本概念、原理和方法,理解生物分子的结构与功能,掌握生物代谢的过程及其调控机制,并能够运用生物化学知识解释生命过程中的实际问题。
具体目标如下:1、掌握生物分子(蛋白质、酶、核酸、糖类、脂类)的结构与功能,理解生物分子之间的相互作用机制。
2、掌握生物代谢的基本过程及其调控机制,了解代谢网络与生命过程的关系。
3、理解基因表达的调控机制,掌握分子生物学的基本技术及其应用。
4、能够运用生物化学知识解释生命过程中的实际问题,如疾病的发生、营养物质的消化吸收等。
三、课程内容本课程主要包括以下四个部分:1、生物分子结构与功能:蛋白质、酶、核酸、糖类、脂类的结构与功能。
2、生物代谢过程及其调控:糖类、脂肪、蛋白质的代谢过程及其调控机制。
3、基因表达与调控:基因表达的机制、转录、翻译的过程及其调控,以及分子生物学的基本技术及其应用。
4、生命过程中的生物化学:生命过程中(如细胞分裂、免疫反应、神经传导等)的生物化学机制。
四、教学方法1、课堂讲解:基本概念、原理和方法的讲解,以及例题的解析。
2、课堂讨论:引导学生积极参与课堂讨论,加深对知识点的理解。
3、小组讨论:分组进行小组讨论,促进学生之间的合作与交流。
4、实验教学:进行实验操作,让学生亲身体验生物化学实验的过程,加深对知识点的理解。
五、评估方式本课程的评估方式包括以下几种形式:1、课堂表现:包括提问、回答问题、课堂讨论等。
2、作业:定期布置作业,以检验学生对知识点的掌握情况。
3、期中考试:通过试卷形式,考察学生对知识点的掌握情况。
4、期末考试:通过试卷形式,全面考察学生对本课程的掌握情况。
《生物化学基础》教学大纲

《生物化学基础》(104010007)(供国家基础药学理科基地班使用)一、说明1、该课程的目的和任务生物化学是研究生命的化学,亦即研究生命现象本质的一门科学。
是当代生物科学领域中发展最为迅速的学科之一。
它从分子水平来研究和阐述生物体(包括人类、动物、植物和微生物)内基本物质的化学组成和生命活动中所进行的化学变化(即代谢反应)的规律及其与生理机能关系的一门科学。
组成生物体的重要物质有蛋白质、核酸、糖类、脂类、无机盐和水分等,此外还有多种含量较少而对生命活动极为重要的维生素、激素和微量元素。
生物化学的任务之一就是研究这些基本物质的化学组成、结构、理化性质、生物功能以及结构与功能的关系,这些内容也被称为静态生物化学。
生物体内的各种基本物质在生命活动过程中不断地进行着互相联系,互相制约,互相对立而又统一的,多种多样,复杂而又有规律的化学变化。
这一系列化学变化就是生物体与外界环境进行的物质交换,称为新陈代谢。
它是生命的基本特征之一,是揭示生命现象本质的重要环节,代谢一停止,生命也就随之停止,所以生物化学的另一任务就是研究代谢的规律。
这些内容又被称为动态生物化学。
总之,生物化学的任务就是研究组成生物体基本物质的性质、结构与功能,以及这些物质在生命活动过程中所进行的化学变化的规律及其与生理机能的关系,从而阐明生命现象的本质,并把这些知识应用到社会实践中去,以达到征服自然和改造自然的目的。
2、课程的基本要求本大纲要求通过讲授及实验,使学生达到:(1)熟悉生物化学的含义和任务以及本课程在药学者的地位和重要性(2)掌握组成生物体基本物质的性质、结构、功能以及结构与功能的关系和验证这些性质的方法。
(3)掌握生物体内各种基本物质在生命活动中进行这的各种合成、分解代谢以及各种物质在代谢过程中互相联系,互相转换的规律。
以及研究这些内容的实验方法和技能。
3、学时安排51学时。
4、教材选用情况《生物化学》,姚文兵主编,人民卫生出版社,2011年,第7版二、教学内容和要求绪论【3课时】[基本内容]1、生物化学的定义、内容、研究目的及任务2、生物化学与医药卫生及工农业生产的相互关系,本学科与其他学科的关系及其在医药工业中的地位和重要性3、生物化学的发展概况、成就及其发展前景[基本要求]1、重点掌握生物化学的概念、内容和研究任务。
生物化学大纲精选全文

可编辑修改精选全文完整版er 《生物化学》教学大纲适用临床医学与医学技术类、法医学、预防医学专业一、课程简介生物化学是研究生命化学的科学,是从分子水平探讨生命的本质(即研究生物体的分子结构与功能、物质代谢与调节及其在生命活动中的作用)。
生物化学是医学生必修的基础医学课程,为学习其它基础医学和临床医学课程、在分子水平上认识病因和发病机理、诊断和防止疾病奠定扎实的基础。
当今生物化学是生命科学领域的前沿学科,已成为生命科学的共同语言。
生物化学的教学任务主要是介绍生物化学的基本知识以及某些与医学相关的生物化学进展,包括生物大分子的结构与功能(蛋白质、核酸、酶),物质代谢及其调节(糖、脂、氨基酸、核苷酸代谢、物质代谢的联系与调节),基因信息的传递(DNA复制、RNA转录、蛋白质生物合成、基因表达调控、基因组计划、重组DNA技术),相关的专题知识(细胞信息传递、血液生物化学、肝的生物化学、维生素与微量元素、癌基因、抑癌基因与生长因子、常用分子生物学技术、基因诊断与基因治疗等)。
从生物化学和分子生物学不断发展与其应用范围日益扩大的实际考虑,根据国家教委对医学生物化学教学要求的精神,密切结合本科阶段基础医学教育要求、硕士研究生入学考试、临床医师执业考试需要,本课程设置122学时(理论72学时,实验50学时,各章节学时数安排见学时分配表),在第三学期开设,适用临床医学与医学技术类、法医、预防医学等专业,属于医学必修课程,学分7.0分(其中康复专业为6.5分)。
本大纲内容按“掌握、熟悉、了解”三级要求学习及掌握。
“掌握”部分为学生必备的基础知识和重要内容,要求理解透彻,熟练掌握、准确表达,并能运用其理论于相关学科的学习及今后的临床及科研工作;“熟悉”部分要求能熟知其相关内容的概念及有关理论,并能适当应用;“了解”部分要求能对其中的概念有一定认识,对相关内容有所了解。
在教学过程中应注重基本理论、基本知识、基本技能的训练,充分调动学生的思维活动,培养学生科学思维能力、科学态度和实践创新能力。
《生物化学》课程大纲
06 基因表达调控与疾病关系
基因表达概述及基本过程
基因表达的定义和意义
基因表达是指基因转录和翻译产生蛋白质的过程,对于生物体的生长、发育和适应 环境具有重要意义。
基因表达的基本过程
包括转录、翻译和蛋白质加工等步骤,其中转录是指DNA模板链在RNA聚合酶的作 用下合成RNA的过程,翻译是指mRNA在核糖体上合成蛋白质的过程,蛋白质加工 包括修饰、折叠和定位等步骤。
基因表达异常与疾病关系
基因表达异常的定义和类型
基因表达异常是指基因在转录或翻译过程中出现异常,导致蛋白质合成量或功能异常的现象。基因表达异 常可分为转录水平异常和翻译水平异常两种类型。
基因表达异常与疾病的关系
基因表达异常与多种疾病的发生和发展密切相关,如癌症、神经退行性疾病、自身免疫性疾病等。这些疾 病往往伴随着特定基因的异常表达,导致细胞增殖、分化、凋亡等生物学过程出现异常。因此,研究基因 表达异常与疾病的关系对于疾病的预防、诊断和治疗具有重要意义。
酶动力学原理及应用
米氏方程
01
介绍米氏方程的推导过程及其意义,解释米氏常数Km和Vmax
的含义及其在酶动力学研究中的应用。
酶促反应的影响因素
02
阐述温度、pH值、底物浓度、酶抑制剂和激活剂等对酶促反应
的影响及其机制。
酶动力学在医学中的应用
03
举例说明酶动力学在疾病诊断、药物设计和治疗等领域的应用。
3
蛋白质一级结构与功能的关系 一级结构是蛋白质空间构象和生物功能的基础。
蛋白质高级结构
01
02
03
蛋白质二级结构
指蛋白质分子中局部主链 的空间结构,包括α-螺旋、 β-折叠、β-转角和无规卷 曲等。
第六章生物氧化(本科第七版)
FADH2或FMNH2
2)铁硫蛋白(铁硫中心)及其辅基铁硫簇(Fe-S):在 生物氧化中起递电子的作用。
5、复合体Ⅲ
复合体Ⅲ又叫泛醌-细胞色素C还原酶,细胞色素 b-c1复合体,含有细胞色素b(b562, b566)、细胞 色素c1和一种可移动的铁硫蛋白(Rieske protein)。
电子传递过程:CoQH2→(Cyt b566(L)→Cyt
NADH氧化呼吸链
FADH2氧化呼吸链
琥珀酸
FAD (Fe-S) NADH FMN (Fe-S) CoQ Cyt b→Cyt c1→Cyt c Cyt aa3 O2
二、 ATP的生成
底物水平磷酸化
ATP生成方式 氧化磷酸化
底物水平磷酸化(substrate level phosphorylation ): 底 物脱氢使分子内部能量重新分布,生成的高能键, 直接转给ADP磷酸化生成ATP的过程。
F
+
-
Ⅰ
NAD+
Ⅱ
NADH+H+
延胡索酸 琥珀酸
-
Ⅲ -
- 1/2O2+2H+
- H2 O
Ⅳ
0
F1
基质侧
ADP+Pi ATP H+
2、ATP合酶(ATP synthase):复合体Ⅴ
F0(疏水部分):由a1b2c9~12亚基组成,是镶嵌
在线粒体内膜中的质子通道
ATP合酶
F1(亲水部分):由33亚基组成,其功能是
能量,当质子顺浓度梯度回流时驱动ADP与Pi生成ATP。
简 单 示 意 图
线 粒 体 内 外 膜 间 隙
线粒体内膜 线粒体基质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
《生物化学》教学大纲第七版(供临床、麻醉、影像、口腔、检验等专业使用)生物化学教研室2008年08月前言生物化学是一门基础医学必修课程,是研究生物体内化学分子与化学反应的科学,主要采用化学的原理和方法从分子水平探讨生命现象的本质。
讲述正常人体的生物化学以及疾病过程中的生物化学相关问题,与医学有着紧密的联系。
是生命科学中进展迅速的基础学科,其理论和技术已渗透至基础医学和临床医学的各个领域。
随着近代医学的发展,越来越多地将生物化学的理论和技术应用于疾病的预防、诊断和治疗,从分子水平探讨各种疾病的发生发展机制。
近年来,对人们十分关注的恶性肿瘤、心脑血管疾病、免疫性疾病、神经系统疾病等重大疾病发病机制进行了分子水平的研究,并取得了丰硕成果。
可以相信,随着生物化学与分子生物学(是生物化学的重要组成部分,是其发展和延续)进一步发展,将给临床医学的诊断和治疗带来全新的理念。
因此,学习和掌握生物化学知识,除理解生命现象的本质与人体正常生理过程的分子机制外,更重要的是为进一步学习基础医学其它课程和临床医学打下扎实的生物化学基础。
本大纲适用于我院五年制本科临床医学、麻醉学、医学影像学、口腔医学及四年制本科医学检验等专业学生学习和教师教学。
主要由前言、学时安排、各章节的主要内容和要求(目的要求、教学难点、教学内容、复习思考题)、参考书籍和常用网址等四个部分组成。
“教学内容”中的下划线部分为重点掌握内容,是“目的要求”中“掌握”的细化或补充。
该课程为6学分,计划学时为136学时,其中:理论学时80,实验学时56。
理论教学采用多媒体辅助的讲授方式为主,学习时应注意结合生活和临床实际进行理解记忆、对照比较记忆(前后对照比较,课程间对照比较)、反复记忆等方式;实验教学紧密结合相关理论知识开设定性、定量、综合性及分子生物学实验,培养学生分析问题、解决问题和实际动手能力。
考试方式及成绩构成:理论考试为闭卷,题型多样化,主要有名词解释、是非题、填空题、选择题、简答题、问答题等,占总成绩的70-80%;实验成绩占20-30%,主要包括考勤、操作、实验报告、实验卷面考核等方面。
学时分配表章节标题学时理论实验合计绪论 1 0 11 蛋白质的结构与功能518232 核酸的结构与功能4483 酶64104 糖代谢108185 脂类代谢88166 生物氧化40 47 氨基酸代谢64108 核苷酸代谢40 49 物质代谢的联系与调节40 410 DNA的生物合成40 411 RNA的生物合成40 412 蛋白质的生物合成40 413 基因表达调控40 414 基因重组与基因工程40 415 细胞信息转导40 416 血液的生物化学自学0017 肝的生物化学40018 维生素与无机物自学0019 糖蛋白、蛋白聚糖和细胞外基质自学0020 癌基因、抑癌基因与生长因子自学0 021 常用分子生物学技术的原理及其应用自学00合计学时80 56 136绪论【目的要求】掌握:生物化学、生物大分子和分子生物学的概念。
熟悉:当代生物化学研究的主要内容。
了解:生物化学的发展简史、生物化学与医学的关系。
【复习思考题】1. 何谓生物化学?2. 当代生物化学研究的主要内容有哪些?第一章蛋白质的结构与功能【目的要求】掌握:蛋白质元素组成及其特点;蛋白质基本组成单位--氨基酸的种类、基本结构及主要特点;蛋白质的分子结构;蛋白质结构与功能的关系;蛋白质的主要理化性质及其应用;蛋白质分离纯化的方法及其基本原理。
熟悉:各种氨基酸的结构;蛋白质的分类。
了解:多肽链氨基酸序列分析;蛋白质空间结构测定。
【教学难点】蛋白质结构与功能的关系;氨基酸序列分析及空间结构测定。
【教学内容】一、蛋白质是细胞的重要组成部分,是功能最多的生物大分子物质,几乎在所有的生命过程中起着重要作用。
二、蛋白质的分子组成1. 蛋白质的元素组成主要有C、H、O、N和S,各种蛋白质的含N量很接近,平均16%。
2. 组成蛋白质的基本单位——L-a-氨基酸:种类、三字英文缩写符号、基本结构、分类(非极性脂肪族氨基酸、极性中性氨基酸、芳香族氨基酸、酸性氨基酸、碱性氨基酸)、理化性质。
3. 肽键、肽、多肽链;肽链的主链及侧链;肽链的方向(N-末端与C-末端),氨基酸残基;生物活性肽:谷胱甘肽及其重要生理功能,多肽类激素及神经肽。
三、蛋白质的分子结构1. 蛋白质一级结构:概念、主要化学键——肽键。
2. 蛋白质的二级结构:概念、主要化学键、肽单元、四种主要结构形式(α螺旋、β折叠、β转角、无规卷曲)及影响因素;模体。
3. 蛋白质的三级结构:概念,主要次级键——疏水作用、离子键(盐键)、氢键、范德华力等,结构域(domain)、分子伴侣。
4. 蛋白质的四级结构:概念,亚基,各亚基之间的结合力——疏水作用、氢键、离子键。
5. 蛋白质的分类:根据组成分为单纯蛋白质和结合蛋白质,根据形状分为球状蛋白质和纤维状蛋白质。
6. 蛋白质组学:基本概念、研究技术平台、研究的科学意义。
四、蛋白质结构与功能的关系1. 蛋白质一级结构与功能的关系:一级结构是高级结构和功能的基础,一级结构相似其高级结构与功能也相似,氨基酸序列提供重要的生物进化信息,氨基酸序列改变可能引起疾病。
2. 蛋白质空间结构与功能的关系:蛋白质的功能依赖特定空间结构,肌红蛋白的结构与功能,血红蛋白结构、运输O 2功能、氧饱和曲线、正协同效应、变构效应,蛋白质构象改变可引起疾病如疯牛病等。
五、蛋白质的理化性质两性解离及等电点、胶体性质、变性、沉淀及凝固、紫外吸收(280nm)、呈色反应(茚三酮反应、双缩脲反应)。
六、蛋白质的分离纯化与结构分析1. 蛋白质的分离纯化:透析及超滤、丙酮沉淀、盐析及免疫沉淀、电泳、层析、超速离心。
2. 多肽链中氨基酸序列分析:化学或反向遗传学方法、Edman降解法。
3. 蛋白质空间结构测定:圆二色光谱、X射线晶体衍射法、磁共振技术。
【复习思考题】1. 名词解释:蛋白质一级结构、蛋白质二级结构、蛋白质三级结构、蛋白质四级结构、肽单元、模体、结构域、分子伴侣、协同效应、变构效应、蛋白质等电点、电泳、层析2. 蛋白质变性的概念及本质是什么?有何实际应用?3. 蛋白质分离纯化常用的方法有哪些?其原理是什么?4. 举例说明蛋白质结构与功能的关系?第二章核酸的结构与功能目的要求:掌握:核酸的分类、细胞分布,各类核酸的功能及生物学意义;核酸的化学组成;两类核酸(DNA与RNA)分子组成异同;核酸的一级结构及其主要化学键;DNA右手双螺旋结构要点及碱基配对规律;mRNA一级结构特点;tRNA二级结构特点;核酸的主要理化性质(紫外吸收、变性、复性),核酸分子杂交概念。
熟悉:核酸的高级结构;核酸酶。
了解:碱基和戊糖的结构;DNA其它二级结构形式;其它小分子RNA及RNA组学;人类基因组计划研究的主要内容;snmRNA参与基因表达调控。
教学难点:DNA的空间结构。
教学内容:一.核酸的分类、分布及主要生物学功能。
二.核酸的化学组成:1、核苷酸中的碱基成分:腺嘌呤(A)、鸟嘌呤(G)、胞嘧啶(C)、尿嘧啶(U)、胸腺嘧啶(T)。
DNA中的碱基(A、G、C、T),RNA中的碱基(A、G、C、U)。
2、戊糖:D-核糖(RNA)、D-2-脱氧核糖(DNA)。
3、磷酸4、核酸及核苷酸:碱基及戊糖通过糖苷键连接形成核苷,核苷与磷酸连接形成核苷酸。
5、重要游离核苷酸及环化核苷酸:A TP、ADP、GTP、cAMP、cGMP三、核酸的一级结构概念、核苷酸间的连接键——3’,5’-磷酸二酯键、方向(5’→3’)及链书写方式。
四、DNA的空间结构与功能1、DNA的二级结构——双螺旋结构:chargaff规则、B-DNA结构要点,Z-DNA、A-DNA。
2、DNA的三级结构:超螺旋、组蛋白、核小体、染色体。
3、DNA的功能:遗传与繁殖、复制、转录,基因和基因组。
4、人类基因组计划研究的主要内容。
五、RNA的结构与功能1、mRNA:结构特点、三联体密码、功能。
2、tRNA:结构特点、氨基酸臂、反密码子环、功能。
3、rRNA:与多种蛋白质结合形成核糖体(大亚基、小亚基),是蛋白质合成场所。
4、snmRNA参与基因表达调控;核酶:概念、化学本质(RNA)、作用底物(核酸)及应用。
5、核酸在真核细胞和原核细胞中表现不同时空特性。
六、DNA的理化性质及其应用1、变性、复性的概念,条件,理化性质的改变,变色效应,Tm值,解链曲线。
2、核酸分子杂交。
七、核酸酶概念、分类、化学本质(蛋白质)、作用底物(核酸)及应用。
第三章酶目的要求:掌握:酶的概念、化学本质及生物学功能;酶的活性中心和必需基团、同工酶;酶促反应特点;各种因素对酶促反应速度的影响、特点及其应用;酶调节的方式;酶的变构调节和共价修饰调节的概念。
熟悉:酶的组成、结构;酶活性测定及酶活性单位;酶含量的调节了解:米-曼方程式的推导过程;酶的命名与分类;酶与医学的关系。
教学难点:抑制剂对反应速度的影响;酶活性的调节。
教学内容:一、酶的概念及其在生命活动中的重要性。
二、酶的分子结构与功能。
1、酶的分子组成:单纯酶和结合酶,辅助因子(金属离子、辅酶、辅基),常见含B族维生素的辅酶形式及其在酶促反应中的主要作用。
2、酶的活性中心、必需基团(结合基团和催化基团)。
3、同工酶概念及应用。
三、酶的工作原理1、酶与一般催化剂的异同,酶促反应的特点:极高的催化效率、高度的特异性、可调节性,酶促反应的机制:酶-底物复合物的形成与诱导契合、邻近效应与定向排列、多元催化、表面效应。
2、酶作用的特异性:绝对特异性、相对特异性、立体异构特异性。
四、酶促反应动力学1、底物浓度的影响:米式方程、Km和Vm的定义。
2、酶浓度的影响及应用。
3、温度的影响及应用、最适温度。
4、pH的影响及应用、最适pH值。
5、酶的抑制:不可逆抑制,可逆抑制(竞争性、非竞争性、反竞争性抑制)。
6、激活剂的影响。
7、酶活性测定和酶活性单位。
五、酶的调节1、酶活性的调节:变构酶和共价修饰酶及其调节、酶原、酶原激活机理及意义。
2、酶含量的调节:酶蛋白合成的诱导与阻遏,酶降解的调控。
六、酶的分类与命名。
七、酶与医学的关系。
第四章糖代谢【目的要求】掌握:糖的主要生理功能;糖的无氧分解(酵解)、有氧氧化、糖原合成及分解、糖异生的基本反应过程、部位、关键酶(限速酶)、生理意义;磷酸戊糖途径的生理意义;血糖概念、正常值、血糖来源与去路、调节血糖浓度的主要激素。
熟悉:糖的消化吸收;糖代谢的概况;糖代谢各途径的调节。
了解:磷酸戊糖途径的基本过程;糖醛酸途径;多元醇的生成;果糖、半乳糖、甘露糖的代谢概况;血糖水平异常。
【教学难点】糖代谢各途径的具体反应过程及其调节。
【教学内容】一、糖的主要生理功能,糖的消化吸收和糖代谢概况。
