浙江省高中作业本化学选修化学反应原理参考答案
【浙江选考】化学选考复习专题精编:第30题化学反应原理

30.化学反应原理1.(一)以四甲基氯化铵[(CH 3)4NCl]水溶液为原料,通过电解法可以制备四甲基氢氧化铵[(CH 3)4NOH],装置如图1所示。
(1) 收集到(CH 3)4NOH 的区域是 (填a 、b 、c 或d)。
(2) 写出电池总反应 。
(二)乙酸乙酯一般通过乙酸和乙醇酯化合成:CH 3COOH(l)+C 2H 5OH(l) CH 3COOC 2H 5(l)+H 2O(l) ΔH =-2.7 kJ·mol -1纯物质 沸点/℃ 恒沸混合物(质量分数)沸点/℃ 乙醇 78.3 乙酸乙酯(0.92)+水(0.08)70.4 乙酸 117.9 乙酸乙酯(0.69)+乙醇(0.31)71.8 乙酸乙酯 77.1 乙酸乙酯(0.83)+乙醇(0.08) +水(0.09)70.2请完成:...的是 。
A .反应体系中硫酸有催化作用B .因为化学方程式前后物质的化学计量数之和相等,所以反应的ΔS 等于零C .因为反应的△H 接近于零,所以温度变化对平衡转化率的影响大D .因为反应前后都是液态物质,所以压强变化对化学平衡的影响可忽略不计(2) 一定温度下该反应的平衡常数K =4.0。
若按化学方程式中乙酸和乙醇的化学计量数比例投料,则乙酸乙酯的平衡产率y = ;若乙酸和乙醇的物质的量之比为n : 1,相应平衡体系中乙酸乙酯的物质的量分数为x ,请在图2中绘制x 随n 变化的示意图(计算时不计副反应)。
(3) 工业上多采用乙酸过量的方法,将合成塔中乙酸、乙醇和硫酸混合液加热至110℃左右发生酯化反应并回流,直到塔顶温度达到70~71℃,开始从塔顶出料。
控制乙酸过量的作用有 。
(4) 近年,科学家研究了乙醇催化合成乙酸乙酯的新方法:2C 2H 5OH(g) CH 3COOC 2H 5(g)+2H 2(g) 在常压下反应,冷凝收集,测得常温下液体收集物中主要产物的质量分数如图3所示。
关于该方法,下列推测合理的是 。
浙江省普通高中新课程作业本 化学 选修6 答案

专题1检测题
1 .C 2 .B 3 .C 4 .D 5 .B 6 .C 7 .D 8 .D 9 .C 1 0 .C 1 1 .B 布氏漏斗 吸滤瓶 安全瓶 抽气泵 防止自来水回流进入吸滤瓶 ( ) 1 3 . 1 4 .1 A D 1 2 .B ( )B )缺石棉网 ; 温度计插到了液体中 , 应使水银球位于蒸馏烧瓶的支 2 C A D 重结晶 1 5 .( 1 冷凝管进出水方向颠倒 ( ) 使蒸馏烧瓶均匀受热 , 控制加热温度不过高 管口 ; 2 蒸馏烧瓶 ) ③ ② ④ ⑧ ( )使漏斗下端管口紧靠烧杯内壁 , 及时关闭活塞, 不要让上层液体流出 1 6 .( 1 2 使内外空气相通, 以保证进行操作时漏斗里的液体能够流出 ( ) 四氯化碳与水不互溶 , 且碘在四氯化 3 碳中的溶解度比在水中的溶解度大很多 ) 将乙酸中和成乙酸钠, 同时使乙酸乙酯在加热时 1 7 .( 1 生成乙酸钠和乙醇 ( )乙醇 ( ) 浓) 2 3 2 C H C O O N a +H S O a S O 2 C H C O OH N 3 2 4( 2 4+ 3 ( )N 海带中所含的碘元素以 ( 为有机基团 ) 的形式存在 , 并不是以 4 a S O 1 8 . R I R I 2 4 2 的形式存在 。 高温灼烧海带后, 海带中的碘元素转化为 N , 碘化钠有较高的熔、 沸点, 不会在灼烧过程中挥发 , 而留 a I 在灼烧后的灰分中
2
专题2 物质性质的探究
课题1 铝及其化合物的性质
1 .D 2 .A 3 .D 4 .A 5 .A 6 .D 7 .m+ n= 6 x 或( 6 - n) x m - 2 - )C 罐内压强减小 C ) 制易拉罐的材 8 .( 1 O O 2 OH O 2 C ( 2 被氢氧化钠溶液吸收 , 2+ 3 +H 2O
正版高中化学选修4课后习题标准答案-人教版

人教版高中化学选修四——《化学反应原理》课本习题参考答案第一单元第一节化学反应与能量的变化1. 化学反应过程中所释放或吸收的能量,叫做反应热,在恒压条件下,它等于反应前后物质的焓变,符号是ΔH,单位是kJ/mol。
例如1 mol H2(g)燃烧,生成1 mol H2O(g),其反应热ΔH=-241.8 kJ/mol。
2. 化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子。
旧键断裂需要吸收能量,新键形成需要放出能量。
当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化为生成物,则此反应为吸热反应。
第二节第三节燃烧热能源1. 在生产和生活中,可以根据燃烧热的数据选择燃料。
如甲烷、乙烷、丙烷、甲醇、乙醇、氢气的燃烧热值均很高,它们都是良好的燃料。
2. 化石燃料蕴藏量有限,不能再生,最终将会枯竭,因此现在就应该寻求应对措施。
措施之一就是用甲醇、乙醇代替汽油,农牧业废料、高产作物(如甘蔗、高粱、甘薯、玉米等)、速生树木(如赤杨、刺槐、桉树等),经过发酵或高温热分解就可以制造甲醇或乙醇。
由于上述制造甲醇、乙醇的原料是生物质,可以再生,因此用甲醇、乙醇代替汽油是应对能源危机的一种有效措施。
3. 氢气是最轻的燃料,而且单位质量的燃烧热值最高,因此它是优异的火箭燃料,再加上无污染,氢气自然也是别的运输工具的优秀燃料。
在当前,用氢气作燃料尚有困难,一是氢气易燃、易爆,极易泄漏,不便于贮存、运输;二是制造氢气尚需电力或别的化石燃料,成本高。
如果用太阳能和水廉价地制取氢气的技术能够突破,则氢气能源将具有广阔的发展前景。
4. 甲烷是一种优质的燃料,它存在于天然气之中。
但探明的天然气矿藏有限,这是人们所担心的。
现已发现海底存在大量水合甲烷,其储量约是已探明的化石燃料的2倍。
如果找到了适用的开采技术,将大大缓解能源危机。
高二化学化学反应原理试题答案及解析

高二化学化学反应原理试题答案及解析1.下列说法不正确的是A.ΔH>0、ΔS>0的反应在任何温度下都不能自发进行B.反应NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1之所以能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均不能单独作为反应自发性的判据D.在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的速率【答案】A【解析】A、根据反应自发进行的判断,ΔG=ΔH-TΔS<0反应自发,则ΔH>0、ΔS>0的反应在高温下可自发进行,错误;B、反应NH4HCO3(s)===NH3(g)+H2O(g)+CO2(g)ΔH=+185.57 kJ·mol-1的ΔH>0,单能自发进行,说明该反应有自发地向混乱度增加的方向转变的倾向,正确;C、根据ΔG=ΔH-TΔS<0反应自发,因此焓变或熵变均不能单独作为反应自发性的判据,正确;D、在其他外界条件不变的情况下,使用催化剂,可以改变活化分子的百分数,从而加快化学反应进行的速率,正确,答案选A。
【考点】考查反应自发进行的判断、催化剂对反应速率的影响判断2.下列图示与对应叙述相符合的是A.图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化B.图Ⅱ:反应2SO2+O2═2SO3达平衡后,缩小容器体积时各成分的物质的量随时间的变化C.图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系D.图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化【答案】B【解析】A.升高温度,平衡发生移动,正、逆速率变化不相等,图像中正、逆速率增大相同的倍数,图像与实际不相符,错误;B.缩小容器体积,压强增大,平衡向正反应方向移动,三氧化硫的物质的量增大、二氧化硫与氧气的物质的量减小,图像与实际相符合,正确;C.增大压强,正、逆反应速率都增大,由于反应物的系数大,所以正反应速率增大的多于逆反应速率增大的影响,平衡向正反应反应移动,图像中逆反应速率增大更多,图像与实际不相符,错误;D.温度越高,速率越快,达到平衡所需要的时间越短,则由图可知,温度T2>T1。
高二化学化学反应原理试题答案及解析

高二化学化学反应原理试题答案及解析1.下列描述违背化学原理的是( )A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高B.反应A(g)+3B(g) 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快D.饱和石灰水中加入少量CaO,恢复到原温度时,溶液中c(OH-)不变,OH-数目减少【答案】B【解析】A、“冰,水为之,而寒于水”说明相同质量的水和冰,冰的温度低于水,所以水的能量高,不违背化学原理,故A不选; B、温度不变平衡常数K不变,违背化学原理,故B选;C、升高温度,加快反应速率,不违背化学原理,故C不选;D、氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,溶液仍为饱和溶液,故溶液的物质的量浓度也不变。
【考点】化学反应的基本原理2.下列说法不正确的是A.反应C(s)+CO2(g)=2CO(g);△H>0,在任何条件下均不能自发进行B.铅蓄电池在放电过程中,溶液的PH值增加C.常温下,在0.1mol/L氨水中,加入少量NH4Cl晶体,溶液的pH减小D.温度一定时,水的离子积常数Kw不随外加酸(碱)浓度的改变而改变【答案】A【解析】根据方程式可知,反应是熵值增加的、吸热的可逆反应,所以根据△G=△H-T·△S可知,反应应该在高温下自发进行,A不正确,其余都是正确的,答案选A。
3.(20分)思考下列问题,按要求填空:(1)某温度下纯水中c(H+) = 2×10-7 mol/L①此时溶液中的C(OH-) = ___ __。
②若温度不变,向水中滴入稀盐酸使c (H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) =___ __。
(2)已知下列热化学方程式:Zn(s)+O2(g)="==ZnO(s)" △H1="-351.1" kJ·mol-1;Hg(l)+O2(g)="==HgO(s)" △H2="-90.7" kJ·mol-1由此可知反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的焓变为___ __。
浙江版高考化学复习阶段检测练化学反应原理含答案
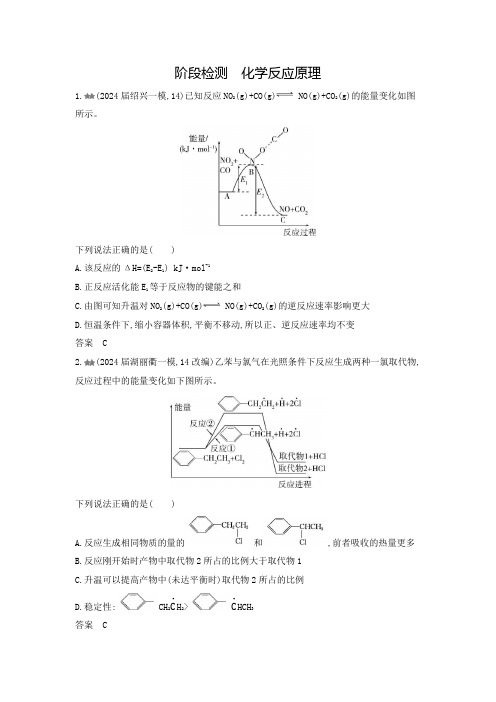
阶段检测 化学反应原理1.(2024届绍兴一模,14)已知反应NO 2(g)+CO(g) NO(g)+CO 2(g)的能量变化如图所示。
下列说法正确的是( )A.该反应的ΔH=(E 2-E 1) kJ ·mol -1B.正反应活化能E 1等于反应物的键能之和C.由图可知升温对NO 2(g)+CO(g) NO(g)+CO 2(g)的逆反应速率影响更大D.恒温条件下,缩小容器体积,平衡不移动,所以正、逆反应速率均不变答案 C2.(2024届湖丽衢一模,14改编)乙苯与氯气在光照条件下反应生成两种一氯取代物,反应过程中的能量变化如下图所示。
下列说法正确的是( )A.反应生成相同物质的量的和,前者吸收的热量更多B.反应刚开始时产物中取代物2所占的比例大于取代物1C.升温可以提高产物中(未达平衡时)取代物2所占的比例D.稳定性:CH 2C ·H 2>C ·HCH 3答案 C3.(2024届名校协作体开学联考,13)甲醇是一种理想的可再生清洁能源。
CO2和H2在一定条件下合成甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH;相关物质的能量如图1所示。
在两个容积相同的密闭容器中分别充入n mol CO2和3n mol H2,在两种催化剂(Ⅰ和Ⅱ)、不同温度下发生上述反应,经过相同时间测得CO2的转化率与温度的关系曲线如图2所示(不考虑温度对催化剂活性的影响),下列说法不正确...的是( )A.ΔH=-49.3 kJ·mol-1B.C点的正反应速率:v正(Ⅰ)=v正(Ⅱ)C.在T2温度下,此反应活化能:催化剂Ⅰ>催化剂ⅡD.T1~T3温度区间,反应未达平衡,CO2的转化率随温度升高而增大答案 B4.(2024届温州一模,15改编)25 ℃时,某小组做如下两组实验:实验Ⅰ:分别往浓度均为0.10 mol·L-1NaHCO3、Na2CO3溶液中通入CO2至pH=7;实验Ⅱ:在1.0 L、0.10 mol·L-1 Na2CO3溶液中加入0.01 mol BaSO4固体,充分反应。
