2020百所名校高一暑假作业及答案 化学1物质结构 元素周期律
高一暑假化学作业(人教版必修二):第一章 物质结构 元素周期律 第一节 元素周期表含解析

知识归纳
一、元素周期表
1.周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
2.族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
门捷列夫,1834年2日生于西伯利亚西部的托波尔斯克,是俄罗斯和蒙古人的后裔。
师范学院毕业时,因成绩异,获得了金质奖章。
后,他又去巴黎学习了三年,还到德国本生那里研究过一段时间。
1861年他返回彼得堡,
说明:
过渡元素:元素周期表中部从ⅢB族到ⅡB族10个纵列共六十多种元素,这些元素都是金属元素。
镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
二、元素的性质与原子结构
(一)元素的性质
1.碱金属元素
(1)结构:
异核电荷数:由小→大;
电子层数:由少→多;
同最外层电子数均为1个。
最外层都有1个电子,化学性质相似;随着核电荷数的增加,原子的电子层
数递增,原子核对最外层电子的引力逐渐减弱,金属性逐渐增强。
(2)物理性质
(3)化学性质:
①相似性:均能与氧气、与水反应,表现出金属性(还原性);
4Li + O2 = 2Li2O(白色、氧化锂)
2Na + O2 = Na2O2(淡黄色、过氧化钠)
2Na + 2H2O = 2NaOH + H2↑。
高一化学(必修二)《原子结构 元素周期律》练习题及答案解析

高一化学(必修二)《原子结构 元素周期律》练习题及答案解析一、单选题1.元素周期表和元素周期律可以指导人们进行规律性的推测和判断。
下列说法不合理的是 A .由水溶液的酸性:HCl >HF ,不能推断出元素的非金属性:Cl >FB .人们可以在周期表的过渡元素中寻找催化剂和耐腐蚀、耐高温的合金材料C .原子半径随着周期序数的增加而增加D .短周期元素形成的微粒X 2-和Y 2+核外电子排布相同,离子半径:X 2->Y 2+ 2.下列说法正确的是A .SO 2能使酸性KMnO 4溶液褪色,故SO 2有漂白性B .NO 2与水反应生成HNO 3,故NO 2是酸性氧化物C .H 2SiO 3的酸性弱于H 2CO 3,故非金属性C 强于SiD .CaCO 3难溶于水,故CO 2能与CaCl 2溶液反应 3.下列关于物质应用错误的是 A .3NaHCO 用作烘焙糕点膨松剂 B .2SO 用作食品添加剂 C .34Fe O 用作磁性材料D .Si 做光导纤维4.下列关于硅酸的叙述,错误的是 A .硅酸是一种很弱的酸 B .硅酸的酸性比碳酸强C .硅酸不稳定,加热脱水会生成二氧化硅D .硅酸可以由可溶性硅酸盐与盐酸反应制得 5.下列有关物质的用途不正确...的是 A .用铁罐车贮存浓硫酸、浓硝酸、浓盐酸B .高纯度的硅可用于制作计算机的芯片和太阳能电池C .碳酸氢钠可用作焙制糕点的发酵粉,也可用作治疗胃酸过多的药剂D .金属镁常用来制造信号弹和焰火,氧化镁是优质的耐高温材料6.四种主族元素的离子a X m+、b Y n+、c Z n-和d R m-( a 、b 、c 、d 为元素的原子序数),它们具有相同的电子层结构,若m>n ,对下列叙述的判断正确的是①元素的原子序数:a>b>c>d ②a-b=m+n ③元素非金属性:Z R >④最高价氧化物对应水化物碱性:X Y > A .只有③B .①③C .①②③D .①②③④7.下列有关说法正确的是()A.元素周期表是元素按相对原子质量大小排列而成的B.元素周期表共有9个周期和18个族C.在金属元素与非金属元素的分界线附近寻找半导体材料D.第IA族元素,原子序数越大,金属性越弱8.下列关于元素周期律的叙述中不正确的是A.Na、Mg、Al最外层电子数依次增多,其单核离子的氧化性依次增强B.P、S、Cl最高正化合价依次升高,对应简单气态氢化物的稳定性依次增强C.原子半径大小关系为Na<Al<Si<ClD.Na、Mg、Al的氢氧化物的碱性依次减弱9.短周期元素 A、B、C、D 的原子序数依次增大,B 与C的简单离子具有相同的电子层结构,D 的最高正价与最低负价代数和为6。
2019-2020年高一暑假作业(三)化学 含答案

2019-2020年高一暑假作业(三)化学含答案一、选择题1.元素性质呈周期性变化的决定因素是()A.元素原子半径大小呈周期性变化 B.元素相对原子质量依次递增C.元素原子最外层电子排布呈周期性变化 D.元素的最高正化合价呈周期性变化2.有5种微粒,它们分别是、、、、,则它们所属元素的种类有()A.2种 B.3种 C.4种 D.5种3.下列叙述中错误的是()A.原子半径:Cl>S>O B.还原性:Na>Mg>AlC.稳定性:HF>HCl>HBr D.酸性:HClO4>H2SO4>H3PO44.下列化合物中,阳离子半径与阴离子半径比值最小的()A. NaF B. NaCl C. MgI2 D. KBr5.氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是 ( )A.35Cl原子所含质子数为18B.1/18mol的1H35Cl分子所含中子数约为6.02×1023C.3.5g35Cl2气体的体积约为22.4LD.35Cl2气体的摩尔质量为70g6.下列不能说明氯的非金属性比硫强的事实是()①HCl比H2S稳定②HClO氧化性比H2SO4强③HClO4酸性比H2SO4强④Cl2能与H2S反应生成S ⑤在与钠反应时,S原子得到的电子数更多⑥Cl2与Fe反应生成 FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强A.②⑤⑦ B.①②⑦ C.②④ D.①③⑤7.X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为()A.HX B.H2X C.XH4 D. XH38.X、Y、Z为短周期元素,这些元素原子的最外层电子数分别为1、4、6,则由这三种元素组成的化合物的化学式可能是()A.XYZ B.X3YZ C.XYZ2D.X2YZ39.已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是()A.元素非金属性按X、Y、Z的顺序减弱B.阴离子的还原性按X、Y、Z的顺序减弱C.气态氢化物的稳定性按X、Y、Z的顺序增强D.单质的氧化性按X、Y、Z的顺序增强10.含硒(Se)的保健品已开始进入市场。
高一化学暑假作业答案
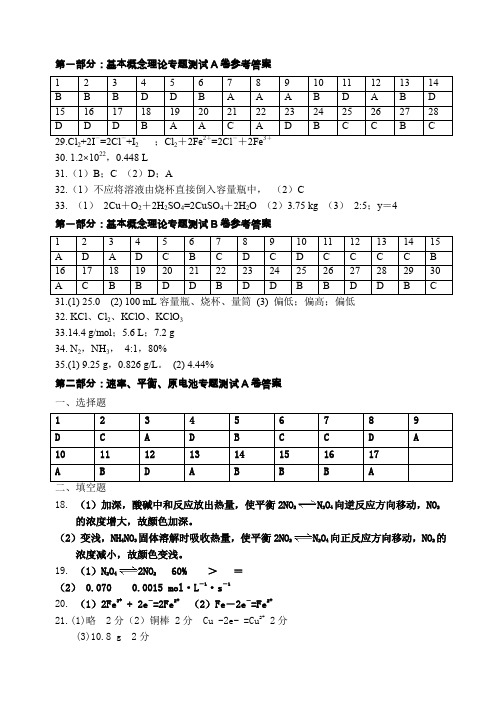
第一部分:基本概念理论专题测试A卷参考答案2 2 230. 1.2×1022,0.448 L31.(1)B;C (2)D;A32.(1)不应将溶液由烧杯直接倒入容量瓶中,(2)C33. (1)2Cu+O2+2H2SO4=2CuSO4+2H2O (2)3.75 kg (3)2:5;y=4第一部分:基本概念理论专题测试B卷参考答案32. KCl、Cl2、KClO、KClO333.14.4 g/mol;5.6 L;7.2 g34. N2,NH3,4:1,80%35.(1) 9.25 g,0.826 g/L。
(2) 4.44%第二部分:速率、平衡、原电池专题测试A卷答案一、选择题18. (1)加深,酸碱中和反应放出热量,使平衡2NO2N2O4向逆反应方向移动,NO2的浓度增大,故颜色加深。
(2)变浅,NH4NO3固体溶解时吸收热量,使平衡2NO2N2O4向正反应方向移动,NO2的浓度减小,故颜色变浅。
19.(1)N2O42NO2 60% >=(2) 0.070 0.0015 mol·L-1·s-120.(1)2Fe3+ +2e-=2Fe2+(2)Fe-2e-=Fe2+21.(1)略 2分(2)铜棒 2分 Cu -2e- =Cu2+ 2分(3)10.8 g 2分22答案:(1)16 (2)8mol (3)5:4 (4)2:3 (5)1:223.(1)N2O4(2)吸热(3)a d第二部分:速率、平衡、原电池专题测试B卷参考答案一、选择1、D2、B3、B4、D5、D6、B7、A8、D9、C10、C11、D12、D13、C14、D15、A16、D二、填空17、(每小题3)①错误,c(X)为0时,不可能发生反应。
②正确,反应物Y的浓度增大,反应速率也加快。
③错误,随着反应的时间延长,反应速率应逐渐减小。
④正确,反应的温度升高,反应速率也加快。
18.(1)3Cu-6e-===3Cu2+8H++2NO3-+6e-===2NO↑+4H2O(2)CH4+2O2+2OH - === CO32-+3H2O19、(1)(A)不能,(B)可以(各1分)(2)(A)的反应非氧化还原反应,没有电子转移(2分)(3)负极:铜,Cu — 2e- = Cu2+正极:碳棒,2Fe3+ + 2e- = 2Fe2+电解质溶液:氯化铁溶液(各1分)20.(1)2-3min 2分该反应是放热反应,此时温度高2分(2)4-5min 2分此时H+浓度小2分(3)0.1 mol/(L·min) 1分(4)A B 2分第三部分:重要的有机化合物专题测试A卷答案512512 2 22(3)CH3CH2CH2CH2CH3、、;22. (1)略(2)先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最(2)先在试管中加入一定量的乙醇,然后边加边振荡试管将浓硫酸慢慢加入试管,最后再加入乙酸。
高中化学必修1《物质结构元素周期律》测试题 (含答案)

24.下表是元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答下列问题。
族
周期
ⅠA
0
1
H
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
2
⑤
Ne
3
①
②
③
④
⑥
(1)元素④的符号是_______;
22.A产生淡黄色沉淀Na2S+Cl2=2NaCl+S↓吸收氯气,防止污染大气Cl2+2OH-=Cl-+ClO-+H2O①③④4mol
23.CO
24.Si<>2NaOH+2Al +2H2O =2NaAlO2+3H2↑
25.(1)0.54 g(2)0≤a<50 mL(3)80(4)2.5(5)Al(OH)3+OH-===AlO2-+2H2O
17.A、B、M、N、O、P、QⅠBⅡBH、I、J10
18.>>
19.DBCEFGH①⑤②③④
20.5种Na2ONa2O2He、Ne、ArNaNH3SiH4
21.浓HClMnO2MnO2+4H++2Cl- Mn2++Cl2↑+2H2O饱和食盐水除去Cl2中混有的HClA有黄色沉淀生成Cl2+S2-=S↓+2Cl-B
14.判断Cl的非金属性比S的强,可依据的事实是
A.HCl的热稳定性比H2S的强B.氯气能溶于水,硫难溶于水
C.常温下,氯单质呈气态,硫单质呈固态D.AgCl是白色固体,Ag2S是黑色固体
2020年人教版化学必修二第一章 物质结构 元素周期律 暑假测试卷含答案

绝密★启用前2020年人教版化学必修二第一章物质结构元素周期律暑假测试卷本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
分卷I一、单选题(共15小题,每小题4.0分,共60分)1.下列关于元素周期表的说法不正确的是()A.编制第一张元素周期表的是俄国化学家门捷列夫B.门捷列夫编制元素周期表的排序依据是原子的核电荷数C.门捷列夫编制元素周期表的排序依据是相对原子质量D.元素周期表揭示了化学元素间的内在规律2.下列各组元素,属于同一周期的一组是()A. H 、Li 、NaB. Na 、Mg 、CaC. Al 、P 、SD. N 、O 、Cl3.可以说明硫元素的非金属性比氯元素的非金属性弱的是()①HCl的溶解度比H2S的大;②HClO的氧化性比H2SO4的强;③HClO4的酸性比H2SO4的强;④HCl比H2S稳定;⑤氯原子最外层有7个电子,硫原子最外层有6个电子;⑥Cl2能与铁反应生成FeCl3,硫与铁反应生成FeS;⑦Cl2可以从H2S溶液中置换出S;⑧同浓度的HCl和H2S的水溶液,前者酸性强;⑨HCl(或Cl-)还原性比H2S(或S2-)弱A.③④⑤⑥⑦⑨B.③④⑥⑦⑧C.①②⑤⑥⑦⑨D.③④⑥⑦⑨4.下列叙述正确的是()A.每个周期均从金属元素开始,以非金属元素结束B.除第一周期外,其他周期均有18种元素C.副族元素中没有非金属元素D.碱金属元素是指第ⅠA族的所有元素5.有X、Y、Z、W四种元素,它们的原子序数分别为6、10、11、17,下列判断错误的是()A. X和W能形成共价化合物B. Z和W能形成离子化合物C. Y和Z不能形成化合物D. Y分子中存在共价键6.A、B、C为三种短周期元素,A、B在同一周期,A、C的最低价离子分别为A2-、C-,离子半径A2-大于C-,B2+和C-具有相同的电子层结构。
下列判断正确的是()A.原子序数由大到小的顺序是C>A>BB.原子半径由大到小的顺序是r(B)>r(A)>r(C)C.离子半径由大到小的顺序是r(C-)>r(B2+)>r(A2-)D.原子最外层电子数由多到少的顺序是B>A>C7.几种短周期元素的原子半径及主要化合价如下表:已知X是短周期中最活泼的金属,且与R同周期。
2020年暑假新高三一轮化学测试物质结构 元素周期律含答案及详细解析

绝密★启用前2020年暑假新高三一轮化学测试物质结构元素周期律含答案及详细解析本试卷分第Ⅰ卷和第Ⅱ卷两部分,共100分,考试时间150分钟。
分卷I一、单选题(共15小题,每小题4.0分,共60分)1.下列反应过程中,同时有离子键、极性共价键和非极性共价键的断裂和形成的反应是() A. NH4Cl NH3↑+HCl↑B. NH3+CO2+H2O===NH4HCO3C. 2NaOH+Cl2===NaCl+NaClO+H2OD. 2Na2O2+2CO2===2Na2CO3+O22.短周期主族元素X、Y、Z、W的原子序数依次增大。
X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z+与Y2-具有相同的电子层结构,W与Y同主族。
下列说法正确的是()A.原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)B. Z在周期表中的位置为第3周期、IB族C. X的最高价氧化物对应水化物的酸性比W的强D. W比Y更容易与氢气反应3.某粒子的结构示意图为,关于该粒子的说法不正确的是()A.核电荷数为16B.核外有3个电子层C.属于非金属元素原子D.在化学反应中容易失去2个电子4.现有如下各说法:①在水中氢、氧原子间均以化学键相结合②金属和非金属化合时一定形成离子键③离子键是阳离子、阴离子的相互吸引作用④根据电离方程式:HCl===H++Cl-,可判断HCl分子里存在离子键⑤H2分子和Cl2分子的反应过程是H2、Cl2分子里共价键发生断裂生成H、Cl原子,而后H、Cl原子形成离子键的过程。
上述各种说法正确的是()A.①②⑤B.都不正确C.④D.②③④⑤5.下列说法正确的是()A.分子晶体中一定存在分子间作用力,不一定存在共价键B.分子中含两个氢原子的酸一定是二元酸C.含有金属阳离子的晶体一定是离子晶体D.元素的非金属性越强,其单质的活泼性一定越强6.下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素原子的核电荷数为X元素的2倍。
高一暑假化学作业(人教版必修二):第一章 物质结构 元素周期律 第二节 元素周期律含解析

知识归纳一、原子核外电子的排布1.电子层:在含有多个电子的原子里,电子分别在能量不同的区域内运动,我们把不同的区域简化为不连续的壳层,也称作电子层。
2.电子层的表示方法:电子层的表示方法通常有两种,一是数字表示法;二是字母表示法(见下表)。
3.电子的能量:在核外运动的电子,能量各不相同,在离核较近的区域运动的电子能量较低,在离核较远的区域运动的电子能量较高。
电子层及电子的能量高低(1)各层最多容纳的电子数目为2n2个(n为电子层序数)。
(2)最外层电子数目不超过8个(K层为最外层时,不超过2个),次外层电子数目不超过18个。
(3)核外电子总是先排布在能量较低的电子层里,然后由里向外,依次排布在能量逐渐升高的电子层里,即按K、L、M、N…依次排列。
二、元素周期律1.定义:元素的性质随原子序数的递增而呈周期性变化的规律。
2.实质:元素原子核外电子排布周期性变化的结果。
3.具体表现形式(1)原子半径⎩⎨⎧同周期主族元素自左而右:原子半径逐渐减小同主族元素自上而下:原子半径逐渐增大(2)主要化合价:同周期自左而右⎩⎨⎧最高正价:+1―→+7最高正价=主族序数(O 、F 除外)负价-4―→-1非金属最低负价=-(8-族序数)(3)元素的金属性⎩⎨⎧同周期自左而右逐渐减弱同主族自上而下逐渐增强(4)元素的非金属性⎩⎨⎧同周期自左而右逐渐增强同主族自上而下逐渐减弱三、元素在周期表和元素周期律的应用(1)分区线附近元素,既表现出一定的金属性,又表现出一定的非金属性。
(2)对角线规则:在元素周期表中,某些主族元素与右下方的主族元素的性质有些相似,其相似性甚至超过了同主族元素,被称为“对角线规则”。
实例:① 锂与镁的相似性超过了它和钠的相似性,如:LiOH 为中强碱而不是强碱,Li 2CO 3难溶于水等等。
② Be 、Al 的单质、氧化物、氢氧化物均表现出明显的“两性”;Be 和Al 单质在常温下均能被浓H 2SO 4钝化;A1C13和BeCl 2均为共价化合物等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020百所名校高一暑假作业化学及答案寒假作业一物质结构元素周期律1.我国稀土资源丰富。
下列有关稀土元素144 62Sm与150 62Sm的说法正确的是()A. 144 62Sm与150 62Sm互为同位素B. 144 62Sm与150 62Sm的质量数相同C. 144 62Sm与150 62Sm是同一种核素D. 144 62Sm与150 62Sm的核外电子数和中子数均为622.下列各组物质的性质比较,正确的是()A.酸性:HClO4>H3PO4>H2SO4B.氢化物稳定性:H2S>HF>H2OC.碱性:NaOH>Mg(OH)2>Ca(OH)2D.氧化性:F2>Cl2>Br2>I23.下列各组物质中的两种物质化学键类型相同的是()A.CaCl2、HClB.MgCO3、Na2SC.KOH、NaClD.H2O、NH34.下列关于元素碘的放射性同位素I-131的叙述中正确的是()A.一个此碘原子中含有131个质子B.I-131位于元素周期表中第4周期ⅦA族C.其氢化物为HI,比HCl的稳定性强D.最高价氧化物的水化物为HIO4,比HClO4的酸性弱5.有a X n—与b Y m+两种简单离子(X、Y全是短周期元素),已知X n—比Y m+多两个电子层,下列说法正确的是()A. X只能是第3周期的元素B.a―b+n+m等于10或16C.b大于5D.Y不可能是第2周期元素6.几种短周期元素的原子半径及主要化合价见下表:下列说法正确的是()A.Q、T两元素的氢化物的稳定性为H n T<H n QB.L、R的单质与盐酸反应速率为R>LC.M与T形成的化合物有两性D.L、Q形成的简单离子核外电子数相等7.X、Y、Z、W为原子序数依次增大的短周期元素,X、Y同主族,Z、W同周期。
下列说法正确的是(m、n均为正整数)()A.若Z(OH)n为强碱,则W(OH)m也一定为强碱B.若H n XO m为强酸,则Z的气态氢化物溶于水一定显酸性C.Z可以从W的盐溶液中将W置换出来D.若Z的最高正价为+3价,则W的氢化物一定是气态的图CA1-18.如图CA1-1所示为短周期的一部分,推断关于Y、Z、M的说法正确的是() A.非金属性:Y>Z>MB.Y原子的结构示意图可表示为C.原子半径:M>Z>YD.ZM2分子各原子最外层均满足8e-稳定结构9.锂原子比镁原子少1个电子层,最外层电子数也比镁原子少1,在周期表中锂和镁的位置关系存在有“对角线”关系,“对角线”关系的元素性质存在相似性。
下列关于锂的判断可能正确的是()A.Li能在空气中燃烧生成Li2OB.Li2O熔点较低C.Li2CO3能溶于水D.LiOH受热不易分解10.下列关于同位素、同素异形体、同分异构体的说法正确的是()A.3517Cl与3717Cl属于同素异形体B.氕、氘、氚属于同分异构体C.O2与O3属于同位素D.CH2CH2CH2CH2CH3与CCH3CH3CH3CH3属于同分异构体11.下面关于氢化物的叙述正确的是()A.1个D2O分子中所含的中子数为8B.NH3的结构式为NHHHC.HCl的电子式为D.热稳定性:H2S >HF12.[发展要求]现有两种短周期主族元素X、Y,且在常温下X的单质呈气态,Y的单质呈固态。
则下列推断不正确的是()A.若X、Y位于ⅠA族,则X、Y可能与氧元素形成原子个数比为1∶1或2∶1的化合物B.若X、Y位于第3周期,则X、Y形成的化合物可能是离子化合物或共价化合物C.若气态H n X的沸点高于H n Y,则X、Y只能位于周期表ⅥA族D.若X、Y位于周期表的同一周期,则最高价含氧酸的酸性H n XO m>H a YO b13.. A、B、C、D均为短周期元素,原子序数依次增大。
已知:①A与D同主族,A形成的氢化物分子M与D形成的氢化物分子N都含有18个电子;②一定条件下,A、D分别和B形成的化合物X和Y具有相同的摩尔质量,且焰色反应均呈黄色;③A和C形成的化合物Z是光导纤维的主要原料。
回答下列问题:(1)X的电子式:__________;Z的化学式:________________________________________。
(2)A、B、C、D 4种元素的原子半径按由小到大排列的顺序为(用元素符号表示)________________________________________________________________________(3)在M的溶液中通入N,可发生反应生成D的单质和A的另一种氢化物,试写出化学方程式:________________________________________________________________________。
14.X、Y、Z、W是原子序数依次增大的短周期元素,且互不同族;其中只有两种元素为金属;X原子的最外层电子数与次外层电子数相等;X与W、Y与Z这两对原子的最外层电子数之和均为9。
单质Y和W都可与浓的NaOH溶液反应。
请回答下列问题:(1)Y、Z、W的原子半径由小到大的顺序是____________。
(2)ZW2的化学式是________ 。
(3)工业生产单质Y的原理是____________________________________________(用化学方程式表示)。
(4)X与Y化学性质相似,则X与浓的NaOH溶液反应的化学方程式是_______________________________________________________________________ _。
(5)0.1 mol的单质W与50 mL 1.5 mol/L的FeBr2溶液反应,则被氧化的Fe2+和Br -的物质的量之比是____________。
2020百所名校高一暑假作业化学参考答案1.A【解析】质子数相同,中子数不同的核素互称为同位素,具有一定数目质子数和中子数的原子称为核素。
144 62Sm与150 62Sm质量数不同,B错;144 62Sm与150 62Sm是不同核素,C错;144 62Sm 与150 62Sm的中子数不同,D错。
2.D【解析】根据非金属性强弱和金属性强弱来判断溶液的酸碱性,选项A和C正确的顺序应为酸性:HClO4>H2SO4>H3PO4,碱性:Ca(OH)2>NaOH>Mg(OH)2。
根据非金属性强弱可以判断氢化物的稳定性:HF>H2O>H2S。
3.D【解析】CaCl2中含离子键,HCl中含共价键;MgCO3含有离子键和共价键,Na2S中只含有离子键;KOH含有离子键和共价键,NaCl中只含有离子键;H2O、NH3中均只含有共价键。
4.D【解析】131为I的质量数,位于第5周期,因与Cl位于同族,且在其下方,因此其非金属性小于Cl,其氢化物的稳定性小于HCl,其最高价氧化物对应的水化物的酸性小于HClO4。
5.B【解析】由X n-比Y m+多两个电子层,可知X、Y在周期表中的相对位置为,且X、Y分别位于第8-n主族和第m主族,Y可能位于第1、2周期,而X可能位于第2、3周期。
a +n=10或18,而b-m=0或2,故B项正确。
6.C【解析】由Q和T有-2价,可知为ⅥA族元素,T的半径小于Q的,故T、Q分别为氧元素和硫元素;由L和R化合价都是+2价,可知为ⅡA族元素,R的半径小于L的,故R 和L分别为铍元素和镁元素;M元素原子半径略小于L(镁),其化合价为+3价,故可知为铝元素。
根据同主族元素从上到下非金属性依次减弱,可知稳定性H2S<H2O,A项错误;根据同主族元素从上到下金属性依次增强,可知金属性Be<Mg,与盐酸反应速率Be<Mg,B项错误;M与T形成的化合物为Al2O3,为两性氧化物,C项正确;Mg与S形成的简单离子相差一个电子层,D项错误。
7.B【解析】A项中Z(OH)n为强碱,W(OH)m未必就是强碱,例如,NaOH是强碱,但Mg(OH)2就不是强碱;若H n XO m为强酸,则X只能是N,Y为P,Z是S,W是Cl,它们的气态氢化物溶于水都呈酸性;若Z、W均为金属,则Z可能将W从它的盐溶液中置换出来,若Z、W均为非金属,则W可能将Z从它的盐或酸溶液中置换出来;D项中W可能为ⅣA、ⅤA、ⅥA、ⅦA及0族元素,当W为O时,它在常温下的氢化物就是液态水。
8.D【解析】题图是短周期的一部分,根据元素周期表的结构可推知X为He,Y为F,M为Cl,Z为S。
根据元素周期律淘汰A、B、C选项。
9.A【解析】有“对角线”关系的元素性质存在相似性,锂及其化合物的性质与镁及其化合物的性质相似,能在空气中燃烧生成Li2O,Li2O是离子化合物,熔点较高,Li2CO3难溶于水,LiOH 受热易分解。
10.D【解析】3517Cl与3717Cl,氕、氘、氚属于同位素,A、B项错误;O2与O3是同素异形体,C项错误;CH2CH2CH2CH2CH3与分子式相同,但结构不同,是同分异构体,D项正确。
11.B【解析】1个D中有1个中子,1个O中有8个中子,故D2O中含10个中子,A项错。
N 可形成3个共价键而H只能形成1个共价键,B项正确。
HCl是共价化合物,不存在离子,C项错。
氢化物的稳定性与非金属性有关,非金属性越强,氢化物越稳定,D项错。
12.C【解析】符合A项的物质为H2O、H2O2和Na2O、Na2O2;符合B项的物质为MgCl2、SiCl4;符合D项的X的原子序数比Y的原子序数大,非金属活泼性X>Y,酸性H n XO m>H a YO b。
符合C选项的X、Y为S和O或P和N。
13.(1) SiO2(2)O<S<Si<Na(3)H2O2+H2S===S↓+2H2O【解析】根据①,含18个电子的氢化物分子最容易想到的是第3周期的气态氢化物,而与之同主族的18电子氢化物分子就只有H2O2和H2S,所以A是O,D是S,则M、N分别是H 2O 2和H 2S ;根据②知B 是Na ,X 、Y 分别是Na 2O 2和Na 2S ;根据③知C 为Si ,Z 为SiO 2。
14.(1)Cl<S<Al (2)SCl 2 (3)2Al 2O 3(熔融)=====通电4Al +3O 2↑(4)Be +2NaOH===Na 2BeO 2+H 2↑ (5)3∶5【解析】 因X 原子的最外层电子数与次外层电子数相等,在短周期中只有Be 符合条件;又X 与W 、Y 与Z 这两对原子的最外层电子数之和均为9,则W 原子的最外层电子数必为7,可能为F 或Cl ;由单质Y 和W 都可与浓的NaOH 溶液反应,且X 、Y 、Z 、W 是原子序数依次增大且互不同族,则Y 是Al ,Z 为S ,W 为Cl 。
