有机化学(上)复习重点
有机化学复习重点

sp 2有机化学复习重点第一章 绪 论1.共价键理论现代共价键理论基本要点①当两个原子互相接近到一定距离时, 自旋方向相反的单电子相互配对, 使电子云密集于两核之间, 降低了两核间正电荷的排斥力, 增加了两核对电子云密集区域的吸引力,因此, 使体系能量降低, 形成稳定的共价键。
② 每个原子所形成共价键的数目取决于该原子中的单电子数目, 即一个原子含有几个单电子, 就能与几个自旋方向相反的单电子形成共价键, 这就是共价键的饱和性。
③ 当形成共价键时, 原子轨道重叠程度越大, 核间电子云越密集, 形成的共价键就越稳定。
因此, 共价键总是尽可能地沿着原子轨道最大重叠方向形成, 这就是共价键的方向性。
2.杂化轨道理论杂化轨道理论 (orbital hybridization theory):原子在形成分子时,由于原子间的相互影响,同一个原子内的不同类型、能量相近的原子轨道可以重新组合成能量、形状和空间方向与原来轨道完全不同的新的原子轨道。
这种重新组合过程称为杂化,所形成的新的原子轨道称为杂化轨道(hybridization orbitals )。
3.sp 3, sp 2, sp 杂化对应碳原子空间构型4.共价键的属性第二章 烷 烃1.系统命名法①对于支链烷烃,把它看作是直链烷烃的烷基取代衍生物。
spsp 3键长 :成键原子的核间距离 键角:两共价键之间的夹角键能:离解能或平均离解能键的极性: 成键原子间的电荷分布决定分子 空间构型→ 化学键强度 → 影响理化性质支链烷烃的命名法的步骤:选取主链(母体)。
选一个含碳原子数最多的碳链作为主链。
(写出相当于这个主链的直链烷烃的名称)含多取代基时,编号采用“最低次序”原则。
所谓“最低序列”指的是碳链以不同方向编号,得到两种或两种以上的不同编号序列,则顺次比较各系列的不同位次,最先遇到的位次最小者为“最低系列”。
②主链碳原子的位次编号:确定主链位次的原则是要使取代基的位次最小。
有机化学知识点复习归纳(同系物、同分异构体)

一、同系物: 结构相似,在分子组成上相差一个或若干个CH2 原子团的有机物。
同系物的判断要点: 1、通式相同,但通式相同不一定是同系物。 2、组成元素种类必须相同 3、结构相似指具有相似的原子连接方式,相同的官能团类别和
数目。结构相似不一定完全相同,如CH3CH2CH3和(CH3)4C, 前者无支链,后者有支链仍为同系物。 4、在分子组成上必须相差一个或几个CH2原子团,但通式相同组 成上相差一个或几个CH2原子团不一定是同系物,如 CH3CH2Br和CH3CH2CH2Cl都是卤代烃,且组成相差一个CH2 原子团,但不是同系物。 5、同分异构体之间不是同系物。
谢谢!
应的化学方程式:
练习5
化合物
有一种链状的同分异构体,
能发生银镜反应,核磁共振氢谱有2个峰,该
同分异构体的结构简式为:
同分异构体小结
各类有机物异构体情况: ⑴CCHn3H(C2nH+22:)3C只H能3、是C烷H烃3C,H而(C且H3只)C有H2碳C链H3异、构C(。CH如3)4
⑵ CnH2n:单烯烃、环烷烃。如CH2=CHCH2CH3、
团异构。 如:1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇
与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与 果糖、蔗糖与麦芽糖等。画出结构简式。
练习2
写出C5H12O2能使NaHCO3溶液反应的同分 异 构体;
思路:碳链异构→官能团位置异构。
写出C5H12O2能与NaOH溶液反应的同分异 构体;
思路:官能团异构→碳链异构→官能团位置异构。
CH3CH=CHCH3、CH2=C(CH3)2、
、
⑶ CnH2n-2:炔烃、二烯烃。如:CH≡CCH2CH3、 CH3C≡CCH3、CH2=CHCH=CH2
有机化学知识点归纳(上)[1]
![有机化学知识点归纳(上)[1]](https://img.taocdn.com/s3/m/2756bddf6f1aff00bed51e4d.png)
有机化学知识点归纳(上)一、同系物结构相似,在分子组成上相差一个或若干个CH 2原子团的物质物质。
同系物的判断要点:1、通式相同,但通式相同不一定是同系物。
2、组成元素种类必须相同3、结构相似指具有相似的原子连接方式,相同的官能团类别和数目。
结构相似不一定完全相同,如CH 3CH 2CH 3和(CH 3)4C ,前者无支链,后者有支链仍为同系物。
4、在分子组成上必须相差一个或几个CH 2原子团,但通式相同组成上相差一个或几个CH 2原子团不一定是同系物,如CH 3CH 2Br 和CH 3CH 2CH 2Cl 都是卤代烃,且组成相差一个CH 2原子团,但不是同系物。
5、同分异构体之间不是同系物。
二、同分异构体化合物具有相同的分子式,但具有不同结构的现象叫做同分异构现象。
具有同分异构现象的化合物互称同分异构体。
1、同分异构体的种类:⑴ 碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C 5H 12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑵ 位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑶ 异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、葡萄糖与果糖、蔗糖与麦芽糖等。
⑷ 其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
各类有机物异构体情况:⑴ C n H 2n +2:只能是烷烃,而且只有碳链异构。
如CH 3(CH 2)3CH 3、CH 3CH(CH 3)CH 2CH 3、C(CH 3)4 ⑵ C n H 2n :单烯烃、环烷烃。
如CH 2=CHCH 2CH 3、CH 3CH=CHCH 3、CH 2=C(CH 3)2、 、 ⑶ C n H 2n -2:炔烃、二烯烃。
有机化学上册复习要点

39. 下列化合物最易与 HBr 加成的是
A. B. C. D.
40. 下列化合物与卢卡斯试剂反应最快的是 A、正丁醇 B、2-丁醇 C、2-甲基-2-丁醇 41. 下列化合物哪个最不稳定?
Br H Br H
H Br
D、正丙醇
H Br
A、
H Br
B、
H Br
Br
H Br
C、
H
D、
42. SN2 反应的特征是: (Ⅰ)生成正碳离子中间体;(Ⅱ) 立体化学发生构型翻转;(Ⅲ)反应速率受反应物浓度影响, 与亲核试剂浓度无关; (Ⅳ)在亲核试剂的亲核性强时容易发生。 A.Ⅰ和Ⅱ B. Ⅲ 和Ⅳ C. Ⅰ和Ⅲ D.Ⅱ和Ⅳ 43. 烯烃和溴化氢在过氧化物存在下的加成,生成反马氏规则加成产物,其反应
18. 下列化合物在水中的溶解度最小的是 A. 1-丁醇 B. 1-己醇 C. 乙二醇 D. 丙三醇 19. 下列构象中稳定的反-1-甲基-4-异丙基环己烷是:
CH3 CH3 CH3 CH3
(H3C)2HC
A
CH(CH3)2
B
(H3C)2HC
C
CH(CH3)2
D
20. 下面化合物中无芳香性的是:
+
A. B. C.
历程为: A、自由基历程 B、亲核加成反应 C、亲核取代反应 D、亲电取代反应 44. 乙醇的沸点比二甲醚的高,其原因是: A、乙醇分子间形成氢键 B、乙醇分子内形成氢键 C、二甲醚分子量小 D、二甲醚分子内形成氢键
45. 下列化合物中最易起SN1 反应的是: A、CH3Br B、CH3CH2Br C、(CH3)2CHBr
各位同学大家好! 为了方便同学复习迎接有机化学上册的期末考试, 特准备了以下问题请大家思考, 并独自完 成总结,选择题看书后完成,不必问老师答案是什么。 Part I. 本概念: 1. 有机化学的定义 2. 共价键及其键参数 3. 原子核外电子的排布规律是什么 4. 化学键的类型 5. 强酸性和强碱性的有机化合物结构特征是什么 6. 烷烃及同分异构体 7. 有机化合物 8. 次序规则 9. 立体化学,烷,烯及炔碳中心的杂化方式 10. 构象 11. 手性,手性分子 12. 烷烃,烯烃和炔烃的定义 13. 有机化学反应的基本类型 14. 亲核取代,消除反应 15. 诱导效应的定义和类型 16. Walden 翻转 17. Zaitsev 规则 18. 亲电加成,马氏规则 19. 醇的定义,结构特征 20. 芳香性,芳烃结构特征,休克尔规则,Birch 还原及其特点 Part II. 选择题 1. 下列化合物与KOH的乙醇溶液按SN2 反应进行,其反应速度最快的是:
大学有机化学-各章重点

H3C H
CH3 H
H3C H
H CH3
顺-2-丁烯 反-2-丁烯 两个相同原子或基团处于双键同侧者为顺式, 处于异侧者为反式。 顺反异构产生的条件: (1) 结构中存在限制旋转的因素(π 键或环) 。 (2) 双键碳上分别连有不同基团
a
即在
b
中当 a ≠ d,b ≠ c 时存在几何异构。当双键的两个碳上若没有相同原子或
第二章 烷烃
2.1 基本要求
1. 2. 3. 4. 掌握烷烃碳原子的杂化状态及分子结构特点。 掌握烷烃的系统命名法和普通命名法。 掌握烷烃构象的概念及构象的写法。 掌握烷烃的卤代反应及其自由基反应的机理。
2.2 基本内容
1. 命名 烷烃的命名常用的有普通命名法和系统命名法两种方法。 (1)普通命名法 简单的烷烃根据碳原子的总数称为某烷 C1~C10 用甲、乙、丙……壬癸表示,从 C11 开始 用中文大写数字表示。 不含支链的称 “正” 某烷, 链的一端第二个碳上有一个甲基并再无其它取代基的称为 “异” 某烷,有二个甲基并再无其它取代基的称为“新”某烷。 (2)系统命名法 系统命名法的基本点是确定主链和取代基的位次,描述一个烷烃结构实际上就是描写主 链(母体)和取代基的具体情况。 2. 烷烃的分子结构 (1) 碳原子的 sp3 杂化和 σ 键的特点 由一个 s 轨道和三个 p 轨道“混合” ,并“重新组合”形成四个相同的新轨道的杂化方 3 3 式称 sp 杂化。饱和烃中碳原子均为 sp 杂化,饱和烃中所有的键均为 σ 键,因为饱和碳上 形成的键都是沿着轨道对称轴方向相互重叠而形成,这是 σ 键的特征。 (2) 碳链异构和碳氢类型 分子式相同,分子中碳原子连接顺序不同而产生的异构称碳链异构。在各种不同结构的 碳链中,由于碳原子所处的地位不同可以分为伯(一级 1º)、仲(二级 2º)、叔(三级 3º)、季(四 级 4º)四种类型。 (3) 烷烃的构象异构 烷烃分子中各原子均以单键(σ 键)相连。从乙烷开始,由于 C-C σ 键的自由旋转,使分 子中的原子或基团在空间上存在不同的排列方式, 称为烷烃的构象。 乙烷有交叉式和重叠式 两种极端构象式。 由于交叉式构象中两个碳原子上的氢原子距离较远, 斥力较小, 内能最低, 称为优势构象式。 分子的热运动提供的能量足可以使不同构象间以极快的速度转化, 所以在 室温下不能分离构象异构体。 (4) 化学性质 烷烃的化学性质较稳定,但在光照或高温加热下可以发生卤代反应。卤代反应是共价键 的均裂产生自由基引起的,所以属于自由基取代反应历程。以外,在一定条件下,烷烃还能 发生氧化与燃烧、热裂等反应。
大学《有机化学》期末考试题与总结
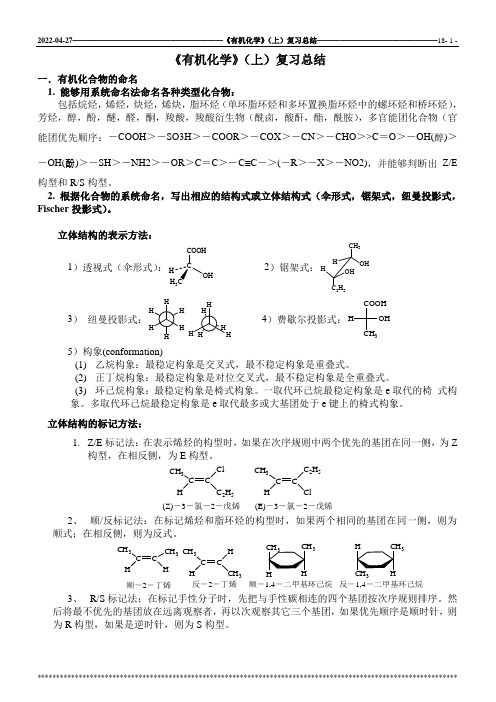
《有机化学》(上)复习总结一.有机化合物的命名1. 能够用系统命名法命名各种类型化合物:包括烷烃,烯烃,炔烃,烯炔,脂环烃(单环脂环烃和多环置换脂环烃中的螺环烃和桥环烃),芳烃,醇,酚,醚,醛,酮,羧酸,羧酸衍生物(酰卤,酸酐,酯,酰胺),多官能团化合物(官能团优先顺序:-COOH >-SO3H >-COOR >-COX >-CN >-CHO >>C =O >-OH(醇)>-OH(酚)>-SH >-NH2>-OR >C =C >-C≡C ->(-R >-X >-NO2),并能够判断出Z/E 构型和R/S 构型。
2. 根据化合物的系统命名,写出相应的结构式或立体结构式(伞形式,锯架式,纽曼投影式,Fischer 投影式)。
立体结构的表示方法:1)透视式(伞形式):CCOOHOH3 2)锯架式:CH 3OHHHOH C 2H 53)纽曼投影式:4)费歇尔投影式:COOHCH 3OH H5)构象(conformation)(1) 乙烷构象:最稳定构象是交叉式,最不稳定构象是重叠式。
(2) 正丁烷构象:最稳定构象是对位交叉式,最不稳定构象是全重叠式。
(3) 环己烷构象:最稳定构象是椅式构象。
一取代环己烷最稳定构象是e 取代的椅 式构象。
多取代环己烷最稳定构象是e 取代最多或大基团处于e 键上的椅式构象。
立体结构的标记方法:1. Z/E 标记法:在表示烯烃的构型时,如果在次序规则中两个优先的基团在同一侧,为Z 构型,在相反侧,为E 构型。
CH 3CC HC 2H 5CH 3CC H2H 5Cl(Z)-3-氯-2-戊烯(E)-3-氯-2-戊烯2、 顺/反标记法:在标记烯烃和脂环烃的构型时,如果两个相同的基团在同一侧,则为顺式;在相反侧,则为反式。
CH 3C CHCH 3HCH 3CH HCH 3顺-2-丁烯反-2-丁烯333顺-1,4-二甲基环己烷反-1,4-二甲基环己烷3、 R/S 标记法:在标记手性分子时,先把与手性碳相连的四个基团按次序规则排序。
有机化学期末复习重点

第1 章 绪 论 1. 有机化合物与有机化学的定义2.有机化合物的特点(了解)3.共价键的特性和属性。
注意:分子的极性与键的极性和分子的对称性有关。
4.共价键的断裂和有机化学反应的基本类型(1) 共价键的断裂方式分为均裂和异裂,根据共价键的断裂和形成的方式不同,可把有机反应机理分为:游离基反应、离子型反应和协同反应等 3 大类。
5.有机反应中“离子型”反应根据反应试剂类型不同,分为亲电反应与亲核反应两类:(1) 亲电试剂与亲电反应:由缺电子的试剂进攻部分负电荷的碳原子而发生的,这类十分需要电子的试剂称为亲电试剂。
如含有 H +、Cl +、Br +、NO 2+、RN 2+、R 3C +等正离子的试剂。
由亲电试剂的进攻而引起的反应称为亲电反应。
(2) 亲核试剂和亲核反应:由能供给电子的试剂进攻具有部分正电荷的碳原子而发生的,这类能供给电子的试剂称亲核试剂,如 H 2O、ROH、OH -、RO -、Br -、NH 3、RNH 2、CN -等。
由亲核试剂的进攻而引起的反应称为亲核反应。
注意:有机反应中,加成反应分为亲电加成(烯烃与卤素的反应)、亲核加成(羰基与氰氢酸、水、醇、格氏试剂、氨的衍生物之间的反应)、自由基加成(如:不对称与 HBr 在过氧化物存在下的反应属于自由基加成,遵循反马氏规则)三类。
第 2 章 烷烃和环烷烃一、烷烃的命名:1.掌握有机化合物系统命名的基本原则2.碳原子的分类(伯、仲、叔、季)与常见烷基的结构和名称(P 48)3.顺序规则 —— 主要烷基的优先次序:甲基<乙基<丙基<异丙基二、烷烃的结构(了解)三、烷烃的构象异构(属于立体异构)乙烷中最典型的 2 种构象是交叉式(稳定构象)和重叠式,用 Newman 投影式和锯架式表示。
丁烷的 4 种典型构象及其稳定顺序:对位交叉式>邻位交叉式>部分重叠式>全重叠式。
四、烷烃的化学性质(掌握)烷烃卤代反应的机制——游离基(自由基)反应,分链引发、链增长与链终止是的 3 个阶段;烷烃卤代反应的取向主要由自由基稳定性次序来决定。
有机化学重点(完整版)

有机化学重点(完整版)烷烃1.室温下,叔、仲、伯氢氯代的速率之比是5:4:1溴代反应中,有一种异构体占绝对,选择性高。
2.异构化反应:ch3ch2ch2ch3alcl390℃1-2mpach3chch3ch31.α-c:与官能团轻易相连的碳原子烯烃2.把烯烃加进溴的四氯化碳溶液中,轻微震荡后,红色显露,需用此反应检验烯烃的存有,以区别饱和状态烃。
(鉴别)3.马氏规则:不等距烯烃与卤化氢等极性试剂差率时,试剂中带正电的部分总是提至含氢较多的双键碳上4.差率硫酸ch2=ch2+h2so4------ch3ch2oso2ohch3ch2oso2oh+h2o-----ch3ch2oh+h2so4(间接水合法制醇)5.加成水:6.加成次卤酸7.hbr存有过氧化物效应(反马氏差率)8.高锰酸钾氧化rchr1kmnoo(分析结构,鉴别,烯----羧酸/酮)4c(直接水合法制醇)r2h+rcooh+r1cr29.催化剂水解:(制环氧乙烷)10.臭味水解:(烯-----醛)11.硼氢化-氧化反应相当于反马氏加成水得到醇,特别是伯醇的合成12.顺丁烯二酸酐与共轭二烯反应生成白色沉淀(鉴别)炔烃1.命名时首先并使双键和叁键位次和最轻,若从两边编号和一样,则优先并使双键的位次尽可能大.2.双、叁键同时存有时,差率首先出现在双键上3.加成卤化氢hgcl2-c(制氯乙烯)hcch+hclch2=ch5.与nanh2、linh2等反应nacch+chchchclchchchcch(增长碳链)6.与硝酸银(或氯化亚铜)的氨溶液反应:生成白色和棕红色沉淀(鉴定末端炔)7.加成水(炔------醛酮)催化剂:hgso4h2so48.3,4环烃类似烯但不能被高锰酸钾氧化(鉴别)可是溴的四氯化碳褪色芳香烃ch2clcl4.亲核差率:炔可与hcn、roh、rcooh差率,与烯烃相同。
h3ccch+ch3coohoh-h3c醋酸锌ococch2ch33223221.+br2苄氯当苯环上甘胺-cooh,-so3h,-cho,-cor,-oh,-nh2等官能团时以苯环为替代基febr3(fe)br2.亲电取代(特别注意催化剂)3.甲基苯的占位ch3so3ch3ch3cl2/feclh/h2o100--150℃so3hso3h+ch3cl(关键)4.烷基化反应(加长碳链)+ch3chch3clalcl3ch(ch3)3+hcl(催化剂:路易斯酸)烷基化试剂rx、roh、烯烃5.酰基化反应(得到支链烷基苯的桥梁)ooalcl3cch2ch3+ch3ch2ccl6.氯甲基化反应:(减少一个c的中间体)+hcho+hclzncl2(无水)60℃h2oh+ch2cl(作为中间体合成多一个c的羧酸,胺,醇)ch2coohnacnrnh2h2o_ohch2cnch2nhrch2oh7.含α-h的芳烃可以被高锰酸钾氧化(鉴别)-----生成羧酸8.氧化反应400-450℃9.第一类替代基+o2v2o5chchccooo+co2+h2ooo-o>-nr2>-oh>-or>-nh-c-r(-o-c-r)_>-ch3(c6h5-)>-x(cl,br)活化苯环的能力依次减少第二类替代基为卤代烃1.卤代烃的水解(制醇)2.卤代烃的醇求解-nh3,-nr3>-coor>-no2(-cn)>-so3h(-cooh)o-c-ro-c-h(合成醚,必须是伯卤代烃与醇钠反应)_3.卤代烃的氰解rcl+nacn钝化苯环+h2orch2oh+clcl的能力依次减弱2醇-水chohrcn+nacl(加长碳链,制酸,胺)rcnh2nirch2nh2rcnh(oh)h2o+_rcooh4.卤代烃的氨解5.卤代烃反应活性phch2x,ch2=chch2x>3orx>2orx>1orx(辨别)cl+nh3rnh2+nh4cl与硝酸银的醇溶液反应鉴别三类氯代烃(快-较快-慢)过量6.格式试剂的分解成rnhr'+r'nh3clrcl+r'nh2无水乙醚rx+mgrmgx(无水乙醚催化)h+h2o新制多一个c的羧酸rmgcl+co27.与有机纳反应rcoomgclrcooh醇1.辨别醇:重新加入申齐气泡产生2..与浓硫酸反应生成盐(鉴别分离醇)-----溶于浓硫酸3.分解成卤代烃(卢卡试剂)rch2ohrch2oh浓硫酸zncl2h2so4+浓hclrch2clrch2br+浓hbr4.卢卡试剂辨别3类羟基伯醇-----加热浑浊仲醇----10分钟浑浊叔醇----1分钟浑浊5.脱水反应oh+浓h2so4roh2hso4钅羊盐_6.用7.制备醛酮浓h2so4ch3ch2och2ch3℃k2cr2o7-h2so4或kmno140叔醇无法被上述两者水解(制取羧酸)4辨别伯仲与叔醇h3ch2oh170℃浓h2so4ch2=ch2ch3(ch2)3ch2-ohcro3吡啶ch3(ch2)3cho酚1.威廉姆森制备醚(醇纳加卤代烃)2.酚与酰氯(酸酐)反应分解成酯narclor+nacl3.与fecl3的显色反应(用于酚的鉴别)4.与溴水反应生成三溴苯酚白色沉淀(酚的鉴别)醛酮1.命名时官能团的优先顺序。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
完成反应式2.1 醚、环氧①制备:醇脱水、williamson 合成法、不饱和烃与醇作用、分子内williamson 合成环醚; ②性质:a,醚键的断裂:甲基醚、叔烷基醚与氢碘酸作用; b,环氧键的断裂(酸催化---生成更稳定的碳正离子,SN1) (碱催化---亲核试剂进攻位阻小(取代基少)的碳原子,SN2) c,claisen 重排(芳基烯丙基醚的重排)△Williamson 合成 :R-ONa+RX ↔R-O-R + NaX1.制备有叔烃基的混醚时,应采用叔醇钠与伯卤烷作用2.制备含芳醚时须采用酚钠,否则反应很难发生。
△不饱和烃与醇作用:可逆反应,可保护醇羟基△醚键断裂 甲基醚:亲核试剂(I-)进攻位阻小的(CH3--) 叔烷基醚:进攻叔烷基△ 苯基烯丙基醚及其类似物在加热的条件下,发生分子内重排生成邻烯丙基苯酚的反应,称为Claisen 重排。
△b,环氧键的断裂(酸催化---生成更稳定的碳正离子,SN1) (碱催化---亲核试剂进攻位阻小(取代基少)的碳原子,SN2)2.2 醛、酮:a ,制备(醇氧化脱氢、炔烃水合、同碳二卤化物水解、芳环酰基化-傅克反应、羧酸衍生物还原)△伯醇、仲醇氧化脱氢△炔烃水合(仅上面)CH 3X +(CH 3)3CONa (CH 3)3C O CH 3O Na + CH 3CI CI + CH 3O Na OCH 3OCH 2CH=CH 2*OH *CH 2CH=CH 2CH 2CH=CH 2*CH2=CH 2*CH 2烯丙位异构CH 3CH 2OH Cu CH 3CHO CH OH CH 3CH 3C OCH 3CH 3+ H 2+ H 2CuRCCH +H 2OHgSO 4H 2SO 4RCO CH 3RC CH1) B 2H 62) H 2O 2, OHRCH 2CHO△傅克酰基化反应:(芳烃的酰基化)△羧酸衍生物还原:△同碳二卤化物的水解b ,亲核加成△反应活性(空间位阻小的好、存在吸电子基好):△氢氰酸HCN------α-羟基腈所以碱性条件反应↑机理:合成上的应用:增长碳链,引进新的活性基团,增加一个C△亚硫酸氢钠---沉淀(醛+脂肪甲基酮+八碳以下环酮)----鉴别与分离 +R C OCl AlCl 3C OR C OCl +AlCl 3C O COClOCH 3CH 3LiAl(OBu-t )3H , 乙醚, 低温H 3O +CHOOCH 3CH 3CH 3CH 2C 10OOC 2H 5Al(n -Bu)2H , 己烷, 低温H 3O+CH 3CH 2C 10O H CH 3CH 2CH 2C O Cl Pd-BaSO 4CH 3CH 2CH 2C O H HCHO > RCHO > ArCHO > CH 3COCH 3 > CH 3COR > RCOR > ArCOAr C O 羟基睛α+HCN C OH CNOH 的存在有利于CN 的产生C O R R +CN -慢C R R O -CN 快C R R OH CN +CN -HCN C O R H (CH 3)+NaHSO 3C R H ONa SO 3HC R H OH SO 3Na( 饱和)(CH 3)(CH 3)α-羟基磺酸钠白色沉淀机理:应用范围:醛、甲基脂肪酮、C8以下环酮分离提纯 (在酸碱条件下分解成原来的酮或醛)△ 两分子醇---- 羰基保护 用生成缩醛或缩酮的方法来保护羰基,保护完毕再用稀酸水解脱掉保护基。
①△ 有机金属----(有机镁、有机锂、有机锌、炔钠) A.格氏试剂(R-Mg-X ) ②☆合成:格氏试剂+环氧乙烷或CH3CHO--→增加两个C 的醇 B.有机锂 更易与二叔丁基酮反应 ☆C.wittig 试剂----烯烃的生成D. 氨衍生物------鉴别与分离☆鉴别:2,4-二硝基苯肼与醛酮加成反应的现象非常明显,故常用来检验羰基,称为羰基试剂*c,α-H 的性质:C O R H +C R H ONa SO 2OH C R H OH SO 3Na S OH ONa O++分子内的酸碱反应Na 2CO 3C R HOH SO 3Na HClH 2O H 2OC O R HC O R H +NaCl +SO 2+H 2O +Na 2SO 3+CO 2+H 2OC OR''OR''R H(R')+H 2OH +C O R (R')H +2R"OH C O R MgX δ+δ-δ+δ-++干醚C OH R C OMgX R H 3O +Mg(OH)X Ph 3P CHR +C O R 1R 2C CHRR 1R 2C O +H 2N G H +C N G +H 2O NH 2-NH C O +H 2OC N-NH 黄( )O 2N NO 22,4 -二硝基苯肼O 2N NO 22,4 -二硝基苯腙C C 3H 7H O+ CH 3OH干HCl C C 3H 7OH OCH 3H C C 3H 7OCH 3OCH 3H 干HClCH 3OH卤仿反应----碘仿(条件:卤素+碱)(能发生反应的有:甲基酮+乙醛+CH3CH(OH)R ) 羟醛缩合----稀碱泊金反应----芳醛+脂肪酸酐+相应的脂肪酸盐△卤仿反应 1、碘仿反应☆可用来鉴别☆用卤仿反应制少一个碳的羧酸 ☆不对称的酮中,酸性较强的α-氢优先反应△羟醛缩合:具有α-H 的醛、酮在稀碱存在下发生两分子缩合生成β-羟基醛、酮的反应,叫羟醛缩合反应.△铂金反应:芳醛和酸酐在相应的羧酸盐存在下的反应,产物是α,β-不饱和芳香酸:黄色沉淀 R C CH 3O+ NaOH + I 2OH -CH I 3 + RCOONa R C C I 3O (H)(NaOX)(H)碘仿 CH 3C O 、CH 3CHOHNaOX 是一种氧化剂,能将 α-甲基醇氧化为α-甲基酮。
C H O CH 3C H O CH 2H 10%NaOH 5℃CH 3CH CH 2O H C OHαβC CH 3O CH 3C CH 3O CH 2H CH 3C CH 2O H C OCH 3αβ10%NaOH CH 3碳链成倍增长 CH 3CH C H 2OH C O H CH 3C H CH C O H αβα, β-不饱和醛 PhCHO + OCH 3C O CH 3C O CH 3COONaOHPhCHCH 2COOH_H 2O PhCH CHCOOHd,氧化还原:Tollens 、Fehling 试剂、催化加氢、氢化铝锂(LiAlH4)、硼氢化钠(NaBH4)、Clemmensen 、Wolff-Kishner 、Cannizzaro 岐化△TOLLENS (银镜反应) (只氧化醛、半缩醛可逆反应 生成醛)△Fehling 试剂(只对脂肪醛[广义]有效)△LiAlH4 还原(不还原C=C 、C ≡C ) △硼氢化钠还原(NaBH4) (只还原醛、酮、酰卤中的羰基,不还原其它基团) △Clemmensen 还原 (只还原芳香酮)R 为-Ph△Cannizzaro 岐化 不含α- 氢原子的醛在浓碱的作用下,能发生自身的氧化还原反应,其中一分子醛还原为醇,另一分子氧化为酸,也称为歧化反应。
2.3 羧酸a,制备(烯烃、醇、醛、甲基酮、芳烃侧链氧化;腈水解;酸衍生物水解;格氏试剂与二氧化碳;酚酸合成)△烯烃氧化:△ 醛的氧化:△甲基酮的氧化: (氯仿反应)△腈的水解:合成增加一个碳的羧酸RCHO + 2Ag(NH 3)2OH RCOONH 4 + 2Ag + H 2O +3NH3托伦试剂RCHO + 2Cu 2+ + NaOH RCOONa + Cu 2O + 4H +费林试剂+H 2O CH 3CH =CH CHO(1) LiAlH 4/Et 2O(2)H 3O +CH 3CH =CH CH 2OH HC CH C CH 3O CH 3NaBH 4HC CH CH CH 3OHCH 3R C H O (R')Zn Hg,HCl浓R CH 2H (R')当甲醛与另一无 α-H 的醛在强碱下共热,主要反应总是甲醛被氧化,而另一醛被还原。
CHO+HCHO 浓OH -CH 2OH +HCOO -C OCH 3Cl 2NaOHH+COOH +CHCl3R X R CN NaCNH 3OR COOHC O R H+ HCNC O H R H CN (α-羟基睛)H 3O R C COOH OHH△格氏试剂与CO2:R-MgX-----------→-- ----------→R-COOH生成增加一个C 的酸△芬酸合成:b,性质(酸性;影响酸性的因素;酰卤、酸酐、酯、酰胺的生成;还原;脱羧(α-碳上连有拉电子基);羟基酸受热反应(α、β、γ与δ、更远);α-H 的反应---卤代)△影响酸性大小因素: 使羧酸根负离子稳定的因素都将增加其酸性,反之,酸性则减弱。
→诱导效应:X-CH2COOH①吸电子基存在(-I) 使酸性增强 NO2 > N+(CH3)3 > F > Cl > Br > I ②供电子基存在(+I )使酸性变弱 (CH3)2CHCOOH > HCOOH > CH3COOH→共轭加诱导效应:X: OCH3 > CH3 > H > Cl > NO2 > OH∴酸性 CH3-Ph-COOH > OH-Ph-COOH > OH-CH2-COOH >CH3COOH△羧酸衍生物(酰氯、酸酐、酯、酰胺) 羟基被取代 酰氯: 酸酐: or酯化:羧酸与醇在强酸性催化剂作用下生成酯 TIP: 酸催化下伯醇、仲醇的酯化是按酰氧断裂方式进行的;叔醇的酯化按烷氧断裂方式进行酰胺:羧酸与氨或胺作用可以生成羧酸铵,再经加热脱水可得到酰胺△还原☆NaH4只还原醛、酮、酰卤中的羰基 △脱羧---用于合成减少一个C 的有机物 失去二氧化碳(α-碳上有拉电子基如 -NO2、-CN 、-CO-、-Cl )①CO2 ②H2O,H+R MgX +R C OMgX O C O O 干醚低温H 3O R C OH O δδONa +CO 290%0.5MPa150o C ~160oCOH COONa H 3O +OH COOH OK +CO 22.02MPa 180o C ~250o C H 3O+HO COOH HO COOK COOH X NO 2COOH NO 2COOCl +SO 2Cl++HCl SO 2 RCOOH +HOOCR RCOCR O O +H 2O COOH COOH 230oCC C OO O+H 2O五元环C 6H 5COOH +H 2NC 6H 5C 6H 5COONH 3C 6H 5+C 6H 5CONHC 6H 5+H 2OCH 2CH CH 2COOH 1. LiAlH 42. H 2O CH 2CH CH 2CH 2OH不影响双键C COOH CICI CICHCI 3 + CO 2CH CH 3HOOC COOHCH 3CH 2COOH + CO 2CHOCOOHO + CO 2△羟基酸受热反应(α、β、γ与δ、更远){△α-羟基酸的的分解 合成比原料少一个碳原子的醛酮2.4 羧酸衍生物 () a,性质:亲核取代—水解、醇解、氨解;与格氏试剂作用;△亲核取代反应活性:酰氯 > 酸酐 > 酯 > 酰胺△水解---反应条件不同△醇解----酰卤和酸酐→生成酯;酯的醇解→酯交换△氨解----生成酰胺b,还原:Rosenmund 还原;氢化铝锂还原;☆钠+乙醇还原--->酯 △AlLiH4还原 酰卤→醇 酸酐→相应的醇 酰胺→胺 羧酸→醇 酯→两分子醇△Rosenmund 还原:Pd 沉积在BaSO4上并用毒化剂毒化作催化剂,常压加氢酰氯还原成相应醛的反应。
