第十一章 取代酸 (2)
取代酸第三节羧酸衍生物
存在于植物的未成熟的果实及 叶子中, 用于制药和食品工业.
整理课件
10
二.羰基酸
(一) 羰基酸的结构和命名
分子中含有羰基和羧基的化合物称为羰基酸, 可分为醛 酸和酮酸. 根据羰基与羧基的相对位置, 酮酸可分为α-酮酸, β-酮酸等. 羰基酸的系统命名是选择含羰基和羧基的最长链为 主链, 称为 “某酮(或某醛)酸”, 并标明羰基的位次.
3.柠檬酸
存在于多种植物的果实中及动物组 织与体液中, 为无色晶体. 可用于食品 工业的调味品(有酸味)也用于制药业.
整理课件
9
4.水杨酸
水杨酸及其衍生物有杀菌防腐、镇痛解热和抗风湿作用, 乙酰水杨酸就是熟知的解热镇痛药阿司匹林. 阿司匹灵有解 热、镇痛作用,能抑制血小板凝聚,防止血栓的形成.
5. 苹果酸
羟基在苯环上不同位置的酚酸酸性顺序
整理课件
6
(2)α-羟基酸的氧化反应 α-羟基酸中的羟基受羧基的影响, 比醇中的羟基更容易
被氧化. 如乳酸在弱氧化剂条件下就能被氧化生成丙酮酸.
(3) α-羟基酸的分解反应 α-醇酸在稀硫酸的作用下, 容易发生分解反应, 生成醛
(或酮)和甲酸.
用途: ① 区别α-羟基酸与其他羟基酸 ② 制备少一个碳 的醛或酸.
整理课件
3
(二) 羟基酸的性质 1.物理性质
羟基酸多为结晶固体或粘稠液体. 由于分子中含有两个或 两个以上能形成氢键的官能团,羟基酸一般能溶于水,水溶性 大于相应的羧酸,疏水支链或碳环的存在使水溶性降低. 羟基 酸的熔点一般高于相应的羧酸.
2.化学性质
羟基酸除具有羧酸和醇(酚)的典型化学性质外,还具有 两种官能团相互影响而表现出的特殊性质。
整理课件
有机化学羧酸取代酸
1. 水解反应(得酸)
RCOCl + H2O
RCOOH + HCl 反应剧烈
RCOOCOR' + H2O H+
RCOOR'+ H2O
RCOOH + R'C9;OH 加热回流
RCOOR'+ H2O NaOH RCOONa + R'OH 皂化反应
反应活性: RCOX > (RCO)2O > RCOOR'
• 二元酸:称“某二酸” • 含脂环和芳环的羧酸:当羧基直接与环相
连时,“环的名称 + 甲酸”;当羧基与侧链 相连时,环作为取代基。
CH3CH2CHCH2CH2COOH CH3
4-甲基己酸
=
CH3CH2CCH2COOH CH2
3-乙基-3-丁烯酸
CH2COOH
环戊基乙酸 COOH
COOH CH3 邻甲基苯甲酸
1.酰卤
可将酰基的名称放在前面,卤素的名称放在 后面合起来命名,称为某酰卤。
CH3CH2COCl (CH3)2CHCOCl
丙酰氯
异丁酰氯
H3C
COCl
对甲基苯甲酰氯
2.酸酐
它们的命名,可在原来羧酸名称之后加一“酐 ”字来称呼
单酐:
O
CH3 C O
H3C C O
乙(酸)酐
混酐: O
CH3 C O
H3CH2C C O
关键步骤
R’OH +
O
R C OR’
质子转移
:OH
+
R C OH2
R’O
由此可见,酸催化的目的是增加羧酸分子中羰基碳 原子的亲电性。
(完整版)有机化学(汪小兰-第四版)教学大纲

《有机化学》教学大纲课程代码及名称:[11C115010]有机化学学分:3 总学时:50开课专业:科学教育(专升本)一、课程性质、目的和培养目标有机化学在化工学院的教学计划中是一门基础课。
它是化学学科一门关于有机化合物结构,用途以及有机反应原理的重要课程。
课程设置目的是使学生掌握有机化学最基本的理论,知识和技能:为进一步学习生物化学等有关课程准备必要的有机化学基础知识。
在教学中应尽可能结合生物系的需要,介绍有关的物质和反应,并兼顾现代有机化学新成就:同时还要注意培养学生辩证唯物主义思想、理论联系实际、实事求是的科学态度和分析问题、解决问题的能力。
要求1、掌握重要有机化学的命名方法,构造异构现象和顺、反异构现象。
2、掌握各类有机化合物的基本结构及其典型性质。
熟悉取代反应、加成反应、聚合反应、缩合反应、氧化、还原反应。
了解游离基反应、亲电加成反应、亲电取代反应、亲核加成反应的反应历程。
3、初步掌握旋光异构现象。
了解外消旋化和内消旋化。
外消旋化的拆分、构象、共轭效应和诱导效应。
4、掌握糖、油脂、类脂、重要杂环母体的结构、组成利性质。
5、萜类、甾类化合物利维生素只作——般了解。
6、每章每节都留有一定的习题作业。
在可能的情况下安排一些习题课。
二、课程内容和建议学时分配第一章绪论(1学时)1-1 有机化学研究对象与任务1-2 化学键与分子结构1-3 共价键的键参数键长、键角、键能、键的极性。
1-4 分子间的力1-5 有机化合物的一般特点1-6 有机反应的基本类型1-7 研究有机化学的方法1-8 有机化合物的分类第二章烷烃(3学时)2-1烷烃的同系列和同分异构2-2烷烃的命名;普通命名法、系统命名法、基的概念。
2-3烷烃的结构;SP3杂化轨道、σ一键、键角、键长、键能2-4烷烃的构象:乙烷、丁烷的构象。
2-5烷烃的性质:物理性质:熔点、沸点、比重、溶解度、化学性质:稳定性、氧化、热裂化、2-6卤化反应(均裂、异裂、游离反应历程)。
基础化学课件:取代酸 旋光异构

A
A
B
D'
C
D
B'
A'
A'
起偏镜
乳酸
旋光性物质
盛液管
α
目镜(亮)
检偏镜
比旋光度
為了比較各種不同光性物質的旋光度的大小,一般用比 旋光度來表示。比旋光度與從旋光儀中讀到的旋光度關係如 下。
测定温度
旋光度(旋光仪上的读数)
[α
]t
λ
=
比旋光度
波长
(钠光D)
α LC
溶液的浓度(g/ml) 盛液长度(分米dm)
測定化合物的旋光度是用旋光儀,旋光儀主要部分是有兩個尼可 爾棱鏡(起偏棱鏡和檢偏棱鏡),一個盛液管和一個刻度盤組織裝而 成。
若盛液管中為光性物質,當偏光透過該物質時會使偏光向左或右 旋轉一定的角度,如要使旋轉一定的角度後的偏光能透過檢偏鏡光柵, 則必須將檢偏鏡旋轉一定的角度,目鏡處視野才明亮,測其旋轉的角度
由於實物和鏡像不能重合而產生的異構現象,叫做對映異構。 這樣的異構體叫做對映異構體,簡稱異構體。
二、偏振光
光波是一種電磁波,它的振動方向與前進方向垂直。
A
B
D'
光源
C
C'
光束前进方向
D A' B'
(1 )光的前进方向与振动方向
(2)普通光的振动平面
图 12-1 光的传播
在光前進的方向上放一個(Nicol)棱鏡或人造偏振片, 只允許與棱鏡晶軸互相平行的平面上振動的光線透過棱鏡, 而在其他平面上振動的光線則被擋住。這種只在一個平面 上振動的光稱為平面偏振光,簡稱偏振光或偏光。
2 、 R/S命名法
讲稿(PP)-取代酸

+ H2O
α-羟基丙酸 羟基丙酸
丙交酯
(2)β-羟基酸受热发生分子内脱水, 羟基酸受热发生分子内脱水, 生成α 生成α,β不饱和酸
CH3-CH-CH2-COOH | OH HO-CHCOOH HO CHCOOH | H-CHCOOH △ CH3-CH=CH-COOH+H2O
酶
HC-COOH || + H2O HOOC-CH
第十一章
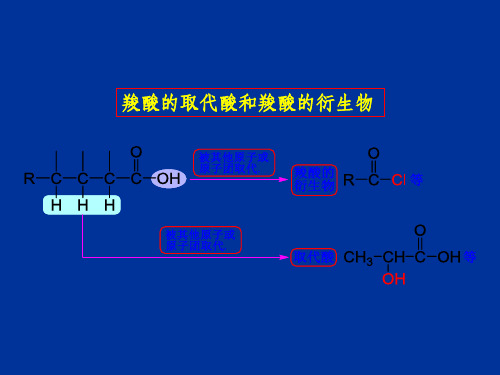
取代羧酸
O || R-C-OH - - (Ar) 羧酸分子中烃基的氢原子被某些原子或原 子团取代的化合物称为取代羧酸。 子团取代的化合物称为取代羧酸。按取代基的 种类不同,取代羧酸可分为卤代酸 羟基酸、 卤代酸、 种类不同,取代羧酸可分为卤代酸、羟基酸、 羰基酸和氨基酸等 羰基酸和氨基酸等。
R-C-CH2-C-R - - - || || O O R-C-CH=C-R - - = - || | O OH
乙酰乙酸乙酯的反应
O
O
CH3-C-CH2-C -O C2H5 - 能和氢氰酸、亚硫酸氢钠、 能和氢氰酸、亚硫酸氢钠、 2,4-二硝基苯肼等发生加成或 二硝基苯肼等发生加成或 加成缩合反应 能使溴褪色 能和三氯化铁发生颜色反应
烯醇式7.5% 烯醇式
二羰基化合物由于具有活泼的亚甲基, β-二羰基化合物由于具有活泼的亚甲基,常被 二羰基化合物由于具有活泼的亚甲基 称为活泼亚甲基化合物。它们在碱的作用下, 称为活泼亚甲基化合物。它们在碱的作用下,容易 形成烯醇负离子(碳负离子), ),作为亲核试剂与卤 形成烯醇负离子(碳负离子),作为亲核试剂与卤 代烃、酰卤、羰基发生亲核反应, 代烃、酰卤、羰基发生亲核反应,在合成上是重要 的增长碳链的试剂。 的增长碳链的试剂。乙酰乙酸乙酯和丙二酸二乙酯 是其中的典型代表。 是其中的典型代表。
【有机化学课件】11 第11章 取代酸

3.γ-醇酸分子内脱水生成五元环的内酯。
CH2 CH2 C O CH2 CH2 CH2 OH OH CH2 C O + H2O
O γ -丁内酯
应用化学系
第11章 取代酸
有机化学2012
4.羟基和羧基相隔五个或五个以上碳原子的醇 酸,受热后则发生多分子间的酯化脱水,生成 链状结构的聚酯。
mHO(CH2)nCOOH H [O(CH2)n CO ] mOH + (m-1)H2O (n ≥ 5)
第11章 取代酸
有机化学2012
第11章 取代酸
主讲人:冯志彪
应用化学系
第11章 取代酸
有机化学2012
羧酸分子中烃基上的氢原子被其它原子或基团取代所生成的化合物叫取代酸。
11.1 羟基酸概述
α-醇酸、β-醇酸、γ-醇酸等。
H3C CH COOH HO 2-羟基丙酸(乳酸)
HOOC CH CH2 COOH HOOC CH CH COOH OH OH OH 2-羟基丁二酸(苹果酸) 2,3-二羟基丁二酸(酒石酸)
CH3COCH(CO2C2H5)2 79%
O R C CH2 O C Y R
有机化学2012
OH CH3C CHCOCH3 20%
OH CH3C C(CO2C2H5)2 21%
OH C C O C Y
Y 为强吸电子基团
应用化学系
第11章 取代酸
有机化学2012
11.9 乙酰乙酸乙酯及丙二酸二乙酯在有机合成中的应用 自学(不要求)
应用化学系
丙氨酰苯丙氨酰甘氨酰丝氨酸
第11章 取代酸
五、呈色反应
1.与水合茚三酮的反应
有机化学2012
α-氨基酸与水合茚三酮在弱酸水溶液中加热时,并生成蓝紫色化合物。
有机化学(第二版)答案__赵建庄
另一组答案为: A.
B. H3C CH2 CH2 CH2Br
C. H3C CH 2 CH CH2
10.
氧化后得到的
对称二酮为:
11.
反应式如下:
12. 透视式
纽曼式
第五章 卤代烃习题参考答案
1. (1) 2-甲基-4-氯戊烷 (3) 4-溴-1-环己烯 (5) 2-氯-4-溴甲苯
(2) 2-氯-2-己烯-4-炔 (4) 苄溴(溴化苄,苯溴甲烷) (6) 3,6-二氯-2-甲萘
H+ -H2O
H3C C CH CH 2 CH3 CH3
+ (1) O3
(2) Zn, H2O H3C CH 2 CHO
O H3C C CH3
丙醛可发生银镜反应,丙酮可发生碘仿反应。
第十章 羧酸、羧酸衍生物和取代酸 参考答案
1. (1) 3-甲基丁酸
(2) 3-乙基-3-丁烯酸
(3) 2,3-环氧丁酸
(4) 1,3-(间)苯二甲酸
(5) 2,4-二氯苯氧乙酸
(6) 反-1,2-环丙二甲酸
(7) 4-甲基-2,4-戊二烯酸
(8) 2-甲基丁酸
(9) 3-(间)甲基苯甲酰溴 (10) 乙酸对甲基苯酯
(11) N-甲基-N-乙基甲酰胺 (12) 乙丙酐
(13) 二乙酸乙二酯
(14) γ –丁内酯
(15) 2-甲基-3-丁酮酸
2.
3. (1)
(2)
(3)
(4)
(5)
4. (1)
(2)
5. (1)
+ CH3I
(2)
O
(3)
(4) 2 H3C C CH3
(5)
(6)
,
取代酸
•1)酸性
• 羟基的吸电子效应,羟基酸比相应的羧酸酸性强,诱导 效应随距离增长而减弱,故羟基离羧基越远酸性越弱
• 比较下列化合物酸性
CH3
CH2
COOH
CH3
CH OH
COOH
CH2 OH
CH2
COOH
•2)α—羟基酸的氧化
• α-羟基酸可被氧化成α-羰基酸
H3C CH COOH OH 乳酸
[ O]
一 羟基酸
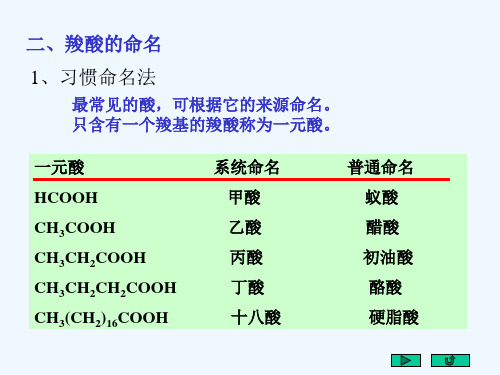
• 1. 命名
• 常用俗名 • 系统命名:含羟基和羧基的最长碳链为主链,编号从 离羟基最近的羧基开始,也可用α 、β 、γ 等表示羟 基的位置
H3C CH COOH 乳 酸 2-羟 基 丙 酸 OH α ?羟 基 酸 HO CH2 CH2 COOH 3-羟 基 丙 酸 β -羟 基 酸
HO
(乙 酰 乙 酸 )(β -酮 酸 )
•主要化合物
• 1乙醛酸
2 COOH
O
CHO COOH
CHO
NaOH
CH2OH COONa
COOH
COONa
+
COONa
• 2 丙 酮 酸 CH3
CH2OH CH2OH COOH
2
C
COOH –有机体内糖代谢的中间产物。可有乳酸氧化,也可 COOH COOH COOH
CH CH3 C O H C OC2H5 O 较稳定 亚甲基上氢的酸性,易离开。 原因 共轭。 分子内氢键。 CH3 C CH COC2H5 OH O
一般的烯醇式结构是不稳定的: 例如: CH3 C CH3
O
CH2
C OH
CH3
仅占2.0×10-2 %
3. 乙酰乙酸乙酯的分解 酮式分解(稀碱)
有机化学之取代酸
C
+
顺乌头酸
COOH
C
2
异柠檬酸
O CO2 CO2
C CH2 CH2
COOH
O H
O
COOH
+
C H 2C O O H C H 2C O O H
H
+
H
H
CO C
CO2
2
C CH O H O
CH2 COOH 戊酮二酸
C H 2C O O H C H 2C O O H
CH2
COOH
草酰琥珀酸
CH2
COOH
H+
酸式分解:浓NaOH
O O || || CH3—C—CH2—C—OC2H5
浓NaOH
2CH3COOH
△
2CH3COO- + C2H5OH
4、乙酰乙酸乙酯
2.
互变异构现象:
—NH—NH2 橙黄色↓ 浅黄色↓ 褪色 紫红色 H2↑
O O || || CH3CCH2COC2H5 +
NaOH—I2 Br2水 FeCl3 Na
二、化学性质
2.
醇酸的酸性:
OH | R—CH—COOH + NaOH OH | R—CH—COONa + H2O
酸性强弱: α—羟基酸 > β—羟基酸 > 羧酸
二、化学性质
3.
氧化:多发生在生物体内。
OH | R—CH—COOH O || R—C—COOH + Ag↓黑
Ag(NH3)+2 OH -
与羟胺、苯肼等生成苯腙 与HCN、NaHSO3等反应
2.互变异构
O OEt
O
H 3C C C C H2
胡勇-有机化学教学 第十一章 羧酸和取代羧酸 104页PPT文档
羧酸酸性的强弱取决于电离后所形成的羧酸根负 离子(即共轭碱)的相对稳定性 。
H C O O H C H 3 C O O H C l C H 2 C O O H C H 3 C H 2 C O O H C 6 H 5 C O O H
3 . 7 7 4 . 7 4
2 . 8 6
4 . 8 8
4 . 2 0
41
2 反应机理
这步反应 不会逆转
RCH2COOH PBr3
O
互变异构
OH BrB-r
RCH2CBr
RCH=CBr
+ OH
RC H -CBr + Br -
-HBr
O RC H -CBr RCH2COOH
Br
Br
Br
O
催化剂的作用是将羧酸转化为酰 卤,酰卤的α-H具有较高的活性而易 于转变为烯醇式,从而使卤化反应 发生。所以用10%~30%的乙酰氯或 乙酸酐同样可以起催化作用。
21
• 取代基的吸电子(-I效应)强弱次序(以饱和C-H键 的诱导效应为零。)
• 取代基的供电子(+I效应)强弱次序:
• [补充]——注意与苯环、1,3-丁二烯和烯烃的-,p-
共轭效应比较: 共轭效应是指在共轭体系中原子间的一
种相互影响,这种影响造成分子更加稳定,内能更小,键长
趋于平均化. 共轭效应常与诱导效应同时存在,共同起作
液态脂肪酸以二聚体形式存在。所以羧酸的沸点 比相对分子质量相当的烷烃高。 所有的二元酸都是结晶化合物。
10
13.3 羧酸的物理性质
• 羧酸的沸点高于质量相近的醇——双分子缔合。 • 低级羧酸溶于水,但高级羧酸不溶于水,能溶于 酒精,乙醚等有机溶剂。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
脱羧 脱羰
2、乙酰乙酸及其酯
(1)乙酰乙酸 乙酰乙酸低温稳定,室温易脱羧。
O CH 3CCH 2COOH
(2)乙酰乙酸乙酯 酮式分解
O CH 3C CH 2 COOC 2H 5
5%NaOH 40%NaOH
O CH 3CCH 3 + CO 2
O CH 3CCH 2COONa
¢ÅH ¢Æ
+
O CH 3CCH 3 + CO 2
2 、α-羟基酸的氧化
α-羟基酸中的羟基比醇中羟基易氧化。Tollen试剂与 醇不反应,但能把α-羟基酸氧化为α-羰基酸。
CH 3CHCOOH OH
O
OH CH3CCOOH OH
H2O
O CH 3CCOOH
能发生银镜反应
3 、α-羟基酸的分解反应
CH 3CHCOOH OH
稀H2SO4
CH 3CHO + HCOOH
2 CH 3COONa + CH 3CH 2OH
酸式分解
(3)乙酰乙酸乙酯的互变异构
O CH3C CH2 COOC2H5
O O CH 3C CH 2 COC 2H 5
加Na,有气体 加Br2褪色 加FeCl3呈色
O OH CH 3C=CH COC 2H 5
7.5%
O 互 CH C CH B 3 2 (吸电子基团 变 O 异 尿嘧啶 构 CH3C NH B
丙酮酸
2.氧化还原反应: 酮和羧酸都不易氧化,但酮酸易氧化脱羧。
O O H3C C COOH H3C O C OH
+
CO2
生物体内在氧化脱羧酶的催化下也能发生类似的氧化脱羧反应。
O O HOOC C CH2 CH2 COOH HOOC CH2 CH2 COOH
+
CO2
氧化脱羧酶
β-二羰基化合物 凡两个羰基中间被一个碳原子隔开的化合物均称为 β-二羰基化合物。如:
O CH2 CH2 C OH
△
H3C O O
+
H2O
OH R CH
O CH2 CH2 CH2 C OH
△
R O
+
H2O
二、酚酸 1、水杨酸:
OH O O C CH3
O
OH O
COOH
COOH
C
O
CH3
邻羟基苯甲酸
乙酰水杨酸 阿司匹林
水杨酸甲酯
2、五倍子酸和五倍子丹宁:
COOH
3,4,5-三羟基苯甲酸 没食子酸
具有羰基的性质——①可与HCN、NaHSO3作用;②可与 NH2OH、C6H5NHNH2作用;③还原可生成β-羟基酸酯。
表现出的其它性质: 可使溴水褪色——证明有不饱和键存在;
能与金属钠作用,放出H2↑ 能与CH3COCl作用生成酯
说明有醇羟基存在。
能与FeCl3水溶液作用呈现出紫红色——说明具有烯醇式结构。
HCCH 2COOH
丙醛酸(甲酰乙酸)
CH 3CCOOH
丙酮酸
CH 3CCH2COOH
3-丁酮酸(乙酰乙酸)
乙醛酸
CHO COOH
丙酮酸
NaOH
CH2OH COONa
+
COONa COONa
稀 H2SO4
O CH 3CCOOH
浓 H2SO4 或
+ Fe2 + H2O2
CH 3CHO + CO 2 CH 3COOH + CO CH 3COOH + CO 2
O C O CH C O R
△
b、β-羟基酸失水反应:分子内失水,形成α、β-不饱和羧酸。
OH R CH O CH2 C OH O
△
R
CH
CH
C
ቤተ መጻሕፍቲ ባይዱOH
c、γ、δ-羟基酸失水反应:分子内酯化反应,生成环状内酯。
1、 酸性
酸性: CH 3CHCOOH
>
CH3CHCOOH > OH
CH3CHCOOH H
Cl
3、化学性质 ⑴ 酸性:由于羟基起吸电子诱导作用,羟基酸的酸 性比相应的羧酸强。
O H3C CH C OH OH H2C OH O CH2 C OH H3C O CH2 C OH
pKa
3.86
COOH OH
4.51
COOH
4.88
COOH COOH
OH OH
pKa
2.98
4.08
4.20
4.57
⑵ 氧化反应:α-羟基酸易氧化。
4 、失水反应
α-羟基酸
R-CH-C=O H O OH HO O H O=C-CH-R
2H2O
R O CH-C O O C-CH O R
OH
β-羟基酸
RCHCH 2COOH
O RCHCH 2CH 2C OH O H
H2O
RCH=CHCOOH
CH 2 CH 2 R-CH O C O
γ-内酯
γ-羟基酸
O O O O O O
=
=
=
R C CH2 C R β -二酮
=
R C CH2 C OR' β -酮酸酯
=
RO C CH2 C OR 丙二酸二酯
=
酮式-烯醇式互变异构
HC CH + H2O
Hg++, H+
HC OH
CH2
CH3CHO
不稳定
但β-二羰基化合物的烯醇式结构却具有一定的稳定性。
实验事实:以乙酰乙酸乙酯为例
H2O
δ-羟基酸
H 2O
δ-内酯
四、 酚酸
酚酸有芳香酸和酚的典型反应性能。与FeCl3显 色;羧基和酚羟基能分别成酯、成盐等。
COOH OH
COOH OH
NaHCO 3
COONa OH
COOH O O CCH 3
O O + CH 3C O CCH 3
Asprin
COOCH 3 OH
水杨酸甲酯
OH R CH
=
CH3 C CH2 C OC2H5
酮 式 99.6 % 89.48 % 53.6 %
=
=
=
> CH3 C CH C OC2H5 CH3
=
=
=
=
=
CH3 C =CH C OC2H5
烯醇式 0.4 % 10.52 % 46.4 %
三、乙酰乙酸乙酯及在合成上的应用
(一) 乙酰乙酸乙酯的制备
1. Claisen酯缩合 含α-H的酯在强碱(如:乙醇钠)催化下缩合,生成β-酮酸 酯的反应称为Claisen酯缩合。
2. 烯醇式含量与溶剂有关,在极性溶剂(如:水或质子性溶剂) 中烯醇式含量↓,而在非极性溶剂中烯醇式含量↑。如:
O O OH O
H 2O C2 H 5 O H C6H12
这是因为在极性溶剂中,酮式或烯醇式均易与水形成分子间氢 键,从而减少了烯醇式形成分子内氢键的几率;而在非极性溶剂中 则有利于烯醇式分子内氢键的形成。
H2C
存在:多种植物的果实中;动物组织与体液中,为无色 晶体。 用途: 食品工业的调味品(有酸味),也用于制药业。
11.2 羰基酸 一、结构:含羰基的酸
1、分类、命名、性质
羰基酸分为醛酸和酮酸。酮酸根据羰基和羧基的相 对位置分为α-酮酸、β-酮酸、γ-酮酸等。 系统命名是选择含羰基和羧基的最长碳链作主链,叫 作某醛酸或某酮酸。酮酸需注明羰基的位置。亦可用酰 基取代酸来命名,醛基以“甲酰基”表示。 O O O
R CHCOOH + OH X R CHCOOH + X OH
水解
2) 氰醇水解 制α-羟基酸
R R' C O + HCN R R' C OH CN R R' C OH COOH
3)列佛尔曼斯基(Reformatsky)反应 制备β-羟基 酸的方法。
CH2COOC2H5 + Zn X R2 C CH2COOC 2H5 OZnX H2O / H Et 2O CH2COOC 2H5 ZnX R2 C CH2COOC 2H5 OH R2C=O R2 C CH2COOC 2H5 OZnX H2O / H R2 C CH2COOH OH
(1) 相同酯的自身缩合
O O O O CH3 C OC2H5
=
+
CH3 C OC2H5
=
=
=
① C2H5O Na ② CH3CO O H
CH3 C CH2 C OC2H5
反应机理:
C2H5O +
CH2 C OC2H5
CH2 C OC2H5
O
O
O OC2H5
CH2 C OC2H5 O
CH3 C
+
CH2 C OC2H5
2-羟基丙酸 乳酸
HO CH COOH HO CH COOH
2,3-二羟基丁二酸 酒石酸
HO CH COOH CH 2 COOH
2-羟基丁二酸 苹果酸
CH 2COOH HO C COOH CH 2COOH
2-羟基-1,2,3-丙烷三羧酸 柠檬酸
二、 醇酸的物理性质
HO CHCOOH CHCOOH CH 2COOH
92.5%
)
O HN O N H HO N
OH N
二、 羰基酸 1、羰基酸具有羰基和羧酸的典型反应。 2、 酮酸的特性反应 α -酮酸与稀硫酸共热时,脱羧生成醛。 β -酮酸受热易脱羧生成酮。
O CH3 C CH2 COOH COOH O O CH3 C CH COOH
O CH3 C CH3 + CO2 + CO2 O O CH3 C CH2 + CO2
