血红蛋白与肌红蛋白
简述血尿、血红蛋白尿和肌红蛋白尿的鉴别方法。

简述血尿、血红蛋白尿和肌红蛋白尿的鉴别方法。
1、血尿鉴别方法:
红色尿不一定是血尿,需仔细辨别。
如尿呈暗红色或酱油色,不混浊无沉淀,镜检无或仅有少量红细胞,见于血红蛋白尿;棕红色或葡萄酒色,不混浊,镜检无红细胞见于卟啉尿;服用某些药物如大黄、利福平,或进食某些红色蔬菜也可排红色尿,但镜检无红细胞。
2、血红蛋白尿鉴别方法:
尿中含有游离血红蛋白而无红细胞,或仅有少许红细胞而含有大量游离血红蛋白的现象。
反映了血管内有超出正常的溶血。
由于尿中血红蛋白含量不等,尿色可以呈红色、浓茶色,严重时呈酱油色。
患者因病因不同可表现为不同症状,如阵发性睡眠性血红蛋白尿患者的血红蛋白尿容易清晨第一次尿出现。
蚕豆病有进食蚕豆史或在蚕豆开花季节发生。
溶血严重时常伴贫血、黄疸,肝、脾大。
3、肌红蛋白尿
尿中有肌红蛋白、红细胞及管型。
血清中肌酶明显增高。
根据典型临床表现及实验室检查诊断不难。
急性期尽量减少肌肉活动,并尽量多饮水或大量补液以稀释尿液有肾功能衰竭者可进行透析疗法。
表现为发作性的肌肉无力、肿胀与疼痛,尿呈棕红色。
少数为遗传性,大多数为散发病例。
常见的病因为肌肉的压榨伤,电击伤,动脉栓塞或较长时间的受压引起的缺血性损害,低血钾、糖尿病酮症酸中毒、高血糖非酮症高渗昏迷、中毒、烧伤和冻伤等。
血红蛋白和肌红蛋白的结构

血红蛋白和肌红蛋白的结构嘿,同学们,今天咱们来聊聊血红蛋白和肌红蛋白的结构。
这俩名字听起来挺复杂,其实没那么难理解。
咱先说说血红蛋白哈。
血红蛋白呢,就像是身体里的小快递员。
它在咱们的血液里跑来跑去,负责把氧气送到身体的各个地方。
那它长啥样呢?血红蛋白就像一个小团子,不过这个小团子有点特别哦。
它是由四个小小的部分组成的,这四个小部分就像四个小伙伴,手拉手在一起。
每个小部分都有一个很重要的东西,叫血红素。
这个血红素呢,就像是一个小口袋,专门装氧气。
当血红蛋白在肺里的时候,氧气就会钻到这些小口袋里。
然后血红蛋白就带着氧气,顺着血液流到身体的各个地方,把氧气送给需要的细胞。
再说说肌红蛋白。
肌红蛋白呢,主要是在咱们的肌肉里。
它就像一个小仓库,专门储存氧气。
肌红蛋白长得也有点像小团子,不过比血红蛋白小一些。
它也有一个血红素,也能装氧气。
当咱们运动的时候,肌肉需要很多氧气,这时候肌红蛋白就会把储存的氧气放出来,给肌肉用。
那血红蛋白和肌红蛋白有啥不一样呢?首先呢,血红蛋白是在血液里跑的,肌红蛋白是在肌肉里待着的。
血红蛋白要把氧气送到全身各处,所以它比较忙。
肌红蛋白就只负责给肌肉提供氧气,所以它的工作比较专一。
还有哦,血红蛋白是由四个小部分组成的,肌红蛋白只有一个小部分。
为啥咱们身体里要有血红蛋白和肌红蛋白呢?这可重要啦!咱们呼吸的时候,吸进了氧气,这些氧气得送到身体的各个地方去,不然咱们的细胞就没法工作啦。
血红蛋白就负责把氧气从肺送到身体各处,肌红蛋白呢,就在肌肉里准备着,万一咱们运动的时候需要更多氧气,它就赶紧把氧气放出来。
同学们想象一下哈,如果没有血红蛋白和肌红蛋白,那会怎么样呢?咱们吸进去的氧气就没法送到该去的地方,细胞就会缺氧。
那咱们就会觉得没力气,头晕,甚至可能会生病呢。
所以啊,血红蛋白和肌红蛋白虽然小小的,但是它们的作用可大啦!咱们平时要多运动,这样可以让咱们的肌肉更健康,肌红蛋白也会更厉害哦。
还要多呼吸新鲜空气,这样血红蛋白就能装更多的氧气,把它们送到身体的各个地方。
从结构和功能上说明血红蛋白和肌红蛋白相同和不同点。

血红蛋白和肌红蛋白是两种不同的蛋白质,它们在结构和功能上存在一些相同和不同之处。
相同点:
1. 共同构成:血红蛋白和肌红蛋白都是由氨基酸组成的蛋白质。
不同点:
1. 分布位置:血红蛋白主要存在于红细胞内,负责携带氧气和部分二氧化碳,而肌红蛋白则主要存在于肌肉组织中,参与肌肉的收缩和运动。
2. 结构组成:血红蛋白是由4个亚基组成,其中包含一个铁离子,可以与氧气结合形成氧合血红蛋白。
而肌红蛋白只由一个亚基组成,无法与氧气结合。
3. 功能:血红蛋白的主要功能是在肺部与氧气结合并在全身输送氧气,同时也参与二氧化碳的运载和释放。
肌红蛋白的主要功能是在肌肉中负责储存和运输氧气,与肌肉的收缩和运动密切相关。
4. 催化作用:血红蛋白对体内的化学反应没有直接的催化作用。
而肌红蛋白具有催化剂活性,可以调节肌肉收缩的速度和力量。
总结起来,血红蛋白和肌红蛋白在结构上主要区别在于它们的亚基数量和是否含有铁离子,而在功能上主要区别在于它们的分布位置和主要的生理作用。
血红蛋白携氧负责输送氧气,肌红蛋白负责肌肉收缩和运动。
血红蛋白和肌红蛋白的氧合曲线

血红蛋白和肌红蛋白的氧合曲线一、血红蛋白与肌红蛋白简介(一)血红蛋白(Hb)1. 结构特点- 血红蛋白是由四个亚基组成的寡聚蛋白,成人主要的血红蛋白(HbA)是由两条α - 链和两条β - 链组成(α₂β₂)。
每个亚基都含有一个血红素辅基。
- 血红素是一个由卟啉环和中心铁离子(Fe²⁺)组成的小分子。
铁离子可以与氧分子可逆结合。
2. 功能- 血红蛋白主要存在于红细胞中,其功能是在肺部结合氧气,然后将氧气运输到身体的各个组织部位释放,以满足细胞呼吸的需求。
(二)肌红蛋白(Mb)1. 结构特点- 肌红蛋白是由一条多肽链和一个血红素辅基组成的单链球状蛋白。
其多肽链二级结构有8段α - 螺旋,各段之间以无规卷曲相连,最终形成球状,被称为珠蛋白,血红素辅基位于球状结构的疏水洞穴中。
2. 功能- 肌红蛋白主要存在于肌肉组织中,它的功能是储存氧气,当肌肉运动时,可及时将储存的氧气释放出来供肌肉细胞呼吸使用。
二、氧合曲线(一)肌红蛋白的氧合曲线1. 形状- 肌红蛋白的氧合曲线为双曲线。
2. 曲线含义- 肌红蛋白与氧气的结合具有简单的化学平衡关系。
根据公式Mb + O_2⇌MbO_2,其结合常数K=([MbO_2])/([Mb][O_2])。
- 在低氧分压下,肌红蛋白就能与氧气结合,随着氧分压的升高,肌红蛋白与氧气的结合逐渐趋于饱和。
例如,在肌肉组织中,当氧分压较低时,肌红蛋白可以迅速与氧气结合,储存氧气,为肌肉细胞的有氧代谢提供储备。
(二)血红蛋白的氧合曲线1. 形状- 血红蛋白的氧合曲线为S形( sigmoidal形)。
2. 曲线含义- 这种S形曲线反映了血红蛋白亚基之间的协同效应。
- 当第一个亚基与氧气结合后,会引起其他亚基的构象发生变化,使得它们更容易与氧气结合;反之,当一个亚基释放氧气后,也会促进其他亚基释放氧气。
- 在肺部(氧分压较高,约100 mmHg),血红蛋白容易与氧气结合,达到较高的氧饱和度,将氧气装载。
肌红蛋白与血红蛋白

蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
血红蛋白结合氧的协同作用示意图
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
Hb的氧结合曲线
• 血红蛋白是目前了解最清楚的别构蛋白质, 血红蛋白的氧合具有正协同效应,即一个 O2的结合会增加同一分子中其余空的氧结 合部位对O2的亲和力。Hb的氧合曲线呈S 形而非双曲线形。每个血红蛋白分子有4个 血红素,因此最多只能结合4分子氧,现假 定O2与Hb的结合是“全或无”的现象。
氧结合引起的血红蛋白构象变化
• 血红素铁 0.039nm 的微小位 移导致血 红蛋白构 象的改变。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合血红蛋白和去氧血红蛋白代表不同的构象 态。(T态和R态)
脱氧血红蛋白(紧张态)
氧合血红蛋白(松驰态)
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合导致稳定T态的离子键和盐桥的断裂,血 红蛋白的氧结合过程是一协同过程。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 血红蛋白4个血红素基分别位于每个多肽 链的E和F螺旋之间的裂隙处,并暴露在 分子的表面。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
氧结合引起的血红蛋白构象变化
• 氧合作用显著改变血红蛋白的四级结构。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
肌红蛋白的结构
3、氧与肌红蛋白的结合 —Fe2+与珠蛋白的93位
(F8)His的咪唑基N相 连; —当形成氧合肌红蛋白 (oxy-myoglobin)时, 第6个配位键与氧结合; —当成高铁肌红蛋白时,第 6配位键被H2O分子占据; —在氧结合一侧有一E7 His氧结合部位形成空间 位阻区
肌红蛋白和血红蛋白的氧解离曲线

肌红蛋白和血红蛋白的氧解离曲线1.引言肌红蛋白和血红蛋白是人体内两种重要的蛋白质,它们在运输氧气和维持氧气平衡方面起着至关重要的作用。
而肌红蛋白和血红蛋白的氧解离曲线则是研究这两种蛋白在氧气运输中的关键指标。
在本文中,我们将深入探讨肌红蛋白和血红蛋白的氧解离曲线,探讨其在人体生理活动和运动中的重要性。
2.肌红蛋白的氧解离曲线肌红蛋白是一种存在于肌肉中的蛋白质,其主要功能是与氧气结合,从而在肌肉组织中转运氧气。
肌红蛋白的氧解离曲线是描述其与氧气结合与解离的关系曲线。
通常情况下,肌红蛋白的氧解离曲线呈S形,这意味着在低氧气压下,肌红蛋白能够更有效地结合氧气,而在高氧气压下,它能够更容易地释放氧气,从而确保肌肉组织能够在不同氧气供应情况下保持正常功能。
3.血红蛋白的氧解离曲线与肌红蛋白类似,血红蛋白也具有氧解离曲线。
血红蛋白是存在于红细胞中的蛋白质,主要负责将氧气从肺部输送到身体各个组织中。
血红蛋白的氧解离曲线同样呈S形,但相比肌红蛋白,血红蛋白在低氧气压下能够更有效地释放氧气,而在高氧气压下能够更容易地结合氧气,从而保证足够的氧气供应到组织中。
4.肌红蛋白和血红蛋白在运动中的作用运动时,身体需要更多的氧气来供应肌肉组织,以维持肌肉的正常运动。
肌红蛋白和血红蛋白的氧解离曲线在这一过程中发挥着关键的作用。
当运动强度较小时,肌红蛋白能够更有效地将氧气输送到肌肉组织中,从而满足肌肉对氧气的需求;而当运动强度增加时,血红蛋白能够更快速地释放氧气,确保身体各个部位都能够得到充足的氧气供应。
5.个人观点在我看来,肌红蛋白和血红蛋白的氧解离曲线是人体自身对氧气运输和利用情况的智慧体现。
通过这两种蛋白的不同氧解离曲线,人体能够根据不同情况下对氧气的需求进行精确调节,从而保证身体能够在不同情况下保持正常的生理功能。
这一机制的存在为我们深入理解人体生理活动和运动提供了重要线索。
6.总结通过对肌红蛋白和血红蛋白的氧解离曲线的探讨,我们深入了解了这两种蛋白在氧气运输中的重要作用。
高等无机化学---血红蛋白和肌红蛋白
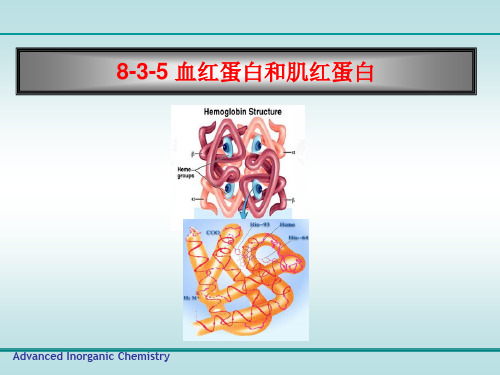
血红蛋白
Hb的结构
Advanced Inorganic Chemistry
Hb and Mb含有不同的序列
Advanced Inorganic Chemistry
不同动物Hb分子的肽链组成
不同;成人Hb的多肽链主要
是两条α链和两条β链构成的
以A-H命名。螺旋区之间有5个非螺旋段,还有2个
非螺旋区。血红素位于Mb分子的一条沟缝中,放在一个非极性 的龛中,它可以保护 Fe 2 不致氧化为 Fe 3 。
Advanced Inorganic Chemistry
Mb使用血红素结合 O2
铁原卟啉IX: 血红素是平面结构。 铁原子在中心,连接着4个N。
是皮肤白皙的人。另外一些生物,如蛇类和蟹类,
用铜来运输氧气,所以他们有真正的蓝血。
Advanced Inorganic Chemistry
一、结构
1. 血红蛋白(Hemoglobin,Hb)是使血液呈
红色的蛋白,它由四条链组成(蛋白质亚
基),两条α链(相同)和两条β链,每一条链
包含一个血红素。每一条蛋白链和肌红蛋白的 结构相似。
是变构蛋白,所以O2和Mb结合并不协作进行。 但是,在同样的氧分压下,Mb结合的氧量是Hb结合的氧
量的6倍。
Advanced Inorganic Chemistry
Thank yistry
氧气结合在铁原子上,Hb起氧的载体。
Advanced Inorganic Chemistry
2、肌红蛋白(Myoglobin,Mb) 是由一条多肽链 (珠蛋白,globin)和一个血红素(铁原卟啉)
组成。分子量17,800。
肌红蛋白和血红蛋白的异同

肌红蛋白和血红蛋白的异同肌红蛋白和血红蛋白是两种具有重要生物学功能的蛋白质。
它们在生物体内具有不同的作用和结构,但也存在一些相似之处。
本文将详细介绍肌红蛋白和血红蛋白的异同。
肌红蛋白和血红蛋白是两种在动物体内广泛存在的蛋白质。
它们都属于血红蛋白超家族,能够结合氧气并参与氧气的运输。
然而,肌红蛋白主要在肌肉中发挥作用,而血红蛋白则主要存在于红细胞中。
首先,肌红蛋白的结构和功能是与肌肉收缩密切相关的。
肌肉收缩需要大量的能量供应和氧气运输,肌红蛋白正是在这个过程中发挥重要作用的,它能够存储和释放氧气。
肌红蛋白的结构由一个含有一个铁离子的血红素分子(HEM)和一个细胞色素b(尤其是细胞色素b5)分子组成。
这种结构使得肌红蛋白能够与氧气发生紧密的结合,并在需要时迅速释放氧气供肌肉使用。
肌红蛋白在肌肉组织中的含量与肌肉的供氧能力密切相关,能够提供更高效的氧气供应,从而增强肌肉的工作能力。
相比之下,血红蛋白是一种在红细胞中广泛存在的蛋白质,主要负责运输氧气。
血红蛋白由四个亚单位组成,每个亚单位都包含一个铁离子的血红素基团。
它与氧气的结合和释放是可逆的,可以根据周围环境中氧气的浓度进行调节。
当血红蛋白与氧气结合形成氧合血红蛋白时,血液呈现鲜红色;而当血红蛋白与氧气分离形成脱氧血红蛋白时,血液呈现深红色。
此外,血红蛋白和肌红蛋白在结构上也存在一些差异。
血红蛋白的四个亚单位之间通过非共价键相互连接,形成一个类似于球形的结构。
而肌红蛋白的亚单位之间没有直接的键连接,而是通过其他蛋白质与细胞色素b5连接在一起。
虽然肌红蛋白和血红蛋白在结构和功能上存在差异,但它们也有一些共同点。
首先,它们都包含有血红素分子,具有与氧气结合的能力。
其次,它们都参与氧气在生物体内的运输和供应,在维持生命过程中发挥着重要作用。
总结起来,肌红蛋白和血红蛋白是两种具有重要生物学功能的蛋白质。
它们在结构和功能上存在一定的差异,肌红蛋白主要参与肌肉的收缩和氧气供应,而血红蛋白则主要负责氧气的运输。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(二)镰刀状细胞贫血病
在1904年,芝加哥的james Herrick发现在一个患有贫血 病的病人的正常细胞之中存在 着许多异常的镰刀形细胞(右 图),Herrick将这种血液病 称之镰刀形细胞贫血病。
• ◇ 1.镰刀状细胞贫血病是血红蛋白分子突变引起的 • ◇ 2.镰刀状细胞血红蛋白的氨基酸序列的细微变化 • ◇ 3.镰刀状细胞血红蛋白可形成纤维状沉淀 • ◇ 4.镰刀状细胞血红蛋白的治疗性矫正
4.突变发生在亚基界面上
• 四级结构中亚基的相互作用是血红蛋白氧合的别构调节所 必需的。例如HbKempsey(a2β225Asp-Asn ),β链的Asp99(G1) 突变为天冬酰胺。在正常的血红蛋白中Aspβ99与a链的Tyr a42(C7)形成氢键,稳定T态构象(图6一23)。但换成Asn 则不能与Tyr a42形成氢键以建立T态。因此,Hb Kempsey 对02的亲和力特别高,以致在组织中不能释放02 。Hb Kansas a2β2 102Asn-Thr 的情况恰好相反,Asnβ102(G4)为 苏氨酸所取代,不能再与a链的Asp a94(G1)形成氢键以建 立R态。结果是对02的亲和力异常低。
第4节 蛋白质结构与功能的关系
• ◆ 一、肌红蛋白的结构与功功能 • ◆ 二、血红蛋白的结构与功能 • ◆ 三、血红蛋白与分子病 • ◆ 四、免疫系统和免疫球蛋白 • ◆ 五、肌球蛋白丝、肌动蛋白丝与肌肉收缩 • ◆ 六、蛋白质的结构与功能的进化
一、肌红蛋白的结构与功能
• ◇ (一)肌红蛋白的三级结构 • ◇ (二)辅基血红素 • ◇ (三) 02与肌红蛋白的结合 • ◇ (四) 02的结合改变肌红蛋白的构象 • ◇ (五)肌红蛋白结合氧的定量分析
• 疏水环境的意义
• 通常O2与Fe(Ⅱ)接触会使Fe(Ⅱ)氧化为Fe(Ⅲ),血红素也 是一样。但在肌红蛋白内部,由于疏水的环境, Fe(Ⅱ) 不易被氧化。
• 微环境的作用:固定血红素基;保护血红素铁免遭氧化; 为O2提供一个合适的结合部位.
(四) 02的结合改变肌红蛋白的构象
• 去氧血红蛋白中的Fe(Ⅱ)只有 5个配体,并位于卟啉环上方 0.055nm。当氧结合时, Fe(Ⅱ)被拉回到卟啉环平面, 离卟啉环平面仅为0.026 nm。 这种结构的改变对肌红蛋白意 义不大,但显著的改变了血红 蛋白的性质,改变了四聚体的 亚基间的作用,是之具有别构 作用。
• O2 和四吡咯环呈60度倾斜。 • 高铁肌红蛋白中水代替O2填
充该部位。
• 氧结合是一个空间位阻区域
• E7 His(远侧)的咪唑环与 Fe原子的距离远,不发生作 用,但与分子O2 能紧密接触, 被结合的O2在His(近侧)的 咪唑N和Fe原子之间。
• 空间位阻的意义
• 游离在溶液中的铁卟啉结合CO的能力比O2大25000倍,但 在肌红蛋白中,仅比O2大250倍。原因是由于空间位阻造 成的。这样可以防止代谢过程中产生的CO占据O2的结合部 位。
2.镰刀状细胞血红蛋白的氨基酸序 列的细微变化
• 大约花费了四十多年的时间才确定镰刀形细胞贫血病 是血红蛋白内氨基酸替换的结果。序列分析发现,贫血病 人血红蛋白(Hb S)分子中的β链的第六个氨基酸残基是 一个非极性的缬氨酸,而正常的Hb A分子中的β链的第六 个氨基酸残基是谷氨酸,这一替换是由编码β链的基因中 的单个核苷酸取代引起的。
(三)血红蛋白的协同性氧结合 (Hb氧结合曲线)
(四)H+、CO2和BPG对血红蛋白结合 氧的影响
• 1.H+、和CO2促进氧的释放(Bohr效应)
2.BPG降低Hb 对氧的亲和力
1.H+、和CO2促进氧的释放(Bohr效应)
• Bohr效应 • Bohr效应的意义
2.BPG降低Hb 对氧的亲和力
• 肌红蛋白的内部几乎都是由疏水氨基酸残基组成 的,特别是一些疏水性强的氨基酸,如缬氨酸、 亮氨酸、异亮氨酸、苯丙氨酸和蛋氨酸。而表面 既含有亲水的氨基酸残基,也含有疏水的氨基酸 残基,通常水分子被排除在球蛋白内部,大多数 可离子化的残基都位于表面。血红素辅基处于一 个由蛋白部分形成的疏水的、象个笼子似的裂隙 内,血红素中的铁原子是氧结合部位。无氧的肌 红蛋白称之脱氧肌红蛋白,而载氧的分子称之氧 合肌红蛋白,可逆结合氧的过程称之氧合作用。
3.镰刀状细胞血红蛋白可形成 纤维状沉淀
• 在β1亚基的第85和88氨基酸为Phe和Lue,形成一 个疏水的口袋,而β2上的Val形成一个凸起,他 们相互缔合使血红蛋白分子结合在一起,溶解度 降低。
4.镰刀状细胞血红蛋白的治疗性矫正
• 在体外用氰酸钾处理镰刀状贫血病患者的红细胞,可以防止它在去 氧状态下形成镰刀状。这种细胞生存时间比处理前要长,输氧能力也 有好转。Hb S分子的一个氨基用KCNO修饰后就能抑制红细胞成镰刀状, 这一反应同CO2,与Hb A结合类似,C02也能结合到N端NH2上,只是反应 可逆,而KCNO的修饰是不可逆的。
1.镰刀状细胞贫血病是血红蛋白 分子突变引起的
• 它是由于遗传基因突变导致血红蛋白分子中氨基酸残基被更换所造成的。
• 镰刀状细胞贫血病是一种致死性疾病,它的纯合子患者(50%红细胞镰刀 状化)有的在童年就死去。杂合子患者(1%红细胞镰刀状化)的寿命虽也 不长,但它能抵抗一种流行于非洲的疟疾(malaria ),它也是一种致死性 疾病。甚至对于携带正常血红蛋白基因的纯合子个体死于这种疟疾的概率 也很高、常常来不及繁殖后代就已死去,而杂合子患者对疟疾有一定的抗 性,尚能繁衍下一代,这是因为杂合子患者加速被感染红细胞的破坏而中 断疟原虫的生活周期的缘故。自然选择的结果是出现一个等位基因的群体, 它使纯合状态的有害作用和杂合状态的抗疟疾作用处于平衡中。这是平衡 多形现象的一个明显实例。
• ◇ 1.血红蛋白的亚基组成
• ◇ 2.血红蛋白的三维结构
1.血红蛋白的亚基组成
• 血红蛋白有两种4个亚基组成 • 人在不同发育阶段血红蛋白亚基的种类是不相同。
2.血红蛋白的三维结构
•
图6-8 血红蛋白中亚基的排列
•
A 正面观
B 侧面观
• 图6-9 血红蛋白α链和β链和肌红蛋白构象的相似性
(二)氧结合引起的血红蛋白构象 的变化
二、血红蛋白的结构与功能
• ◇(一)血红蛋白的结构 • ◇ (二)氧结合引起的血红蛋白构象的变化 • ◇ (三)血红蛋白的协同性氧结合(Hb氧结合
曲线) • ◇ (四)H+、CO2和BPG对血红蛋白结合氧的影
响
(一)血红蛋白的结构
血红蛋白的主要功能是在血液中结合并转运氧。它存在于红 细胞中,每个成熟红细胞约含3亿个血红蛋白分子。血红蛋白 从肺部经心脏到达外围组织的动脉血中有96%氧饱和度。在静 脉血中的饱和度为64%。因此,每100ml的血经过组织约释放 1/3的氧或相当于大气压和体温下6.5ml氧气.
抹香鲸肌红蛋白(Myoglobin)的三级结构
(二)辅基血红素
• 血红素中的Fe可以 是亚铁,也可以是 高铁,相应的血红 素称为亚铁血红素 和高铁血红素;相 应的蛋白称为亚铁 和高铁血红蛋白。 只有亚铁态的蛋白 质才能结合氧。
血红素
(三) 02与肌红蛋白的结合
• 卟啉铁和F8(93)His(近侧) 的咪唑N结合。底6和配位键 和O2 结合。
2.突变发生在血红素辅基附近
• 这种突变影响血红素与氧的结合,或影响亚基与血红素的 结合,因而失去氧合能力)。
• 例如造成先天性青紫的几种血红蛋白M就是属于这一类。 它们大多数是由于其他氨基酸取代了血红素附近的重要残 基如近侧组氨酸(F8)或远侧组氨酸(E7)等而形成。例如 lHb M是His a58(F8)突变为酪氨酸的结果,由于Tyr残基 的酚基与Fe结合稳定Fe3十离子,因而血红蛋白的异常的a 链失去氧合能力。
滑动接触 α1β2和相同的α2β1接触。 涉及螺旋C、G、H和非螺旋段FG拐弯的 19个残基,当血红蛋白因氧合作用而 发生构象变化时,这些接触也发生改 变。
血红蛋白半分子(αβ二聚体的侧面观)
• 作为动态构象分子,血红蛋白可以看作是αβ-二聚体的二 聚体,也可以看作是相同的二聚体半分子组成:α1β1-亚 基和α2β2-亚基对。每个αβ-二聚体作为钢体移动。当血 红素基氧合时,分子的两个二聚体半分子彼此滑动。如果一 个αβ-二聚体固定不动,则另一个αβ-二聚体将绕一个设 想的αβ-二聚体的偏心枢轴旋转约15°并平移0.08nm。
(五)肌红蛋白结合氧的定量分析
1.氧分数饱和度(Y),携氧肌红 蛋白分子数和去氧肌红蛋白以及携 氧肌红蛋白分子数的比值。当Y 为 1时,所有的肌红蛋白被氧饱和。 2.P50 肌红蛋白被半数饱和时的 氧分压。
3.线粒体中的氧浓度为0-10torr,静脉血中为15torr,或更高一些。肌红蛋 白P50 为2torr,因此大多数情况下,肌红蛋白是高度氧合的。如果由于肌肉 收缩而使线粒体中氧含量下降,它可以立即供氧。 4.肌红蛋白有利于氧从细胞内表面向线粒体转运。细胞内表面10torr(Y为 80%),线粒体1torr (Y为25%)。
图6-19 BPG对Hb氧合曲线的影响
• 图6-18 BPG分子接及其与Hb 的两个β-链的离子结合
三、血红蛋白与分子病
• ◇ (一)分子病是遗传的 • ◇ (二)镰刀状细胞贫血病 • ◇ (三)其他血红蛋白病 • ◇ (四)地中海贫血
(一)分子病是遗传的
• 血红蛋白的异常由基因突变引起,并通过遗传在群体中散 布。这是血红蛋白进化的基础。但是许多突变是有害的, 将产生遗传病(genetic disease)。在自然选择的条件 下这些有害的突变最终将会消失。其他许多是无害的,经 常被称为“中性”突变(neutral mutation),其中一些 突变可能具有今天尚未被认识的优点,有朝一日将在群体 中占优势。至今已知存在人类群体中的血红蛋白遗传变体 ( variant)有300多种。
