蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
生物化学(第三版)第六章 蛋白质结构与功能的关系课后习题详细解答_ 复习重点

第六章蛋白质结构与功能的关系提要肌红蛋白(Mb)和血红蛋白(Hb)是脊椎动物中的载氧蛋白质。
肌红蛋白便于氧在肌肉中转运,并作为氧的可逆性贮库。
而血红蛋白是血液中的氧载体。
这些蛋白质含有一个结合得很紧的血红素辅基。
它是一个取代的卟啉,在其中央有一个铁原子。
亚铁(Fe2+)态的血红素能结合氧,但高铁(+3)态的不能结合氧。
红血素中的铁原子还能结合其他小分子如CO、NO等。
肌红蛋白是一个单一的多肽链,含153个残基,外形紧凑。
Mb内部几乎都是非极性残基。
多肽链中约75%是α螺旋,共分八个螺旋段。
一个亚铁血红素即位于疏水的空穴内,它可以保护铁不被氧化成高铁。
血红素铁离子直接与一个His侧链的氮原子结合。
此近侧His(H8)占据5个配位位置。
第6个配位位置是O2的结合部位。
在此附近的远侧His(E7)降低在氧结合部位上CO的结合,并抑制血红素氧化或高铁态。
氧与Mb结合是可逆的。
对单体蛋白质如Mb来说,被配体(如)O2占据的结合部位的分数是配体浓度的双曲线函数,如Mb的氧集合曲线。
血红蛋白由4个亚基(多肽链)组成,每个亚基都有一个血红素基。
Hb A是成人中主要的血红蛋白,具有α2β2的亚基结构。
四聚体血红蛋白中出现了单体血红蛋白所不具有的新性质,Hb除运载氧外还能转运H+和CO2。
血红蛋白以两种可以相互转化的构象态存在,称T(紧张)和R(松弛)态。
T态是通过几个盐桥稳定的。
无氧结合时达到最稳定。
氧的结合促进T态转变为R态。
氧与血红蛋白的结合是别构结合行为的一个典型例证。
T态和R态之间的构象变化是由亚基-亚基相互作用所介导的,它导致血红蛋白出现别构现象。
Hb呈现3种别构效应。
第一,血红蛋白的氧结合曲线是S形的,这以为着氧的结合是协同性的。
氧与一个血红素结合有助于氧与同一分子中的其他血红素结合。
第二,H+和CO2促进O2从血红蛋白中释放,这是生理上的一个重要效应,它提高O2在代谢活跃的组织如肌肉的释放。
相反的,O2促进H+和CO2在肺泡毛细血管中的释放。
血红蛋白和肌红蛋白的氧合曲线

血红蛋白和肌红蛋白的氧合曲线一、血红蛋白与肌红蛋白简介(一)血红蛋白(Hb)1. 结构特点- 血红蛋白是由四个亚基组成的寡聚蛋白,成人主要的血红蛋白(HbA)是由两条α - 链和两条β - 链组成(α₂β₂)。
每个亚基都含有一个血红素辅基。
- 血红素是一个由卟啉环和中心铁离子(Fe²⁺)组成的小分子。
铁离子可以与氧分子可逆结合。
2. 功能- 血红蛋白主要存在于红细胞中,其功能是在肺部结合氧气,然后将氧气运输到身体的各个组织部位释放,以满足细胞呼吸的需求。
(二)肌红蛋白(Mb)1. 结构特点- 肌红蛋白是由一条多肽链和一个血红素辅基组成的单链球状蛋白。
其多肽链二级结构有8段α - 螺旋,各段之间以无规卷曲相连,最终形成球状,被称为珠蛋白,血红素辅基位于球状结构的疏水洞穴中。
2. 功能- 肌红蛋白主要存在于肌肉组织中,它的功能是储存氧气,当肌肉运动时,可及时将储存的氧气释放出来供肌肉细胞呼吸使用。
二、氧合曲线(一)肌红蛋白的氧合曲线1. 形状- 肌红蛋白的氧合曲线为双曲线。
2. 曲线含义- 肌红蛋白与氧气的结合具有简单的化学平衡关系。
根据公式Mb + O_2⇌MbO_2,其结合常数K=([MbO_2])/([Mb][O_2])。
- 在低氧分压下,肌红蛋白就能与氧气结合,随着氧分压的升高,肌红蛋白与氧气的结合逐渐趋于饱和。
例如,在肌肉组织中,当氧分压较低时,肌红蛋白可以迅速与氧气结合,储存氧气,为肌肉细胞的有氧代谢提供储备。
(二)血红蛋白的氧合曲线1. 形状- 血红蛋白的氧合曲线为S形( sigmoidal形)。
2. 曲线含义- 这种S形曲线反映了血红蛋白亚基之间的协同效应。
- 当第一个亚基与氧气结合后,会引起其他亚基的构象发生变化,使得它们更容易与氧气结合;反之,当一个亚基释放氧气后,也会促进其他亚基释放氧气。
- 在肺部(氧分压较高,约100 mmHg),血红蛋白容易与氧气结合,达到较高的氧饱和度,将氧气装载。
肌红蛋白和血红蛋白的氧合作用机理

肌红蛋白和血红蛋白是人体内两种重要的血红素蛋白,它们分别在肌肉组织和血液中发挥着至关重要的作用。
肌红蛋白主要存在于横纹肌中,而血红蛋白则主要存在于红细胞中。
两者都具有氧运输和释放功能,然而其氧合作用机理却有着一定的不同。
我们来探讨肌红蛋白的氧合作用机理。
肌红蛋白在肌肉组织中起着储存和释放氧气的作用。
当我们进行高强度运动时,肌肉组织需要大量氧气来支持能量代谢,这时肌红蛋白就发挥作用了。
肌红蛋白的分子结构中含有一个铁离子,它与氧气结合形成氧合物,从而实现氧气的储存。
在肌纤维中,肌红蛋白还能与血红蛋白交换氧气,使得氧气能够更加高效地输送到肌肉组织中。
而血红蛋白的氧合作用机理与肌红蛋白有着一定的相似之处,但也存在着显著的差异。
血红蛋白主要存在于红细胞中,它通过血液循环将氧气从肺部输送到全身各个组织和器官中。
血红蛋白分子结构中同样含有一个铁离子,这使得它能够与氧气形成氧合物。
在肺部,血红蛋白会与肺泡中的氧气结合,形成氧合血红蛋白。
在组织和器官中,氧合的血红蛋白会释放出氧气,从而满足细胞呼吸和能量代谢的需要。
肌红蛋白和血红蛋白通过与氧气的结合和释放,完成了氧气的运输和供应。
但就其氧合作用机理而言,肌红蛋白主要用于氧气的储存和释放,而血红蛋白则主要用于氧气的输送和供应。
这种不同的功能定位使得两者在机体内协同作用,保障了氧气的顺利运输和有效利用。
对于我个人而言,对肌红蛋白和血红蛋白的氧合作用机理有了更深入的理解后,对于身体内氧气运输和代谢的过程也有了更清晰的认识。
而这种认识也为我更好地调节锻炼和生活方式提供了有益的指导。
在本篇文章中,我们深入探讨了肌红蛋白和血红蛋白的氧合作用机理,并对两者的功能定位进行了比较和分析。
通过这样的全面评估,相信读者已经对这一主题有了更深入的了解。
希望本文所传达的知识能够帮助读者更好地管理自己的运动和健康。
肌红蛋白和血红蛋白作为人体内两种重要的血红素蛋白,在氧合作用机理中发挥着关键的作用。
肌红蛋白与血红蛋白

蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
血红蛋白结合氧的协同作用示意图
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
Hb的氧结合曲线
• 血红蛋白是目前了解最清楚的别构蛋白质, 血红蛋白的氧合具有正协同效应,即一个 O2的结合会增加同一分子中其余空的氧结 合部位对O2的亲和力。Hb的氧合曲线呈S 形而非双曲线形。每个血红蛋白分子有4个 血红素,因此最多只能结合4分子氧,现假 定O2与Hb的结合是“全或无”的现象。
氧结合引起的血红蛋白构象变化
• 血红素铁 0.039nm 的微小位 移导致血 红蛋白构 象的改变。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合血红蛋白和去氧血红蛋白代表不同的构象 态。(T态和R态)
脱氧血红蛋白(紧张态)
氧合血红蛋白(松驰态)
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合导致稳定T态的离子键和盐桥的断裂,血 红蛋白的氧结合过程是一协同过程。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 血红蛋白4个血红素基分别位于每个多肽 链的E和F螺旋之间的裂隙处,并暴露在 分子的表面。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
氧结合引起的血红蛋白构象变化
• 氧合作用显著改变血红蛋白的四级结构。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
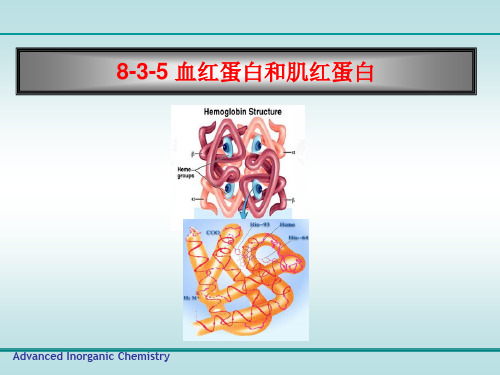
肌红蛋白的结构
3、氧与肌红蛋白的结合 —Fe2+与珠蛋白的93位
(F8)His的咪唑基N相 连; —当形成氧合肌红蛋白 (oxy-myoglobin)时, 第6个配位键与氧结合; —当成高铁肌红蛋白时,第 6配位键被H2O分子占据; —在氧结合一侧有一E7 His氧结合部位形成空间 位阻区
高等无机化学---血红蛋白和肌红蛋白
血红蛋白
Hb的结构
Advanced Inorganic Chemistry
Hb and Mb含有不同的序列
Advanced Inorganic Chemistry
不同动物Hb分子的肽链组成
不同;成人Hb的多肽链主要
是两条α链和两条β链构成的
以A-H命名。螺旋区之间有5个非螺旋段,还有2个
非螺旋区。血红素位于Mb分子的一条沟缝中,放在一个非极性 的龛中,它可以保护 Fe 2 不致氧化为 Fe 3 。
Advanced Inorganic Chemistry
Mb使用血红素结合 O2
铁原卟啉IX: 血红素是平面结构。 铁原子在中心,连接着4个N。
是皮肤白皙的人。另外一些生物,如蛇类和蟹类,
用铜来运输氧气,所以他们有真正的蓝血。
Advanced Inorganic Chemistry
一、结构
1. 血红蛋白(Hemoglobin,Hb)是使血液呈
红色的蛋白,它由四条链组成(蛋白质亚
基),两条α链(相同)和两条β链,每一条链
包含一个血红素。每一条蛋白链和肌红蛋白的 结构相似。
是变构蛋白,所以O2和Mb结合并不协作进行。 但是,在同样的氧分压下,Mb结合的氧量是Hb结合的氧
量的6倍。
Advanced Inorganic Chemistry
Thank yistry
氧气结合在铁原子上,Hb起氧的载体。
Advanced Inorganic Chemistry
2、肌红蛋白(Myoglobin,Mb) 是由一条多肽链 (珠蛋白,globin)和一个血红素(铁原卟啉)
组成。分子量17,800。
蛋白质的定义

H
N
C S + H2N
C
在弱碱中
COOH
PITC
R
H HO
N
CO
H+
SC
H C
N
R
H
O NC
H
SC
C
N
R
H
PTC-氨基酸
PTH-氨基酸
氨基酸的光谱性质:组成蛋白质的氨基酸中,Trp、Tyr 和 Phe 对紫外光有一定的吸收,这 是因为它们分子中含有苯环,是苯环的共轭双键造成的,这三个氨基酸的光吸收都在 280nm 附近
蛋白质的一级结构是指蛋白质多肽链中氨基酸的排列顺序(sequence),一级结构的主要连 接键是肽键。 共价结构:包括蛋白质的肽链数目、端基组成、氨基酸序列和二硫键的位置。 一级结构是蛋白质空间构象和特异生物学功能的基础。 一级结构的测定主要用小片段重叠的原理,测序步骤: 一,多肽链的拆分:由多条多肽链组成的蛋白质分子,必须先进行拆分。如:血红蛋白(四 聚体)可用 8mol/L 尿素或 6mol/L 盐酸胍处理,即可分开多肽链(亚基)。 二,测定蛋白质分子中多肽链的数目:通过测定末端氨基酸残基的摩尔数与蛋白质分子量 之间的关系,即可确定多肽链的数目 三,二硫键的断裂 :用过甲酸氧化法或巯基还原法拆分多肽链间的二硫键用过甲酸氧化法 或巯基还原法拆分多肽链间的二硫键 四,测定每条多肽链的氨基酸组成,并计算出氨基酸成分的分子比 五,分析多肽链的 N-末端和 C-末端 N 端分析方法 1.二硝基氟苯(DNFB)法 2.丹磺酰氯法:在碱性条件下,丹磺酰氯(二甲氨基萘磺酰氯)可以与 N-端氨基酸的游离氨 基作用,得到丹磺酰-氨基酸。此法的优点是丹磺酰-氨基酸有很强的荧光性质,检测灵敏度 可以达到 110-9mol。 3 苯异硫氰酸(酯)法(PITC 法、PTC 法、PTH 法、Edman 降解法 ) 4.氨肽酶(aminopeptidase, Apase)法 C 端分析 1.硼氢化锂还原法 2.肼解法:也称联氨法;
肌红蛋白和血红蛋白的异同

肌红蛋白和血红蛋白的异同肌红蛋白和血红蛋白是两种具有重要生物学功能的蛋白质。
它们在生物体内具有不同的作用和结构,但也存在一些相似之处。
本文将详细介绍肌红蛋白和血红蛋白的异同。
肌红蛋白和血红蛋白是两种在动物体内广泛存在的蛋白质。
它们都属于血红蛋白超家族,能够结合氧气并参与氧气的运输。
然而,肌红蛋白主要在肌肉中发挥作用,而血红蛋白则主要存在于红细胞中。
首先,肌红蛋白的结构和功能是与肌肉收缩密切相关的。
肌肉收缩需要大量的能量供应和氧气运输,肌红蛋白正是在这个过程中发挥重要作用的,它能够存储和释放氧气。
肌红蛋白的结构由一个含有一个铁离子的血红素分子(HEM)和一个细胞色素b(尤其是细胞色素b5)分子组成。
这种结构使得肌红蛋白能够与氧气发生紧密的结合,并在需要时迅速释放氧气供肌肉使用。
肌红蛋白在肌肉组织中的含量与肌肉的供氧能力密切相关,能够提供更高效的氧气供应,从而增强肌肉的工作能力。
相比之下,血红蛋白是一种在红细胞中广泛存在的蛋白质,主要负责运输氧气。
血红蛋白由四个亚单位组成,每个亚单位都包含一个铁离子的血红素基团。
它与氧气的结合和释放是可逆的,可以根据周围环境中氧气的浓度进行调节。
当血红蛋白与氧气结合形成氧合血红蛋白时,血液呈现鲜红色;而当血红蛋白与氧气分离形成脱氧血红蛋白时,血液呈现深红色。
此外,血红蛋白和肌红蛋白在结构上也存在一些差异。
血红蛋白的四个亚单位之间通过非共价键相互连接,形成一个类似于球形的结构。
而肌红蛋白的亚单位之间没有直接的键连接,而是通过其他蛋白质与细胞色素b5连接在一起。
虽然肌红蛋白和血红蛋白在结构和功能上存在差异,但它们也有一些共同点。
首先,它们都包含有血红素分子,具有与氧气结合的能力。
其次,它们都参与氧气在生物体内的运输和供应,在维持生命过程中发挥着重要作用。
总结起来,肌红蛋白和血红蛋白是两种具有重要生物学功能的蛋白质。
它们在结构和功能上存在一定的差异,肌红蛋白主要参与肌肉的收缩和氧气供应,而血红蛋白则主要负责氧气的运输。
以肌红蛋白和血红蛋白为例,论述蛋白质结构和功能的关系

以肌红蛋白和血红蛋白为例,论述蛋白质结构和功能的关系蛋白质是生物体内最重要的功能性分子之一,其结构和功能之间存在着密切的关系。
以肌红蛋白和血红蛋白为例,我们可以深入探讨这种关系。
1. 肌红蛋白(Myoglobin):-结构:肌红蛋白是一个含有单一多肽链的球状蛋白质,这个多肽链折叠成一个特定的三维结构。
该蛋白质的一个显著特点是它包含一个血红素基团,这是一个铁离子中心,能够结合氧分子。
-功能:肌红蛋白的主要功能是在肌肉细胞中储存和运输氧气。
当肌肉细胞需要更多的氧气时,肌红蛋白可以迅速释放所储存的氧气以满足需求。
2. 血红蛋白(Hemoglobin):-结构:血红蛋白是一个四聚体蛋白质,由两个α-亚基和两个β-亚基组成。
每个亚基都包含一个血红素基团,总共有四个,这使得血红蛋白能够结合四个氧分子。
-功能:血红蛋白的主要功能是在血液中运输氧气从肺部到身体的各个部位。
此外,它还参与二氧化碳的运输。
结构和功能的关联:-血红素基团:肌红蛋白和血红蛋白都具有血红素基团,这是它们能够结合氧的关键结构特征。
血红素基团的存在使得这两种蛋白质都能够执行其氧气运输的功能。
-四级结构:尽管肌红蛋白和血红蛋白都是由多肽链组成的,但它们的四级结构不同。
血红蛋白的四聚体结构使其能够高效地在血液中运输氧气,而肌红蛋白的单体结构则使其更适合在肌肉细胞中储存氧气。
-调控机制:肌红蛋白和血红蛋白的结构决定了它们对氧气的亲和力。
例如,血红蛋白在肺部的高氧浓度下容易结合氧气,而在组织的低氧浓度下容易释放氧气,这是由于其结构变化导致的。
总的来说,肌红蛋白和血红蛋白的特定结构赋予了它们特定的功能。
这些蛋白质的结构决定了它们如何与其他分子相互作用,以及它们如何在生物体内执行其功能。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
血红蛋白结合氧的协同作用示意图
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
镰刀状细胞贫血是分子病
• 镰刀状细胞贫血病是血红蛋白分子突变引 起的。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
病因: 患者的二条β 链上的N-末端开始的第6位Glu 被Val所取代。Hb-S 比 Hb-A负电荷减少,即电泳 时向正极移动的速率下降。从三级结构上看,由 于β-6-Glu位于分子表面,因此Hb-S表面多了一 疏水侧链,血红蛋白的对氧亲和力和别构性质并 不受此影响,但这一变化显著地降低了脱氧血红 蛋白的溶解度。疏水侧链与其互补链之间通过疏 水作用而沉淀,压迫细胞质膜,使其弯曲成镰刀 形状。用氰酸钾处理镰刀状的红细胞可以防止它 在脱氧状态下形镰成刀状。
氧结合引起的血红蛋白构象变化
• 血红素铁 0.039nm的 微小位移 导致血红 蛋白构象 的改变。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合血红蛋白和去氧血红蛋白代表不同的构象 态。(T态和R态)
脱氧血红蛋白(紧张态)
氧合血红蛋白(松驰态)
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 氧合导致稳定T态的离子键和盐桥的断裂,血 红蛋白的氧结合过程是一协同过程。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
血红蛋白何川0743095006
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
血红蛋白的结构
◇ Hb分子近似球形;M.W.=68 000 ◇ Hb由四个亚基组成(二条α亚基和二条β亚 基); ◇ α亚基(141aa)比β亚基(146aa)短,但 都比肌红蛋白链(153aa)短;这主要是因为 末端H螺旋比较短; ◇ 4个血红素分别位于四条多肽链的E和F螺旋 之间的裂隙处,并暴露于分子表面。 ◇ Hb- α和Hb- β及Mb虽然三级结构相似,但 其氨基酸序列却有很大的不同,约只有27个位 置是相同的。
THE END!
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
• 血红蛋白4个血红素基分别位于每个多肽 链的E和F螺旋之间的裂隙处,并暴露在 分子的表面。
蛋白质与配体的可逆结合——肌红蛋白与血红蛋白
氧结合引起的血红蛋白构象变化
• 氧合作用显著改变血红蛋白的四级结构。
