Toll样受体的结构及免疫功能探究
TLR4促进肿瘤细胞免疫逃逸和凋亡抵抗的分子机制研究

TLR4促进肿瘤细胞免疫逃逸和凋亡抵抗的分子机制研究一、本文概述随着对肿瘤发生发展机制的深入研究,越来越多的证据表明,肿瘤细胞能够利用多种机制逃避宿主免疫系统的攻击,从而实现免疫逃逸。
其中, toll样受体4(TLR4)作为一种重要的模式识别受体,在肿瘤免疫逃逸和凋亡抵抗中发挥了关键作用。
本文旨在深入探讨TLR4在肿瘤细胞免疫逃逸和凋亡抵抗中的分子机制,以期能为肿瘤免疫治疗提供新的思路和方法。
我们将对TLR4的基本结构和功能进行简要介绍,明确其在天然免疫和适应性免疫中的重要作用。
然后,我们将详细阐述TLR4如何被肿瘤细胞利用,通过调控免疫细胞的功能,实现免疫逃逸。
这包括但不限于抑制抗原提呈细胞的成熟和活化,抑制T细胞的增殖和活化,以及促进免疫抑制性细胞的生成和功能等。
接下来,我们将关注TLR4在肿瘤细胞凋亡抵抗中的作用。
我们将从凋亡信号通路的角度,探讨TLR4如何调控凋亡相关分子的表达,从而抵抗凋亡。
这包括但不限于抑制凋亡诱导信号的传递,下调凋亡执行分子的表达,以及促进抗凋亡分子的表达等。
我们将对TLR4在肿瘤免疫治疗中的潜在应用进行探讨。
我们将结合目前的研究进展,分析以TLR4为靶点的肿瘤免疫治疗策略的优点和挑战,以及未来的发展方向。
通过本文的综述,我们期望能够更深入地理解TLR4在肿瘤细胞免疫逃逸和凋亡抵抗中的分子机制,从而为肿瘤免疫治疗提供新的理论支持和实践指导。
二、TLR4与肿瘤免疫逃逸肿瘤免疫逃逸是指肿瘤细胞通过一系列机制逃避宿主免疫系统的攻击,从而得以在体内生长和扩散。
近年来,越来越多的研究表明,TLR4在这一过程中发挥着重要作用。
TLR4,即 Toll样受体4,是一种模式识别受体,能够识别并响应多种病原体相关分子模式(PAMPs)以及损伤相关分子模式(DAMPs),进而激活下游信号通路,诱导免疫应答。
在肿瘤微环境中,肿瘤细胞可以通过多种方式上调TLR4的表达。
这些方式包括但不限于基因突变、表观遗传学改变以及微环境信号的影响。
TOLL样受体
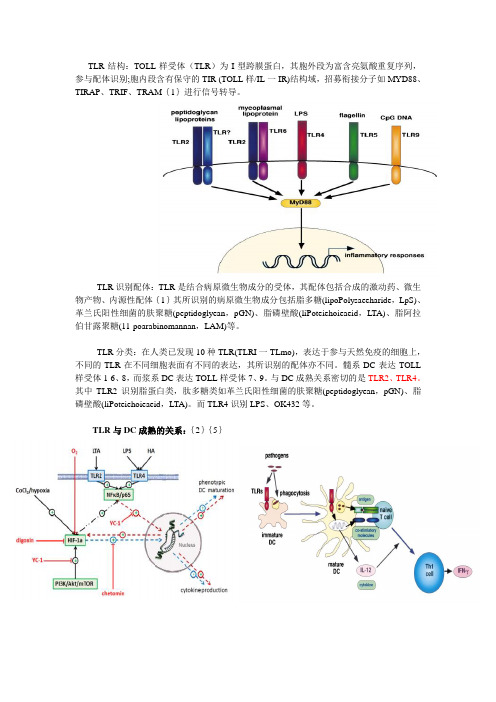
TLR结构:TOLL样受体(TLR)为I型跨膜蛋白,其胞外段为富含亮氨酸重复序列,参与配体识别;胞内段含有保守的TIR (TOLL样/IL一IR)结构域,招募衔接分子如MYD88、TIRAP、TRIF、TRAM{1}进行信号转导。
TLR识别配体:TLR是结合病原微生物成分的受体,其配体包括合成的激动药、微生物产物、内源性配体{1}其所识别的病原微生物成分包括脂多糖(lipoPolysaeeharide,LpS)、革兰氏阳性细菌的肤聚糖(peptidoglyean,pGN)、脂磷壁酸(liPoteiehoieaeid,LTA)、脂阿拉伯甘露聚糖(11-poarabinomannan,LAM)等。
TLR分类:在人类已发现10种TLR(TLRI一TLmo),表达于参与天然免疫的细胞上,不同的TLR在不同细胞表面有不同的表达,其所识别的配体亦不同。
髓系DC表达TOLL 样受体1-6、8,而浆系DC表达TOLL样受体7、9。
与DC成熟关系密切的是TLR2、TLR4。
其中TLR2识别脂蛋白类,肽多糖类如革兰氏阳性细菌的肤聚糖(peptidoglyean,pGN)、脂磷壁酸(liPoteiehoieaeid,LTA)。
而TLR4识别LPS、OK432等。
TLR与DC成熟的关系:{2}{5}TLR信号转导机制:{3}TLR受体激动药在肿瘤微环境下的免疫调节作用:{1}TLR基因定位:{4}特异性引物序列:TLR2(forward GCAAACGCTGTTCTGCTCAG) (reverse AG GCGTCTCCCTCTA TTGTA TT) TLR4 (forward ATGGCATGGCTTACACCACC) (reverse GA GGCCAA TTTTGTCTCCACA)细胞筛选机制:{1}Toll-like receptor agonists in cancer therapy{2}Roles of Toll-like receptors in innate immune responses{3}生物谷图库{4}Modulation of TNFSF expression in lymphoid tissue inducer cells by dendritic cells activatedwith Toll-like receptor ligands{5}Effects of TLR Agonists on the Hypoxia-Regulated Transcription Factor HIF-1a andDendritic Cell Maturation under Normoxic Conditions。
免疫细胞表面的TLR9及其免疫调节作用

免疫细胞表面的TLR9及其免疫调节作用前言Toll样受体9(TLR9)是Toll样受体家族的成员之一,其可被病原体来源的非甲基化磷酸胞苷鸟苷DNA(CpG DNA)或人工合成的含非甲基化CpG的寡核苷酸(CpG ODN)激活,并通过其下游信号传导直接或间接启动固有免疫反应,从而抵抗病原体的入侵。
长期以来,TLR9一直被认为是位于内溶酶体中的细胞内DNA传感器。
然而,随着研究的深入,发现TLR9也可以在细胞膜表面表达,如中性粒细胞、B细胞甚至红细胞,被称为表面TLR9(sTLR9)。
此外,细胞免疫反应的激活可以在细胞内外的这两个TLR9位点启动,TLR9在细胞膜上的定位有助于激活内体TLR9(eTLR9)介导的信号通路。
sTLR9的存在可能有利于某些细胞类型或组织中的宿主反应,例如红细胞可以通过sTLR9介导巨噬细胞等先天免疫细胞的激活,从而在炎症状态下加速自身的清除。
因此,深入了解sTLR9的结构特征、sTLR9与CpGDNA的关系,以及sTLR9在免疫细胞中的免疫调节作用,将为TLR9激动剂的临床应用提供理论参考。
sTLR9的结构sTLR9的结构并不特别清楚,它是否与eTLR9相同也存在争议。
众所周知,eTLR9属于I型跨膜蛋白,由细胞外、跨膜和细胞内区域组成。
eTLR9的胞外区位于内体中,由25个富含亮氨酸的重复序列(LRR)组成,其N-末端和C-末端分别称为TLR9-N和TLR9-C。
TLR9-N和TLR9-C可以通过天冬氨酸内切酶释放,该内切酶作用于eTLR9中间的LLR14和LLR15之间的Z环结构域,形成TLR9-N+C复合物,这是eTLR9的活性形式。
然而,sTLR9的结构尚不清楚。
一项研究表明,与TLR9-N 结合的抗体完全不能与人外周中性粒细胞上的sTLR9结合,这可能表明这些中性粒细胞的sTLR9不是TLR9-N+C复合物的活性形式。
而抗全长TLR9和抗TLR9-N的抗体都能识别B 细胞上的sTLR9,这表明全长TLR9和TLR9-N存在于B细胞上。
tlr信号转导原理

tlr信号转导原理引言:tlr信号转导是指Toll样受体(Toll-like receptor,TLR)家族在免疫系统中起到信号传导的重要作用。
TLR是一类跨膜受体,主要存在于免疫细胞表面,能够识别和结合到病原体的分子模式,并启动相应的免疫应答。
本文将介绍TLR的结构特点、信号转导机制以及其在免疫应答中的重要作用。
一、TLR的结构特点TLR是一类由多个跨膜蛋白组成的受体家族,目前已经发现了十多种不同的TLR。
这些TLR的结构特点有以下几个方面:1. 跨膜结构:TLR大部分由一个跨膜蛋白组成,跨膜区域具有保守的氨基酸序列。
2. 外显区域:TLR的外显区域分为N端和C端两部分,N端是TLR 家族的保守结构域,能够识别和结合到病原体的分子模式。
3. 受体配体:不同的TLR能够识别和结合到不同的病原体分子模式,如TLR2能够识别和结合到细菌的脂多糖,TLR3能够识别和结合到病毒的双链RNA等。
二、TLR的信号转导机制TLR的信号转导机制主要包括三个关键步骤:识别和结合、信号传导和免疫应答。
1. 识别和结合:TLR的外显区域能够识别和结合到病原体的分子模式,如细菌的脂多糖、病毒的双链RNA等。
2. 信号传导:识别和结合后,TLR能够激活下游信号分子,启动信号传导通路。
TLR主要通过两条信号传导通路进行信号转导:MyD88依赖通路和TRIF依赖通路。
a. MyD88依赖通路:大部分TLR通过MyD88依赖通路传递信号。
在这条通路中,TLR与MyD88蛋白结合,激活下游信号分子,最终激活核转录因子NF-κB和IRF,促进炎症因子和抗病毒因子的产生。
b. TRIF依赖通路:少数TLR通过TRIF依赖通路传递信号。
在这条通路中,TLR与TRIF蛋白结合,激活下游信号分子,最终激活IRF和NF-κB,促进抗病毒因子的产生。
3. 免疫应答:信号传导通路的激活会引起一系列的免疫应答,包括炎症反应、抗病毒应答和抗肿瘤应答等。
toll样受体名词解释

toll样受体名词解释
Toll样受体是一类重要的蛋白质受体,也被称为Toll-like receptors(TLRs)。
它们是一类存在于人类和其他动物的免疫系统中的受体分子,起着识别和应答外来微生物的关键作用。
Toll样受体最早是在果蝇(Drosophila)的免疫系统中被发现的,后来在人类和其他脊椎动物中也被发现。
它们的命名源自于果蝇的Toll受体,因为人类的TLRs在结构和功能上与果蝇的Toll受体相似。
TLRs主要存在于免疫细胞表面,如巨噬细胞、树突状细胞和B 淋巴细胞等。
它们通过结合微生物的特定分子模式(例如细菌的脂多糖、病毒的核酸等)来识别和区分病原体。
一旦TLRs与这些微生物分子结合,它们会激活免疫细胞,并引发一系列的免疫反应。
TLRs的激活会触发多种信号传导途径,包括NF-κB和MAPK等途径,从而导致炎症反应和免疫细胞的活化。
这些反应有助于清除病原体、增强免疫应答,并最终保护机体免受感染。
除了对微生物的识别,TLRs还参与了一些非感染性疾病的发生
和发展,如自身免疫性疾病、癌症和慢性炎症等。
因此,研究TLRs
的功能和调控机制对于理解免疫系统的工作原理以及相关疾病的治
疗具有重要意义。
总结起来,Toll样受体是一类存在于免疫细胞表面的受体分子,通过识别微生物的特定分子模式来激活免疫反应。
它们在免疫应答
中起着重要作用,并参与了多种疾病的发生和发展。
Toll样受体简介及TLR2在类风湿关节炎中的研究进展

Toll样受体简介及TLR2在类风湿关节炎中的研究进展Toll样受体(Toll like receptors,TLRs)作为天然免疫分子的成员已经成为目前免疫学研究的热点,迄今为止人类TLR家族至少包括有11个成员[1],主要表达在单核细胞和树突状细胞,它们参与多种免疫反应,对类风湿关节炎(rheumatoid arthritis,RA)的发病也有突出影响。
TLR2是Toll样受体家族的重要成员,本文就TLRs做一简介,并对TLR2在RA中的研究进展做一综述。
1 Toll样受体简介Toll样受体最早是在研究果蝇的胚胎发育中发现的,称为Toll受体,它们不仅是果蝇胚胎发育过程中的必须成份蛋白,同时也能介导天然免疫,抵抗微生物的感染[2]。
1997年Janeway[3]等首次发现与果蝇同源的人的Toll蛋白,并命名为TLRs。
1.1 TLRs的结构和分布哺乳动物的TLRs均为Ⅰ型跨膜蛋白受体,主要由三个功能区构成:胞外区、跨膜区和胞内区。
胞外区含有18-31个富含亮氨酸的重复序列(leucine rich repeats,LRR),研究发现TLR家族成员胞外区的同源性差,提示不同的TLR成员与不同的配体结合[4],亦即表示LRR具有决定TLRs与配体结合部位的特异性。
TLR的胞内区与人白介素-Ⅰ受体(IL-IR)胞内区结构相似,故称为TIR结构域(Toll/IL-IR domain,TIR)[5],TIR结构负责向下游进行信号转导,它是TLR和IL-IR向下游转导信号的核心元件,其关键位点的突变或序列缺失会阻断信号下传。
TLRs分布广泛,大部分组织至少表达一种TLR,有些甚至表达全部,其中所有淋巴组织都有TLRs的表达,在外周血白细胞中表达水平最高,单核/巨噬细胞、B细胞、T细胞及DC都表达TLR mRNA。
1.2 TLRs的配体TLRs是一类Ⅰ型跨膜形式识别受体(pattern recognition receptors,PRR),它主要识别广泛存在于病原体细胞表面的分子标志,即病原相关分子模式(pathogen associated molecular patterns,PAMPs),从而迅速激活免疫反应的。
细胞表面受体的功能及其在免疫系统中的应用

细胞表面受体的功能及其在免疫系统中的应用细胞表面受体是细胞表面上的一种分子,它们是细胞与环境、其他细胞之间通信的关键。
不同类型的受体会响应不同的信号物质,从而调控细胞内信号传递通路,影响细胞生长、分化、存活以及攻击病原体和肿瘤等功能。
本文将介绍一些常见的细胞表面受体,以及它们在免疫系统中的应用。
1. Toll样受体(TLRs)TLRs是能识别病原微生物模式分子的一类跨膜受体。
它们主要存在于宿主免疫系统的细胞表面上,包括淋巴细胞、巨噬细胞、树突细胞等。
当微生物入侵机体时,TLRs会识别并结合它们表面的PAMPs (pathogen-associated molecular patterns,即病原微生物模式分子),激活宿主的天然免疫防御机制。
TLRs和PAMPs之间的结合能够激活转录因子NF-κB,从而促进炎症因子的生成,增强巨噬细胞、树突细胞和T细胞的活性,最终消灭入侵的微生物。
2. 细胞因子受体细胞因子受体是能够识别并结合不同类型的细胞因子的跨膜受体。
它们的作用是调控细胞之间的相互作用、细胞增殖、分化、凋亡以及炎症反应等生物过程。
常见的细胞因子受体包括IL-1受体、IFN感受器、IL-2受体、IL-4受体、IL-12受体、TNF受体等。
这些受体能够识别不同类型的细胞因子,激活相关的信号通路,从而改变细胞的功能和相互作用。
在免疫系统中,细胞因子受体与细胞因子的相互作用是非常关键的。
例如,IL-2受体是T细胞增殖和生存所必需的,而TNF受体则是炎症反应的关键调节因子。
3. T细胞受体(TCR)TCR是T细胞表面的一种膜受体,它能够识别并与MHC分子上的肽段结合。
在机体抵抗病原微生物和肿瘤时,TCR是T细胞识别和消灭目标细胞的重要途径。
同时,TCR还能够判定机体自身组织是否被外界攻击,从而发挥着重要的自身免疫作用。
TCR的结构包括α链和β链,α链和β链每个都是由V、D、J三个可变区域组成。
每个可变区域都有多种不同的基因段可以选择,因此TCR的多样性非常高。
Toll样受体及其信号通路研究进展

Toll样受体及其信号通路研究进展摘要:Toll样受体(TLRs)是一类模式识别受体,可以识别微生物并对其作出反应。
TLRs家族成员在免疫系统中起着重要作用,既是参与先天免疫的重要分子,也是连接先天免疫和特异性免疫的桥梁。
该受体可以特异性地识别微生物,并启动免疫应答。
本文对TLRs结构、功能和信号通路等方面进行综述。
关键词:Toll样受体免疫系统信号通路在天然免疫系统的研究中,Toll样受体的发现是最重要的进展之一。
TLRs 最早是1980年在果蝇胚胎中发现的,此基因决定了果蝇背腹侧的分化[1]。
1991年Gay等发现,TLRs蛋白的结构与哺乳动物中IL-1具有同源性[2]。
随后,TLRs 被发现能够激活获得性免疫[3]。
至今,已经发现21种TLRs,其中人13种(TLR1-13),小鼠12种(TLR1-9及TLR11-13),斑马鱼18种(TLR1-9、TLR11-14和TLR18-22)。
1、TLRs的结构TLRs结构由三部分组成,胞外区、跨膜区和胞浆区。
胞外区是亮氨酸富集的重复序列,识别病原体细胞表面的分子;跨膜区富含半胱氨酸;胞浆区与哺乳动物IL-1受体高度同源,称为TIR[5]。
TIR的构型与病原识别相关,不同种类TLRs,识别不同种类的微生物。
2、TLRs的功能TLRs是抵御感染性疾病的第一道屏障,在免疫系统中起识别微生物的作用。
TLRs通过TIR识别相应的配体来激活免疫反应。
TLR1可识别细菌的三酰脂肽;TLR2可识别革兰氏阳性细菌的脂蛋白、肽聚糖等;TLR3主要识别dsDNA;TLR4能识别革兰氏阴性菌的脂多糖;TLR5特异识别细菌的鞭毛蛋白;TLR6主要识别细菌的肽聚糖;TLR7、TLR8可识别单链RNA病毒;TLR9可识别CpGDNA。
另外树突细胞可表达TLRs。
TLRs在识别脂多糖、肽聚糖、脂蛋白及病毒后,树突细胞被活化并成熟,提供获得性免疫的共刺激信号。
TLRs是微生物成分引起树突细胞活化的桥梁。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Toll样受体的结构及免疫功能探究发表时间:2011-09-06T11:23:55.560Z 来源:《中国健康月刊(学术版)》2011年第7期供稿作者:何玉林刘小双叶狄[导读] TLR是一类从线虫到哺乳动物序列高度保守的模式识别受体。
何玉林刘小双叶狄基金项目:贵州省遵义医学院博士启动基金 (F-332号)作者简介:何玉林(1969-),男,甘肃天水人,副教授,博士【摘要】Toll样受体(Toll-like receptors,TLRs)是天然免疫系统中特异的Ⅰ型跨膜受体及病原体模式识别受体,它通过识别病原体,能立即启动先天性免疫,并能通过信号传导启动获得性免疫,在急性炎症反应、细胞信号转导和细胞凋亡中起重要作用。
目前已发现TLR家族共有13个受体,分布于各个器官脏器,针对不同的病原体发挥其识别作用。
该文对TLRs的结构和分布、相应配体及免疫功能等方面作简要综述。
【关键词】Toll样受体(TLRs);配体;天然免疫应答;免疫功能【中图分类号】R441【文献标识码】A【文章编号】1005-0515(2011)07-0002-02TLR是一类从线虫到哺乳动物序列高度保守的模式识别受体。
最早的Toll基因是在研究果蝇背腹极性时发现的,因与果蝇的Toll分子高度同源而得名。
后来的研究发现Toll在果蝇的天然免疫应答中扮演了重要角色。
TLR通过识别外源性微生物,启动先天性免疫反应,清除侵入的病原微生物。
同时活化的TLR也能激活T细胞,启动获得性免疫反应。
TLR在天然免疫方面的特殊意义及在沟通天然免疫和获得性免疫方面的桥梁作用,使生物学界和医学界对其投入了极大的热情。
随后,人类和小鼠中先后克隆出多个Toll的同源蛋白,共同构成Toll受体家族。
目前为止,已经鉴定了至少13种TLRs,其中TLR1TLR9是人类与老鼠共有,TLR似乎只在人类中有功能,而TLR11TLR13为小鼠所特有。
1TLRs的生物特点1.1TLR的结构:TLRs属于Ⅰ型跨膜糖蛋白,是具有类似结构的跨膜型式识别受体(pattern recongnition receptors,PRR),由胞外区、跨膜区和胞质区组成。
胞外区是由1831个串联的富含亮氨酸的重复基序(leucine-rich repeat,LRR)形成的亮氨酸结构域,空间结构如马蹄形且高度保守,其中亮氨酸在三维空间的一侧排列形成疏水界面,该区为序列多变的Ig样结构域,与宿主对感染反应的特异性有关,其空间结构的细微变化就会影响TLR对病原相关分子模式(pathogen associated molecular pattern,PAMP)的识别;跨膜区是富含半胱氨酸结构域,一般认为跨膜结构域决定了TLRs分子的亚细胞定位;胞质区和白介素受体-1受体(interleukin-1 receptor,IL-1R)家族的胞质区有高度的同源性,称为TIR(Toll/IL-1R)结构域,约200个氨基酸组成。
TLRs识别存在于各种病原体细胞表面分子,如酵母细胞壁的甘露糖以及细菌细胞壁的脂多糖、多肽糖及胞壁酸等各种成分,统称病原体相关的分子模式(PAMP).1.2TLR的分布:1.2.1细胞分布和亚细胞定位:TLRs是固有免疫细胞膜上的识别系统中重要组成部分,他们分布于各种组织的细胞膜上,分布十分广泛。
如TLR1广泛表达于单核细胞、T和B淋巴细胞、树突状细胞(dendritic cell,DC)、多形核白细胞、NK细胞;TLR2/4/5主要分布于除T、B、NK细胞以外的免疫细胞;TLR3主要表达于未成熟的DC等。
但TLR因其识别的PAMP性质不同人在细胞中有不同的分布区。
TLR1/2/4/6分布于细胞表面,并能聚集到接触微生物的吞噬体上;TLR3/7/8/9则定位在细胞内,尤其是内质网上,并用于识别核酸。
1.2.2组织分布:不同的TLR在各种组织中有不同程度的表达,其中在淋巴组织尤其是脾和外周血的白细胞中表达最强。
TLR1广泛分布且表达明显,如卵巢、脾脏;TLR2在肺、心脏、脑和肌肉组织可测到TLR2mRNA的表达;TLR3主要表达于胎盘和胰腺;TLR4表达于胎盘组织等;TLR5表达与前列腺和外周血单核细胞;TLR6、TLR9广泛表达于多种细胞;TLR10主要表达于淋巴样组织和脾脏细胞。
2TLR的配体虽然TLR家族具有相似的结构,但TLR通过识别相应的配体来激活免疫反应。
不仅外来病原体的产物,而且宿主自身的某些物质也可以是不同的TLR的配体。
配体包括脂多糖(LPS)、病毒蛋白F、透明质酸酶、硫酸肝素、纤维蛋白原、酵母多糖、白色念珠菌以及宿主来源的热休克蛋白60(HSP-60)、纤维连接蛋白等。
TLR1能识别细菌的三酰脂肽;TLR2识别的配体包括G+细菌、分支杆菌、疏密螺旋体、酵母菌和支原体的某些成分,如脂蛋白、脂肽、脂磷壁酸、肽聚糖和酵母多糖等;TLR3构成同源二聚体或与TLR4形成异源二聚体,识别鞭毛蛋白,还可识别多聚肌苷胞苷(poly riboinosinic polyribocytidylic acid, poly I:C);TLR4形成同源二聚体,识别LPS及牛型结核杆菌胞壁的骨架、链球菌来源的脂质酸;TLR5特异识别细菌的鞭毛蛋白,有选择的识别渗透过肠上皮的细菌,并引起反应;TLR6主要识别细菌的肽聚糖和脂肽;TLR7、TLR8均能识别单链RNA病毒;TLR9主要识别细菌中非甲基化的胞嘧啶鸟嘌呤二核苷酸(CpG DNA);TLR11能识别来源于尿路细菌的配体。
除了同型二聚体表现出来的功能外,TLR的一些功能也来自于异型二聚体。
3TLR的免疫功能美国免疫学家Janeway(2000年)首次提出固有免疫细胞识别模式理论,被科学家观察杂志列为2001年十大生物科学重要进展之一。
固有免疫细胞膜上不表达特异性抗原受体,但他们具有模式识别受体(PRR),能直接识别并结合各种病原微生物表达的固有保守基序的分子,即PAMPS,其中TLRs是固有免疫细胞膜上最重要的模式识别受体。
天然免疫细胞借助PRR中TLR,识别各种病原微生物的相关分子模式(PAMPs)。
因此,天然免疫细胞可以区分自身和非自身成分,识别PAMPs后的天然免疫细胞,迅速被活化,无需这些细胞再克隆分化增殖,此时巨噬细胞通过胞内氧依赖性杀菌系统和氧非依赖行杀菌系统,杀伤病原体。
同时把一些具有免疫原性的小分子抗原肽,借助主要组织相容性复合体(major histocompatibility complex,MHC)提供各相应T细胞,启动获得性免疫应答,分泌多种细胞因子,参与免疫调节或杀伤肿瘤细胞等生物学功能。
因此,把天然免疫和获得性免疫紧密联系起来。
尽管目前所发现的TLR家族成员种类有限,但同一细胞或不同细胞间TLRs各成员间的相互组合及不同协助蛋白共同作用,组织有效的天然免疫应答,对相对广泛的病原微生物进行特异性识别,引起一系列特异的天然免疫和获得性免疫反应,以对抗微生物感染乃至慢性炎症(如哮喘)及自身免疫性疾病(如类风湿性关节炎等)。
4展望近年来随着对TLR研究的展开和深入,人们对TLR在免疫中的作用有了更多的认识和了解。
TLR在识别侵入的病原、早期启动机体的先天性免疫反应、诱导多种炎症介质和细胞因子的产生有着重要的作用;同时通过抗原呈递和对T细胞的致敏,接到获得性免疫反应的发生。
因此,TLR可为人类的抗感染免疫、免疫耐受、自身免疫、超敏反应及疫苗佐剂提供新的切入点和生长点并通过对TLR多态性的研究,对于TLT与感染性疾病、败血症性休克、病毒性感染和自身免疫性疾病等多种疾病的发生有了进一步的认识,并为疾病的治疗提供了新的思路。
目前TLR热方兴未艾,今后的研究内容主要可能有以下几个方面:模式生物和经济生物TLR家族成员的探明;新的TLR配基的不断挖掘;TLR与各种疾病的关系及相关药物与疫苗的研制与开发;新TLR信号通道的发现;TLR的起源与进化及在物种起源和进化研究中的价值等。
参考文献[1]Jun Zhou,Huazhang An,Hongmei Xu,Heat shock up-regulates expression ofToll-like receptor-2 andToll-like receptor-4 in human monocytes via p38 kinase ignal pathway. Immunology,2004.114,522-530[2]王建华.Domestic Animal Medicine 中国农业出版社.第三版,266-270[3]蔡基忠.福建畜牧兽医.2000年第5期. 龙海市畜牧兽医站[4]任美玉,吴欣怡.Toll样受体的研究进展.现代免疫学,2006,26(4):340-342[5]陈慰峰.医学免疫学.第4版.北京:人民卫生出版社,2004:89-92[6]何维,高晓明,曹雪涛,等.医学免疫学.北京:人民卫生出版社,2005:143-149[7]林怡,熊思东.Toll样受体在亚单位疫苗分子设计中研究进展.现代免疫学,2006,26(5)2:427-430[8]王海坤;韩代书 Toll样受体(TLRs)的信号转导与免疫调节生物化学与生物物理进展 2006年第09期[9]王平忠;黄长形;王九平 Toll样受体介导的抗病毒天然免疫细胞与分子免疫学杂志 2008年第05期[10]任卫聪;李传友 Toll样受体及其在抗结核感染免疫中的作用国际呼吸杂志 2009年第17期[11]吕烽,宋勇;Toll样受体在脂多糖耐受性机制作用中的研究进展[J];中国危重病急救医学;2005年04期[12]俞秀丽,李兰娟. Toll样受体家族信号转导的研究进展. 国际流行病学传染病学杂志,2006年第02期作者单位:519041遵义医学院珠海校区免疫学与病原生物学教研室。
