左先群 第一节 元素周期表1
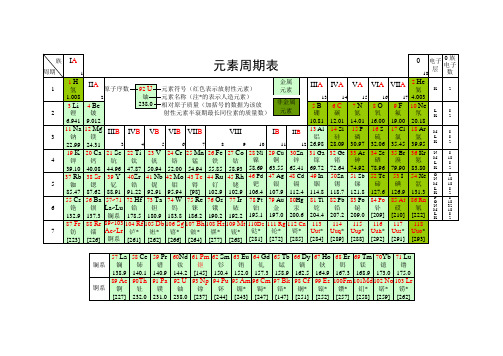
化学元素周期表-超清-可打印
[244]
95Am
镅*
[243]
96Cm
锔*
[247]
97Bk
锫*
[147]
98Cf
锎*
[251]
99Es
锿*
[252]
100Fm
镄*
[257]
101Md
钔*
[258]
102No
锘*
[259]
103Lr
铹*
[262]
铜
63.55
30Zn
锌
65.41
31Ga
镓
69.72
32Ge
锗
72.64
33As
砷
74.92
34Se
硒
78.96
35Br
溴
79.90
36Kr
氪
83.80
N
M
L
K
8
18
8
2
5
37Rb
铷
85.47
38Sr
锶
87.62
39Y
钇
88.91
40Zr
锆
91.22
41Nb
铌
92.91
42Mo
钼
95.94
43Tc
锝
氡
[222]
P
O
N
M
L
K
8
18
32
18
8
2
7
87Fr
钫
[223]
88Rr
镭
[226]
89~103
Ac~Lr
锕系
104Rf
钅卢*
[261]
105Db
钅杜*
[262]
元素周期表(word高清打印版)--拼音注释元素读音--原周期表规律总结

一、元素周期表基本排列规律1、原子半径由左到右依次减小,上到下依次增大。
2、元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
3、同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
4、同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
二、电子排布规律最外层电子数为1或2的原子可以是IA族、ⅡA族或副族元素的原子;最外层电子数是3~8的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。
序数差规律(1)同周期相邻主族元素的“序数差”规律①除第ⅡA族和第ⅢA族外,其余同周期相邻元素序数差为1。
②同周期第ⅡA族和第ⅢA族为相邻元素,其原子序数差为:第二、第三周期相差1,第四、第五周期相差11,第六、第七周期相差25。
(2)同主族相邻元素的“序数差”规律①第二、第三周期的同族元素原子序数相差8。
②第三、第四周期的同族元素原子序数相差有两种情况:第IA族和第ⅡA族相差8,其它族相差18。
③第四、第五周期的同族元素原子序数相差18。
④第五、第六周期的同族元素原子序数镧系之前相差18,镧系之后相差32。
⑤第六、第七周期的同族元素原子序数相差32。
三、奇偶差规律元素的原子序数与该元素在周期表中的族序数和该元素的主要化合价的奇偶性一致。
若原子序数为奇数时,主族族序数、元素的主要化合价均为奇数,反之则均为偶数(但要除去N元素,它有多种价态,Cl元素也有ClO2)。
零族元素的原子序数为偶数,其化合价视为0。
四、元素金属性、非金属性的强弱规律(1)金属性(原子失电子)强弱比较①在金属活动性顺序中位置越靠前,金属性越强。
(完整word版)元素周期表(word全面版)

元素周期表有关知识物的俗名NaCl食盐MgCl:• 6H:0盐卤Nag纯砒、苏打NaHCG小苏打NaOH v-r -h KOH 苛性伸化学式俗名化学式俗名Ca(OH):熟石灰.消石灰C«F:漬石.氟石FeS:黄铁矿、篠铁矿CuSO. • 5HcO绿矶ZnSO t•7H:O皓矶BaSOi重晶石COJs)干冰2CaS0:• H:0熟石灰CaSO;lOH^)生石膏KNO:泻盐N&SO芒硝CO和乩智利硝石、火硝Ca3(PO.):大苏打、梅波CaCO3水煤气CaO生石灰CaC:电石SiC金刚砂NajAlB冰晶石Na:SiO3水玻璃AI:O5刚玉.铝矶上FeA铁红、赤铁矿Fe3O<磁性辄化铁AsA砒也As 1S1堆黄HgO三仙丹恥双氣水CaO 和NaOH礙石灰HNO3・HC1(1:3)王水Ca(ClO):和CaCL:潭白粉SiO:石英、水晶、硅石KAI (SO:) •12H:0明矶CaCO3大理石、石灰石、方解石、石樂三、元素周期表有关背诵口诀(1)元素周期表族背诲口诀氢锂仙钾f如他紡-诘李娜加入私访彼镂钙總徼锚媲关孟茨被宙硼铝铢钢佗——碰女嫁音他磺硅济锡铅-探,者西迁氮磷砂怫桃-蛋临身体闭氧51硒确针--养牛西蹄扑氟氯溟碘破一父女绣点爱氮烦氟氮抵氧害耐亚克先动(2)元素周期丧原子序数背诵口诀从前.有一个富裕人家.用鲤龟皮捧碳,走熟科蛋供养看有福气的奶妈,这家冇个很关丽的女儿•叫桂林•不过她有两颗绿色的大门牙(哇. 太恐怖了吧).厉來只庞嫁给了一个叫康太的反革命•刚嫁入门的那天. 就被小姑子号称“铁姑■狠狠地捏了-•把•新姐一生气•当时就休克了。
这下不得了・娘家雯上告铁姑的老爸和她的哥曙夜入县太爷府.把大印假偷走一貢往两跑.跑到一个仙人住的地方。
这里风戢优灵:彩色贝壳蓝蓝的河.一只角鸦用一缕长长的白巾牵來一只鹅•因为它们不喜欢冬天,所以要去南方.一路上还相互提剋:南方多雨.要注怠防宙啊。
第一节元素周期表(共40张PPT)
第ⅦA 族
与水缓慢反应
(2)原子结构特点 Cl2+H2O=HCl+HClO
静置后,液体分为两层。
通一过个以 12上C相质比量较同×,1点/思12考:钠和钾最的外性质层有 7个电子
静置后,液体分为两层。
和递变性。 (氧化性:Cl2 >I2)
核电荷数依次增多
不同点: 电子层数依次增多 上层无色,下层分别呈橙红色、紫红色
第一章 物质结构、元素周期律
第一节 元素周期表 一、元素周期表的结构
原子序数:依原子核电荷数由小到大的顺序给元素编号,这种
编号叫原子序数。
原子序数=核电荷数=质子数=核外电子数 (一)元素周期表的编排原则
1、横行: 把电子层数相同的各种元素按原子序数递增顺序
从左到右排列。
2、纵行: 把最外层电子数相同的各种元素按电子层数递增顺序 从上而下排成。
性逐渐增强,非金属性逐渐减弱。
2. 元素性质与原子结构有有密切的关系,主要与原子
核外的排布,特别是最外层电子数有关。原子结构
相似的一族元素,它们在化学性质上表现出相似性 和递变性。
1、砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或
砹的化合物不可能具有的性质是( B)
A、砹易溶于某些有机溶剂 B、砹能与水剧烈反应
应越来越
,剧生烈成的氧化物越来越
。
最高复价杂氧化物对应水化物的碱性越来越 。
强
讨论1:Li与K 应如何保存? Li封存于固体石蜡中, 少量K保存于煤油中。
讨论2:碱金属与盐酸: 2R+2H+= 2R++H2 ↑ 讨论3:碱金属与盐溶液: 先与水反应
讨论4:Li+、Na+、K+、Rb+、Cs+也具有强还原性吗? 没有。 有较弱的氧化性。 氧化性: Li+ > Na+ > K+ > Rb+ > Cs+
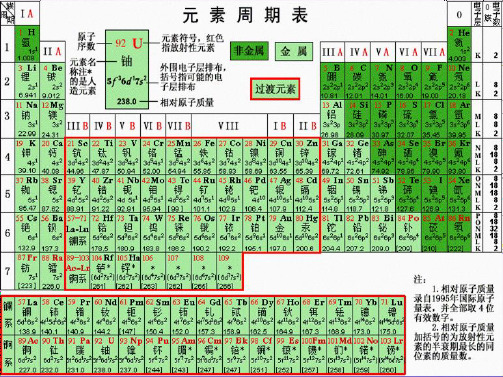
(完整版)元素周期表详解

(完整版)元素周期表详解元素周期表中元素及其化合物的递变性规律1 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
注意:原子半径在VIB族及此后各副族元素中出现反常现象。
从钛至锆,其原子半径合乎规律地增加,这主要是增加电子层数造成的。
然而从锆至铪,尽管也增加了一个电子层,但半径反而减小了,这是与它们对应的前一族元素是钇至镧,原子半径也合乎规律地增加(电子层数增加)。
然而从镧至铪中间却经历了镧系的十四个元素,由于电子层数没有改变,随着有效核电荷数略有增加,原子半径依次收缩,这种现象称为“镧系收缩”。
镧系收缩的结果抵消了从锆至铪由于电子层数增加到来的原子半径应当增加的影响,出现了铪的原子半径反而比锆小的“反常”现象。
2元素变化规律(1)除第一周期外,其余每个周期都是以金属元素开始逐渐过渡到非金属元素,最后一稀有气体元素结束。
(2)每一族的元素的化学性质相似3元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价4单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增5元素的金属性与非金属性(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
6最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
元素周期表

化学元素周期表 - 递变规律1、原子半径(1)同一主族自上而下半径增大。
(2)同一周期从左到右,原子半径逐渐减少。
2、元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同3、单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减。
5、最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6、非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7、单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的氧离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
8、化学元素周期表 - 位置规律1、元素周期数等于核外电子层数。
2、主族元素的序数等于最外层电子数。
阴阳离子的半径大小辨别规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子所以,总的说来:1、阳离子半径小于原子半径,阴离子半径大于原子半径2、核外电子排布相同的离子,核电荷数越多,离子半径越小。
3、电子层数越多,半径越大。
以上不适合用于稀有气体。
化学元素周期表 - 推断元素位置的规律:判断元素在周期表中位置应牢记的规律:(1)元素周期数等于核外电子层数;(2)主族元素的序数等于最外层电子数。
阴阳离子的半径大小辨别规律由于阴离子是电子最外层得到了电子而阳离子是失去了电子所以, 总的说来(1) 阳离子半径<原子半径 (2) 阴离子半径>原子半径 (3) 阴离子半径>阳离子半径(4)或者一句话总结,对于具有相同核外电子排布的离子,原子序数越大,其离子半径越小。
完整word版)化学元素周期表 超清 可打印

完整word版)化学元素周期表超清可打印元素周期表是一张按照元素的原子序数、电子结构和元素性质等规律排列的表格。
它可以让我们更好地了解元素之间的关系和特性。
元素周期表被分为七个周期和十八个族。
周期数代表了元素的电子层数,而族数则代表了元素的电子数。
每个周期的第一个元素是碱金属,而每个周期的最后一个元素则是惰性气体。
而族则根据元素的性质分为了不同的类别,比如第一族是碱金属,第二族是碱土金属,第十八族则是惰性气体。
周期表中的元素按照原子序数从小到大排列。
原子序数是指元素原子核中的质子数,也是元素在周期表中的位置。
原子序数越大,元素的原子结构就越复杂,化学性质也就越多样化。
元素周期表中的元素可以分为金属、非金属和半金属三类。
金属元素具有良好的导电性和热导性,而非金属元素则通常是脆性的,不具备导电性。
半金属元素则介于金属和非金属之间,具有介于两者之间的性质。
总的来说,元素周期表是一张重要的工具,可以帮助我们更好地了解元素之间的关系和特性,为化学和物理学的研究提供了基础。
本文是一个元素周期表,展示了所有元素的符号、原子序数和原子量。
但是,由于格式混乱和一些明显的错误,需要进行修正和改写。
修正后:元素周期表展示了所有元素的符号、原子序数和原子量。
下面是各元素的相关信息:1 H 氢 1.0082 He 氦 4.0033 Li 锂 6.9414 Be 铍 9.0125 B 硼 10.816 C 碳 12.017 N 氮 14.018 O 氧 16.009 F 氟 19.0010 Ne 氖 20.1811 Na 钠 22.9912 Mg 镁 24.3113 Al 铝 26.9814 Si 硅 28.0915 P 磷 30.9716 S 硫 32.0717 Cl 氯 35.4518 Ar 氩 39.9519 K 钾 39.1020 Ca 钙 40.0821 Sc 钪 44.9622 Ti 钛 47.8723 V 钒 50.9424 Cr 铬 52.0025 Mn 锰 54.9426 Fe 铁 55.8527 Co 钴 58.9328 Ni 镍 58.6929 Cu 铜 63.5530 Zn 锌 65.3831 Ga 镓 69.7232 Ge 锗 72.6333 As 砷 74.9234 Se 硒 78.9635 Br 溴 79.9036 Kr 氪 83.8037 Rb 铷 85.4738 Sr 钡 87.6239 Y 钇 88.9140 Zr 锆 91.2241 Nb 铌 92.9142 Mo 钼 95.9443 XXX 98.0044 Ru 钌 101.145 Rh 铑 102.946 Pd 钯 106.447 Ag 银 107.948 Cd 镉 112.449 In 铟 114.850 Sn 锡 118.751 Sb 锑 121.852 Te 碲 127.653 I 碘 126.954 Xe 氙 131.355 Cs 铯 132.956 Ba 钡 137.357 La 镧 138.958 Ce 铈 140.159 Pr 镨 140.960 Nd 钕 144.261 Pm 钷 14562 Sm 钐 150.463 Eu 铕 152.064 Gd 钆 157.365 Tb 铽 158.966 Dy 镝 162.567 Ho 钬 164.968 Er 铒 167.369 Tm 铥 168.970 Yb 镱 173.071 Lu 镥 175.072 Hf 铪 178.573 Ta 钽 180.974 W 钨 183.875 Re 铼 186.276 Os 锇 190.277 Ir 铱 192.278 Pt 铂 195.179 Au 金 197.080 XXX 200.681 Tl 铊 204.482 Pb 铅 207.283 Bi 铋 208.984 Po 钋 209.085 At 砹 210.086 Rn 氡 222.087 Fr 钫 223.088 Ra 镭 226.089 Ac 锕 227.090 Th 钍 232.091 Pa 镤 231.092 U 铀 238.093 Np 镎 237.094 Pu 钚 244.095 Am 镅 243.096 Cm 锔 247.097 Bk 锫 247.098 Cf 锎 251.099 Es 锿 252.0 100 Fm 镄 257.0 101 Md 钔 258.0 102 No 锘 259.0 103 Lr 铹 262.0 104 Rf 铌 267.0 105 Db 镝 270.0106 Sg 271.0107 Bh 波 270.0108 Hs 哈 277.0109 Mt 马 276.0110 Ds 达 281.0111 Rg 钅钅 280.0112 Cn 钅钅 285.0113 Nh 钅钅 284.0114 Fl 钅钅 289.0115 Mc 钅钅 288.0116 Lv 钅钅 293.0117 Ts 钅 294.0118 Og 钅 294.0这是一个元素周期表,其中包含了所有元素的符号、原子序数和原子量。
初三化学元素周期表完整版

初三化学元素周期表完整版元素周期表是一张按照原子序数分组排列的表格,其中包含了所有已知元素。
这张表格是化学中最基本的工具之一,它可以帮助人们更深入地了解元素的性质及其在化学反应中的作用。
元素周期表中的每一个元素都有其独特的原子结构和化学性质。
在元素周期表中,元素按照其原子序数的增加而排列。
原子序数指的是元素原子中所含的质子数,同时也是这个元素在元素周期表中的位置。
在同一周期(横行)中的元素,它们的电子外层壳层的最大数量相同,这个数量也就是该周期的周期数。
同时,在同一族(竖列)中的元素,它们的电子外层壳层的电子数相同,因此它们的化学性质也相似。
元素周期表中的第一周期中只有两个元素,它们是氢和氦。
氢是宇宙中最常见的元素之一,它也是化学元素中最轻的元素。
它的原子结构只包含一个质子和一个电子。
氮气是一种惰性气体,在自然状态下不会参与任何化学反应。
而氦则是一种质量较大的惰性气体,并且也不会参与任何化学反应。
第二周期包含了八个元素,其中包括了一些非常有用且普及的元素,如锂、铍、硼、碳、氮、氧、氟以及氖。
除氖之外,这些元素都是金属元素,它们在自然状态下都可以和其他元素形成化合物。
其中,碳被认为是最重要的元素之一,它的存在使得地球上的所有生命都能够得以维持。
第三周期包含了八个元素,其中比较重要的有钠、镁、铝、硅、磷、硫、氯以及氩。
钠和镁都是常见的金属元素,它们在化学反应中都可以释放出电子。
铝是一种轻质而稳定的金属,它们在现代工业和建筑方面都有着广泛的应用。
硅是一种电子元素,在现代电子工业中有着非常重要的作用。
第四周期包含了18个元素,其中比较有名的元素有钾、钙、钪、铁、铜、锌、银以及氩等元素。
这些元素在生活中都有着广泛的应用。
比如,钙和铁是人体中必需的元素,锌则是一种非常重要的工业材料。
氩是一种惰性气体,在现代科学研究中有着广泛的应用。
第五周期包含了18个元素,其中比较有名的元素有硒、钒、钼、铬、锰、铁、镍、铜、锌以及氩等元素。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
这张前人的 心血凝结成的元素周期表吧!
1-18号元素原子结构 示意图
原子序数: 按照元素在 周期表中的顺序 给元素编号 这个编号就 是原子序数
你发现原子序数与原子结构之间的关 系了吗? 原子序数= 核电荷数 = 质子数 = 核外电子数
学习方法探究
巧记“族”
十八纵行十六族
一八一0有规律
八九十列成Ⅷ族 每逢ⅡⅢ分主副
镧系锕系各十五
都在Ⅲ副里面住
探究四、元素周期表中周期与族的位置关系 2 10 18 36 54 86 118
知识拓展:据稀有气体元素定位 稀有 原子 每周期元 周期数 气体 序数 素种类 2 He 2 1 例:现有115号 8 Ne 10 2 元素,请推测它 8 Ar 18 3 在元素周期表中 的位置。 18 Kr 36 4 18 Xe 54 5 第 七 周期 32 Rn 86 6 第 ⅤA 族 118 32 7
门捷列夫
Mendeleev
门捷列夫的第一张元素周期表 你发现了 什么? 排列的 基本顺序 相对原子质 量由小到大 横行: 化学性质相 近的元素 揭示了化学元素 间的内在联系, 是化学发展史上 的重要里程碑
Ga
门捷列夫在排列元素周期表时,发现某 些元素的位置跟信念中的周期性矛盾时,他 是怎么做的呢? 他敢于怀疑某些元素的原子量测错了, 敢于改正某些元素的化合价,敢于为某些没 发现的元素留下空位,也敢于违背原子量递 增的少数个例。 这说明:正确的世界观对于发现和发 明有多么深刻的指导性的意义。历史证明 了门捷列夫的正确性。
观察,可得A是氮元素
7N 8OS
练习:
1.已知碳元素、镁元素和溴等主族元素 的原子结构示意图:
它们分别位于周期表的什么位置?
由电子层数决定,每一个横行为一个周期
除第一周期外,其余周期均是由金属元 素过渡到非金属元素,最后是0族元素。
看看周期,完成下表 三短、四长 周期 周期 起止元素 类别 序数 1 H—He 短 周 2 Li—Ne 期 3 Na—Ar 4 K—Kr 长 5 Rb—Xe 周 6 Cs—Rn 期 7 Fr—112号 起止原 元素 电子 子序数 种数 层数 1—2 2种 1 3—10 8种 2 11—18 8种 3 19—36 18种 4 37—54 18种 5 55—86 32种 6 87—112 26种 7
探究四、元素周期表中周期与族的位置关系
探究四、元素周期表中周期与族的位置关系
探究四、元素周期表中周期与族的位置关系 应用: 同周期ⅡA、ⅢA原子序数之间的关系
ⅡA、ⅢA
周期数 原子序数 相差 2、3 4、5 1 11
6、7
25
探究四、元素周期表中周期与族的位置关系 应用: 同主族相邻元素原子序数之间的关系
门捷列夫的元素周期表
你又发现什么? 4、5、6三个横行均有两行 感觉不太直观 排列的基本顺序 相对原子质量由小到大 纵行 化学性质相近的元素 科学在不断的发展,人类开始进行原 子结构的探索,当原子结构的奥秘被发 现后:
第一部分 元素周期表
其它形式的元素周期表
其它形式的元素周期表
其它形式的元素周期表
A.①②③
C.②③④
B.①②③④
D.①②④
X和Y均为短周期元素, 已知aXn-比bYm+多 两个电子层, 则下列说法正确的是( A C ) A.b<5
B. X只能位于第三周期
C.a+n-b+m=10或16 D. Y不可能位于第二周期
练习与思考: 1、推算原子序数为6、13、34、53、88 的元素在周期表中的位置。 原子 序数 6 2 IVA 13 3 34 4 53 5 88 7 IIA
请你探究下列问题 探究一、元素周期表的编排原则 元素排列的总顺序 原子序数递增 每个 共同点 电子层数相同 横行 递变性 从左至右,原子序数递增 每个 共同点 (基本上)最外层电子数相同 纵行 递变性 从上到下,电子层数递增
每个 共同点 电子层数相同 横行 递变性 从左至右,原子序数递增 探究二、周期 在周期表中,把电子层数相同 的元素,按原子序数递增的顺序从 左到右排成的横行称为周期(教材4页)
周期 族
IIIA VIA VIIA
练习与思考:
2、下列各表为周期表的一部分(表中为原 D 子序数),其中正确的是( ) 3 4 (B) 2 (A) 2 11 10 11 19 18 19 6 6 (C) 11 12 13 (D) 14 24 31 32 7
练习与思考:
3.在短周期元素中,原子最外电子层只有 1个或2个电子的元素是 (D ) A.金属元素 B.稀有气体元素 C.非金属元素 D.无法确定为哪一类元素
铜梁中学校 左先群
课程三维目标 [知识技能] 1.掌握元素周期表的结构,原子结构与 元素在周期表中的位置关系 2. 知道金属、非金属在元素周期表中的 位置及其性质的递变规律 3. 知道元素、核素、同位素的涵义 [过程与方法] 阅读、比较、分析、归纳、 信息处理、实验验证 [情感态度] 1.养成从现象看本质的良好的科学习惯 2.体验由量变到质变的自然规律
每个 共同点 (基本上)最外层电子数相同 纵行 递变性 从上到下,电子层数递增 探究三、族 第8、9、10三个纵行叫第Ⅷ族, 其余每个纵行各为一族 元素周期表中有18个纵行,分为16个族 探 族 究 第Ⅷ族 0族 主族 族序数后标A 副族 族序数后标B
十六个族
七个主族 七个副族 0族 第Ⅷ族
由长周期元 只由长周 由稀有气 周期表中从 素和短周期 期元素构 体元素构 左向右第 元素共同构 成 ⅢB~ 成,位于周 8,9,10三个 期表中第 纵行的元素 成ⅠA~ⅦA ⅡB 构成 18纵行 排列顺序ⅠA ⅡA ⅢB ⅣB ⅤB ⅥB ⅦB Ⅷ ⅠB ⅡB ⅢA ⅣA ⅤA ⅥA ⅦA 0
你知道吗?它们也有小名喔。
第ⅠA族(除H) 第ⅡA族 第ⅢA族 第Ⅳ族 第ⅤA族 第ⅥA族 第ⅦA族 0族 碱金属 碱土金属 硼族元素 碳族元素 氮族元素 氧族元素 卤族元素 稀有气体元素
两种短周期元素组成的化合物中,原子 个数比为1:3,若两元素的原子序数分别为 a和b,则a和b的关系可能为 ① a=b+5 ② a+b=8 ③ a+b=30 ④ a=b+8,下列那个 组合是正确的( ) B
练习与思考: 第三周期第IVA族的元素原子序数是:14 Na元素的原子序数为11,相邻的同族元素 的原子序数是: 3、19 短周期元素中,族序数=周期序数的元素 有: H、Be 、 Al 族序数等于周期序数2倍的元素有:C S Li、Ca 周期序数=族序数2倍的有:
练习与思考:
A、B、C是周期表中相邻的三种元素, 其中A、B是同周期,B、C是同主族。此三 种元素原子最外层电子数之和为17,质子 数之和为31,则A、B、C分别为什么元素?
周期 之间
二三 三四 四五 五六 六七
ⅠA ⅡA 8 8 18 18 32
ⅢA~ ⅦA
8 18 18 32 32
探究五、元素周期表中的相关信息 元素符号 原子序数 红色表示 17 Cl 放射性元素 元素名称 氯 3s23p5 注*的是 外围电子层排布 加括号指 人造元素 35.45 可能的电子 层排布 相对原子质量 加括号的数据为该放射性元素半衰 期最长同位素的质量数
课前预习内容 一、元素周期表 原子序数、核电荷数、质子数、 周期、族、 二、元素的性质与原子结构 碱金属元素、卤族元素性质的相似性 和递变性
三、核素 核素、同位素、质量数、
琳 琅 满 目 的 物 质 世 界
丰富多彩的物质世界是由一百多种元 素组成的,这些元素有着不同的性质。 面对这一百多种不同的元素,我们怎 么样才能更好的认识他们呢? 1869年,俄国化学家门捷列夫就开始 做这件事了。
4.下列说法中正确的是( C ) A.每一周期的元素都是从碱金属开始, 最后以稀有气体结束 B.同一周期中(除第一周期外),从左到 右,各元素原子核的电子数都是从1个逐 渐增加到8个 C.第二、三周期上下相邻元素的原子 核外电子数相差8个 D.第七周期只有23种元素
5.某元素X,它的原子最外层电子数是次 外层电子数的2倍,则X在周期表中位 于( )A C • A.第二周期 B.第三周期 • C.ⅣA族 D.ⅥA族
