肿瘤相关循环内皮细胞的分类标志物及其功能研究进展
循环内皮细胞的研究新进展

伤部位 的 内皮 细胞通 过局部 的迁徙 和增殖来进行
1 E C C的概念及研究进展
c C是 指外 周血 中测得 的血 管 内皮 细 胞 E ( C, Ⅵ、 ) 其数量的变化可反映血管内皮受损的程
等肿瘤细胞分泌物和系统调节因子能够刺激内皮 细胞产生 或表达 与循环肿 瘤细胞 相互作用 的表面
粘附分子 。被损 坏 的内皮 细胞将 释放使基 底膜退 化 的蛋 白酶 , 从而 使循环 肿瘤细 胞更容 易播 散 , 最 终释放 出更多变 成循环 内皮 细胞 的内皮 细胞进入
血液 。
循环 内皮细 胞起 源的另 一观点起 于 19 97年 , A aaa shr 等描述 了循环 内皮 前 体 细胞 [] 这些 细 1, 5
度 , 目前唯一 可作为 活体组 织 中反 映 V C损 伤 是 E 的直接而特异 的标 志物 L J 目前较 公 认 的循 环 2 。 内皮 细胞 的定 义 , 是 在 外 周 血 中表 达 C 4膜 就 Dl 6
修复的。在肿瘤中 , 血管 内皮细胞提供 了原发肿 瘤块生长所需 的补 给营养素。在转移癌病人体 内 , 环肿瘤 细胞在 进 入 ( 入 ) 循 渗 和离 开 ( 出 ) 渗 循 环系统时与内皮细胞相互作用。当毛细血管血流 量降低时 , 这种相互作用很可能在毛细血管发生 , 此时循环 肿 瘤 细 胞 与 内皮 细胞 相 毗邻 [-J 1 。诸 34
如细胞 因 子 , 肿瘤 坏 死 因子 一, 血 酶 和 内毒 素 a凝
糖蛋 白, 在正常人血中数量极少 , 而在炎症 、 免疫 应答 、 感染 、 肿瘤 形成 和心血管 疾病 等情况数 量可
肿瘤相关抗原及抗体作为肿瘤标志物的研究及应用现状_管星

诊断与预后中的应用发展迅速,巨大的潜力开发为肿瘤常规诊断方法。
【关键词】 肿瘤相关抗原; 自身抗体; 早期诊断
doi: 10. 3969 / j. issn. 1004 - 7484( x) . 2013. 04. 075
文章编号: 1004 - 7484( 2013) - 04 - 1691 - 02
肿瘤标志物大致分为以下几类: 癌胚性抗原; 肿瘤相关抗原及相应自身 抗体、激素、受体、酶及同工酶、血清或组织蛋白、癌基因及其产物、多胺等其 他生物分子。其中发展最为迅速的为肿瘤相关抗原( Tumour - associated antigens,TAAs) 及肿瘤相关抗体( Tumour - associated antibodies,TAbs) 。 3 肿瘤相关抗原及自身抗体
use of negative pressure wound therapy in traumatic wounds and reconstructive surgery: steps towards an international consensus[J]. Injury, 2011,42( S1) : S1 - 12. [11] 韩焱福,徐光,周京志,刘静,吕岳. 负压创面治疗结合植皮术修复糖 尿病足溃疡的临床研究[J]. 中国美容医学,2012,21( 10) : 88 - 90. [12] 张诚,杨金存,冯永强,王海涛,李霞,陈宁杰. 联合 bFGF 的负压创面 治疗技术在难治性 压 力性 溃疡治 疗中的 应用[J]. 中华医学杂志, 2012,92( 40) : 2862 - 2864.
参考文献 [1] TseJK,CarltonRM,周常青译. MillerMS 美国负压创面治疗技术[M]. 北
肿瘤内皮细胞在血管新生中的作用及其机制

肿瘤内皮细胞在血管新生中的作用及其机制肿瘤是一种常见的疾病,而血管新生是肿瘤发展过程中非常重要的一环。
肿瘤内皮细胞就是在这个过程中起到关键作用的细胞类型之一。
本文将介绍肿瘤内皮细胞在血管新生中的作用以及其机制。
一、肿瘤内皮细胞的特点及其在血管新生中的作用肿瘤内皮细胞是一种具有内皮细胞特征的细胞类型,由内皮前体细胞转化而来。
它们表达了内皮细胞标志物,如CD31、CD144等,但很少表达内皮细胞的功能分子,如抗凝血因子和纤溶酶原激活因子等。
大量研究表明,肿瘤内皮细胞在肿瘤血管形成中起到重要作用。
首先,肿瘤内皮细胞是肿瘤血管形成的起始细胞。
肿瘤内皮细胞源自肿瘤干细胞和肿瘤细胞,它们能够表达肿瘤微环境中的各种生长因子,如VEGF、bFGF等,这些生长因子可以通过自分泌或是作用于周围细胞来促进肿瘤内皮细胞的生长和增殖。
同时,肿瘤内皮细胞还可以分泌胶原酶等降解基质的酶类,促进肿瘤内皮细胞侵入周围组织,形成新的血管。
其次,肿瘤内皮细胞参与了肿瘤新血管的稳定。
肿瘤内皮细胞和周围的基质相互作用,形成稳定的肿瘤血管。
同时,肿瘤内皮细胞还能合成和分泌基质蛋白,如胶原、纤维连接蛋白等,支持血管的完整性与稳定性,使其具有正常血管的结构和功能。
此外,肿瘤内皮细胞还能与周围肿瘤组织细胞交流,从而影响肿瘤细胞的分化、增殖、转移等病理过程。
二、肿瘤内皮细胞参与血管新生的机制肿瘤内皮细胞参与肿瘤血管新生的机制十分复杂,涉及许多生物学过程。
在这里,我们将主要介绍以下几点。
首先,肿瘤内皮细胞通过VEGF信号通路参与肿瘤血管新生。
VEGF是肿瘤生长过程中的一个重要因子,能够促进血管内皮细胞增殖和迁移,从而促进肿瘤新血管的形成。
肿瘤内皮细胞可以通过表达VEGF信号通路中的受体,如Flt-1和KDR,来响应VEGF的信号,从而促进血管新生。
其次,肿瘤内皮细胞可以通过HIF-1α信号通路参与肿瘤血管新生。
HIF-1α是一个重要的调节因子,能够调节氧气供应、血管生成和代谢等生物学过程。
EMT标志物:循环肿瘤细胞分类新依据
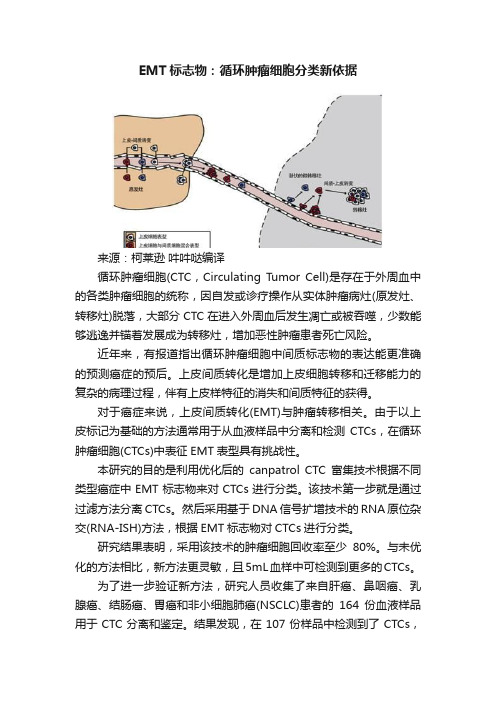
EMT标志物:循环肿瘤细胞分类新依据来源:柯莱逊吽吽哒编译循环肿瘤细胞(CTC,Circulating Tumor Cell)是存在于外周血中的各类肿瘤细胞的统称,因自发或诊疗操作从实体肿瘤病灶(原发灶、转移灶)脱落,大部分CTC在进入外周血后发生凋亡或被吞噬,少数能够逃逸并锚着发展成为转移灶,增加恶性肿瘤患者死亡风险。
近年来,有报道指出循环肿瘤细胞中间质标志物的表达能更准确的预测癌症的预后。
上皮间质转化是增加上皮细胞转移和迁移能力的复杂的病理过程,伴有上皮样特征的消失和间质特征的获得。
对于癌症来说,上皮间质转化(EMT)与肿瘤转移相关。
由于以上皮标记为基础的方法通常用于从血液样品中分离和检测CTCs,在循环肿瘤细胞(CTCs)中表征EMT表型具有挑战性。
本研究的目的是利用优化后的canpatrol CTC富集技术根据不同类型癌症中EMT标志物来对CTCs进行分类。
该技术第一步就是通过过滤方法分离CTCs。
然后采用基于DNA信号扩增技术的RNA原位杂交(RNA-ISH)方法,根据EMT标志物对CTCs进行分类。
研究结果表明,采用该技术的肿瘤细胞回收率至少80%。
与未优化的方法相比,新方法更灵敏,且5mL血样中可检测到更多的CTCs。
为了进一步验证新方法,研究人员收集了来自肝癌、鼻咽癌、乳腺癌、结肠癌、胃癌和非小细胞肺癌(NSCLC)患者的164份血液样品用于CTC分离和鉴定。
结果发现,在107份样品中检测到了CTCs,并且3个CTC亚型是采用EMT标志物得到鉴定的,包括上皮CTCs、生物学表型上皮/间充质CTCs和间充质CTCs。
与癌症的早期阶段相比,在不同类型癌症的转移阶段通常会检测到间充质CTCs。
循环肿瘤微栓子(CTM)与间质表型也在肿瘤的转移阶段被检测到。
通过EMT标志物对CTCs分类有助于识别更多浸润性的CTC亚型,为临床探讨提供了一个有用的证据。
该方法适用范围广,可用于不同类型的癌症。
内皮细胞在肿瘤血管形成中的作用

内皮细胞在肿瘤血管形成中的作用随着人们对肿瘤研究的深入,越来越多的细胞类型被纳入其中。
内皮细胞是肿瘤形成过程中重要的一种细胞类型,它在肿瘤血管的形成中发挥着重要的作用。
本文将着重探讨内皮细胞在肿瘤血管形成中的工作机理以及其在肿瘤治疗中的潜在应用。
一、内皮细胞的概述内皮细胞是一种衬于血管内壁的细胞,主要作用是构成血管的内层。
内皮细胞形态多样,有扁平、类似平滑肌细胞或表面被伪足笼罩、有丰富突起等。
内皮细胞可以通过血管内皮生长因子(VEGF)、FGF等多种细胞因子对血管壁进行重建和修复。
此外,内皮细胞还可以分泌多种降钙素家族的生长因子,可以出现在肺泡的鳞状上皮和肺泡树丛顶端形成的血管中。
内皮细胞正常生理功能的调节不仅仅只是中心舒张作用,而和多种生物活性物质的合成相互作用密不可分。
二、内皮细胞在肿瘤血管形成中的作用肿瘤血管形成又称肿瘤新生血管形成,是肿瘤形成的重要基础之一。
为了延续肿瘤的生长,肿瘤需要依赖新生血管向其组织和细胞供应氧气和营养物质。
而内皮细胞在这个过程中扮演着重要的角色。
一方面,内皮细胞可以受到肿瘤细胞、炎症细胞等诸多因素的诱导,产生大量VEGF等血管生成因子,从而启动新生血管的形成。
另一方面,内皮细胞可以通过分泌多种基质金属蛋白酶等蛋白质酶降解周围基质,为新生血管提供顺利生长的生理环境。
此外,内皮细胞还可以与成纤维细胞等肿瘤周围细胞相互作用,进一步促进肿瘤新生血管的形成。
三、内皮细胞在肿瘤治疗中的应用前景由于内皮细胞在肿瘤血管形成中的重要作用,科学家们希望可以针对这一过程进行针对性的治疗。
近年来,多项研究发现,通过控制内皮细胞自身特性的表达,可以有效地控制肿瘤新生血管的发生。
例如,一些药物可以抑制肿瘤细胞向内皮细胞的诱导,从而降低肿瘤新生血管的形成;而另一些药物可以直接靶向调控内皮细胞代谢和增殖,从而有效抑制肿瘤新生血管的发生。
这些研究为探索更有效的肿瘤治疗手段提供了新的思路和方向。
总之,内皮细胞在肿瘤血管形成中扮演着重要的角色。
肿瘤相关循环内皮细胞的分类标志物及其功能研究进展

d p r e d ic t o
—
o
f tre
.
a
tm
e n
t
f f ic
a c
y
I n t h is
r e v ie w
,
w e
c u s s
the
c la s s
—
t io
m a rke rs
a n
d fu
A
n n
t io
f tu
m o r re
la t e d C E C s g
e n e s
( Cir c u la t in
g
e n
临床之 亟 需
1
。
do the lia l
c e
lls
,
CE Cs )
,
包括源 于现有
ito
成熟
CE Os
标 志物
呈 CD4 5
、
血 管 壁 的 成 熟 内 皮 细 胞 和 源 于 骨 髓 的 内皮 祖 细 胞
成熟
CD l l 7 CD34
FR
一
CE Cs
CD 3
2009
年第 3 6 卷第 6 期
中国 肿 瘤临 床
。
353
综
述
肿 瘤 相 关 循 环 内皮 细 胞 的 分 类 标 志 物 及 其 功 能研 究进 展 术
摘要
皮 细 胞 (c
ir c
u
经 典肿瘤新 生血
la tin g
e n
管 的 形 成 主 要 包括 血 管 生 成 ( a
c e
n
g io g e
s s
R
e c e n c u
CellSearch系统检测循环肿瘤细胞及其分子标记的研究进展

1
1. 1
CellSearch 系统简介
肿瘤微环境中血管生成和内皮细胞的研究

肿瘤微环境中血管生成和内皮细胞的研究肿瘤是一种细胞异质性很高的疾病,其微观结构中的一些关键非血管成分,如肿瘤细胞、间质细胞、炎性细胞和免疫细胞,被称为肿瘤微环境。
良性和恶性组织的血管形态和功能都会受到肿瘤微环境的影响,并对其生长和进展产生重要影响。
肿瘤来源的异常血管生成是一种常见现象,在私人和公共疾病中起着关键作用。
肿瘤依赖于血管(在通常情况下)来提供其生存所需的氧、营养和内分泌通信,因此,肿瘤组织中的血管形态和功能是非常重要的。
在肿瘤血管形成的早期阶段,动脉-静脉畸形形成,这种形态常常是不稳定和流量不足的,可以通过可能带来更具侵略性的结构调整。
内皮细胞是血管壁的主要组成部分之一,其结构和功能决定了血管系统的生物学特性。
在肿瘤微环境中,内皮细胞代表一种重要的谋略,支撑肿瘤生长的供血功能和管壁稳定性。
内皮细胞的增生和分化被认为是肿瘤血管生成的关键过程,因为内皮细胞和外周血管是血管生成过程中的关键组成部分。
近年来,越来越多的研究表明,肿瘤微环境中的生理、生化及机械直接影响了血管生成,这实际上是通过影响血管内皮细胞的功能和数量来实现。
肿瘤细胞和间质细胞的散发活力是通过释放一系列生长因子和细胞因子来促进肿瘤血管生成的。
正如细胞迁移和增殖是肿瘤组织生成和扩散的动态过程一样,肿瘤血管生成也不断变化,从未真正被完全修改或中断。
通过研究癌症领域的动态治疗和新药开发,神经瘤关键词,如生长因子,炎性因子,低氧和体液动力学的作用正在增强。
在糖尿病和高血压等慢性心血管病方面的研究已经发现,内皮细胞的活性对于维护血管稳定至关重要。
在肿瘤微环境中,肿瘤细胞释放的各种因素可以直接影响内皮细胞的数量和活力,从而影响肿瘤血管生成。
例如,Vegf是一种重要的生长因子,可以直接促进内皮细胞的分化和增生。
因此,内皮细胞在肿瘤微环境中的作用被认为是不可或缺的,并且正在为新型肿瘤治疗方法的开发提供重要的借鉴和灵感。
总之,近年来,肿瘤微环境中血管生成和内皮细胞的研究得到了越来越多的关注。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2009年第36卷第6期中国肿瘤临床・353・・综述。
肿瘤相关循环内皮细胞的分类标志物及其功能研究进展:l:摘要经典肿瘤新生血管的形成主要包括血管生成(angiogenesis)和血管发生(vaseulogenesis)、均依赖循环内皮细胞(circulatingendothelialcells,CECs)的增殖、迁移、黏附而形成管腔。
CECs不仅与血管新生和肿瘤生长、播散有关,还可能作为抗血管生成药物的靶点和反映疗效的标志物。
循环内皮细胞膜上可表达多种表面分子,在从幼稚到成熟及活化过程要经历不同的阶段,而不同阶段细胞表达的表面分子有所不同。
各表面分子在肿瘤血管新生过程中发挥重要作用。
监测可靠的分子标志物量化CECs尤其是活化血管内皮细胞(activatedcirculatingvascularendothelialcells。
aCECs),来判定肿瘤新生血管和血管靶向治疗的疗效具有重要意义且已成为临床上的迫切需要。
本文就肿瘤相关循环内皮细胞的分类、标志物及其功能做一综述。
关键词血管生成血管发生循环内皮细胞内皮祖细胞doi:10.3969/j.issn.1000-8179.2009.06.014RecentProgressinClassification.MarkersandFunctionofTumor-relatedCirculatingEndothelialCellsXUWenjing,LIKaiCorrespondingauthor:LIKai,E-mail:likai5@medmail.com.cnDepartmentofThoracicOncology,CancerInstituteandHospitalofTianjinMedicalUniversity,Tianjin300060,ChinaGrantsupport:WUJieping’sFoundationSpecialforClinicalResearch(No.04101002)AbstractTwomajorprocessesbywhichtumorbloodvesselsaredevelopedandremodeledarebasedontheproliferation,migration,andadhesionofcirculatingendothelialcalls(CECs).CECsthereforecontributetotumorneovasculogenesisandpossiblytotheprogressionandmetastasisoftumors.CECsarepossibletar-getsforantiangiogenictherapyandpredictorsoftreatmentefficacy.Inthisreview。
wediscusstheclassifica-tion.markersandfunctionoftumor-relatedCECs.KeywordsAngiogenesis;Vasculogenesis;Circulatingendothelialcells(CECs);Endothelialprogenitorcalls(EPCs)外周血巾的血管内皮细胞称为循环内皮细胞(Circulatingendothelialcells,CECs),包括源于现有血管壁的成熟内皮细胞和源于骨髓的内皮祖细胞或内皮前体细胞(endothelialprogenitorcells,EPCs)。
成熟CECs由正常组织血管的内皮细胞经肿瘤分泌的促血管生成凶子激活后进入循环中形成,转变为“活化内皮细胞”(activatedcirculatingvascularendotheliMcells,aCECs),脱落到皿中并迁移到肿瘤部位,参与形成新生血管。
另一部分CECs从EPCs分化而来,经历了从幼稚到成熟、活化的不同阶段,表达不同标志。
aCECs是形成新生血管的主要成分,在肿瘤生长中起重要作用。
故了解其特异标志,以监测血管内皮细胞水平可能有助于反映新生血管生成状态及预测抗血管生成疗效,已成为临床之亟需。
1成熟CECs标志物‘成熟CECs呈CD45、CD3、CD4、CDl4、CDllh、CDll7、CDl33等阴性表达和CDl46、CDl05、CD31、CD34、CDl44、CD54、CDl06、vWF、CD62E、VEG--FR一2等阳性表达¨-s]。
其中活化的血管内皮细胞(aCECs)呈CD45一、CDl46+、CD54+、CD62E+、CDl05+或CDl06+等表达¨’4】。
1.1共有标志1.1.1CDl46又名P1H12、S—Endo一1,是粘附分子,表达于所有【ffL管内皮细胞、内皮祖细胞、脐血前体细胞和内皮细胞、活化的T淋巴细胞和间充质干细胞等f5J】。
尽管其无特异性,但可与CD31等阳性表达及泛白细胞标志物、造血干细胞标志物等阴性・本文课题受吴阶平基金会临床科研专项基金资助(编号:04101002)通讯作者:李凯likai5@medmail.corn.cn・354・中国肿瘤临床2009年第36卷第6期表达一起用于识别CECsf7】,即:CDl46+CDl05+CD3l+CD34+CDl44+CD54+CDl06+vWF+CD62E+VEGFR一2+CD45一CD3一CD4一CDl4一CDllb—CDll7一CDl33一。
1.1.2CDl44内皮特异性黏附分子VE一钙黏素(VE—cadhe6n/cadhefin一5/CDJ44),表达于肿瘤新生血管内皮细胞,介导细胞问作用、维持单细胞层的完整。
Martin等【8】报告,乳腺癌组织中的CDl44水平与微血管密度呈正相关。
1.1.3CD31血小板内皮细胞黏附分子(PECAM—I/CD31),主要表达于血小板、白细胞和内皮细胞,在骨髓干细胞、EPCs及巨核细胞系亦有表达,参与介导肿瘤细胞黏附于内皮细胞。
肿瘤内CD31标记的微m管密度与肿瘤生长及转移有相关性,但其与巨噬细胞有交叉反应,故不作为内皮细胞特异性标志物。
1.1.4vWF血管性血友病因子(vonWillebrandFactor,vwF),由血管内皮细胞和巨核细胞产生、是内皮细胞受损的重要标志物,但在淋巴管内皮细胞上也有表达,故缺乏特异性。
1.2活化标志1.2.1CDl05主要存在于内皮细胞的血管腔面一侧,在增殖活跃的肿瘤内皮细胞I|1也呈强表达。
在正常基质细胞、活化单核细胞、胎儿B细胞等表面弱表达。
CDl05能特异结合其配体转化生长因子一B(TGF—B)、改变信号转导、对抗TGF—p1对内皮细胞的增殖抑制作用、促进肿瘤血管生成,还町使肿瘤细胞逃避TGF—B1的抑制、促进侵袭转移【91。
CDl05表达于内皮细胞膜卜且与增殖标志(如cyclinA和Ki一67)相关,与泛内皮标志物(CD31、CD34、vWF等)相比,CDl05能更准确地反映内皮细胞增殖h0。
微血管密度与免疫组化染色方法分析证实,其在肿瘤组织新生血管内皮细胞巾的染色密度大于对照组织,提示町作为大多数肿瘤新牛血管标志。
在原发或转移乳腺癌中,血浆SCDl05水平显著升高并在化疗后降低,故可作预测恶性肿瘤复发、转移的危险性¨1‘。
1.2.2CD62E内皮细胞选择素(Endothelium—se—lectin或CD62E),主要在血管内皮细胞上表达。
CD62E可诱导白细胞向活化血管内皮表面滚动、与内皮细胞黏附、促进炎症反应。
另外,CD62E可激活MAPK(mitogen—activatedproteinkinase)级联效应、导致c—fos等多种促炎基冈表达上调。
CD62E在肿瘤转移中可能介导肿瘤细胞黏附于血管壁。
可溶性CD62E(sCD62E)在结直肠癌周血管内皮细胞中高表达、与肿瘤侵袭明硅相关。
Takahashi等¨21发现,在结直肠癌肝转移的血清标本中,sCD62E的特异性及敏感性综合指标均超过CEA和CAl99。
文献报告,肿瘤患者总CECs和aCECs数量与ELISA法检测的血清sCD62E浓度呈正相关,可作为aCECs特异性标志物。
1引。
1.2.3CD54。
细胞问黏附分子一1(ICAM一1/CD54),表达于内皮细胞。
与其配体淋巴细胞功能相关抗原一l(LFA一1)结合介导白细胞与血管内皮细胞的黏附、促进炎症发生与发展。
促进肿瘤转移的机制可能为:1)促进血管内游离的癌细胞与靶器官的血管内皮细胞黏附;2)影响肿瘤细胞从血管内向血管外游fH。
亦有研究认为其协助肿瘤细胞逃避T细胞的免疫监视,进而逃避免疫攻击。
Kaihara等【141报告,在胃癌患者血清中CD54含量比正常人高且其升高与肿瘤发展程度相关。
亦有研究显示¨5‘,肺癌血清中可溶性ICAM一1(sI—CAM一1)水平明显升高,与临床分期和肿瘤进展有关。
1.2.4CDl06血管细胞黏附分子一1(VCAM一1/CDl06),主要表达于血管内皮细胞膜、特别是aCECs表面,介导白细胞与血管内皮细胞紧密结合、在跨膜迁移中起关键作用。
CDl06在肿瘤转移中可能介导了肿瘤细胞黏附于血管壁的过程。
研究显示【l引,TNF—Ot作用6h后HUVEC细胞的CDl06表达显著升高,其机制可能与激活NF—KB信号传导有关。
在多种恶性肿瘤中,其血浆浓度可升高。
有报道认为,sVCAM一1可作为乳腺癌、胃癌,结直肠癌和泌尿系统恶性肿瘤等的预后指标。
1.2.5CD248主要表达于结肠癌、肺癌等多种恶性肿瘤的微血管内皮细胞,在较大的肿瘤血管、正常组织的血管和淋巴管内皮细胞上不表达或弱表达。
可能介导细胞间作用、参与信号转导、调节活化成纤维母细胞等增殖及迁移、促进肿瘤新生血管生成¨引。
Welt等研究发现,113I标记的抗CD248单克隆抗体(抗CD248mAb)浓聚存结直肠癌肝转移患者的病灶中。
综上所述,成熟CECs具有两类标志物:共有标志可表达于所有成熟CECs,活化标志仅表达于具有增殖、迁移、黏附、管样结构生成等活化功能的aCECs表面。
2内皮祖细胞2.1生物学特征人胚胎期的第15天左右,卵黄囊胚外中胚层内会出现许多血岛,血岛外周是扁平状的成血管细胞即早期EPCs。
它们可分化成原始血管内皮细胞,血岛中央的球形细胞为造血干细胞(hematopoietic2009年第36卷第6期肿瘤相关循环内皮细胞的分类标志物及其功能研究进展・355・stemcells,HSCs),分化成原始血细胞。
此时的EPCs与HSCs具有相同的细胞表面抗原如Flk一1、Tie一1、Tie_2¨副(angiopointin受体)、CD34和CDI17等。
