2021届(2020题)年高考化学试题分类汇编---有机化学
2020-2021学年度高三下学期总复习化学专题精品试题 专题二十一 有机化学基础 (含答案)

2020-2021学年度高三下学期总复习化学专题精品试题专题二十一有机化学基础【满分:100分】非选择题(本题共8题,100分。
)1.(12分)丁二酸二乙酯()是重要的增塑剂和液体润滑剂。
以乙烯为起始物质,制备丁二酸二乙酯的合成路线如下:(1)反应①的反应类型为,B的化学名称是。
(2)C的结构简式为,丁二酸二乙酯的官能团名称是。
(3)G为八元环状化合物,G的结构简式是。
(4)反应⑤的化学方程式为。
(5)能发生银镜反应,能与碳酸钠反应生成且分子内能发生酯化反应的D的同分异构体有种。
(6)根据上述合成路线,设计由丙醇合成2–甲基丙酸()的合成路线。
2.(14分)有机物Ⅰ()是一种新型感光高分子化合物,工业上合成它的一种路线图如下,图中C、D也是高分子化合物且D具有强的亲水性,反应①中发生了加成反应,烃E的质谱图中质荷比最大值为92,G能发生银镜反应。
又知同一个碳原子上若连接有2个或3个羟基时,自动脱去一个水分子。
(1)A的结构简式为,E的名称是,③的反应类型是。
(2)B中官能团的名称是,C的结构简式为。
(3)写出反应④的化学方程式:。
(4)X是H的芳香族同分异构体,X具有如下性质,能发生银镜反应且与足量银氨溶液反应时可得到,则X共有种,写出一种核磁共振氢谱有4组峰的同分异构体的结构简式:。
(5)以乙苯、乙炔为基本原料制备苯乙酸乙烯酯(),写出其合成路线图。
3.(12分)高分子化合物G是一种液晶材料,其合成路线如下:已知:卤代烃与或反应生成胺。
回答下列问题:(1)A的化学名称是。
(2)下列与B互为同分异构体,且结构中含有手性碳原子的是(填标号)。
A.B.C.D.(3)②的反应类型是,⑤的反应类型是。
(4)C的结构简式是。
(5)芳香族化合物X与E是同分异构体,且X能发生银镜反应,则X有种。
(不包括酯类)(6)设计以甲苯为原料制备对氨基苯甲酸树脂()的合成路线。
4.(11分)“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。
2020-2021高考化学 有机化合物推断题综合试题及答案

2020-2021高考化学 有机化合物推断题综合试题及答案一、有机化合物练习题(含详细答案解析)1.I.A ~D 是四种烃分子的球棍模型(如图)(1)与A 互为同系物的是___________(填序号)。
(2)能使酸性高锰酸钾溶液褪色的物质是_____________(填序号)。
(3)D 和液溴反应的化学方程式是_____________。
Ⅱ. 某些有机物的转化如下图所示。
已知A 的产量可以用来衡量一个国家的石油化工水平,D 是食醋的有效成分。
请回答下列问题:(4)A 中官能团的名称是______________。
(5)B 的结构简式为_________________。
(6)反应③的化学方程式为__________________。
【答案】C B +Br 23FeBr −−−→ +HBr 碳碳双键 CH 3CH 2OH 或C 2H 5OH3323232CH COOH CH CH OH CH COOCH CH H O 浓硫酸加热++垐垐?噲垐? 【解析】【分析】I.由球棍模型可知,A 为甲烷,B 为乙烯,C 为丁烷,D 为苯;结合同系物的概念和乙烯与苯的性质分析解答(1)~(3);Ⅱ. A 的产量可以用来衡量一个国家的石油化工水平,则A 为CH 2=CH 2,与水在一定条件下发生加成反应生成CH 3CH 2OH ,乙醇在Cu 作催化剂条件下发生氧化反应CH 3CHO ,CH 3CHO 可进一步氧化生成CH 3COOH ,CH 3CH 2OH 和CH 3COOH 在浓硫酸作用下反应生成乙酸乙酯,据此分析解答(4)~(6)。
【详解】I.由球棍模型可知,A 为甲烷,B 为乙烯,C 为丁烷,D 为苯。
(1) 甲烷、丁烷结构相似,都是烷烃,互为同系物,故答案为:C ;(2)乙烯中含有碳碳双键,能使酸性高锰酸钾溶液褪色,故答案为:B ;(3)苯和液溴反应生成溴苯和HBr ,反应的方程式为 +Br 23FeBr −−−→+HBr ,故答案为: +Br 23FeBr −−−→ +HBr ;Ⅱ. (4)A 为乙烯(CH 2=CH 2),含有的官能团是碳碳双键,故答案为:碳碳双键;(5)B 的结构简式为CH 3CH 2OH 或C 2H 5OH ,故答案为:CH 3CH 2OH 或C 2H 5OH ;(6)反应③为CH 3CH 2OH 和CH 3COOH 在浓硫酸作用下反应生成乙酸乙酯,反应的化学方程式为CH 3COOH+CH 3CH 2OHCH 3COOCH 2CH 3+H 2O ,故答案为:CH 3COOH+CH 3CH 2OH CH 3COOCH 2CH 3+H 2O 。
2020-2021高考化学 有机化合物 推断题综合题及详细答案

2020-2021高考化学有机化合物推断题综合题及详细答案一、有机化合物练习题(含详细答案解析)1.某些有机化合物的模型如图所示。
回答下列问题:(1)属于比例模型的是___(填“甲”、“乙”、“丙”、“丁”或“戊”,下同)。
(2)表示同一种有机化合物的是___。
(3)存在同分异构体的是___,写出其同分异构体的结构简式___。
(4)含碳量最低的是___,含氢量最低的分子中氢元素的质量百分含量是___(保留一位小数)。
(5)C8H10属于苯的同系物的所有同分异构体共有___种。
【答案】乙、丙甲、丙戊 CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4甲、丙 16.7% 4【解析】【分析】甲、丁、戊分别是甲烷、丁烷、戊烷的球棍模型,乙、丙分别是乙烷和甲烷的比例模型。
【详解】(1)乙、丙能表示的是原子的相对大小及连接形式,属于比例模型;(2)甲、丙分别是甲烷的球棍模型与比例模型,属于同一种有机化合物;(3)存在同分异构体的是戊(戊烷),其同分异构体的结构简式CH3CH2CH2CH2CH3、CH3CH(CH3)CH2CH3、C(CH3)4;(4)烷烃的通式为C n H2n+2,随n值增大,碳元素的质量百分含量逐渐增大,含碳量最低的是甲烷,含氢量最低的分子是戊烷,氢元素的质量百分含量是126012×100%=16.7%;(5)C8H10属于苯的同系物,侧链为烷基,可能是一个乙基,如乙苯;也可以是二个甲基,则有邻二甲苯、间二甲苯和对二甲苯三种,则符合条件的同分异构体共有4种。
2.为探究乙烯与溴的加成反应,甲同学设计并进行如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应;乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性气体杂质,由此他提出必须先除去杂质,再让乙烯与溴水反应。
2020-2021学年度高二化学《有机化合物的分类》知识点归纳总结 例题解析
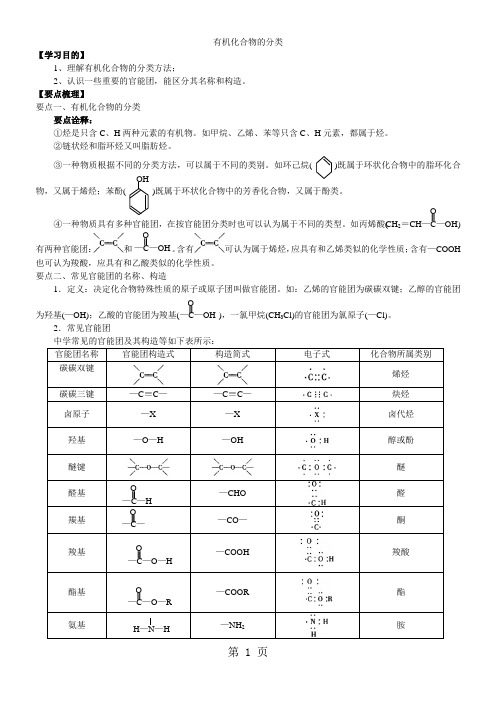
有机化合物的分类【学习目的】1、理解有机化合物的分类方法;2、认识一些重要的官能团,能区分其名称和构造。
【要点梳理】要点一、有机化合物的分类要点诠释:①烃是只含C 、H 两种元素的有机物。
如甲烷、乙烯、苯等只含C 、H 元素,都属于烃。
②链状烃和脂环烃又叫脂肪烃。
③一种物质根据不同的分类方法,可以属于不同的类别。
如环己烷 )既属于环状化合物中的脂环化合物,又属于烯烃;苯酚 )既属于环状化合物中的芳香化合物,又属于酚类。
④一种物质具有多种官能团,在按官能团分类时也可以认为属于不同的类型。
如丙烯酸( )有两种官能团:和 。
含有可认为属于烯烃,应具有和乙烯类似的化学性质;含有—COOH 也可认为羧酸,应具有和乙酸类似的化学性质。
要点二、常见官能团的名称、构造1.定义:决定化合物特殊性质的原子或原子团叫做官能团。
如:乙烯的官能团为碳碳双键;乙醇的官能团 为羟基(—OH);乙酸的官能团为羧基( ),一氯甲烷(CH 3Cl)的官能团为氯原子(—Cl)。
2.常见官能团中学常见的官能团及其构造等如下表所示:官能团名称 官能团构造式构造简式电子式化合物所属类别碳碳双键烯烃 碳碳三键 —C ≡C — —C ≡C —炔烃 卤原子 —X —X 卤代烃 羟基 —O —H—OH醇或酚 醚键醚 醛基 —CHO醛羰基—CO —酮羧基 —COOH羧酸酯基—COOR酯氨基—NH 2胺OHCH 2=CH —C —OHO—C —OH O —C —OH O—C —H O —C — O—C —O —HO—C —O —R OH —N —H要点诠释:①官能团是中性基团,不带电荷。
②官能团决定有机物的主要化学性质,但一样的官能团连接的方式和位置不同,化学性质也有所不同。
③分子中含有两种或两种以上的官能团时,该分子可能具有多方面的性质,假设多种官能团之间互相影响,又可能表现出特殊性质,如羟基与链烃相连时形成的是醇,而直接与苯环相连时形成的是酚。
2020-2021高考化学有机化合物-经典压轴题含答案

2020-2021高考化学有机化合物-经典压轴题含答案一、有机化合物练习题(含详细答案解析)1.酪氨酸是一种生命活动不可缺少的氨基酸,它的结构简式如下:(1)酪氨酸能发生的化学反应类型有________(填字母)。
A.取代反应 B.氧化反应C.酯化反应 D.中和反应(2)在酪氨酸的同分异构体中,同时满足如下三个条件的,除酪氨酸外还有________种。
①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应;③氨基(—NH2)不与苯环直接相连。
(3)已知氨基酸能与碱反应,写出酪氨酸与足量的NaOH溶液反应的化学方程式:___________________。
【答案】ABCD 5【解析】【分析】【详解】(1)该有机物中含有羟基、氨基和羧基,所以具有羧酸、氨基酸和酚的性质,能和羧酸或氨基酸发生取代反应,酚也能发生取代反应;能和氢氧化钠发生中和反应,能与醇发生酯化反应;酚羟基及氨基能发生氧化反应,故答案为ABCD;(2)在酪氨酸的同分异构体中,①属于氨基酸且“碳骨架”与酪氨酸相同;②与氯化铁溶液能发生显色反应则含有酚羟基;③氨基(—NH2)不与苯环直接相连。
同时满足条件,除酪氨酸外还有共5种;(3)酪氨酸与足量的NaOH溶液反应生成和水,反应的化学方程式为:。
2.下图为某有机化合物的结构简式:请回答下列问题。
(1)该有机化合物含有的官能团有_______________(填名称)。
(2)该有机化合物的类别是_______________(填字母序号,下同)。
A .烯烃 B .酯 C .油脂 D .羧酸(3)将该有机化合物加入水中,则该有机化合物_______________。
A .与水互溶 B .不溶于水,水在上层 C .不溶于水,水在下层 (4)该物质是否有固定熔点、沸点?_______________(填“是”或“否”) (5)能与该有机化合物反应的物质有_______________。
全国各地2020┄2021届高三化学试题分类汇编电解质溶液2

2021年各地高三试题汇编(电解质溶液2)2021年高考化学热点测试卷--电解质溶液说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.第Ⅰ卷(共83分)一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.1.1C 、2C 、1α、2α、1][H +、2][H +分别表示两种一元弱酸的物质的量浓度、电离度和溶液中][H +.如果已知21αα>,21][H ][H ++>,则1C 和2C 的关系为( ) A .21C C > B .21C C = C .21C C < D .无法确定2.1L mol 0.1-⋅氨水10 mL ,加蒸馏水稀释到1 L 后,下列变化中正确的是( ) ①电离度增大 ②O]H [NH 23⋅增大 ③+4NH 数目增多 ④][OH -增大 ⑤导电性增强 ⑥O]H [NH ][NH 234⋅+增大 A .①②③ B .①③⑤ C .①③⑥ D .②④⑥3.某一元弱酸溶液中存在22101.9⨯个弱酸分子和21101.0⨯个+H 离子,该酸的电离度为( )A .1.0%B .2.0%C .5.0%D .10.0%4.一元弱酸HCN 在一定条件下电离度为,已知此溶液中有1 mol HCN 分子、则此溶液中溶质微粒的物质的量之和为( )A .mol αα1+B .mol α1α1-+C .mol α21+D .molα1α21-+5.下列说法一定正确的是( )A .强电解质溶液的导电性比弱电解质溶液的导电性强B .4BaSO 投入水中,导电性较弱,故它是弱电解质C .弱电解质溶液中存在两种共价化合物分子D .氯水能导电,所以2Cl 也是电解质二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.6.在不断搅拌和研磨下,把3AgNO m ol/L 0.010 m L 150溶液逐滴加入200 mL 0.010mol /LKI 溶液中,把制得的AgI 溶胶等分为6份,分别加入相同物质的量浓度的下列溶液: ①3AlCl ②342)(SO Al ③2BaCl ④NaCl ⑤42SO Na ⑥43PO Na则引起凝聚所需上述溶液的体积大小顺序是( )A .②<①<③<⑥<⑤<④B .②<⑥<⑤<①<③<④C .②<⑥=①<⑤=③<④D .⑥<②<⑤<①<③<④ 7.已知由3AgNO 溶液和稍过量的KI 溶液制得的AgI 溶液,跟3)Fe(OH 溶液相混合时,析出AgI 和3)Fe(OH 的混合沉淀.由此可知( )A .该AgI 胶粒带正电荷B .该AgI 胶粒电泳时向阳极移动C .该AgI 胶粒带负电荷D .3)Fe(OH 胶粒电泳时向阳极移动8.在室温下进行中和滴定,酸和碱恰好完全反应时,以下说法一定正确的是( )A .参加反应的酸和碱的物质的量相等B .参加反应的酸中的+H 离子总量和碱中-OH 离子总量相等C .反应混合液的pH =7D .能用适当的酸碱指示剂来判断9.已知pH =3的酸溶液和pH =11的碱溶液等体积混合后的溶液呈酸性,则发生的反应是( )A .强碱和弱酸溶液之间的反应B .强碱和强酸溶液之间的反应C .较浓酸溶液和较稀碱溶液之间的反应D .多元强酸和一元强碱之间的反应 10.在32CO Na 溶液中,下列等量关系成立的是( )A .][H ]CO [H ][HCO ][OH 323+--++= B .]CO [H ][HCO ][CO ]2[Na 32323++=--+ C .][OH ][CO ][HCO ][H ][Na 233---++++=+D .][H ]CO 4[H ]3[HCO ]2[CO ][OH ][Na 32323+---++++=+11.下列说法中正确的是( )A .pH =10与pH =12的NaOH 溶液等体积混和,溶液pH =11B .pH =5的盐酸溶液稀释100倍,溶液的pH 近似等于7C .pH =2的42SO H 与pH =12的NaOH 溶液等体积混和,溶液pH =7D .pH =12的OH NH 23⋅与pH =2的HCl 溶液等体积混和,混和液pH =712.物质的量浓度相同的下列物质,在指定的离子浓度的比较中错误的是( )A .][PO 34-:4342443PO H PO NaH NaHPO PO Na >>>B .][CO 23-:34332324HCO NH NaHCO CO Na CO )(NH >>> C .][NH 4+:ClNH HSO NH CO )(NH SO )(NH 444324424>>>D .][S 2-:S )(NH NaHS S H S Na 2422>>> 13.乙醇、液氨、水都可以发生自偶电离,如OH O H 22+-++OH O H 3,33NH NH +124NH NH -++,则下列叙述正确的是( )A .乙醇的电离方程式:OHCH 2CH 2325252OH H C O H C +-B .液氨的离子积常数为:28101.0-⨯,则液氨浓度为114L mol 101.0--⋅⨯C .若可用与pH 相当的定义来规定pOH 、-2pNH 等,则乙醇中与pH 相当的为]OH H [C lg 252+-D .乙醇中3052252W 101.0]O H ][C OH H [C --+⨯==K ,则此时的15O H pC 52-=-三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.14.向100 mL0.2 mol /L 的NaOH 溶液通入2CO 气体448 mL (标准状况),所得溶液中各种离子浓度大小顺序是( ) A .][H ][CO ][OH ][HCO ][Na 233+---+>>>>B .][OH ][HCO ][H ][CO ][Na 323--+-+>>>>C .][H ][CO ][OH ][HCO ][Na 233+---+>>=>D .][OH ][CO ][H ][HCO ][Na 233--+-+>=>>15.常温时,等体积等物质的量浓度的下列物质的溶液中,水的电离度由大到小顺序排列的是( ) ①32CO Na ②4NaHSO ③COOHCH 3 ④3NaHCOA .①>②>③>④B .①>④>③>②C .②>①>③>④D .②>③>④>① 16.室温下,水的电离度为( )A .003101.8-⨯B .004101.5-⨯C .006101.7-⨯D .007101.8-⨯ 17.水是极弱的电解质,在室温下,平均每n 个水分子中只有1个水分子发生电离,则n 值为( )A .11101-⨯ B .71055.6⨯ C .710 D .55.618.pH =3的二元弱酸R H 2溶液与V L pH =11的NaOH 溶液混合后,混合液的pH =7.下列判断正确的是( )A .溶液的总体积为2 V LB .溶液中][OH ][H ][Na ][R 2-++-=>> C .溶液中][H ][Na ][OH ][R 2++--+=+ D .溶液中][Na ][HR ]2[R 2+--=+ 19.对于难溶盐MX (弱电解质),其饱和溶液的+n M 和-n X 离子的物质的量浓度之间的关系近似于水的离子积WK (]][OH [H W -+=K ,存在着K n n =-+]][X [M 的关系(K 为常数).现将足量的AgCl 固体分别放入下列物质中,AgCl 的溶解度由大到小排列的顺序是( ) ①324CO )m ol/L(NH 0.1 m L 20溶液 ②40 mL 0.03 mol /LHCl ③3AgNO m ol/L 0.05 m L 50溶液④2m ol/LCaCl0.02 m L 30溶液 ⑤10 mL 蒸馏水 ⑥34NO NH m ol/L 0.02 m L 30溶液A .②>③>④>⑥>⑤>①B .①>⑥>⑤>②>④>③C .①>②>③>④>⑤>⑥D .③>②>④>⑥>①>⑤20.两种pH 不同的NaOH 溶液,其pH 分别为8和10,将这两种溶液等体积混合后溶液的[+H ]最接近于( ) A .m ol/L )10(101108--+⨯ B .mol/L)10(1021108--+⨯C .m ol/L )10510(1514--⨯-⨯ D .mol/L 10210-⨯ 21.分别将等pH 或等物质的量浓度的盐酸和醋酸等体积混合,加入足量镁,产生2H 的体积(同温同压下测定)的变化图示如下:其中正确的是( )A .①③B .②④C .①②③D .①②③④22.已知一定温度下的弱电解质的稀溶液,当加水稀释使物质的量浓度变为原来的m1时,其电离度将增大到原溶液电离度的m 倍.现有pH =2的某一元弱酸溶液10 mL ,加水至1 L 后,溶液的pH 是( )A .等于4B .在3~4之间C .等于3D .在2~3之间题号 1 2 3 4 5 6 7 8 9 10 11 分值 3分 3分 3分 3分 3分 4分 4分 4分 4分 4分 4分 选项题号 12 13 14 15 16 17 18 19 20 21 22 分值4分4分4分4分4分4分4分4分4分4分4分第Ⅱ卷(共67分)四、本题包括2小题,共15分23.(7分)有甲、乙两份等体积的浓度均为1L mol 0.1-⋅的氨水,pH 为11. (1)甲用蒸馏水稀释100倍,则OH NH 23⋅的电离平衡将向________(填“促进”或“抑制”)电离的方向移动,溶液的pH 将为________(填序号). A .9~10之间 B .11 C .12~13之间 D .13(2)乙用1L mol 0.1-⋅的氯化铵溶液稀释100倍,稀释后的乙溶液与稀释后的甲溶液相比较,pH_________(填“甲大”、“乙大”、“相等”),其原因是_______________________ _______________.24.A 、B 两种物质都是由氢、氮、氧、钠四种元素中的任意三种元素所组成,它们的水溶液分别呈酸性或碱性,在同温下,A 溶液的pH 大于相同浓度的B 溶液的pH (溶液浓度不大于15L mol 10--⋅),请找出A 和B 可能有的两种组合,并且要求当这两种组合中的B 溶液pH 相同时,第一种组合的B 溶液中的水的电离度小于第二种组合的B 溶液中水的电离度.(1)写出可能有的两种组合中,A 和B 的化学式:第一种组合:A 是_________,B 是_________; 第二种组合:A 是_________,B 是_________.(2)说明pH 相等时,第一种组合B 溶液中的电离度比第二种混合的B 溶液中水的电离度小的原因:________________________.五、本题包括2小题,共20分25.(10分)测定海水中溶解氧的步骤如下:①水样的固定:取a mL 海水样迅速加入固定剂4MnSO 溶液和碱性KI 溶液(含KOH ),立即塞好塞子,并振荡均匀,使之充分反应.②酸化:开塞后迅速加适量1∶1硫酸,再迅速塞好塞子,反复振荡至沉淀完全溶解. ③滴定:向溶液中加入1 mL 0.5%淀粉溶液,再用1L mol -⋅b 的322O S Na 标准溶液滴定至溶液刚好褪色. 有关的离子反应如下:)(2222MnO(OH)4OH O 2Mn 该反应极快-+++O 3H I Mn 4H 2I )MnO(OH 2222++++++----++2642322O S 2I O 2S I请回答下列问题:(1)在进行①、②操作时,要注意“迅速”,如果操作缓慢,会使测定结果________(填偏高、偏低或无影响),原因是___________________________. (2)滴定前,用蒸馏水洗净滴定管即加入322O S Na 标准溶液,会使测定结果_______(填偏高、偏低或无影响),原因是__________________________.(3)滴定前,未排除滴定管中的气泡,在滴定过程中气泡排除,会使测定结果_______(填偏高、偏低或无影响),原因是__________________________. (4)滴定时消耗了322O S Na mL V 标准溶液,则水中溶解2O (g/L )的量的计算式为_________.26.(10分)对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.若25℃时有HA-++A H ,则[HA]]][A [H -+=K 式中:K 为电离平衡常数,只与温度有关,[ ]为各微粒的平衡浓度.下表是几种常见酸电离方程式电离平衡常数KCOOH CH 3COOH CH 3+-+H COO CH 351076.1-⨯32CO H711031.4-⨯=K1121061.5-⨯=K S H 212281101.1101.9--⨯=⨯=K K43PO H311052.7-⨯=K821023.6-⨯=K1331020.2-⨯=K(1)K 只与温度有关,当温度升高时,K 值________(填“增大”、“减小”、“不变”).(2)在温度相同时,各弱酸的K 值不同,那么K 值的大小与酸性的相对强弱有何关系? ________________________________________________________________________. (3)若把COOHCH 3、32CO H 、-3HCO 、S H 2、-HS 、43PO H 、-42PO H 、-24HPO 都看作是酸,其中酸性最强的是_________,最弱的是________.(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的1K 、2K 、3K 之间存在着数量上的规律,此规律是________________,产生此规律的原因是_________________________.(5)电离平衡常数是用实验的方法测定出来的.现已经测得25℃时,C mol/L 的COOHCH 3的电离数为 .试表示该温度下醋酸的电离平衡常数=COOH CH 3K _________.六、本题包括2小题,共15分 27.(8分)简答下列各题:(1)在工厂里,Cl NH 4和2ZnCl 可作焊药,是何道理?(2)在2CaCl 溶液里通入2CO ,不会产生3CaCO 沉淀,但加入氨水,则立即有3CaCO 沉淀产生.(3)试说明工业用O6H AlCl 23⋅制无水3AlCl 时,必须将O6H AlCl 23⋅在干燥的HCl气流中加热脱水是何道理?(4)土壤的碱性主要是由-23CO 水解引起的,用石膏能否改良碱性土壤?为什么?(5)在农业上,草木灰不能跟铵态氮肥、普钙等混用,试阐述理由.农田在长期施用硫铵后,又要施用一些消石灰,这是为何?28.(7分)测定某32CO Na 和3NaHCO 混合物的组成,可取两份各w g 的试样分别溶于水.第一份用甲基橙为指示剂,用m ol/L 1M 稀盐酸在不停摇动时滴定到终点,消耗该酸mL 1V .第二份准确加入m L 2V 浓度为m ol/L 2M 的NaOH 溶液后,再加2BaCl 溶液至沉淀完全为止,然后滴入酚酞指示剂,再用mol/LmL 13M V 的盐酸滴定到终点.②若第二份试样换用甲基橙为指示剂,再用盐酸滴定至终点,其结果会是_______________________________________________,原因是________________________. ②3NaHCO 在原混合物中质量百分数的计算式为______________.③32CO Na 在原混合物中质量百分数的计算式为______________.七、本题包括2小题,共17分 29.(9分)把NaOH 、2MgCl 、3AlCl 三种固体组成的混合物溶于足量水后有1.16 g白色沉淀,在所得的浊液中逐滴加入1L mol 1-⋅HCl 溶液,加入HCl 溶液的体积与生成沉淀的质量关系如图.试回答:(1)A 点的沉淀物的化学式为________________,B 点的沉淀物的化学式为_________________.(2)原混合物中2MgCl 的质量是________g ,3AlCl 的质量是_________g ,NaOH 的质量是_________g .(3)Q 点HCl 溶液加入量是_________mL .30.(8分)为了度量水中有机物等还原性污染物的含量,通常把1 L 水样与强氧化剂完全作用时消耗氧化剂的量,折算成以氧气为氧化剂时的质量(12L mg O -⋅)来表示,称为该水样的化学耗氧量(COD ).我国明文规定:1L m g 500COD -⋅>的污水不得直接排放.为测定某工业为水的COD ,实验如下:量取废水样品20.00 mL ,加入1L mol 0.100-⋅4KMnO 溶液10.00 mL 和少量稀42SO H ,在一定条件下充分反应后,再用1L mol 0.200-⋅的草酸钠(422O C Na )溶液滴定过量的4KMnO ,达到终点时消耗422O C Na 溶液11.00 mL .(1)写出在酸性介质中4KMnO (被还原为+2Mn )与422O C Na (被氧化为2CO )反应的离子方程式________________.(2)计算该水样的COD ,写出计算过程.(3)如果每次取水样20.00 mL ,加入等体积的1L mol 0.100-⋅酸性4KMnO 溶液,为简化计算,令滴定过量4KMnO 时,每消耗422O C Na m L 1.00溶液,就相当于水样的COD为1L 10.0mg -⋅,该422O C Na 溶液的物质的量浓度应配制为_________.(4)若无需其他计算,只需通过实验测定下列两组方案中a 与b 的值,并直接根据a 与b 的比值来确定该工业废水可否直接排放.你认为其中适宜可行的方案是________(填写序号);并根据你的选择计算:当b a(填写取值范围)________时,该工业废水不能直接排实验方案 mL )(水样V mL )KMnO (2溶液V14L mol )KMnO (-⋅cmL )O C Na (422溶液V1422L mol )O C Na (-⋅cA a a0.100 b0.100B a20.000.10020.00b参考答案1.D 2.C 3.C 4.B 5.C 6.C 7.BC 8.BD 9.AC 10.D 11.C12.BD 13.AC 14.A 15.B 16.D 17.B 18.D 19.B 20.D 21.D 22.C23.(1)促进,A (2)甲大乙用氯化铵溶液稀释后,[+4NH ]增大很多,使O H NH 23⋅的电离平衡向抑制电离的方向移动;+4NH 发生水解,使稀释后的乙溶液的[+H ]增大 24.(1)第一种组合 A :NaOH B :3HNO第二种组合 A :2NaNO B :34NO NH(2)由于3HNO 电离出+H ,使水的电离平衡:OH 2-++OH H 向左移动,使水的电离度小于纯水中水的电离度,而34NO NH 溶液中由于OH NH 24++++⋅H O H NH 23由于O H 2电离出的-OH 与+4NH 结合生成弱电解质O H NH 23⋅,从而促进水的电离,使水的电离度比纯水中的大.25.(1)偏高;空气中的氧气溶于样品中 (2)偏高;使322O S Na 溶液浓度变低,消耗体积偏大(3)偏高;使最后读取体积数比实际消耗322O S Na 溶液体积数大(4)a bV826.(1)增大(2)K 值越大,酸性越强(3)43PO H -24HPO(4)10532110101::::--≈K K K 上一级电离产生的+H 对下一级电离有抑制作用(5)a a C K --=1227.(1)Cl NH 4和2ZnCl 水解均呈弱酸性,可除去金属表面的氧化物(2)2CO 水溶液中[-23CO ]很小,不会生成沉淀(或弱酸不能生成强酸).加入氨水时,O H NH 23⋅-++OH NH 4,使32CO H 电离平衡右移,[-23CO ]增大,产生沉淀(或OH NH 23⋅与32CO H 生成324CO )(NH ,使[-23CO ]增大(3)在HCl 气流中,+H 抑制+3Al水解,从而可得到3AlCl 无水物(4)能.↓++-3223CaCO Ca CO ,降低[-23CO ],其水解平衡左移,碱性减弱(5)32CO K 水解呈碱性,+4NH 水解呈酸性,二者混合施用,会促进水解,大量生成易挥发的OH NH 23⋅,从而使氮肥降低肥效242)PO Ca(H 电离呈酸性,与32CO K 混合施用,会产生4CaHPO 或243)(PO Ca 沉淀而丧失肥效.硫铵(即硫酸铵)水解呈酸性,长期施用土壤会板结酸化,加消石灰可调节酸度,防止板结.28.(1)造成测定数值偏高(2)003122100100084)(⨯⨯-w V M V M (3)00312211100100053)]([⨯⨯--w V M V M V M29.(1)2)Mg(OH ;2)Mg(OH 、3)Al(OH(2)1.90 2.67 5.20 (3)130分析:(1)因为在浊液中加入HCl 溶液至10 mL ,沉淀质量一直为1.16 g ,说明浊液显碱性,Al 元素以-2AlO 形式存在,继续加入HCl 溶液,-2AlO 转变为3)Al(OH 沉淀,加至30 mL 时,-2AlO 全部转变为3)Al(OH ,所以在A 点的沉淀物为2)Mg(OH ,在A 至B点间,沉淀物为2)Mg(OH 和3)Al(OH 的混合物.当加入的HCl 溶液超过30 mL 时,2)Mg(OH 和3)Al(OH 同时溶解.(2)原混合物中: 2MgCl 的质量g 90.1mol g 95molg 58g1.1611=⨯=--⋅⋅HClAlO AlCl 23-m ol 0.02L 10)10(30L m ol 131=⨯-⨯--⋅ 3AlCl 的质量g 2.67m ol g 133.5m ol 0.021=⨯=-⋅ NaOH :①浊液中存在的:O H NaCl HClNaOH 2++1×0.01 mol②22)Mg(OH MgCl →消耗的: 2NaOH MgCl 2 mol 04.02mol g 58g 1.161=⨯-⋅③23NaAlO AlCl 消耗的: -+23AlO 4NaOH Al0.02 mol ×4=0.08 molNaOH 总质量g 5.20m ol g 40)m ol 0.08m ol 0.04m ol 0.01(1=⨯++=-⋅ (3)从B 点开始,33AlCl )Al(OH →消耗的HCl :0.02 mol ×3=0.06 mol 22MgCl )Mg(OH →消耗的HCl :0.02 mol ×2=0.04 mol所消耗HCl 溶液的体积为:m L 100L m L 1000L m ol 1m ol 0.04m ol 0.0611=⨯+--⋅⋅Q 点HCl 溶液总量为:30 mL +100 mL =130 mL30.(1)O 8H 10CO 2Mn 16H O 5C 2MnO 2222424+↑+++++--(2)m ol 101.00m L L 1010.00m L L m ol 0.100)(KMnO 31314----⨯=⨯⨯=⋅⋅nm ol 102.20m L L 10m L 11.00L m ol 0.200)O C (Na 3131422----⨯=⨯⨯=⋅⋅n 根据 4224O C 5Na ~2KMnO过量4KMnO 为:mol 108.80mol 1020.25243--⨯=⨯⨯20.00 mL 水样消耗4KMnO 为mol 101.20mol 108.80mol 101.00443---⨯=⨯-⨯根据得电子数目相等,则有245O ~4KMnO相当于1 L 水样消耗2O 为: m g 240g m g 10m ol g 32m L 20.001000mL m ol 101.20451314=⨯⨯⨯⨯⨯---⋅⋅,即该水样的1L m g 240COD -⋅=(3)1L mol 5.00-⋅(4)A ,3516>。
全国2021届高中化学试题汇编(2020年题):A1 阿伏伽德罗常数和物质的量

A1 阿伏伽德罗常数和物质的量【理综卷·2020届重庆市重庆一中高三上学期第一次月考】9. NA为阿伏伽德罗常数,下列叙述错误的是A.常温常压下,42g乙烯和丁烯混合气体中,极性键数为 6 NAB.1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子C.由CO2和O2组成的混合气体中共有NA个分子,其中的氧原子数为2NAD.6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA【知识点】阿伏伽德罗常数 A1【答案解析】D 解析:D.当SO2与O2反应时是可逆反应,反应物不可能完全转化为产物,故6.4g SO2反应时转移电子数小于0.2 NA,错误。
【思路点拨】本题考查了阿伏加德罗常数的值在有关物理量中的如分子中含有的原子数的计算、化学键的计算以及在氧化还原反应中的转移的点子数的计算等,包括的知识内容较多,综合性较强。
【理综卷·2020届重庆南开中学高三9月月考】3.设N A表示阿伏加德罗常数的值,下列叙述中不正确的是:A.常温常压下,1mol甲基(-C H3)含有的电子数为9N AB.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后胶体粒子的数目小于N AC.标况下,2.24LHF中含有的电子数为N AD.1 mol 金刚砂(SiC)中含有4N A碳硅键【知识点】阿伏伽德罗常数 A1 H3【答案解析】C 解析:A、甲基含一个未成对单电子,故1mol甲基含有电子数为9NA,故A 正确;B、水解程度小,故生成的胶体粒子数目小于NA,故B正确;C、标况下HF是液体,不能用气体摩尔体积计算,故C错误;D、金刚砂(SiC)与金刚石结构类似,一个C连4个Si,故1mol金刚砂含有4NA碳硅键,故D正确;【思路点拨】本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,难度中等。
【理综卷·2020届贵州省遵义航天高级中学高三上学期第二次模拟考试(202010)】11、向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为()。
2020-2021高考化学有机化合物推断题综合题附详细答案

2020-2021高考化学有机化合物推断题综合题附详细答案一、有机化合物练习题(含详细答案解析)1.有机物种类繁多,结构复杂。
(1)下列各图均能表示甲烷的分子结构,其中甲烷的球棍模型是__(填序号,下同),表现甲烷的空间真实结构是__。
(2)下列有机物中所有原子可以在同一个平面上的是___(填序号)(3)如图是由4个碳原子结合成的6种有机物(氢原子没有画出)①上述有机物中与(c)互为同分异构体的是__(填序号)。
②写出有机物(a)的名称__。
③有机物(a)有一种同分异构体,试写出其结构简式__。
④写出与(c)互为同系物的最简单有机物和溴水反应的化学方程式:__;生成物的名称是___。
(4)某单烯烃与氢气加成后生成异戊烷,该烯烃的结构简式有__种。
(5)“立方烷”是一种新合成的烃,其分子为正方体结构。
如图表示立方烷,正方体的每个顶点是一个碳原子,氢原子均省略,一条短线表示一个共用电子对。
碳原子上的二个氢原子被氨基(-NH2)取代,同分异构体的数目有_种。
【答案】C D ABD bf 异丁烷 CH3CH2CH2CH3 CH2=CH2+Br2→CH2Br-CH2Br 1,2-二溴乙烷 3 3【解析】【分析】【详解】(1)甲烷的球棍模型是C,甲烷的电子式是B;A是分子结构示意图;D是比例模型;其中比例模型更能形象地表达出H、C的相对位置及所占比例;电子式只反映原子最外层电子的成键情况;(2)乙烯和苯分子中所有原子共平面,甲烷是正四面体结构,所以C不可能原子共面;D 苯环和碳碳双键之间的碳碳单键可以旋转,所有原子可以共平面;(3)①c为C4H8与它分子式相同,结构不同的为b、f,②由图示可知a为烷烃,含有4个C原子,主链含有3个C,甲基在2号C,是异丁烷③含有4个碳原子的烷烃有CH3CH(CH3)CH3和CH3CH2CH2CH3,a为CH3CH(CH3)CH3,则其同分异构体为:CH3CH2CH2CH3;④c为丁烯,单烯烃碳原子数目最少的是CH2=CH2;(4)加成反应不改变碳链结构,异戊烷CH3-CH2-CH(CH3)2两个甲基与碳相连的价键是相同的,所以烯烃的双键位置有三种,烯烃的结构就有三种;(5)在一个面上有邻位和对位两种;不在一个面上,有1种,即立方体体对角线一个顶点一个-NH2。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2020年高考化学分类汇编---有机化学
包括: 常见的有机化合物有机化学基础
北京卷
11.下列说法正确的是
A,天然植物油常温下一般呈液态,难溶于水.有恒定的熔点、沸点
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖、
C.若两种二糖互为同分异构体,则二者的水解产物不一致
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体
28. (17分)
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
己知芳吞化合物苯环上的氢原子可被卤代烷中的烷基取代。
如:
(1) B为芳香烃。
①由B生成对孟烷的反应类型是
②(CH3 ), CHCI与A生成B的化学方程武是
③A的同系物中相对分子质量最小的物展是
(2) 1.2020g的C与饱和溴水完全反应生成3.45 g白色沉淀。
E不能使Br2的CC14溶液褪色.
①F的官能团是
②C的结构简式是
⑧反应I的化学方程式是
(3)下列说法正确的是(选填字母)
a. B可使酸性高锰放钾溶液褪色 b. C不存在醛类同分异构体
c. D的酸性比 E弱 d. E的沸点高于对孟烷
(4) G的核磁共振氢谱有3种峰,其峰面积之比为3:2:1 .G与NaHCO3反应放出CO2。
反应II的化学方程式是
重庆卷
9.萤火虫发光原理如下
关于荧光素及氧化荧光素的叙述,正确的是 A.互为同系物 B.均可发生硝化反应 C.均可与碳酸氢钠反应 D.均最多有7个碳原子共平面
28.(16分) 衣康酸M 是制备高效除臭剂、粘合剂等多种精细化学品的重要原料,可经下列反应路线得到(部分反应条件略).
(1)
A 发生加聚反应的官能团名称是 ,所得聚合物分子的结构型式是 (填“线型”或“体型”)。
(2)B D →的化学方程式为 。
(3)M 的同分异构体Q 是饱和二元羧酸,则Q 的结构简式为 (只写一种)
(4)已知,E 经五步转成变成M 的合
成反应流程为:
①E G →的化学反应类型为 ,G H →的化学反应方程式为 ②J L →的离子方程式为 ③已知:
,E 经三步转变成M 的合成反应流程
为
①E G →的化学反应类型为 ,G H →的化学反应方程式为 。
②J L →的离子方程式为 。
③已知:3
()C OH -
—— 2COOH H O +,E 经三步转变成M 的合成反应流程为 (实例如题28图);第二步反应试剂及条件限用NaOH 水溶液、加热)
自动脱水
13.橙花醇具有玫瑰及苹果香气,可作为香料,其结构简式如下下列关于橙花醇的叙述,错误的是(D)
A.既能发生取代反应,也能发生加成反应
B.在浓硫酸催化下加热脱水,可以生成不止一种四烯烃
C.1mo1橙花醇在氧气中充分燃烧,需消耗470.4氧化(标准
D.1mo1橙花醇在室温下与溴四氯化碳溶液反应,最多消耗240g溴
30.(15分)(注意:在试题卷上作答无效)
化合物A(C11H8O4)在氢氧化钠溶液中加热反应后再酸化可得到化合物B和C。
回答下列问题:
B的分子式为C2H4O2,分子中只有一个官能团。
则B的结构简式是CH3COOH,B与乙醇在浓硫酸催化下加热反应生成D,该反应的化学方程式是
CH3COOH+CH3CH2OH=CH3COOCH2CH3+H2O_,该反应的类型是取代反应或酯化反应_;写出两种能发生银镜反应的B的同分异构体的结构简式_HCOOCH2CH2CH3、HCOOCH(CH3)2___。
C是芳香化合物,相对分子质量为180,其碳的质量分数为60.0%,氢的质量分数为4.4%,其余为氧,则C的分子式是C9H8O4。
(3)已知C的芳环上有三个取代基,其中一个取代基无支链,且还有能使溴的四氯化碳溶液退色的官能团及能与碳酸氢钠溶液反应放出气体的官能团,则该取代基上的官能团名称是:碳碳双键、羟基。
另外两个取代基相同,分别位于该取代基的邻位和对位,则C的结构简式是 CH=CHCOOH 。
或
(4)A的结构简式是。
30.(14分)过渡金属催化的新型碳-碳偶联反应是近年来有机合成的研究热点之一,如反应①
化合物Ⅱ可由化合物Ⅲ合成:
化合物I的分子式为______________。
化合物Ⅱ与Br2加成的产物的结构简式为______________。
化合物Ⅲ的结构简式为______________。
在浓硫酸存在和加热条件下,化合物Ⅳ易发生消去反应生成不含甲基的产物,该反应方程式
为______________(注明反应条件)。
因此,在碱性条件下,由Ⅳ与反应合成Ⅱ,其反应类型为___________。
Ⅳ的一种同分异构体V能发生银镜反应。
V与Ⅱ也可发生类似反应①的反应,生成化合物Ⅵ,Ⅵ的结构简式为___________(写出其中一种)。
30、(1) C7H5OBr
(2) (3)
(4) ;取代反应。
(5)
江苏卷
11. 普伐他汀是一种调节血脂的药物,其结构简式如图6 所示
(未表示出其空间构型)。
下列关于普伐他汀的性质描述正确的
是
A.能与FeCl3 溶液发生显色反应
B.能使酸性KMnO4 溶液褪色
C.能发生加成、取代、消去反应
D. 1 mol 该物质最多可与1 mol NaOH 反应
17. (15 分)化合物H 是合成药物盐酸沙格雷酯的重要中间体,其合成路线如下:
(1)化合物A 中的含氧官能团为和 (填官能团名称)。
(2)反应①→⑤中,属于取代反应的是 (填序号)。
(3)写出同时满足下列条件的B 的一种同分异构体的结构简
式:。
I. 分子中含有两个苯环;II. 分子中有7 种不同化学环境的氢;III. 不能与FeCl3溶液发生显色反应,但水解产物之一能发生此反应。
(4)实现D→E 的转化中,加入的化合物X 能发生银镜反应,X 的结构简式
为。
(5)已知:。
化合物是合成抗癌药物美法伦的中间体,请写出以和为原料制备该化合物的合成路线流程图(无机试剂任用)。
合成路线流程图示例如下:
17. (15 分)
(1)羟基醛基 (2)①③⑤
(3) (或)
(4)
(5)
山东卷。
