二基团切断(教案)
战略VIII:羰基缩合反应导论资料

表1 自然的或合乎逻辑的合成子
8.3.1 二基团切断II: 1,3-二官能团化合物和 ,-不饱和碳基化合物
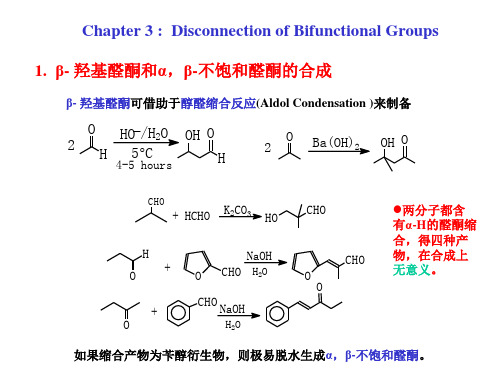
• 这一组化合物有可 能在两种氧化级, 将二羰基( 1 )和 - 羟基羰基( 3 ), 进行直接切断。烯 酮( 4 )放在本章 中讨论是因为它们 通常系由(3 )脱 水而得。
一、1, 3 -二羰基化合物
ቤተ መጻሕፍቲ ባይዱ
合成
• 这一制取环酮的路线实际上是条制取不管是环状的,或是 象(18 )之类的非环状的对称酮的通用路线,往后本书 将要用到它。
二、-羟基羰基化合物
• 这是在较低氧化级的同一种切断,但酯被醛或酮代替了。 化合物(19 )看来似乎很复杂,但它只有一个可能的切 断,且其起始原料是两分子同一化合物。分析
• 我们需要一个比甲醛本身活性较差的甲醛等当物。最常的 方法是用曼尼奇反应,此中甲醛与一个烯醇化的成分和一 个仲胺发生反应。先是形成中间体(41);此物与烯醇加 成形成曼尼奇碱(42)。 • 这些化合物可以 再经烷基化和消 除反应使之变成 甲叉酮类化合物, 即甲醛缩合反应 的产物,如( 42 ) 转变成(44)。
8.3 战略VIII:羰基缩合反应导论
• 我们把诸如(1),(2)和(3)之类的化合物作为 1,3-二 官能团化合物归集成一组,因为重要的是官能团的位置而 不在于它的类型。我们的逻辑是,官能团都可从醇,酮 (或醛),或酸通过取代反应衍生出来。还有,这三种化 合物可通过氧化或还原而相进行转化。 利用FGI 和C一X 切断 倒退至只具有合适氧化 级的含氧官能团的基本 骨架,然后再用我们打 算要讨论的二基团法来 切断C-C 键。
• 对二基团切断来说,例如(4),每个合成子都带有官能 团,而我们将用其中的官能团能帮助稳定亲核试剂或亲电 试剂的那种合成子作为开端(表1)。亲核试剂通常将是 烯醇盐(5)。与“直接”的亲电试剂(表1)结合起来, 必定就会形成1,3-关系,例如(4) 。
第三章:双官能团切断
( 1 )
O + O E t
C O2 E t O 1 . N a O E t 2 . H O +
3
C O2 E t ( 2 )
O CO Et CO Et +
2
NaOEt
2
- CO O EtO O CO Et Δ EtO CO Et (3)
2
CO Et
C O2 E t + E t O O E t 2 . E t O H C O2 E t ( 4 )
O
2
A T M 6 1 O E t
O H
H O 2 . P h
T M 5 3
O
[TM]
O
FGA EtO C
2
O CO Et
2
2
[切断]
O
O
O
O
[合成 合成] 合成
(2) 异酯缩合 交叉Claisen 缩合 异酯缩合--交叉 交叉
O + H C O E t 2 O E t 1 . N a O E t 2 . H O +
3
有一种没有α-氢 有一种没有 氢
H C O2 E t O
2
N M e
2
O F G I N M e + O E t H O
2
[切断]
H O P h
H O P h O B r O E t + P h O
N M e O + N M e
2
H O
2
[合成 合成] 合成
O O 1 . P , B r
2
A O 1 . Z n , E t O B r O E t 2 . E t O H P h P h
第三章分子的拆开介绍

是将分子结构中的化学键人为地断裂,使分子变为可能原料的
一种过程。 基本要求:(1)会运用分子拆开法设计合成路线 (2)熟练掌握所介绍的几类分子拆开的方法
分子拆开的原理
通过碳—碳成键反应,能够用小的分子去合成较大分子,这是
合成的基本原理。 反过来,通过碳—碳键的拆开,把较大的分子变成它的原料和 较小的试剂分子,然后把原料和试剂通过一系列反应步骤串联 起来,也就形成了合成路线。
2 C 2H5MgBr/ THF
Br MgC CMgBr
H C CMgBr
C2H5MgBr/THF
H C C H
2 Na / NH3 (l)
190~220℃
Na / NH3 (l)
Na C CNa
H C CNa
110℃
HC
CMgBr
(1) R HC CNa
1
O C R2
R R2
1
(2) H2O
C C CH OH 炔醇
控制加氢
BrMgC CMgBr (1) NaC CNa O C (2) H2O
烯醇
C OH
C
C
C OH
炔二醇
(1) 水和 或 (2) 加HX,X2 或(3) 控制氧化 羰基醇 卤代醇
多元醇
二、合成路线设计实例
OH
例1 试设计
Ph
Ph
的合成路线
(1)分析:先弄清TM是什么化合物,结构特点,可以 拆成什么样的合成子或等价物。 显然,它是一种具有对称结构的仲醇,一般有两种拆法:
3、合成等价物(Synthetic equivalents):一种能起合成
子作用的试剂(化合物)。合成子常因其本身不太稳定而不能 直接使用。a的合成等价物是丙酮。b的合成等价物是HCN
双官能团
OH CHO TM84
二者的关系在1,3-位,而且分子的碳数是对称的,它正 好来自羟醛缩合:
H OH + B H
O
O H A
O
O H
合成:
O O H 碱 OH H TM84
两个官能团在1,3-位,还涉及到羰基活性的问题:
O H O TM85 H HCHO + OH O
H O A + HCHO 弱碱 TM85
O HO Ph O NMe2 TM110
• 分析如下:
O HO Ph O NMe2 FGI HO COOH + HO APh COOH + O C Ph D B NMe2
HO
COOH Ph
1,3-二氧
• 合成:缩合中需要控制,因为在烯醇化和亲电能 力两个方面,酮C都比酸D要活泼。Reformatsky反 应看来是一个好方法。
5.85
9 10. 21 11 11.2
环戊二烯
PhCOCH3 CH3COCH3 HC≡CH
16
16 20 ~25
CH3COOCH3 24. 5
CH2(CO2Et)2
(CH3SO2)2CH2 (CH3)2CHCHO EtOH
13.3
14 15.5 15.9
CH3CN
Ph3CH CH2=CH2 CH3CH3
O
5
COOEt 稳定的碳负离子
O -不饱和
CO2Et 1,5-二羰基化合物
两个组分:一般是一个活化了的碳负离子和一个αβ不饱和羰基化合物。
分析:对称,两侧切断相同, 试剂丙酮需要活化。
OMe O O 对称 O + O CHO OMe O + OMe
3一基团切断(教案)

NO2 Cl
b
OMe O
a OMe O
b Me
NO2
Cl
OMe
O
2019/10/17
21
羧酸的合成设计
RCOCl RCO O. C.OR' RCOO.R '
SOCl2 或 PCl5
RCO2H
RMg Br + CO2
RCO. NR'2
R-CN
R-Cl + NaCN
RCOCl RCO . O .COR ' RCO .OR' RCONR2'
COOEt 1. 脂 水 解
COOEt 2.加 热(_co2)
Br COOH
23 P33
练习九 羧酸衍生物均可转化为羧酸再切断
N O
NH HO
O
+
CHO MgBr
HO
CO2 + BrMg
Br
1. Mg , Et2O
Br
2. EtCHO HO
1. SOCl2 2.
NH
N O
2019/10/17
1. PBr3 2. Mg , Et2O
R R' C OH
R''
2. 烯烃
R' R MgBr + R''
+PPh3 + O
O 维蒂 希反应
3. 羧 酸
R CO2H
RMgBr + CO2 或 R-Br + NaCN
R CH2CO2H
RBr + CH2(COOEt)2
4. 羰 基 化 合物 Ar COR
ArH + ClCOR 费_ 克
4二基团切断(教案)

a R
O
O
+
OEt H3C O R'
+
R CH3
二基团切断
EtO
R'
7
2015-1-9
药物合成设计
• 能生成1,3-二羰基化合物的反应:
羧酸酯与含活泼氢酮、腈、酯化合物反应
– Claisen反应:分子间酯缩合反应(必需一个酯 的位有活泼氢) – Dieckmann反应:分子内酯缩合反应(必需一 个酯的位有活泼氢)
二基团切断合成设计
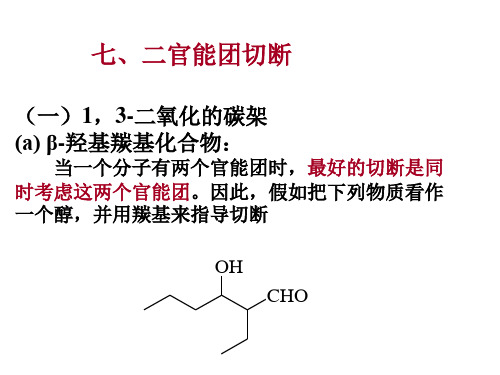
• - 羟 基 羰 基 化 合 物
• ,-不饱和羰基化合物 • 1 , 3 - 二 羰 基 化 合 物 • 1 , 5 - 二 羰 基 化 合 物
2015-1-9 药物合成设计 二基团切断 1
-羟基羰基化合物
OH O H
OH _ +
O H
O H
OH O H CHO 碱 Aldol缩 合
2015-1-9 药物合成设计 二基团切断 19
O CO2 Et
_ EtO I O
O EtO
O _ O O CO2 Et A CO2 Et 1.碱 2.水 解 和 脱羧 O
+ CH2O
O + CH2O ' 2 NH + Me H+ NMe2 O
O MeI ' ' NR2 '
O + ' NMe 2 B Me 碱 迈 克 尔反 应条件
O A
2015-1-9
B可以代替 A直接参加 Michael反应 药物合成设计 二基团切断
20
Mannich反应
• 具活泼氢原子化合物(酮、醛、酸、酯、 氰、硝基烷、炔、酚类及某些杂环)与 甲醛(其它活性大的醛)及氨、仲氨、 伯胺缩合反应——又称-氨甲基化反应
一基团切断教案
SOCl2 或PCl5
RCO2H
RMgBr + CO2
RCO.NR2'
R-CN
R-Cl + NaCN
R C O Cl R C O O .C .O R' R C O O .R'
最 活 泼
,
R C O ClR O 'HR C O O .R R ,N 2HR C O N .R 2 '
R C O N R 2 '
COOEt
a
CH2OH b
CHO
C O O Et
CHO
醇衍生物的合成设计
醚 ROR'
H
卤烃 R-X
P X3 或 HX
醛 RCHO 酮 RCO R'
ROH 醇
RCH=CHR' 烯
消 除 反应
R C O Cl 或
( R C O )2 O
RCO O R' 酯
氧化
RCOOH 羧酸
醇的衍生物均可转化成醇再切断
Me
a
Me NO2
NO2 Cl
b
OMe O
a OMe O
b Me
NO2
Cl
OMe
O
羧酸的合成设计
RCOCl RCOO. C.OR' RCOOR. '
SOCl2 或PCl5
RCO2H
RMgBr + CO2
RCO.NR2'
R-CN
R-Cl + NaCN
R C O Cl R C O O .C .O R' R C O O .R'
Me
TM
练习十二 羧酸衍生物均可转化为羧酸再切断
2.1 切断法解析
室中均感不便,而
采用(2 )为中间 体的路线虽然长些
但却较为简单。这
条路线还算较短, 便用的是廉价起始
原料,而且每步给
出高产率。
设计一个合成的例行程序
1. 分析
认出目标分子中的官能团 用相当于已知和可靠的反应进行切断 进行切断以到达易于取得的起始原料
2. 合成
根据分析写出合成计划,加进试剂和条件 根据实验室中遇到的失败和成功,修改计划
第二章 切断法
• 本书旨在帮助你自行设计合成而不着重于讲述他人所设计 的合成。但书中包括许多他人工作的实例,因为在任何书 里借助例题学习知识始终是重要的。本章先展示一下以后 要发生的情景,以便让你不必过多关心合成的细节而要着 重关心合成之通法。
• 酮(1 )是个从廉价起始原料成吨地生产的重要工业化学 献,并被用于合成维生素A 和某些食用香精和香料。 高压、高温在实验
• 这些碎片(3 )和(4)都是合成子― 它们是想象中的碎片,可能被 牵涉到反应之中,也可能不被卷入,但它们都有助于使我们明白该用 哪些试剂。此处碰巧(4)是合成中的一个中间体,而不是(3 )。 分析完成后,必须以实际所用的试剂来代替合成子。一个负离子型合 成子的试剂往往是相应的烃;一个正离子型合成子的试剂往往是相应 的卤代物。
• 芳香腈(15)可
以极容易地按重 氮法加以切断。 由重氮盐的亲核 取代反应而制得 的芳族化合物
• 卤代物的亲核取代反应
• 只有当邻位和对位存在硝基或类似的吸电子基团时卤原子 才可能从芳环上被取代出来。幸运的是这种化合物易于通 过硝化反应制得:
• 如三氟拉灵B (17)之类的芽前除草剂可作为这条路线的优 秀代表。氨基可按此法引入,而两个硝基则可通过直接硝 化加以引进。起始原料( 18 )的合成将在第三章中加以 讨论。
研究有机化合物的一般方法(教案)高二化学(沪科版2020选择性必修3)
5.2研究有机化合物的一般方法一、教学目标1、了解有机化合物分离和提纯的方法;2、知道有机化合物结构鉴定的一般研究过程3、了解用于有机化合物结构测定的现代常用仪器技术4、结合简单图谱信息分析判断有机化合物的分子结构二、教学重难点重点:1.了解有机化合物分离和提纯的方法;2.结合简单图谱信息分析判断有机化合物的分子结构。
难点:结合简单图谱信息分析判断有机化合物的分子结构。
三、教学方法总结归纳法、分组讨论法等四、教学过程【导入】展示:研究有机化合物的一般过程【讲解】主要步骤:分离、提纯有机化合物,研究有机化合物的组成、结构、性质和应用,对有机化合物分子进行设计和合成。
操作简单而应用广泛的有机物分离和提纯的方法【生】重结晶、萃取、分液、蒸馏、升华、色谱分离【问】有机化合物的分离、提纯原则是什么?【生】①不增、不减、易分离、易复原①方法简便易行①途径最佳(步骤少、转化率高、无副产物等)【讲解】化学方法:一般是加入或通过某种试剂进行化学反应物理方法:利用有机物与杂质物理性质差异进行分离有机物分离的常用物理方法包括:【展示】用柱色谱分离有机物按固定相载体不同,色谱可以分为柱色谱、纸色谱、薄层色谱等;按流动相的状态不同,可以分为气相色谱、液相色谱、超临界流体色谱等。
【讲解】一般是加入或通过某种试剂进行化学反应在一般情况下,离子化合物在水中具有较大的溶解度,而在有机溶剂中溶解度很小。
利用这一性质,可以用酸或碱将某些杂质(如乙酸、苯酚、液溴)转化为离子化合物除去。
【讲解】物质的性质与分离、提纯方法的选择(1)根据物质的溶解度差异,可选用结晶、过滤的方法将混合物分离。
(2)根据物质的沸点差异,可选用蒸馏的方法将互溶性液体混合物分离。
(3)根据物质在不同溶剂中溶解度的差异,用萃取的方法把溶质从溶解度小的溶剂中转移到溶解度较大的溶剂中。
(4)根据混合物中各组分的性质不同可采用加热、调节pH、加适当的试剂等方法,使某种成分转化,再用物理方法分离而除去。
高中生物教案7篇
高中生物教案7篇高中生物教案篇一一、教学目标(一)知识教学点1、使学生初步学会运用生态学的基本观点来认识生态系统中的能量流动、物质循环对生物界的重要性。
2、使学生了解生态系统的主要功能和较多的名词概念以及能量流动与物质循环的特点。
3、使学生理解掌握能量流动过程和物质循环过程,以及它们在生态系统中的重要意义。
(二)能力训练点1、学会识图,提高学生分析能力。
2、通过电视录像和多媒体软件的观察以及实地考查生态系统,结合课本上理论联系实际,培养学生的观察能力和分析问题的能力。
3、通过讨论交流培养口头表达能力。
4、以生态系统中能量流动和物质循环与人类生存的关系为题撰写小论文,提高学生的综合能力。
(三)德育渗透点通过生态系统功能的学习,使学生热爱大自然、保护生态环境,热爱祖国的美好山河,热爱家乡,培养高尚的爱国情操。
二、教学重点、难点及解决方法1、重点(1)生态系统的能量流动过程及特点。
(2)生态系统的物质循环过程及特点。
(3)碳循环过程图解。
(4)生态系统的能量流动和物质循环的关系。
2、难点(1)生态系统的能量流动过程。
(2)生态系统的物质循环过程。
3、疑点在生态系统中为什么只能是物质循环,能量能否循环。
4、解决办法(1)将能量流动和物质循环的知识重点、难点编制成图文、音形并茂的多媒体课件,使它们变静为动,变抽象为形象,将难理解的内容转化为易接收的知识。
(2)培养提高学生的识图能力,分析问题、解决问题等思维能力,讨论交流将知识化难为易。
三、课时安排2课时:能量流动1课时,物质循环1课时。
四、教学方法多媒体组合教学模式,采用自学、讨论与讲述法。
五、教具准备1、能量流动和物质循环的多媒体软件及电教设备。
2、电视录像带、放像机。
六、学生活动设计1、自学生态系统的能量流动和物质循环的全部内容。
2、质疑讨论、学生相互启迪,教师点拨指导。
3、交流总结,相互取长补短,获取新的知识体系。
4、巩固所学的新知识,学生相互提问解答,归纳小结,课后练习,写小论文。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
The Design of Drug Syntheses
2011-11-23 药物合成设计 二基团切断 1
综合练习讲解
TM1 OMe OMe
OMe OMe MeO FGl + MeO NH2 HO2C
MeO MeO HN
O
Cl
FGI
FGI
RO RO
H + CH2O
RO RO
RO CN RO
O A
2011-11-23
B可以代替 直接参加 可以代替A直接参加 可以代替 直接参加Michael反应 反应 药物合成设计 二基团切断
29
Mannich反应 反应
• 具活泼氢原子化合物(酮、醛、酸、酯、 氰、硝基烷、炔、酚类及某些杂环)与 甲醛(其它活性大的醛)及氨、仲氨、 伯胺缩合反应——又称α-氨甲基化反应
O HNMe2 NMe2 E 脂 交 交 HO Ph
2011-11-23 药物合成设计 二基团切断
HO
O
21
1,5-二羰基化合物 二羰基化合物
• 1,5-二羰基化合物生成反应 二羰基化合物生成反应
Michael反应 活泼亚甲基化合物和α , β-不 反应: 活泼亚甲基化合物和α 反应 不 饱和羰基化合物碱催化加成 –活泼亚甲基化合物: 丙二酸酯、氰乙酸 活泼亚甲基化合物: 活泼亚甲基化合物 丙二酸酯、 乙酰乙酸酯、乙酰丙酮、 酯、乙酰乙酸酯、乙酰丙酮、硝基烷类 –α,β-不饱和羰基化合物: α,β-烯醛、 不饱和羰基化合物: 烯醛、 α α,β-烯(炔)酮、α,β-烯(炔)酯、α,β烯腈、 烯酰胺、 烯腈、α,β-烯酰胺、α,β-不饱和硝基化 合物、对醌类、杂环α 合物、对醌类、杂环α,β-不饱和烃类 22 2011-11-23 药物合成设计 二基团切断
2011-11-23
药物合成设计
二基团切断
2
CI HO HO H Me2SO4 MeO MeO NH2 MeO MeO COCl HN O MeO MeO CH2O, H Cl AcOH , 80% MeO NaCN H2 O ,EtOH OMe MeO OMe CN LiAIH4
MeO COCl MeO CO2H MeO
– Claisen反应:分子间酯缩合反应(必需一个酯 反应:分子间酯缩合反应( 反应 的α位有活泼氢) 位有活泼氢) – Dieckmann反应:分子内酯缩合反应(必需一 反应:分子内酯缩合反应( 反应 个酯的α位有活泼氢) 个酯的α位有活泼氢)
2011-11-23 药物合成设计 二基团切断 14
Claissen 缩合,b 路线的对称性强 缩合,
b
O a
CHO
a
O
Ph Ph Ph b _ C O Ph D _ Ph CHO H
2011-11-23
药物合成设计
二基团切断
24
CN + EtO2C a
PhCHO + O
Ph
O
CN b EtO2C Ph +
CN EtO 2 C
a
Ph
O
b
O
CN
CHO + Ph
EtO2C
O CO2Et Ph Ph
Ph O
O CO2Et Ph
O COOEt
+
O Ph Ph
25
O +
2011-11-23
O H Ph 二基团切断
Ph
药物合成设计
O
O
O 1,5二 二 二
O
_ + O
O
O
O
OMe
OMe
OMe O
O
O
O
+
+
O C O O Et
C O 2 Et
CHO
2011-11-23
药物合成设计
二基团切断
26
OMe
O CO2Et 碱(只 只 只只 只 只只 ) OMe
Me
O H
a
CHO
Me
O
b
O OHC Me
+
O Me
EtO
H
O
O
CHO Me
O
_ O H
Me
+
EtO
H
2011-11-23
药物合成设计
二基团切断
18
O H3C
_ CHO OH , H3C H2O
O
O H
_ OH H3C
O
_ O
OH H
_ O H3C H3C O
水 HCOOH
2011-11-23
药物合成设计
1,5-二羰基化合物 二羰基化合物
R O
a b
O a R _ +
O R'
O + _ R'
b
O R
O R'
2011-11-23
a、b切断的选择原则:生成稳定的碳负离子 、 切断的选择原则 切断的选择原则:
药物合成设计 二基团切断 23
O
O C O 2 Et O
C O 2 Et _ +
O
B A
O Ph Ph
O R + CH2O ' + R2NH H+ R NR2 O
2011-11-23
药物合成设计
二基团切断
30
O
+
O Ph
CH2O
O O Ph
+ +
O
HNM e2 M eI
O +
1,5-二二 二
O CH2O,Me2NH,H + MeI
O O C O2Et O 1 .C H 2 O , M e 2 N H , H 2 . M eI O 碱 P H C H2Br O C O2Et Ph Ph C O2Et 碱 H + O
MeO MeO COCl MeO
2011-11-23
药物合成设计
二基团切断
3
MgBr
CO2H
+
CO2
Br FGI - CN
OH FGI
FGI
O
+
Cl O
FGA
+_
O
2011-11-23
药物合成设计
二 Br 1. MgBH4 2. PBr3 NaCN , , CN H3O+ COOH
COCl AlCl3
MeCOCl AlCl3
2011-11-23
药物合成设计
二基团切断
5
OH FGA
B g rM O +
_ 佛 迈 H + MeCOCl
H
MeCOCl AlCl3
O
_ 异 PrMgBr
OH
H+
烯烯
H 2 _Pd _C
2011-11-23
药物合成设计
二基团切断
6
OHC OHC
O O
OH O H
OH _ +
O H
O H
OH O H CHO 碱 Aldol缩 缩
药物合成设计 二基团切断
O H
A
2011-11-23
9
O
b a
O Ph
a
O O
O _ Ph
Ph
OH
b
PH
O O + O Ph Ph
O Ph
2011-11-23
O + Ph
O 碱 Ph
药物合成设计 二基团切断
O
O Ph OH
12
1,3-二羰基化合物 二羰基化合物
O R a b O R' b O
切割点选择是关键
a R
O
O
+
OEt H3C O R'
+
R CH3
二基团切断
EtO
R'
13
2011-11-23
药物合成设计
• 能生成 ,3-二羰基化合物的反应: 能生成1, 二羰基化合物的反应 二羰基化合物的反应: 羧酸酯与含α活泼氢酮、 羧酸酯与含α活泼氢酮、腈、酯化合物反应
2011-11-23 药物合成设计 二基团切断 28
O CO2Et
_ EtO I O
O
O _ EtO O O CO2Et A CO2Et 1.碱 2.水 水 水 水水 O
+ CH2O
O + CH2O ' + Me2NH H+ NMe2 O
O MeI ' ' NR2 '
O + ' NMe2 B Me 碱 迈 迈 迈 迈 应应应
O
O CO2Et
CO2Et OMe
碱
CHO O CO2Et O H+ H2O
O
O
MeO
CO2Et
2011-11-23
药物合成设计
二基团切断
27
O
+ HCHO
O
O
?
O
O +
A
O
a
b
a 加 加 加加 COOEt
b O + O B
O CO2Et + I H
不选择b切断的原因 不选择 切断的原因: 切断的原因 1.中间体 的合成较 的合成难 中间体B的合成较 中间体 的合成较A的合成难 2.中间体 引入一个控制基 中间体A引入一个控制基 中间体 引入一个控制基COOEt, 即利于烷 基化的合成又利于Michael加成反应 基化的合成又利于 加成反应
Ph O Et + O CO2Et
b Ph a
Ph O CO2Et
