19-酒石酸美托洛尔片评价方法研究经验分享-陈民辉
酒石酸美托洛尔片一致性评价参比制剂溶出曲线测定
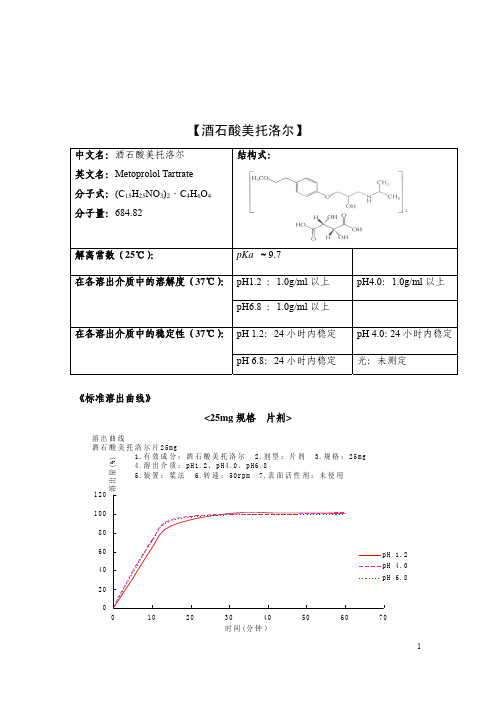
酒石酸美托洛尔片一致性评价参比制剂/溶出曲线测定(草案) 【酒石酸美托洛尔】中文名:酒石酸美托洛尔 英文名:Metoprolol Tartrate 分子式:(C 15H 25NO 3)2·C 4H 6O 4 分子量:684.82结构式:解离常数(25℃):pKa ≈9.7pH1.2 :1.0g/ml 以上 pH4.0:1.0g/ml 以上在各溶出介质中的溶解度(37℃):pH6.8 :1.0g/ml 以上pH 1.2:24小时内稳定 pH 4.0:24小时内稳定在各溶出介质中的稳定性(37℃):pH 6.8:24小时内稳定光:未测定《标准溶出曲线》<25mg 规格 片剂><50mg规格片剂>溶出曲线测定方法:照高效液相色谱法(中国药典2010年版二部附录VD)测定。
色谱条件与系统适用性试验用十八烷基硅烷键合硅胶为填充剂,以0.1mol/L高氯酸钠溶液(用0.85%高氯酸调节pH值至3.2)-乙腈(3:1)为流动相,检测波长为274nm,柱温为30℃,调整流速使美托洛尔主峰保留时间约为8分钟,理论板数按美托洛尔峰计算不低于2000,拖尾因子不大于1.5。
测定法取本品,照溶出度测定法(中国药典2010年版二部附录XC第二法),分别以规定的三种溶剂900ml为溶出介质,转速为每分钟50转,依法操作,经5、10、15、30、45、60分钟时,取溶液适量(5~10ml),滤过,并及时补充相同温度相同体积的溶出介质,取续滤液作为供试品溶液;另取酒石酸美托洛尔对照品适量,精密称定,加相应的溶出介质溶解并定量稀释制成每1ml 中约含28µg(25mg规格)、56µg(50mg规格)的溶液,作为对照品溶液。
精密量取供试品溶液和对照品溶液各50μl,分别注入液相色谱仪,记录色谱图,按外标法以峰面积计算每片在不同时间点的溶出量。
以12片的平均溶出量为纵坐标,时间为横坐标,绘制溶出曲线。
两厂家产酒石酸美托洛尔片的溶出度及相对生物利用度比较研究

(AR) ,水为自制双蒸水 。 113 溶出度研究 :取本品 6 片 ,精密称重后 , 照中国药典溶出度测定法 (附录 X《第一法》) 测定 , 以无 酶胃液 ( 取氯化钠 1010 克 , 盐酸 3510 克 ,加水至 500ml , PH 值约为 112) 900ml 为溶剂 ,转速为 100 转/ 分 ,依法操作 ,调节 5 ±015) , 经 5 , 15 , 30 , 45 , 60 分 钟 分别 取 样 10ml ,同时补充同体积的溶出介质 ,用 018um 微孔滤膜滤过 ,取续滤液在 27410nm 处测定 吸收度 A 值 ,与标准液的 A 值进 行比较 ,计 算出溶出度 。
标准液的配制 : 精密称取酒石酸美托洛 尔标准品 112002g ,置 100ml 容量瓶 中 ,加上 述无酶胃液溶解 ,定容 ,摇匀 。精密量取此液 5ml ,用无酶胃液定溶至 50ml ,摇匀 ,再精密量 取此液 5ml ,用无酶胃 液定溶至 50ml , 摇匀 , 即得。 114 生物利用度研究 11411 研究对象 : 受试者 均为健康男性 ,年 龄 21~23 (2116 ±017) 岁 , 体重 53~70 (6313 ±418) kg ,身高 165~180(17116 ±415) cm ,无 烟酒嗜好 ,实验前经询问病史 、体格检查和实 验室检查未发现异常 。无药物过敏史和药物 依赖史 ,无慢 性病史 , 两周 内未服用 任何药 物 ,受试期间统一清淡饮食 ,受试者试验前签 署知情同意书。 11412 研究方法 :采用双周期双交叉试验设 计 ,洗 脱期 : 1 周。将 受试者 随机 等分 成两 组 ,一组先服用受试制剂 ,后服用参比制剂 , 另一组先服用 参比制 剂 ,后 服用受 试制剂 。 志愿者禁食 12 小时后 ,于清晨顿服 100mg 药 物 , 于 服药 前 和 服 药后 0125 , 015 , 0175 , 1 , 115 ,2 ,3 ,4 ,6 ,8 ,10 ,12h ,抽取静 脉血各 3ml 。 血样立即离心 5min 后 ,置 - 20 ℃冰箱中保存 至测定 。 11413 血样浓度测定方法 : 血浆样品采用固
酒石酸美托洛尔片的性状和鉴别研究

酒石酸美托洛尔片的性状和鉴别研究摘要】目的:控制酒石酸美托洛尔片产品质量,针对片剂的性状、鉴别研究并制定了质量标准。
方法:质量研究工作参照中国药典2015年版二部中关于酒石酸美托洛尔及酒石酸美托洛尔片的质量标准,及中国药典2015年版四部片剂通则和化学药品质量标准分析方法验证指导原则进行。
结果:试生产酒石酸美托洛尔片在性状、鉴别符合相关质量要求。
所制备的酒石酸美托洛尔片样品质量稳定,符合相关质量要求。
【关键词】酒石酸美托洛尔片;性状;鉴别【中图分类号】R927 【文献标识码】A 【文章编号】2096-0867(2016)08-171-02石酸美托洛尔是一种强效的Bl肾上腺素受体阻滞剂,可用于治疗高血压、心绞痛、心力衰竭和心律失常等疾病,合理使用可以减少心肌梗死的发生率和病死率[1]。
其剂型有片剂、胶囊剂、注射剂和缓释片。
酒石酸美托洛尔的质量标准研究方法有紫外分光光度法[2-3]、离子选择电极法[4]和高效液相色谱(HPLC)法[5-6]。
1.实验仪器和材料高效液相色谱仪(岛津2010、岛津10A);色谱柱:十八烷基键合硅胶为填充剂(4.6mm×15cm×5μm,安捷伦);电子天平:梅特勒XS205DU(梅特勒-托利多仪器有限公司);溶出度检测仪:RC806(天津天大天发科技有限公司);脆碎度检查仪:FT-2000A(天津天大天发科技有限公司);纯化水(哈尔滨三联药业股份有限公司自制)。
酒石酸美托洛尔片自制样品(来源:哈尔滨三联药业股份有限公司;批号:150801、150802、150803;规格:50mg)。
酒石酸美托洛尔片进口市售样品(商品名:倍他乐克,生产商:阿斯利康制药有限公司,国药准字H32025390,批号:1503064,规格:50mg)。
酒石酸美托洛尔,(来源:广州白云山汉方现代药业有限公司,国药准字H44022678,执行标准中国药典2015年版二部,经哈尔滨三联药业股份有限公司检验合格后使用。
酒石酸美托洛尔片治疗扩张型心肌病的疗效及药理分析

酒石酸美托洛尔片治疗扩张型心肌病的疗效及药理分析摘要】目的:评价酒石酸美托洛尔片在治疗扩张性心肌病的临床疗效与药理机制。
方法:择2015年1月—2017年11月我院收治的100例扩张性心肌病患者展开分析,随机分对照组50例接受常规治疗,分析组50例则在其基础上接受酒石酸美托洛尔治疗,比较两组疗效与安全性。
结果:分析组总有效率为86.00%(43)明显高于对照组60.00%(30),差异具有统计学意义(P<0.05);分析组治疗后不良反应发生率为12.00%(6)明显低于对照组26.00%(13),差异具有统计学意义(P<0.05)。
结论:酒石酸美托洛尔片应用于扩张性心肌病患者中具有理想疗效收益,并可降低并发症,值得临床推广应用。
【关键词】酒石酸美托洛尔片;扩张性心肌病;疗效;药理;安全性【中图分类号】R54 【文献标识码】A 【文章编号】1007-8231(2018)11-0177-02扩张性心肌病(dilated cardiomyopathy,DCM)指的是一组原因不明的原发性心肌肌病,以患者左、右心室或双侧心室扩大,并伴有心室收缩功能障碍、心力衰竭等疾病类型,伴有较高致死率[1]。
药物仍是当前治疗的主要方案,现有研究认为酒石酸美托洛尔片有助于提升临床疗效,且伴有较高安全性。
鉴于此,本文择2015年1月—2017年11月我院收治的100例扩张性心肌病患者展开分析,评价酒石酸美托洛尔片在治疗扩张性心肌病的临床疗效与药理机制,为临床提供参考。
1.资料与方法1.1 一般资料择2015年1月—2017年11月我院收治的100例扩张性心肌病患者展开分析;纳入标准:本组病例入院均行心电图、X线、超声心动图等检查确诊,伴有程度不一的心肌收缩障碍、心力衰竭等典型扩张性心肌病表现,符合临床诊断标准;本组患者中男性72例,女性28例,年龄30~70岁,平均年龄(41.79±2.62)岁,病程6个月~10年,平均病程(4.13±0.85)年;以数字表随机法分两组各50例,两组基线资料差异无统计学意义(P>0.05),具有可比性。
酒石酸美托洛尔片溶出曲线的测定和评价

酒石酸美托洛尔片溶出曲线的测定和评价摘要目的:比较受试片剂和不同厂家市售片剂的溶出行为。
方法:依据中国药典2015版第四部通则0931第二法,结合高效液相色谱法测定受试片剂和市售片溶出度,采用f2相似因子评价不同制剂溶出曲线的相似度。
结果:三种介质中,受试制剂溶出曲线f2因子均大于50,市售片A的溶出曲线f2因子均小于50,市售片B在pH 4.0介质中的溶出曲线f2因子大于50,但在pH 1.2和pH 6.8介质中小于50。
结论:受试片在三种介质中的f2因子均符合一致性评价要求,两种市售片剂则不完全符合,相对而言,pH6.8介质中测定、计算获得的f2因子可以在一定程度上区分不同来源酒石酸美托洛尔片的溶出行为。
ABSTRACT Objective:To compare the dissolution behaviors among home-made metoprolol tartrate tablets and two other commercially available ones. Methods:Dissolution was determined based on Chinese Pharmacopoeia and the similarity of dissolution among those tablets was evaluated by the f2 similarity factor. Results:As compared with the dissolution profiles of reference substance,the f2 similarity factors of the home-made metoprolol tartrate tablets were greater than 50,while those of the commercially available tablet A were less than 50 in pH 1.2,pH 4.0 and pH 6.8 media and those of the commercially available tablet B were greater than 50 in pH 4.0 medium,but less than 50 in pH 1.2 and pH 6.8 medium. Conclusion:The f2 similarity factors of home-made metoprolol tartrate tablets in three different media are consistent with those of reference substance,but two commercially available tablets are not or only partially,indicating that the dissolution behaviors of metoprolol tartrate tablets from different companies can be distinguished to some extent by f2 similarity factors calculated based on the dissolution profiles determined in pH 6.8 medium.KEY WORDS metoprolol tartrate tablets;dissolution profiles;consistency;f2 similarity factor美托洛尔系高选择性β1受体阻滞剂,可以减低心肌自律性,延长房室结有效不应期,减慢传导速度,提高室颤阈值,防止室速、室颤的发生。
不同剂量美托洛尔治疗心肌梗死患者的有效性分析

Health Protection and Promotion August 2021 Vol.21 No.1652临床论著不同剂量美托洛尔治疗心肌梗死患者的有效性分析宋鹏【摘要】 目的 探讨不同剂量美托洛尔治疗心肌梗死患者的临床疗效。
方法 选取2019年1月—2020年1月,本中心收治的心肌梗死患者60例为研究对象,根据患者组间性别、年龄均衡可比的原则分为小剂量组和大剂量组,各30例。
两组均实施美托洛尔治疗,但使用剂量不同,通过观察患者胸痛持续时间及发作次数、心功能及心率改善情况、不良反应,比较两组的治疗效果。
结果 结果表明,大剂量组患者胸痛持续时间及发作次数治疗后均明显降低,且少于小剂量组(P <0.05)。
两组治疗前后的心率变化相差不大,但心功能改善变化大,尤其是大剂量组左心室射血分数(LVEF)高于小剂量组,左心室收缩末期容积(LVESV)低于小剂量组,差异均有统计学意义(P <0.05)。
结论 治疗心肌梗死使用大剂量美托洛尔效果突出,作用更明显。
【关键词】 心肌梗死;美托洛尔;治疗有效性中图分类号 R542.22 文献标识码 A 文章编号 1671-0223(2021)16-052-03作者单位:734000 甘肃省张掖市甘州区北街社区卫生服务中心心肌梗死是由于冠状动脉出现持续缺血、缺氧而导致的心肌坏死症状,是一种冠心病的严重类型[1]。
随着人们生活水平的不断提高,发生心肌梗死的概率逐年上升,具有较高的发病率和病死率,已成为影响人类健康的重要疾病之一。
在药物治疗中,使用美托洛尔可减少心肌梗死出现的梗死面积,降低猝死率和病死率,另外还可控制疾病症状,改善预后[2]。
但临床对于美托洛尔的剂量要求尚未明确。
为此,本研究重点观察分析美托洛尔用药剂量对心肌梗死临床疗效的影响。
1 对象与方法1.1 研究对象选取2019年1月—2020年1月本中心收治的心肌梗死患者60例为研究对象。
纳入标准:所有患者均出现心肌缺血缺氧等症状;发病后生存期大于1个月的患者。
国产酒石酸美托洛尔片的溶出度质量评价
国产酒石酸美托洛尔片的溶出度质量评价严菲;蔡美明;李忠红;陈民辉【期刊名称】《药学与临床研究》【年(卷),期】2015(000)006【摘要】Objective: To evaluate the quality of metoprolol tartrate tablets from 7 different domestic manufacturers by determining their dissolution. Methods: The dissolution of different metoprolol tartrate tablets were determined in the following 4 kinds of mediums, namely water, pH 1.2 sodium chloride hy-drochloric acid solution, pH 4.0 acetate buffer solution and pH 6.8 phosphate buffer solution. The dissolu-tion tests were proceeded by paddling at 50 r·min-1. The differences in the dissolution rates among the ref-erence preparation and the 7 domestic products were evaluated by a similarity factor method. ResuIts: The dissolution curves of metoprolol tartrate tablets from the 7 domestic manufacturers were different. The f2 factors of products from manufacturers C, F and G were under 50. The drug release behavior showed sig-nificant difference with that of the reference preparation. ConcIusion: There are significant differences in the quality among the metoprolol tartrate tablets from different manufactures. Attentions should be paid to the quality of domestic metoprolol tartrate tablets.%目的:通过考察国内7家不同生产企业的酒石酸美托洛尔片与参比制剂(商品名:倍他洛克 TM)的体外溶出情况评价药品质量。
酒石酸美托洛尔片中间产品检验方法验证报告
分发部门:目录一、概述二、验证前准备三、验证记录与结果四、漏项与偏差处理五、评价与建议六、验证结论七、附件:相关记录一、概述为更好实现产品过程控制,我中控实验室依据《分析方法确认与验证管理规程》(文件编码:F0004-00)与《中华人民共和国药典》2010版附录中相关规定和相应指导原则的要求,制定出一系列检验方法验证实验来考察本产品中间产品检验方法的适用性,从而确保该方法能够可靠有效地用于控制药品的内在质量。
本中间产品检验标准操作规程中所列检验项目有:含量测定,溶出度,干燥失重。
其方法验证参见相应成品检验方法验证,现主要对酒石酸美托洛尔含量测定检验项目进行方法验证。
验证实施时间:自年月日开始至年月日完成。
二、验证前准备1、培训确认2、所用仪器设备,包括电子分析天平、检验方法中规定的仪器设备已经校验,且在有效期内。
3、试验所用的玻璃计量器具需清洁,并经检定后符合要求。
4、相关对照品、试剂试药均符合《中国药典》要求。
三、验证结果1、含量测定方法各项验证实验结果含量——专属性验证结果试验人/日期复核人/日期含量——重复性验证结果试验人/日期复核人/日期含量——准确度验证结果是否符合要求:试验人/日期复核人/日期含量——线性验证结果试验人/日期复核人/日期2、含量测定方法验证小结小结人:日期:四、漏项与偏差处理无五、评价与建议小结人:日期:六、验证结论总结人:日期:七、附件相应验证记录与图谱。
酒石酸美托洛尔片中间产品检验方法验证记录1 检验依据:《中国药典》2005版。
2 检验方法:取相当于本品20片的颗粒,精密称定,研细,精密称取适量(约相当于酒石酸美托洛尔0.12g),置100ml量瓶中,加2%氯化钠溶液适量,振摇使酒石酸美托洛尔溶解并稀释至刻度,摇匀,滤过,滤过,精密量取续滤液5ml,置50ml量瓶中,加水稀释至刻度,摇匀。
照紫外-可见分光光度法(中国药典2005年版二部附录IV A),在274nm的波长处测定吸收度。
采用视频跟踪技术考察酒石酸美托洛尔片的溶出行为
采用视频跟踪技术考察酒石酸美托洛尔片的溶出行为
李耕;严菲;曹玲;夏颖;陈民辉
【期刊名称】《中国处方药》
【年(卷),期】2022(20)2
【摘要】目的采用视频跟踪技术考察酒石酸美托洛尔片的溶出行为,为仿制药的质量评价提供新的技术参考。
方法以酒石酸美托洛尔片为模型药物,pH1.2的氯化钠盐酸溶液为溶出介质,采用摄像头视频跟踪直观考察溶出行为;同时测定酒石酸美托洛尔片的溶出曲线并计算相似因子(f_(2)),并对处方组成、比例及其制剂工艺进行剖析。
结果各时间点的视频图显示各企业样品均为溶蚀性崩解,与原研一致;企业A的样品与原研溶出行为最为接近,B、G和J的25 mg规格样品以及企业E、I和J的50 mg规格样品与原研溶出行为存在较大的差异,与溶出曲线获得的结果一致。
溶出视频记录的溶散速率和崩解的颗粒大小、形态更直观反映出处方工艺的差异。
结论视频跟踪技术清晰客观地反映了酒石酸美托洛尔片的溶出行为,为溶出质量评价提供新思路新方法。
【总页数】3页(P21-23)
【作者】李耕;严菲;曹玲;夏颖;陈民辉
【作者单位】江苏省食品药品监督检验研究院
【正文语种】中文
【中图分类】TP3
【相关文献】
1.酒石酸美托洛尔片仿制与原研的溶出度比较
2.酒石酸美托洛尔片溶出曲线的测定和评价
3.酒石酸美托洛尔片仿制药与原研药溶出曲线的相似性评价
4.利巴韦林胶囊溶出曲线测定方法的建立及国产利巴韦林胶囊溶出行为的考察
5.采用原研制剂制备米诺膦酸片及体外溶出度的一致性考察
因版权原因,仅展示原文概要,查看原文内容请购买。
酒石酸美托洛尔片人体生物利用度和生物等效性研究
心得安相比除 了 其 药 效 学 上 具 有 " & 受体阻滞剂的 优点外, 也有其药代动力学优点, 如较心得安首过效 应弱、 体内代谢途径简单、 大部分代谢产物无药理活
[ #] 。因此, 实验只需测定血浆中参比制剂与试 性等
验制剂原型药物 浓 度, 比较两者生物等效性和生物 利用度。 本试验的目的是以阿斯利康制药有限公司生产 的酒石酸美托洛尔 片 (进 口) 为 参 比 制 剂, 通过比较 研究石家庄以岭药业股份有限公司研制的酒石酸美 托洛尔片 (国产) 与参比制剂的给药后的药代动力学 参数, 考察两者的生物等效性, 并计算国产制剂相对 于进口制剂的生物利用度。
F#
浓度数据, 求出 其 均 值 及 标 准 差。 计 算 出 每 位 受 试 者的主要药代动 力 学 参 数 ( " :N> 和 # :N> 采 用 实 测 值, 其 他 参 数 用 7*8 程 序 计 算 ) 。 $%# 用 梯 形 法 计 算, 根据 每 位 受 试 者 交 叉 应 用 试 验 制 剂 和 参 比 制 剂 ( $%# ! F / ) 。 ! % # ’ 后血药浓度 B 时间曲线下面积 & 4 ? $%# 试 验 药 ( $%# 对 照 药 ; #!!C 根据 8O7* 和 PE6 有 关 生 物 等 效 性 试 验 指 导 原则, 对 $%# ! F / 、 " :N> 和 # :N> 采用孙瑞元教授主编 的 其中 7*8 程序进行 双 向 单 侧 ’ 检 验 进 行 统 计 分 析,
# ・K F (图 。 结 果 表 明, 空白血浆中的内源 $! ’ # F 9)
性物质不干扰酒石酸美托洛尔和氢溴酸右美沙芬的 测定。 $ %# %$ 灵敏度 用最低检测限 ( ,LR-4 ,+:+/ LS TUN./+B 表示, 能测出 " I & 个 半 衰 期 或 能 检 出 /N/+L.,KK6V) # :N> 的 #(#! I #($! 的 药 物 浓 度。本 方 法 测 定 的 最 低 检测限为 $ % ! ! ・K F # 。 ’ $ %# % " 精密度与准确度 按 “血 浆 样 品 的 处 理” 项 操作, 制备酒石酸美托洛尔低、 中、 高 " 个浓度 (分 别 为 #! 、 ・K F # ) 的质量控制 ( V9) 样品, 每 一浓 &! 、 $!! ! ’ 度进行 & 样本分 析, 连 续 测 定 " H, 根据当日的标准 曲线, 计算 V9 样 品 的 测 得 浓 度, 根 据 V9 样 品 结 果 计算本法的准确度与精密度, 结果见表 # 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
符合规定 符合规定 转篮法 桨板法 100转/分 50转/分 不加酶的人工胃液 水 900ml 为 溶 出 介 900ml 为 溶 出 介 质 , 质, 30分钟取样 30分钟取样 275nm测定 HPLC法测定 限度:75% 限度:80% 符合片剂通则 HPLC法。 限度:93.0-107.0%
其他
TABLET;ORAL
TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL
100MG
25MG 50MG 100MG 25MG 50MG 100MG 25MG 50MG 100MG
酒石酸美托洛尔片一致性评价 方法研究
江苏省食品药品监督检验研究院 陈民辉 2015年11月
酒石酸美托洛尔片一致性评价方法研究
1 2 3
背景介绍
酒石酸美托洛尔一致性评价方案研究
仿制药一致性评价的相关思考
酒石酸美托洛尔基本情况
1975年ASTRA公司首研
全球销量最大的
β受体阻滞剂
商品名为“倍他乐克”
METOPROLOL TARTRATE
METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE
高血压心绞痛的首选药 物
仿制药的质量属性
安全等效
• BA/BE试验一致
• 有关物质限量 • BA/BE试验一致
临床疗效等效
药学等效
体外溶出行为一致 • 过程控制、制剂稳定性
• 原辅料、处方、工艺一致
仿制药质量一致性评价研究的依据
1 普通口服固体制剂参比制剂的选择与确立指导原则
2
3
普通口服固体制剂溶出曲线测定与比较指导原则
酒石酸美托洛尔片研究用参比样品信息
唯一号 批号 规格 片 /盒 含量(%)
JS2012YT0408 JS2012YT0409
JS2012YT0450 JS2012YT0410 JS2012YT0411 JS2012YT0412 JS2012YT0766 JS2012YT0767 JS2012YT0768
(2) HPLC鉴别 (3) UV-Vis鉴别
[检查] 有关物质 含量均匀度
(2) TLC鉴别
(2) UV-Vis鉴别 (3) HPLC鉴别
/ /
溶出度
HPLC法。 HPLC法。 限 度 : 单 个 最 大 杂 质 限度:单个最大杂 ≤0.3%,杂质总量≤0.5% 质≤0.3% ,杂质总 量≤0.5% 25mg规格有此要求 / 转篮法 / 100转/分 氯化钠的盐酸溶液 900ml 或500ml为溶出介质, 30分钟取样 274nm测定 限度:75% 符合片剂通则 HPLC法。 限度:95.0-105.0%
AUROBINDO PHARMA
AUROBINDO PHARMA AUROBINDO PHARMA IPCA LABS LTD IPCA LABS LTD IPCA LABS LTD MUTUAL PHARM MUTUAL PHARM MUTUAL PHARM MYLAN
阿斯利康制药有限公司地产化产品
日本橙皮书收载情况
< 20mg规格 片剂 > A型(阿司利康)
日本橙皮书收载情况
< 20mg规格 片剂 > B型(诺华)
日本橙皮书收载情况
< 40mg规格 片剂 > A型(阿司利康)
日本橙皮书收载情况
< 40mg规格 片剂 > B型(诺华)
美托洛尔的BCS分类
Compound: Metoprolol
US PHARMS HOLDINGS I ALEMBIC PHARMS LTD ALEMBIC PHARMS LTD ALEMBIC PHARMS LTD
N017963 AB
N017963 AB A202871 AB A202871 AB A202871 AB
No
No No No No
METOPROLOL TARTRATE
pH-溶解度曲 线图的测定
溶液稳定性 测定
酒石酸美托洛尔pKa的测定
方法:采用电位pH值滴定法
结果:酒石酸美托洛尔电解常数pKa为9.7
与日本橙皮书收载结果一致!
pH-溶解度曲线图的测定
批号 溶剂 水 pH 1.2 pH 2.0 pH 3.0 pH 4.0 606147 pH 5.0 称样(g) 1.00 1.00 1.00 1.00 1.00 1.00 体积(ml) 1.00 1.00 1.00 1.00 1.00 1.00 现象 完全溶解 完全溶解 完全溶解 完全溶解 完全溶解 完全溶解
METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE
A077739 AB
A077739 AB A077739 AB A078459 AB A078459 AB A078459 AB A073654 AB A073654 AB A073653 AB A076704 AB
仿制药质量一致性评价人体生物等效性研究技术指导原则
11月4日征求意见稿
研究背景——溶出曲线研究的作用
1
为仿制药体内生物等效性试验提供研究指导 用于剖析参比制剂的内在技术特点 用于仿制药与被仿制药质量的一致性评价 建立用于质量控制的溶出度试验方法
2
3 4
酒石酸美托洛尔片一致性评价方法研究
1 2 3
1210051 1210052
1210053 1210016 1210018 1210019 60001223 60001345 60001346
25mg 25mg
25mg 50mg 50mg 50mg 100mg 100mg 100mg
20 20
20 20 20 20 220 300 300
100.2 100.0
参比制剂的选择
原研
多来源 国内上市
优选
国外上市
日本橙皮书品种目录
FDA ORANGE BOOK(FDA橙皮书)
Appl No TE Code RLD Active Ingredient
Dosage Form; Route
TABLET;ORAL
TABLET;ORAL TABLET;ORAL TABLET;ORAL TABLET;ORAL
[含量测定]
符合片剂通则 符合片剂通则 UV 法 , 无 水 乙 醇 HPLC法。 为 溶 剂 , 274nm 测 限度:90.0-110.0% 定,对照品法。 限度:95.0-105.0%
Байду номын сангаас
日本橙皮书收载情况 酒石酸美托洛尔理化性质
结构式: 解离常数(25℃): pKa ≈9.7 37℃在各溶出介质中的溶解度: pH1.2:1.0g/ml以上 pH4.0:1.0g/ml以上 pH6.8:1.0g/ml以上 水:1.0g/ml以上
Strength
100MG
50MG 100MG 25MG 50MG
Proprietary Name
LOPRESSOR
LOPRESSOR METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE
Applicant
US PHARMS HOLDINGS I
背景介绍
酒石酸美托洛尔一致性评价方案研究
仿制药一致性评价的相关思考
评价方案研究
1、文献查阅 FDA orange book 2、参比制剂的选择 日本橙皮书
评价方案研究
3、试验部分
地产化产品 原料药理化性质的测定 仪器的验证 溶出方法的建立 预实验 4、评价方法的确立
5、草案的拟定
查阅产品相关文献
经过检查,每个搅拌桨都符 合要求 每个仪器的溶出杯,搅拌桨, 转篮,篮杆单独放置,没有 发生刮擦。
均符合USP的COA或者COC USP和CP的规定是一样的
其它
器皿
转篮 规格
搅拌桨
所有的溶出杯必须有编号,有符合USP的COA 或者COC 或者自己测量规格参数 所有的转篮和篮头必须有编号,有符合USP的 COA或者COC 或者自己测量规格参数 所有的搅拌桨必须有编号,有符合USP的COA 或者COC 或者自己测量规格参数
267.36
1000.0 1.34 Measured HIGH Permeability
Do (min) 1.9E-4 1.0E-4 2.0E-4
Do (max) 4.0E-4 4.0E-4 4.0E-4
Solubility HIGH HIGH HIGH
BCS Class (Human) Class I Class I Class I
No
No No No No No No No No Yes
METOPROLOL TARTRATE
METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE METOPROLOL TARTRATE
99.7 99.8 99.7 98.8 100 99 100
