制备氢氧化亚铁(有答案)
高中化学“氢氧化亚铁的制备”
高中化学“氢氧化亚铁的制备”
关键词:高中化学、“氢氧化亚铁的制备”、知识归纳
在进入今天的主题前,我们先来瞅瞅下面这道题。
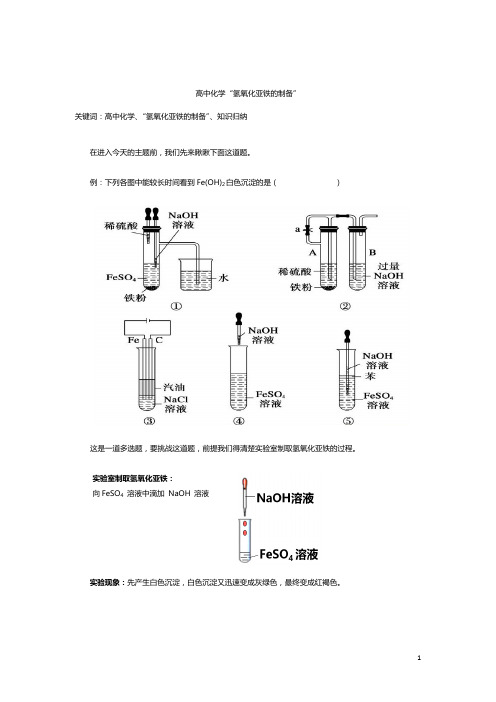
例:下列各图中能较长时间看到Fe(OH)2白色沉淀的是()
这是一道多选题,要挑战这道题,前提我们得清楚实验室制取氢氧化亚铁的过程。
实验室制取氢氧化亚铁:
向FeSO4溶液中滴加NaOH 溶液
实验现象:先产生白色沉淀,白色沉淀又迅速变成灰绿色,最终变成红褐色。
由实验现象可知,制得的白色氢氧化亚铁沉淀持续的时间很短。
为了提高观察效果,我们就必须改进实验,使白色氢氧化亚铁沉淀持续时间更长。
实验实质:(备注:以下涉及的化学方程式或者离子方程式中,沪教版用箭头连接,人教版用等号连接。
)
所以,要想得到持续时间更长的白色氢氧化亚铁沉淀,必须防止第二步氢氧化亚铁与氧气的反应。
那么问题的关键就变成了——隔绝O2。
试剂避氧:
例如:
1、把配制溶液用的蒸馏水事先加热煮沸一下。
2、使用新配制的FeSO4溶液和NaOH溶液。
操作避氧:
例如:
3、加入NaOH溶液的胶头滴管的尖端插入FeSO4溶液液面以下。
装置避氧:
例如:
4、如果在试管中FeSO4溶液液面上预先注入一层植物油或苯。
因此,成功制备氢氧化亚铁的前提是避氧,避氧的方法总结如下:
①用煮沸的蒸馏水新配置溶液;
②滴管需要插入到液面以下;
③采用液封或氢气保护的实验装置。
吃透了实质,我们再回头来刷开始的那道题目。
结果就很简单了,答案是:①②③⑤。
氢氧化亚铁制备

氢氧化亚铁制备
氢氧化亚铁是一种重要的化学物质,在工业上有着广泛的应用。
它是由氢氧化钠反应亚铁氢气而制得,即氢氧化亚铁反应。
氢氧化亚铁反应可以概括如下:Fe +2NaOH +3H2→ Fe(OH)3 +2NaH。
该反应可以由若干种结构组成,其中最主要的组成部分包括硫酸钠、氢氧化钠和氢氧化亚铁。
当氢氧化钠和氢氧化亚铁组合时,将形成激烈变化,从而产生氢氧化亚铁。
在制备氢氧化亚铁的过程中,主要的技术要素有:分离、脱水、熔融、电解、细致之类。
首先,将灰铁进行分离,将其中的纯铁和其他杂质分离出来,然后将纯铁块放入脱水机进行脱水,去除水分;之后,将脱水好的铁块放入熔融炉中熔融,当其完全熔融之后,可以获得熔融铁條;接着将熔融铁放入电解槽中进行电解,电解过程中将电解出氢氧化亚铁。
最后,再将所得氢氧化亚铁经过细致,将其转换为粉状,以便更好地利用。
以上就是氢氧化亚铁制备的步骤,为了获得更高质量的氢氧化亚铁,实验过程中要控制住各个参数,尤其是温度的控制,因为温度的变化将会直接影响氢氧化亚铁的最终结果。
制备氢氧化亚铁的方法

制备氢氧化亚铁的方法
氢氧化亚铁(Fe(OH)2)的制备方法有多种,以下为一种常用方法:
材料:
1. 铁粉(Fe)
2. 醋酸钠(NaCH3COO)
3. 氢氧化钠(NaOH)
4. 水(H2O)
步骤:
1. 将一部分铁粉(Fe)加入适量的水(H2O)中,搅拌使其完全湿润。
2. 将醋酸钠(NaCH3COO)逐渐加入铁粉溶液中,并继续搅拌,直到产生稀释盐酸(HCl)气体停止为止。
3. 逐渐加入氢氧化钠(NaOH),并继续搅拌,直到溶液变为混浊的灰色沉淀。
4. 将混浊的沉淀用过滤纸或滤芯分离出来,用水洗净以去除未反应的化学品。
5. 将得到的湿沉淀置于开放空气中晾干,或者在低温烘箱中加热干燥。
注意事项:
- 在操作过程中,需要注意使用适当的眼部和呼吸保护设备,以避免化学品对人体的伤害。
- 该实验涉及到的化学品可能有毒,应在通风良好的实验室中进行,并遵循相关的实验规范。
高三化学 氢氧化亚铁的制备方程式

氢氧化亚铁的制备方程式因Fe(OH)2在空气中易被氧化,4Fe(OH)2+O2+2H2O===4Fe(OH)3,故Fe(OH)2在水中不能稳定存在,在实验室制取Fe(OH)2时,一定要用新制的亚铁盐和先加热驱赶掉O2的NaOH溶液,且滴管末端要插入试管内的液面以下,再滴加NaOH溶液,也可以在反应液面上滴加植物油或苯等物质进行液封,以减少Fe(OH)2与O2的接触。
关于Fe(OH)2制备的方法很多,核心问题有两点,一是溶液中溶解的氧必须除去,二是反应过程必须与O2隔绝。
1、操作方法:在试管里注入少量新制备的硫酸亚铁溶液,再向其中滴入几滴煤油,用胶头滴管吸取氢氧化钠溶液,将滴管尖端插入试管里溶液液面下,逐滴滴入氢氧化钠溶液,观察现象。
另外,为使氢氧化亚铁的制备成功,先将硫酸亚铁溶液加热,除去溶解的氧气。
实验现象:滴入溶液到硫酸亚铁溶液中有白色絮状沉淀生成。
白色沉淀放置一段时间,振荡后迅速变成灰绿色,最后变成红褐色。
注:白色沉淀:Fe(OH)2;灰绿色沉淀:Fe(OH)2和Fe(OH)3的混合物;红褐色沉淀:Fe(OH)3方法的改进:可在液面上滴加苯或者油进行液封,可有效防止氧的溶解。
氢氧化亚铁的制备在如图所示的装置中,用NaOH溶液、铁屑、稀H2SO4等制备。
(1)在试管I里加入稀H2SO4和铁屑;(2)II中的试剂加入前应煮沸;(3)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后稍等片刻后关闭止水夹;(4)试管Ⅰ中反应生成的H2充满了试管Ⅰ和试管Ⅱ,且外界空气不易进入,这样生成的Fe(OH)2沉淀能较长时间保持白。
•氢氧化亚铁:化学式为Fe(OH)2,白色固体,难溶于水,碱性较弱,可与常见酸反应;在空气中易被氧化,白色→灰绿色→红褐色。
反应方程式如下:(1)(2)(3)•氢氧化亚铁的性质:氢氧化亚铁极易被氧化,水中的溶解氧就可以把它氧化。
4Fe(OH)2+O2+2H2O=4Fe(OH)34Fe(OH)2+O2=△=2Fe2O3+4H2O•铁的氢氧化物:【典例】Ⅰ.用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配制的NaOH 溶液反应制备。
氢氧化亚铁的制备.

4. 打开a处止水夹,用洗耳球从b处鼓气,使 试管Ⅱ中的氢氧化钠溶液被轻轻压入试管 Ⅰ中,即可在试管Ⅰ中看到白色絮状沉淀 生成。白色可在相当长的时间内不改变。 5. 从a处用洗耳球向试管Ⅰ中鼓入空气,振 荡,可看到白色絮状沉淀变成灰绿色, 最后变成红褐色。
改进Ⅴ
1. 向烧杯中加入无锈光亮的铁丝团或铁钉, 再加入1:4的稀硫酸,盖上一个表面皿, 给烧杯加热,待反应完全后,停止加热, 冷却待用。
3. 称取3.4g固体氯化铵置于洁净的烧杯 中,再加入28.5mL浓氨水,搅拌,溶解后, 移至50mL的容量瓶中,加入经煮沸过的、 冷却的蒸馏水稀释到刻度备用。 4. 在漏斗上放置一张折叠好的滤纸,用煮沸 过的蒸馏水润湿滤纸,并使之紧贴在漏斗 内壁,赶去滤纸和漏斗壁之间的气泡,再 注入较多的经煮沸的蒸馏水,使漏斗颈内 充满水形成水柱,这样既可加快过滤速度, 又可排除漏斗颈中的空气,防止Fe2+被氧 化。
氢氧化亚铁的制备
【实验目的】
1. 使学生掌握氢氧化亚铁制备的方法; 2. 使学生掌握产生氢氧化亚铁时的现象及 其转化为氢氧化铁时的现象。
【实验原理】
+2价铁离子与碱反应,生成白色絮状的氢氧化 亚铁沉淀,氢氧化亚铁在空气中不稳定,又迅 速变成灰绿色,最后变成红褐色的氢氧化铁沉 淀。反应的离子方程式及化学方程式为: Fe2++2OH- = Fe(OH)2↓ 4Fe(OH)2+O2+2H2O = 4Fe(OH)3
3. 氢氧化亚铁的制备
取1支5mL针筒,将针头插入盛有硫酸亚铁的 针筒内,抽取2mL-3mL硫酸亚铁溶液,排出 空气,将此溶液通过胶帽,注入盛有氢氧化 钠溶液的针筒内,立即有白色沉淀生成(如图 7-30II所示)。
氢氧化亚铁的制备

在Fe(OH)2制备中,你 还能想出更好的改进
方法吗?
-
铁的氢氧化物的制备
利用可溶性铁盐与碱溶液反应制备
Fe3++3OH-==Fe(OH)3↓ Fe2++2OH-==Fe(OH)2↓
制备Fe(OH)2实验改进方案:
注意:避免 与氧气接触
-
谢谢!
-
-
NaOH溶液
FeSO4溶液
白色 迅速 灰绿色 最终红褐色
Fe2++2OH-==Fe(OH)2↓
-
实验反思
为什么会出现这样的颜 色变化?
4Fe(OH)2+2H2O+O2==4Fe(OH)3
-
成功 制
备Fe(OH)2 的关键:
操作避氧
避 氧
试剂避氧
装置避氧
-
如何改进实验方案呢?
-
方法总结: ①用煮沸的蒸馏水配置溶液 ②滴管需要插入到液面以下 ③采用液封或氢气保护的实 验装置
-
铁的氢氧化物
Fe(OH)32的性质:白红色褐固色体固,体难,溶难于溶水,
于可水溶,解铁可在的溶酸解中氢在。氧酸不化中稳物,定分受,热极别易具分被解氧。化 F2成也Fe(e为FO(OeHF(H)O3e)+32H=3O△H=有)F3+3。=e。2=哪OF在3e+3些3+空+H32性气HO2O中质受呢热?分解的产物
Fe(OH)2+2H+==Fe2++2H2O
-
活动探究(1): 如何制备铁的氢氧化物?
-
方案探究:
金属氢氧化物的制备方法: ①活泼金属与水反应 ②活泼金属氧化物与水反应 ③可溶性盐与碱溶液反应
-
实验验证:
专题十四 氢氧化亚铁制备

专题十四氢氧化亚铁制备
作者:汤国柱
来源:《广东教育·高中》2015年第11期
高考动向
理解和掌握氢氧化亚铁制备的特殊性,从而加深对氢氧化亚铁的不稳定性强、还原性的认识、记忆和巩固。
考点分析
氢氧化亚铁制备。
(1)原理:Fe2++2OH-Fe(OH)2↓
(2)操作步骤:往硫酸亚铁溶液中滴入少量氢氧化钠溶液。
现象:先产生白色沉淀,后白色沉淀迅速变成灰绿色,最后变成红褐色,化学方程式:
Fe2++2OH-Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O4Fe(OH)3(红褐色)
(3)注意事项:
空气中Fe(OH)2能够非常迅速地被氧气氧化成Fe(OH)3。
考点突破
1. 成功制备Fe(OH)2的关键。
解析:Ⅰ.(1)钠的密度在煤油和水之间,与水反应生成NaOH和氢气,生成的NaOH和FeSO4反应生成Fe(OH)2沉淀,所以反应的现象为钠在煤油和FeSO4溶液之间跳动,有气泡生成。
(3)利用电解原理生成Fe(OH)2,所以阳极为金属铁,生成Fe2+,阴极为惰性电极碳棒,电解质溶液电解生成OH-,则符合条件的电解质溶液为NaCl溶液。
生成的Fe (OH)2易被氧气氧化,所以加热煮沸除去溶液中溶解的氧气。
Ⅱ.(1)根据资料信息及配色原理可知灰绿色物质应是氢氧化亚铁晶体,化学式为Fe(OH)2·nH2O。
(2)Fe3(OH)8可写成FeO·Fe2O3·4H2O,可利用检验Fe3+的方法来检验。
(作者单位:蕉岭县蕉岭中学)
责任编校李平安。
用硫酸亚铁制备氢氧化亚铁

用硫酸亚铁制备氢氧化亚铁1.引言1.1 概述硫酸亚铁是一种重要的无机化合物,是通过将硫酸与亚铁粉末反应得到的。
它具有广泛的应用领域,特别是在化学实验室和工业生产中。
而氢氧化亚铁则可通过将硫酸亚铁溶液与碱反应得到。
本文将介绍使用硫酸亚铁制备氢氧化亚铁的方法,这是一种常用的实验室制备方法。
首先将详细介绍制备硫酸亚铁的步骤和实验条件。
然后,将介绍制备氢氧化亚铁的方法,包括反应的化学方程式和实验过程。
最后,将总结实验结果并讨论可能的应用领域。
通过本文的阅读,读者将了解到硫酸亚铁和氢氧化亚铁的制备方法,并了解到其在实验室和工业中的应用。
同时,读者也可以了解到实验过程和实验条件,以便在需要的时候可以进行类似的实验。
此外,本文还将提供可能的应用领域,为读者进一步的研究和应用提供参考。
1.2文章结构文章结构部分的内容可以包括如下内容:文章结构部分旨在介绍本文的整体结构和各个部分的内容安排,以便读者能够更好地理解文章的逻辑和组织架构。
本文分为引言、正文和结论三个部分。
引言部分将对本文进行概述,介绍硫酸亚铁和氢氧化亚铁的相关背景知识,以及本文的研究目的。
正文部分包括了制备硫酸亚铁和制备氢氧化亚铁的方法。
在制备硫酸亚铁的方法中,将介绍所采用的实验步骤、原材料和操作条件,以及反应机理和反应过程。
在制备氢氧化亚铁的方法中,同样会给出实验步骤、原材料和操作条件,并解释反应机理和反应过程。
结论部分将总结本次实验的结果,对实验数据进行归纳和分析,并提出可能的应用领域。
通过实验结果的总结,可以对制备硫酸亚铁和氢氧化亚铁的方法进行评估和比较,指出其优缺点及存在的问题,并展望其在实际应用中的潜力和前景。
以上就是本文的结构安排,通过这样的结构安排,读者可以清晰地了解文章内容的组成和逻辑关系,有助于读者更好地理解和阅读文章。
1.3 目的本文旨在介绍用硫酸亚铁制备氢氧化亚铁的方法和过程,并探讨其可能的应用领域。
通过实验和理论分析,我们将深入了解硫酸亚铁和氢氧化亚铁的性质、制备方法和反应机理,为进一步研究和应用提供基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
制备氢氧化亚铁
①原理:Fe+H2SO4=FeSO4+H2↑(或铁置换硫酸铜)
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓
②现象(第二个反应):产生白色絮状沉淀,溶液由浅绿色变为无色,产生的白色絮状沉淀迅速转化为灰绿色,最后变为红褐色沉淀。
③氢氧化亚铁变质原理:
________________________________
④实验设计:
⑤实验操作、现象及结论:
(1)当A装置开始产生气体时,打开弹簧夹,此时B 装置中的现象为____________________。
(2)若此时关闭弹簧夹,则能看到的现象是_________。
(3)请写出B中发生反应的化学方程式__________。
(4)请写出该实验能发生反应的原理(不是反应原理)___________________________.
(5)用铁和稀硫酸反应制取硫酸亚铁的好处是
__________________。
(为什么不用铁置换硫酸铜制取硫酸亚铁)
(6)若不采用此装置,采用正常装置,则为防止生成的氢氧化亚铁被空气中的氧气氧化为氢氧化铁,可以做如下操作:
Ⅰ.在原来的硫酸亚铁溶液中加入________,可防止氢氧化亚铁氧化,请写出该原理的离子方程式__________。
Ⅱ.将试管伸入硫酸亚铁溶液中滴加氢氧化钠的目的是______________。
Ⅲ.在实验进行前,可以将蒸馏水_______,这样做的目的是__________。
(7)如果在二氯化铁溶液中滴入硫氰酸钾溶液,溶液出现血红色,则可能二氯化铁溶液中混有__________(写出三种或更多),请写出其中一种的离子方程式________,请写出溶液出现血红色的化学方程式__________。
生成的血红色物质是沉淀吗?_____如果不是,请写出这类反应发生的原理_________,并写出这种物质叫做什么__________。
(8)单质铁,二价铁离子和三价铁离子之间能否互相转化?_________,若能,请写出每种反应的化学方程式。
___________________________________________
③4Fe(OH)2+2H2O+O2=4Fe(OH)3 2’
⑤
(1)装置B的导管口有气泡产生。
2’
(2)装置A中的溶液被倒吸入B中,过一段时间产生白色絮状沉淀。
4’
(3)2NaOH+H2SO4=Na2SO4+2H2O
FeSO4+2NaOH=Na2SO4+Fe(OH)2↓4’
(4)装置A中铁和稀硫酸反应生成氢气,使装置A 内气压变大,氢气将部分硫酸和硫酸亚铁溶液压入装置B中,使氢氧化钠和硫酸亚铁开始反应。
4’(5)装置A中铁和稀硫酸反应能生成氢气,氢气会通过导管进入装置B。
氢气难溶于水,将装置B中的氧气排掉,使氢氧化亚铁能被保存较长时间(或使氢氧化亚铁不被空气中的氧气氧化)。
4’
(6)
Ⅰ. 铁钉Fe+2Fe3+=3Fe2+(该反应运用了三价铁离子的氧化性)4’
Ⅱ.使生成的氢氧化亚铁保留在底部,不与氧气接触。
(或防止被空气中的氧气氧化)2’
Ⅲ.煮沸除去蒸馏水中少量溶解的氧气,使氢氧化亚铁能保留较长时间。
4’
(7)
Cl 2,O 2,H 2O 2,KMnO 4溶液,K 2Cr 2O 7溶液(写三种);
6’
2Fe 2++Cl 2=2Fe 3++2Cl -(氯气) 或H 2O 2+2H ++2Fe 2+=2H 2O+2Fe 3+(双氧水) 或4Fe 2++O 2 + 4H +=4Fe 3+ + 2H 2O (氧气) 或MnO4- +5Fe 2++8H +=Mn 2++5Fe 3++4H 2O (高锰酸钾溶液)
或6Fe 2++Cr 2O 72-+14H + =6Fe 3+ +2Cr 3+ +7H 2O (重铬酸钾溶液)【写一种】; 2’ FeCl 3+3KSCN=Fe(SCN)3+3KCl ; 2’ 不是; Fe 3++ 3SCN -=Fe(SCN)3; 4’ 络合物(配位化合物) 2’
(8)能; 2’
铁变为二价铁:Fe+H 2SO 4=FeSO 4+H 2↑ 铁变为三价铁:+2
3232Fe Cl FeCl 点燃 二价铁变为铁:222FeO C Fe CO ↑++高温 三价铁变为铁:232323Fe O CO Fe CO ++高温
二价铁变为三价铁:2FeCl 2+Cl 2=2FeCl 3 三价铁变为二价铁:2FeCl 3+Fe=3FeCl 2 12’ 总计:60’。
