金属指示剂
分析化学 第5章 金属指示剂

OH
OH COOH
NaO3S
NN
不同 pH 时颜色不同, 重点掌握其性质和适用的 pH 范围, 以下介绍之。
性质 1. 只在 pH 8 ~ 13 时本身为蓝色
pH 小于 8 和大于 13 时本身均为近红色。
2. 各 pH 下均与 Ca2+生成红色配合物。
可见,为了使终点有明显颜色变化,
适用范围: pH 8 ~ 13 最常用于: pH 12 ~ 13 的 Ca2+、Mg2+ 混合液
解 查附录Ⅲ得:
lgKӨ(BiY) = 27.94 lgKӨ(PbY) = 18.04 已知 c(Bi3+) = c(Pb2+) = 0.01 mol·L-1 ∵ lgcr(Bi3+)KӨ(BiY) - lgcr(Pb2+)KӨ(PbY) = 27.94 - 1Байду номын сангаас.04 = 9.9 > 5 ∴ 可利用控制溶液酸度法选择滴定 Bi3+。 查酸效应曲线(P93 图 5.3)得滴定 Bi3+ 的最低 pH = 0.7,即 pH > 0.7 时可准确 滴定 Bi3+。
滴定开始后,EDTA 滴定剂先与游离的 M 反应, 游离的 M 反应完全后,发生如下置换反应:
Y + MIn 乙色
MY + In 溶液由乙色变为甲色 甲色 以指示终点到达。
二、金属指示剂应具备的条件
由以上原理可以理解:
1. MIn 之色与 In 之色应显著不同;
以使终点有明显色变。
2. 反应灵敏、迅速, 有良好的可逆性;
因此:
lg cr (M)K (MY) lg cr (N)K (NY) lg cr (M)K (MY) lg cr (N)K (NY) ≥ 5 时
金属指示剂名词解释

金属指示剂名词解释
金属指示剂是一种影响金属产品表面质量的重要因素,包括各种颜色、功能和性能等。
它们可以在金属和其他材料上形成一层膜层,以及提供防腐、防护或装饰的作用,使金属的使用寿命大大延长。
一般而言,金属指示剂可以分为防腐剂和涂料。
防腐剂称作表面处理剂,主要用于防止金属表面的污染、腐蚀和氧化,以及颜色的变化。
涂料则是将金属表面做一层保护,以减少金属表面的磨损和腐蚀,并增加金属表面的光泽度。
第二段:
有一类特殊的金属指示剂,叫做表面活性剂,它们主要是为了提高金属表面的润湿性,以便把涂料稳定地附着在金属表面上。
表面活性剂的作用不仅仅是在金属表面做一层保护,还可以增强金属表面的抗腐蚀、耐磨性和延展性能,以提高产品的使用寿命。
此外,还可以增加金属表面的粘合性,使涂料更好地与金属表面结合,以改善产品外观和性能。
第三段:
金属指示剂也可以分为选择性和非选择性类型。
选择性类型包括抑制剂、静电喷涂剂、离子源表面活性剂和聚合物表面活性剂等,它们的作用是保持金属表面的平整度和润湿性,以便把涂料附着到金属表面上。
非选择性类型包括电镀剂、氧化剂、磷化剂和电泳剂等,这些金属指示剂可以使金属表面形成一层氧化膜,增加金属表面的抗腐蚀性、耐磨性和高温热稳定性。
第四段:
正确使用金属指示剂可以提高金属产品的使用性能和服务寿命,不仅可以改善产品外观,而且可以减少金属表面的腐蚀,以及使产品更加耐用和易维护。
此外,金属指示剂还可以用于表面加工和涂装工艺的优化,以提高金属零件的表面质量。
因此,金属指示剂可以被看作是工业生产环节中不可缺少的一环。
金属指示剂具备的条件

金属指示剂具备的条件金属指示剂是一种用于检测金属离子存在与否或进行金属离子浓度分析的化学试剂。
以下是金属指示剂具备的一些条件和相关参考内容。
1. 明显的颜色变化能力:金属指示剂应能够产生明显的颜色变化来指示金属离子的存在。
这是由于金属离子与金属指示剂发生配位或氧化还原反应而产生的。
颜色变化应该是可观察的,以便进行定性或定量分析。
2. 选择性:金属指示剂应该具备一定的选择性,即能够与特定金属离子发生反应,而不与其他金属离子发生反应。
这可以通过合适的配体选择和反应条件控制来实现。
例如,酞菁类染料可以选择性地与铜离子反应形成稳定的络合物。
3. 灵敏度:金属指示剂应具备足够的灵敏度,即能够检测到低浓度的金属离子。
这可以通过增加指示剂的摩尔吸光系数或灵敏度来实现。
4. 耐久性:金属指示剂应该稳定,并能在常规实验条件下保持其反应性能。
这样可以确保金属指示剂的可靠性和可重复性。
5. 可逆性:金属指示剂的颜色变化应该是可逆的,即颜色变化能随金属离子的存在或消失而变化。
这样可以进行多次使用和操作。
除了以上条件,金属指示剂的选择还受到以下因素的影响:- 容易获取和储存的:金属指示剂应该是容易获得和储存的,以便在实验室中广泛使用。
- 经济性:金属指示剂的制备成本应该相对较低,能够提供经济有效的分析方法。
- 可持续性和环境友好性:金属指示剂的使用和处理过程应符合环境保护的要求,不对环境造成污染或危害。
金属指示剂的研究和开发是一个广泛的领域,有许多文献和研究文章可供参考。
例如,研究人员可以通过查阅化学文摘数据库或相关学术期刊来了解最新的金属指示剂制备和应用方法。
一些常见的金属指示剂家族包括酞菁类染料、锂离子缓冲盐、肼氧化铀盐等。
此外,相关化学实验教材和指南中也会提供关于金属指示剂的详细信息和实验操作步骤,供学生和实验员参考。
分析化学第6章金属指示剂

15
判断单一离子能否准确滴定
Et
10pM 10-pM (K (MY) csp (M))1/ 2
当pM=±0.2 , Et≤±0.1%时 计算: csp(M) ·K ’(MY)≥10 6.0
若 csp(M) = 0.01mol·L-1 则 K ’ (MY)≥108.0
即 lg K ’ (MY)≥8.0
6.4.1 金属指示剂
1. 金属指示剂的作用原理 EDTA
In + M
MIn + M A色
MY + In B色
要求: 1)A、B颜色不同(合适的pH); 2)反应快,可逆性好; 3)稳定性适当,K(MIn) < K(MY).
1
EBT(铬黑T)
O-
HO
NN
-O3S
+ Mg2+
HIn2- (蓝)
NO2
此pH下Bi3+水解,影响滴定.
➢ 实际上,在pH=1.0条件下滴定Bi3+ (XO指示剂)
lgY(H)=18.3, lgK(BiY’)=27.9-18.3=9.6
可以准确滴定Bi3+
滴定Bi3+后, 用N4(CH2)6调pH至5左右,继续滴定Pb2+.
28
6.7 使用掩蔽剂提高滴定选择性
(clgK’<5.0)
O
Mg O
NN
-O3S
MgIn-(红)
lgK(MgIn)=7.0
NO2
2
EBT本身是酸碱物质
H3In pKa1 H2In- pKa2
紫红 3.9 紫红 6.3
HIn2- pKa3 In3-
蓝 11.6 橙 pH
EBT适用pH范围:8~10
化学分析技术:金属指示剂

例如,铬黑T是一个三元弱酸,第一级离解十分容 易,在溶液中:
H2In
HIn2
3-
In
红色
蓝色
橙色
pH≤6.0
pH=8.0~11.0 pH>12.0
铬黑T能与许多金属阳离子形成红色的配合物。显然
,在pH<6或pH>12时,游离指示剂的颜色与指示
剂配合物的颜色没有显著差别。只有在pH=8~11.0
9Leabharlann 指示剂的封闭滴定前加入指示剂 In + M
MIn
滴定开始至终点前 Y + M
MY
终点 Y + MIn
MY + In
由于K’MY < K’MIn , 反 应不进行
例如Cu 2+, Co 2+, Ni 2+, Fe 3+, Al 3+ 等对铬黑T 具有封闭作用。
终点
Y + MIn
MY + In
体系中含有杂 质离子N,NIn 的反应不可逆
1:100NaCl (固体)
Fe3+、Al3+、Cu2+、 Ni2+等离子封闭
EBT
EBT
酸性铬蓝 K (Acid Chrome
Blue K)
8~13
蓝
红
pH=10,Mg2+、Zn2+、Mn2+ 1:100NaCl
pH=13,Ca2+
(固体)
二甲酚橙
(Xylenol Orange) 简称 XO
pH<1,ZrO2+
3 pKa 4 13.67 4
红色
蓝色
红色
钙指示剂能与Ca2+形成红色配合物,故常在pH= 12~13的范围内使用。
金属指示剂
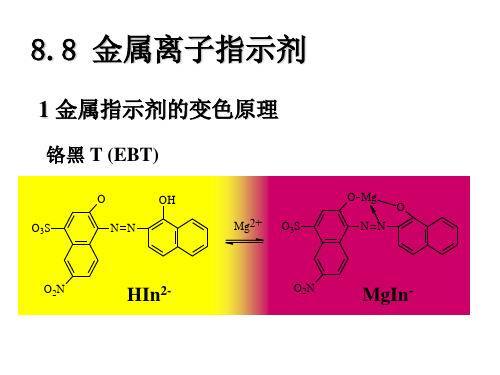
1 金属指示剂的变色原理
铬黑 T (EBT)
O
-
OH N N Mg2+
-
O Mg O3S N N
O
O3S
O2N
HIn2-
O2N
MgIn-
金属指示剂的变色原理 金属指示剂的变色原理
滴定前加入指示剂
In + M
游离态颜色
MIn
配合物颜色
滴定开始至终点前
Y
+
M
MY
MY无色或浅色 无色或浅色
(1)指示剂的封闭 ) 滴定前加入指示剂
In + M MIn
滴定开始至终点前 Y + M 终点
Y + MIn MY +
MY
由于K’MY < K’MIn , 反 应不进行
In
例如Cu 2+, Co 2+, Ni 2+, Fe 3+, Al 3+ 等对铬黑T 具有封闭作用。 等对铬黑T 具有封闭作用。 例如 终点
H6In
-
-4 H+ pKa1 ~pKa4
H2In4pKa5 = 6.3
HIn5-
pH pH < 6.3 pH > 6.3
型体及颜色
H2In4HIn5-
指示剂络合物颜色
2H+
+ M
MIn
+ຫໍສະໝຸດ H+适宜pH 范围:< 6.3 范围: 适宜
3 常用金属指示剂
吡啶基偶氮) 萘酚 萘酚) ( 吡啶基偶氮 (3) PAN金属指示剂 (1-(2-吡啶基偶氮)-2-萘酚) ) 金属指示剂
H2In
金属指示剂的变色范围

金属指示剂的变色范围
金属指示剂的变色范围是根据其化学性质决定的,不同的金属指示剂对于不同的金属离子具有不同的显色反应。
一般而言,金属指示剂可以根据金属离子的浓度和pH值的变
化发生不同的颜色变化。
例如:
1. 硬脂酸指示剂:主要用于检测碱金属离子,如钠、钾等。
在酸性条件下,硬脂酸指示剂呈现橙色或红色;而在碱性条件下,会发生颜色变化,变为蓝色或蓝紫色。
2. 硫氰酸铁指示剂:适用于检测铁离子。
在无铁离子存在时,硫氰酸铁呈现无色或浅黄色;而当有铁离子存在时,会形成红褐色或深红色的络合物。
3. 键合指示剂:例如EDTA(乙二胺四乙酸)等,可以用于配合滴定或金属离子分析。
在络合滴定过程中,EDTA与金属离
子形成稳定络合物,溶液颜色会发生变化,可以由淡黄色转变为蓝色。
需要注意的是,不同的金属指示剂具有不同的变色范围和特定的适用条件,因此在实验研究中需要根据具体的实验目的选择合适的金属指示剂。
金属指示剂名词解释

金属指示剂名词解释
金属指示剂是一种用于显示金属氧化指数的化学指示剂,它的使用可以帮助我们快速简单地检测特定金属的氧化状态。
它是通过吸附和固化金属表面上的氧化物来反映金属氧化指数的。
金属指示剂分为两大类:金属酸性指示剂和金属碱性指示剂。
金属酸性指示剂由特定金属离子和酸性材料构成,酸性材料可以是碳酸钙、硅酸钠或氧化锌。
它们的功能是当金属离子溶解在酸性介质中,吸附酸性材料上形成薄膜,从而显示出金属表面氧化指数。
而金属碱性指示剂是由金属离子和碱性材料构成,以碳酸钠、氢氧化钠和氢氧化钙为主。
它们的功能是当金属离子溶解在碱性介质中,金属表面会出现淡黄色沉淀,这暗示金属氧化过程已经完成。
金属指示剂的使用可以给我们提供一种快速、简单的金属表面氧化指数测试的方法。
比如使用金属酸性指示剂可以快速获得金属表面氧化指数,而使用金属碱性指示剂可以检测完全氧化金属表面的氧化指数。
归根结底,金属指示剂简化了金属表面氧化指数测试过程,有助我们更好地控制金属表面改性镀膜的过程,从而可以更有效提高金属的腐蚀防护性能。
金属指示剂的应用还可以扩展到实验室,在实验室中可以利用它来判断溶液中金属离子的浓度。
同时,它也可以用于检测家用电器、造纸行业的机械设备和海洋金属设备中金属表面的氧化指数,从而帮助我们正确预测和控制金属表面发生腐蚀衰变的情况,使用指示剂可以更有效地节约成本。
总之,金属指示剂是一种简单有效的金属表面氧化测试技术,在实际工业环境中的应用能够有效的检测和预测金属表面的氧化情况,起到防护金属腐蚀的作用,节约成本。
它将为我们提供更科学、更有效的金属表面氧化测试技术,为工业界带来更多便利,获得更好的经济效益。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
络合滴定的滴定曲线 (2) )
• 左图为在 不同pH值 时以 左图为在不同 值 不同 0.010mol/LEDTA 滴 定 + 0.01mol·L 的Ca2+(仅考 虑酸效应的影响) 虑酸效应的影响) 。
• 络合物的条件稳定常数 大 小 随 pH 值 而 变 化 . 当 pH 值 为 7 时 ,lgK′Ca = 7.3 , 曲线上看不到突跃。 曲线上看不到突跃。 • 所以 溶液pH值的选择在 所以,溶液 值的选择在 溶液 络合滴定法中十分重要 。
小结( ) 小结(2)
3. MIn与In在测定的体系中呈现的颜色, 与 在测定的体系中呈现的颜色 在测定的体系中呈现的颜色, 要有较显著的差别,有利终点的确定。 要有较显著的差别,有利终点的确定。 4. 指示剂与金属离子的反立必须迅速, 指示剂与金属离子的反立必须迅速, 且有较好的可逆性。 且有较好的可逆性。
金属指示剂指示终点原理( ) 金属指示剂指示终点原理(3)
• 临近终点时的滴定反应 临近终点时的滴定反应: Y + MgIn (红色 = MgY + In(蓝色) 红色) 红色 (蓝色) • pH=10 络合剂将与指示剂络合的金属离子夺取出来,使 络合剂将与指示剂络合的金属离子夺取出来 使 指示剂游离出来,在该介质条件下呈现指示剂本 指示剂游离出来,在该介质条件下呈现指示剂本 身的颜色. 身的颜色 根据上面的讨论,络合滴定中金属离子指示剂指 根据上面的讨论 络合滴定中金属离子指示剂指 示终点的原理可用下面的通式表示: 示终点的原理可用下面的通式表示 Y+MIn=MY+In = MIn与In(游离指示剂 的颜色有较显著的差别 游离指示剂)的颜色有较显著的差别 与 游离指示剂
• • •
四、金属指示剂的选择和滴定误差(1) 金属指示剂的选择和滴定误差( )
• 滴定体系中存在多种平衡: M+Y In + H+ MY M + In HIn, H2In, ...... MIn
• 指示剂配合物的条件稳定常数为:
KMIn [MIn] = K MIn = ' [M][In ] αIn(H)
黄
紫 红
pH=2~3Bi3+ Th4+ pH=4~5Cu2+ Ni2+Zn2+ Cd2+Pb2+ Mn2+Fe2+
三、金属指示剂指示终点的原理(1) 金属指示剂指示终点的原理( )
• 例如 铬黑T指示剂 简称 例如铬黑 指示剂 简称EBT) 是 三元酸 , 在不 三元酸, 铬黑 指示剂(简称 值条件下不同的离解产物呈现不同颜色。 同 pH值条件下不同的离解产物呈现不同颜色 。 值条件下不同的离解产物呈现不同颜色 表示此三元酸,其离解平衡为: 以H3In表示此三元酸,其离解平衡为: Ka1 表示此三元酸 Ka1 H3In 红色 Ka2 H2In- 红色 pH<6 Ka3
12~13 钙指示剂 (calconcarboxylic acid简称NN) PAN [1-(2pyridylazo)2-naphthol] 2~12
1:100 Fe3+ Al3+ NaCl Ni2+TiIVCu2+ 2+ 2+ (固体) Mn Co 等 离子封闭NN 0.1% MIn在水中 乙醇 溶解度小,为 溶液 防止PAN僵 化,滴定时须 加热
Fe3+ 、 Al3+ 、 Ni2+、 TiIV等离 子封闭 XO
磺基水杨酸 (Sulfosalicylic acid 简称ssal)
1.5~2.5 无 色
紫 红
5%水 ssal本身 溶液 无 色,FeY呈黄色
常见的金属指示剂( 常见的金属指示剂(续)
指示剂 使用的 适宜 pH范 围 颜色变 化 In MIn 蓝 红 pH=12~13, Ca2+ 直接滴定的 离子 指示 剂配 制 注意事项
[M]SP = K'MY×c
sp M
即:pMep = 1/2(lgK'MY + lgcMsp) (
五、使用金属指示剂的注意事项
• 1、指示剂的封闭 、 • 金属离子与指示剂生成的络合物要有一定的稳定 金属离子与指示剂生成的络合物要有一定的稳定 常数。 常数。但若K稳(金属离子 指示剂 >K 金属离子 络合剂, 金属离子—指示剂 指示剂) 金属离子—-络合剂 • 滴定到终点时,指示剂游离不出,无法指示终点 滴定到终点时,指示剂游离不出, 此现象称为指示剂的封闭。 此现象称为指示剂的封闭。 指示剂的封闭 • 所以,在选择金属离子指示剂时必须注意的是: 所以,在选择金属离子指示剂时必须注意的是: KMIn要有一定的数值,但不能大于 MY。 要有一定的数值,但不能大于K
络合滴定的滴定曲线 (3) )
• 左图是:在氨性缓冲溶 左图是: 液中用EDTA来滴定 液中用 来 Ni2+的滴定曲线。这类 的滴定曲线。 滴定受酸效应和络合效 滴定受酸效应和络合效 应的影响, 应的影响,从图中看到 当pH为9时,滴定曲线的 为 时 滴定曲线的 突跃最长。 突跃最长。 • 化学计量点前,主要因 化学计量点前, pH值对辅助络合剂效 值对辅助络合剂效 应的影响而变化;化学 应的影响而变化; 汁量点后,主要因pH 汁量点后,主要因 值对EDTA酸效应的影 值对 酸效应的影 响而变化。 响而变化。
常见的金属指示剂( 常见的金属指示剂(续)
指示剂 使用的 适宜 pH范 围 <6 颜色变 化 In 亮 黄 MIn 红 直接滴定的离子 指示 剂配 制 注意事 项
二甲酚橙 (Xylenol Orange) 简称XO
0.5% pH<1 ZrO2+ 水溶 pH=1~3.5 Bi3+、 液 Th4+ pH=5~6 Ti3+ 、 Zn2+、Pb2+、Cd2+、 Hg2+稀土元素离 子 pH=1.5~2.5Fe3+
7.3
金属离子指示剂
一、金属离子指示剂的意义
1、什么是金属指示剂? 、什么是金属指示剂 能指示金属离子浓度变化的物质, 能指示金属离子浓度变化的物质,称之为金 属指示剂。 属指示剂。 2、 2、金属指示剂的性质 金属指示剂是弱的有机酸或弱的有机碱, 金属指示剂是弱的有机酸或弱的有机碱,在 不同pH值条件下可与金属离子形成有色络合 不同 值条件下可与金属离子形成有色络合 其颜色与游离指示剂的颜色不同, 物,其颜色与游离指示剂的颜色不同,因而它能 其颜色与游离指示剂的颜色不同 指示滴定过程中金属离子浓度的变化情况。 指示滴定过程中金属离子浓度的变化情况。
铬黑T 8~10 (Eriochro me black T) 简称BT或 EBT 酸性铬蓝K (Acid Chrome Blue K) 8~13
1:100 Fe3+、 NaCl Al3+、 (固 Cu2+、 体) Ni2+等 离子封 闭EBT 1:100 NaCl (固 体)
蓝
红
pH=10 Mg2+ 、 Zn2+、 Mn2+ pH=13 Ca2+
3、金属指示剂的特点 、
• 金属离子指示剂本身也是络合剂,而且 金属离子指示剂本身也是络合剂, 多为含双键的物质,不太稳定, 多为含双键的物质,不太稳定,故此在 配制和使用时要特别注意。 配制和使用时要特别注意。
二、常见的金属离子指示剂(表) 常见的金属离子指示剂(
指示剂 使用的 颜色变化 直接滴定的离子 适宜 In MIn pH范 围 蓝 红 pH=10 Mg2+、 Zn2+、 Cd2+、 Pb2+、Mn2+稀土 元素离子 指示 剂配 制 注意事 项
- HIn2- 蓝色 pH=8~11 - In3- 橙色 pH=12
EBT与Mg2+、Zn2+、Cd2+等多种金属离子所形成 与 的络合物都是呈现红色的 的络合物都是呈现红色的. 红色
金属指示剂指示终点原理( ) 金属指示剂指示终点原理(2)
• 例如 如在pH=10.0条件下 、 以 EDTA滴定 2+ 。 例如:如在 条件下、 滴定Mg 如在 条件下 滴定 在pH=10时,铬黑 的游离颜色为蓝色,金属离子 时 铬黑T的游离颜色为蓝色, 与铬黑T生成的络合物为红色 , 与铬黑 生成的络合物为红色, 终点的颜色为游 生成的络合物为红色 离铬黑T颜色 蓝色), 在滴定的pH值范围内 颜色(蓝色 值范围内, 离铬黑 颜色 蓝色 , 在滴定的 值范围内 , 游 离指示剂和指示剂与金属离子生成的络合物两者 这之间的颜色有显著的区别。 这之间的颜色有显著的区别 。 即 红 →蓝, 容易观 蓝 察。临近终点时的滴定反应: 临近终点时的滴定反应 Y + MgIn (红色 = MgY + In(蓝色) 红色) 红色 (蓝色) pH=10
金属指示剂ቤተ መጻሕፍቲ ባይዱ选择和滴定误差( ) 金属指示剂的选择和滴定误差(3)
• 由此可见,终点时 由此可见,终点时pMep的值与所选用的指示剂 的 性 质 有 关 ( K'MIn 大 小 ) , 且 在 lgK'MIn~lgK'MIn+1之间。 1之间。 • 选择的金属离子指示剂应使 选择的金属离子指示剂应使pMep 与化学计量 点的pMsp尽量一致,或在此化学计量点附近的 尽量一致, 点的 pM突变范围内。 突变范围内。 突变范围内 • 化学计量点的 化学计量点的pMsp由下式求得: 由下式求得:
'
[In' ] pM = lg K MIn + lg [M ] In
'
• 滴定终点时指示剂由MIn色过渡为In色。
金属指示剂的选择和滴定误差( ) 金属指示剂的选择和滴定误差(2)
• 当 [In']/[MIn]=1时 ,是指示剂的变色点 , 此 是指示剂的变色点, 时 是指示剂的变色点 时,滴定终点金属离子浓度为: pM=lgK'MIn • 当 [In']/[MIn]>10/1时 ,MIn色将不可觉察 , 色将不可觉察, 时 色将不可觉察 为临界值代入上式, 以 [In']/[MIn]=10/1为临界值代入上式 , 求 为临界值代入上式 得滴定终点时金属离子浓度为: pMep=lgK'MIn+1 1
