2013陕西师范大学物理化学考研试题
陕西师范大学物理化学模拟题3

《考研专业课高分资料》陕西师范大学《物理化学》模拟题考研专业课研发中心北京总部售后电话189********目录物理化学模拟试题及答案(一) (3)物理化学模拟试题及答案(二) (9)第五模块 模拟试题物理化学模拟试题及答案(一)所有答案必须做在答案题纸上,做在试题纸上无效!一、填空题(30分)1.写出实际气体压缩因子定义Z = ,当实际气体的Z >1时,说明该气体比理想气体 。
2.已知乙醇的正常沸点为78℃,若要计算25℃乙醇的饱和蒸气压(假定乙醇蒸发焓不随温度变化),请写出乙醇饱和蒸汽压p 的计算公式 。
3.某一化学反应A(g) + B(g) → C(g),在500K 恒容条件下放热10kJ ,若反应在500K 恒压条件下完成,反应热Q p = 。
4.水蒸气通过灼热的C (石墨)发生下列反应:H 2O(g) + C() CO(g) + H 2(g),此平衡系统的组分数C = ;相数P = ;自由度F = 。
这说明生成的CO(g)、H 2(g)在气相中组成及 有关。
5.将蔗糖溶于纯水中形成稀溶液,及纯水比较,其沸点温度将 ;凝固点温度将 。
6.液滴的半径越小,饱和蒸气压越 ;毛细管中凹液面的曲率半径越小,凹液面的饱和蒸气压越 。
7.某液体在玻璃表面的润湿角θ= 45°,其表面张力σl-g及σs-g和σs-l之间的关系是 ,且σs-g 及σs-l之间关系是 。
8.兰格缪尔(Langmuir )吸附等温式仅适用于 吸附,公式形式为bpbp+Γ=Γ∞1,式中Г∞代表 ,在Г—p 图上示意画出Langmuir 吸附等温线 。
9.加入少量表面活性剂,使水溶液的表面张力随浓度的变化率cd d σ ,并且表面活性剂在溶液表面产生 吸附。
10.丁达尔效应产生的原因是 。
11.KI 溶液及过量的AgNO 3溶液混合,形成AgI 溶胶,其胶团结构为 。
KCl 、K 2C 2O 4、K 3Fe(CN)6三种电解质中,对该溶胶聚沉能力最大的是 。
最新陕西师范大学-物理化学-复习题1

复习试题一1.有一系统在某一过程中,吸热30J ,对外做功50J ,则内能变化量为 ;2.已知反应C(s)+O 2(g)=CO 2(g) 的标准平衡常数为K 1;CO(g)+1/2O 2(g)=CO 2(g)的标准平衡常数为K 2; 2C(s)+O 2(g)=2CO(g) 的标准平衡常数为K 3;则K 3与K 1、K 2的关系为 _____________ ; 3.某理想气体在20℃、100kPa 下的摩尔体积为 ;4.焓、吉布斯自由能的定义式分别为 、;1.下列各种条件下,CO 2在水中溶解度最大的是( )A 高压低温B 低压低温C 高压高温D 低压高温2.在 400K ,液体A 的蒸气压为4×104 Pa ,液体B 的蒸气压为6×104 Pa ,两者组成理想液态混合物。
当气-液平衡时,在溶液中A 的摩尔分数为0.6,则在气相中B 的摩尔分数应为( ) A 0.31 B 0.40 C 0.50 D 0.603.在0.1 kg 水中含 0.0045 kg 某纯非电解质的溶液,于272.685 K 时结冰,水的凝固点降低常数 K f 为1.86 K.mol -1.kg -1,则该溶质的摩尔质量大约为( ) A 0.135 kg/mol B 0.172 kg/molC 0.090 kg/molD 0.180 kg/mol4. PCl 5的分解反应是PCl 5(g )=PCl 3(g) + Cl 2(g),在473 K 达到平衡时, PCl 5(g)有48.5%分解,在573 K 达到平衡时,有97%分解,则此反应为( )A 放热反应B 吸热反应C 即不放热也不吸热D 这两个温度下的平衡常数相等一、填空题(共4小题,将适当的内容填入题中划线处。
每空3分,满分15分)二、选择题( 共4题,将判断结果填入题后的括号中。
每题3分,满分12分)( )1. 某一化学反应的标准摩尔吉布斯函数△r G m $> 0,这就说明该反应不能自发进行; ( )2. 在通常情况下,对于二组分系统平衡共存时最多相数为3; ( )3. 米和面混合的十分均匀,再也无法彼此分开,则该系统有一个相; ( )4. 水的三相点和水的冰点不是一回事;( )5. 标准平衡常数改变了,平衡一定会移动。
(NEW)陕西师范大学《730物理化学(含结构化学)》历年考研真题汇编(含部分答案)

2013年陕西师范大学730物理化学(含结构化学)考研真题 2012年陕西师范大学730物理化学(含结构化学)考研真题 2011年陕西师范大学730物理化学(含结构化学)考研真题及详解 2010年陕西师范大学730物理化学(含结构化学)考研真题及详解 2009年陕西师范大学730物理化学(含结构化学)考研真题及详解 2008年陕西师范大学647物理化学(含结构化学)考研真题 2006年陕西师范大学341物理化学(含结构化学)考研真题 2005年陕西师范大学341物理化学(含结构化学)考研真题 2004年陕西师范大学341物理化学考研真题 2003年陕西师范大学341物理化学考研真题
2004年陕西师范大学341物理化学 考研真题
2003年陕西师范大学341物理化学 考研真题
2013年陕西师范大学730物理化学 (含结构化学)考研真题
2012年陕西师范大学730物理化学 (含结构化学)考研真题
2011年陕西师范大学730物理化学 物理化学 (含结构化学)考研真题及详解
2009年陕西师范大学730物理化学 (含结构化学)考研真题及详解
2008年陕西师范大学647物理化学 (含结构化学)考研真题
2006年陕西师范大学341物理化学 (含结构化学)考研真题
2005年陕西师范大学341物理化学 (含结构化学)考研真题
陕西师范大学考研物理化学资料
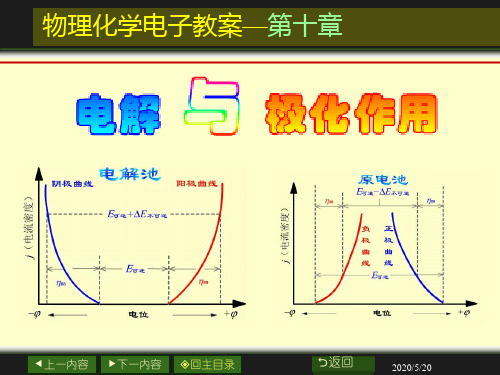
2 1
E分解
电压E
测定分解电压时的电流-电压曲线
返回
2013-11-11
分解电压的测定
将I-E曲线中2-3段的 直线部分外延到I = 0处所
得的电压就是Eb, max 。
这是使某电解液能连 续不断发生电解时所必须
电 流 I
3
的最小外加电压——使电
解池不断工作所必需外加 的最小电压,称为电解液 的分解电压。
返回
2013-11-11
分解电压
分解电压:使某电解质溶液能连续不断发生电解反应
所必须外加的最小电压称为电解质溶液的分解电压。
理论分解电压在数值上等于该电解池作为可逆电池时
的可逆电动势。
E(理论分解 ) E(可逆)
由于电池回路的电压降和阴、阳极的极化所产生的超
电势,使得实际分解电压要比理论分解电压大。
η阴
负 极 曲 线
正 极 曲 线
E可逆
上一内容 下一内容
电位
返回
2013-11-11
原电池中两电极的极化曲线
回主目录
极化曲线(polarization curve)
上一内容
下一内容
回主目录
返回
2013-11-11
氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H+ 在阴极会与金属离子竞争还原。
上一内容 下一内容 回主目录
返回
2013-11-11
分解电压的测定
原电池产生了一个与 外加电压方向相反的反电 动势Eb。外加电压必须克 服这反电动势。
电 流 I
3
继续增大外加电压, 电极上就有H2和Cl2继续产 生并向溶液中扩散,因而 电流也有少许增加,相当 于I-E曲线上的1-2段。
陕西师范大学考研物理化学资料

反应分子数(Molecularity of reaction)
反应分子数:是指在基元反应过程中参与反应 的粒子(分子、原子、离子、自由基等)的数
目,只可能是1,2或3(不大于3的正整数)。
根据反应分子数可以将化学反应分为单分子反
应,双分子反应,三分子反应,三分子以上的
反应目前还未发现。
单分子反应
速率方程中各反应物浓度项的指数称为该反应
物的反应级数。 所有浓度项指数的代数和称为该反应的总级数,
通常用n表示。n的大小表明浓度对反应速率的影响
程度。 反应级数可以是正数、负数、整数、分数或零,
有的反应无法用简单的数字来表示级数,称为无级数
反应。 反应级数是由实验测定的。
反应级数(Order of reaction) 例如:
下,反应机理还要给出所经历的每一步的立体化学结
构图。
同一反应在不同的条件下,可有不同的反应机
理。了解反应机理可以掌握反应的内在规律,从而 更好的调控反应。
简单反应
一步能够完成的反应叫简单反应,简单反应由
一个基元反应组成。且质量作用定律可直接用于每 一基元反应,而简单反应本身是由一个基元反应组 成,故质量作用定律可直接用于简单反应。
(3)取值不同:反应级数可以为0、1、2、3、分数、 负数,而且对指定反应,反应级数可依反应条件变化 而改变。反应分子数只能为1、2、3,对指定的基元 反应为固定值。
(4)对于简单反应来说,反应分子数和反应级数不
一定一样,如蔗糖水解是双分子反应,但为一级反应。 (5)简单级数反应不一定有简单的机理;一种级数
dcA kc cA cB dt
dpA k p pA pB dt
pB = cBRT ,由(1)和(2)式可得kp与kc的关系:
师范类物理化学试题及答案(两份题)

师范类物理化学试题之一一、选择题(每题2分,共50分,将唯一的答案填进括号内) @( b )1. 下列公式中只适用于理想气体的是1. BA. ΔU=Q VB. W=nRTln(p 2/p 1)C. ΔU=dTC m ,V T T 21⎰ D. ΔH=ΔU+p ΔV@( c )2. ΔH 是体系的什么 2. CA. 反应热B. 吸收的热量C. 焓的变化D. 生成热( )3. 2000K 时反应CO(g)+1/2O 2(g)=CO 2(g)的K p 为 6.443,则在同温度下反应为2CO 2(g)=2CO(g)+O 2(g)的K p 应为3. CA. 1/6.443B. (6.443)1/2C. (1/6.443)2D. 1/(6.443)1/2( ) 4. 固态的NH 4HS 放入一抽空的容器中,并达到化学平衡,其组分数、独立组分数、相数及自由度分别是 4. CA. 1,1,1,2B. 1,1,3,0C. 3,1,2,1D. 3,2,2,2 @( c) 5. 下列各量称做化学势的是 5.DA. i j n ,V ,S i )n (≠∂μ∂ B. i j n ,V ,T i )n p (≠∂∂ C. i j n ,p ,T i )n (≠∂μ∂ D. ij n ,V ,S i )n U(≠∂∂( ) 6. A 和B 能形成理想溶液。
已知在100℃时纯液体A 的饱和蒸汽压为133.3kPa, 纯液体B 的饱和蒸汽压为66.7 kPa, 当A 和B 的二元溶液中A 的摩尔分数为0.5时,与溶液平衡的蒸气中A 的摩尔分数是6.CA. 1B. 0.75C. 0.667D. 0.5 @( ) 7. 理想气体的真空自由膨胀,哪个函数不变? A. ΔS=0 B. V=0 C. ΔG=0 D. ΔH=0 7. D( ) 8. A 、B 两组分的气液平衡T-x 图上,有一最低恒沸点,恒沸物组成为x A =0.7。
现有一组成为x A =0.5的AB 液体混合物,将其精馏可得到A. 纯A 和恒沸混合物B. 纯B 和恒沸混合物C. 只得恒沸混合物D. 得纯A 和纯B 8. B( ) 9. 实验测得浓度为0.200mol·dm-3的HAc溶液的电导率为0.07138S·m-1,该溶液的摩尔电导率Λm(HAc)为9.BA. 0.3569S·m2·mol-1B. 0.0003569S·m2·mol-1C.356.9S·m2·mol-1D.0.01428S·m2·mol-1@( ) 10. 表面活性物质溶于水时,关于溶液的表面张力和溶液表面的描述正确的是10.D A. 表面张力升高,正吸附 B. 表面张力降低,正吸附C. 表面张力升高,负吸附D. 表面张力显著降低,正吸附( ) 11. 一体积的氢气在0℃,101.3kPa下等温膨胀至原来体积的3倍,其内能变化是多少?(设氢气是理想气体)11.BA. 0.4JB. 0C. 6JD.0.04J( ) 12. 已知反应CO(g)+1/2O2(g)=CO2(g)的ΔH,下列说法中何者不正确A. ΔH是CO2(g)的生成热B. ΔH是CO(g)的燃烧热C. ΔH是负值D. ΔH与反应ΔU的数值不等12.A( ) 13. 对于0.002mol/kg的Na2SO4溶液,其平均质量摩尔浓度m±=0.219是A. 3.175×10-3B. 2.828×10-3C. 1.789×10-4D. 4×10-3 13.A@( ) 14. 对弯曲液面所产生的附加压力14.BA. 一定等于零B. 一定不等于零C. 一定大于零D. 一定小于零@( ) 15. 已知下列反应的平衡常数:15.AH2(g) + S(s) = H2S(g) K1S(s) + O2(g) = SO2(g) K2则反应H2S(g) + O2(g)= H2(g) + SO2(g) 的平衡常数为A. K2/K1B. K1—K2C. K1×K2D. K1/K2( ) 16. 对于N2和H2混合气体的绝热可逆压缩(没有生产NH3),则16.CA.ΔU=0B. ΔH=0C. ΔS=0D.ΔG=0@( ) 17. 温度升高溶胶的稳定性17.BA. 增加B. 下降C. 不变D. 先增加后下降( ) 18. 101℃时,水在多大外压下沸腾?18. CA. 101.3kPaB. 1013kPaC. 略高于101.3kPaD. 略低于101.3kPa ( ) 19. 在HAc 电离常数测定实验中,直接测定的物理量是不同浓度的HAc 溶液的 A. 电导率 B. 电阻 C. 摩尔电导 D. 电离度 19. B ( ) 20. 定温下气相反应K p 有什么特点?20. AA. 恒为常数B. 恒等于K cC. 随压力而变D. 与体积有关 ( ) 21. 某化学反应其反应物消耗8/7所需的时间是它消耗掉4/3所需的时间的1.5倍,则反应的级数为 21.BA. 零级反应B. 一级反应C. 二级反应D. 三级反应( ) 22. 在一定量AgI 溶胶中加入下列不同电解质溶液,则使溶胶在一定时间内完全聚沉所需电解质的量最少的是 22. BA. La(NO 3)3B. Mg(NO 3)2C. NaNO 3D. KNO 3@( a ) 23. 接触角可确定固体某种性质,若亲液固体表面能被液体润湿,其相应的接触角是 23. CA. 0=θB. 90>θC.90<θ D. θ为任意角( ) 24. 混合等体积0.08mol ·dm 3 KI 和0.1mol ·dm 3AgNO 3溶液得到一溶胶体系,在该体系中分别加入下述三个电解质:(1) MgSO 4, (2) CaCl 2, (3) Na 2SO 4, 则其聚沉能力的大小为 A. (1)>(2)>(3) B. (2)>(1)>(3) C. (3)>(1)>(2) D. (3)>(2)>(1) ( ) 25. 298K 时反应Zn+Fe 2+=Zn 2++Fe 的E 0为0.323V ,则其平衡常数为 A. 2.89×105 B. 8.34×1010 C. 5.53×104 D. 2.35×102一、二、计算题:(共50分)1.(10分) A(熔点651℃)和B(熔点419℃)的相图具有一个低共熔点,为368℃(42% A,质量百分数,下同)。
陕西师范大学 普通物理 850 真题及考点分析(09年——13年)

2012年陕西师范大学物理学与信息技术学院研究生入学考试学科代码 850 普通物理(含力学、热学、光学、电磁学)试卷各部分分值与考点分析一、填空题(每题5分,共7个)1、考查曲线运动、运动学基本概念——线加速度、加速度概念辨析(高频考点)2、运动学概念+动量定理/动能定理(这种思维方式很重要,功是能量转化的度量,要求功用能量变化来计算)3、根据x-t图像求简谐振动运动学方程(必考考点)4、闭合线圈磁通量、磁力矩5、感生电动势求法及其基本概念的理解6、全电流定律中对位移电流的计算(高频考点)7、单缝衍射明暗条件推导的理解二、填空题(每小题5分,共9个)8、功的计算9、对于转动惯量的理解,考察转动定律10、对波动图像y-x的理解(高频考点)11、分子动理论知识(这个图像很重要,将由图像的出的结论记下来就没问题了,热学考查知识比较少,所以这个知识点算热学部分的重点知识了,尤其是选择题部分,地位举足轻重)12、p-v图像,热力学第二定律的理解(热学部分考察有一个特点:考点特点明显,历年真题中的考点绝对是高频考点,所以各位考生必须高度重视)13、对高斯定理的理解,求电势14、高斯定律和静电场的综合考察15、对于光程差概念的理解,对光程差的简单计算的考察16、分辨率的概念三、计算题(共7小题,每小题10分)17、牛顿第二定律的应用(曲线运动的牛顿第二定律应用、牛顿第二定律的矢量性理解)18、角动量守恒与机械能守恒定律的综合应用(分析历年的真题,会发现,质点的牛顿定律和刚体转动定律在都是力学的高频考点,两者必考一个)19、热机效率与熵变计算(高频考点)20、用高斯定律求电场分布,求某处电势(高频考点)21、用安培环路定律求磁场、通电导体安培力的计算、力矩的计算22、动生电动势、牛顿第二定律综合应用23、波的干涉的应用(高频考点)陕师大考研 12年普通物理 850 整体试卷分析力学、热学、光学、电磁学各部分所占分值比重:力学:40分;热学:20分;光学:30分(注:其中光学部分占25分,波动部分5分,振动部分5分);电磁学:55分(电磁学与力学的综合应用,这是本试卷最难部分);本试卷题型分值分析:填空:35分 5分*7个;选择:45分 5分*7个;计算:70分 10分*7个;总题数:23道总体评价:光学和热学部分很基础,最难的大题是电磁学中的题目!2012年陕西师范大学物理学与信息技术学院研究生入学考试学科代码 850 普通物理(含力学、热学、光学、电磁学)试卷各部分分值与考点分析二、填空题(每题5分,共7个)1、考查曲线运动、运动学基本概念——线加速度、加速度概念辨析(高频考点)2、运动学概念+动量定理/动能定理(这种思维方式很重要,功是能量转化的度量,要求功用能量变化来计算)3、根据x-t图像求简谐振动运动学方程(必考考点)4、闭合线圈磁通量、磁力矩5、感生电动势求法及其基本概念的理解6、全电流定律中对位移电流的计算(高频考点)7、单缝衍射明暗条件推导的理解二、填空题(每小题5分,共9个)8、功的计算9、对于转动惯量的理解,考察转动定律10、对波动图像y-x的理解(高频考点)11、分子动理论知识(这个图像很重要,将由图像的出的结论记下来就没问题了,热学考查知识比较少,所以这个知识点算热学部分的重点知识了,尤其是选择题部分,地位举足轻重)12、p-v图像,热力学第二定律的理解(热学部分考察有一个特点:考点特点明显,历年真题中的考点绝对是高频考点,所以各位考生必须高度重视)13、对高斯定理的理解,求电势14、高斯定律和静电场的综合考察15、对于光程差概念的理解,对光程差的简单计算的考察16、分辨率的概念三、计算题(共7小题,每小题10分)17、牛顿第二定律的应用(曲线运动的牛顿第二定律应用、牛顿第二定律的矢量性理解)18、角动量守恒与机械能守恒定律的综合应用(分析历年的真题,会发现,质点的牛顿定律和刚体转动定律在都是力学的高频考点,两者必考一个)19、热机效率与熵变计算(高频考点)20、用高斯定律求电场分布,求某处电势(高频考点)21、用安培环路定律求磁场、通电导体安培力的计算、力矩的计算22、动生电动势、牛顿第二定律综合应用23、波的干涉的应用(高频考点)陕师大考研 12年普通物理 850 整体试卷分析力学、热学、光学、电磁学各部分所占分值比重:力学:40分;热学:20分;光学:30分(注:其中光学部分占25分,波动部分5分,振动部分5分);电磁学:55分(电磁学与力学的综合应用,这是本试卷最难部分);本试卷题型分值分析:填空:35分 5分*7个;选择:45分 5分*7个;计算:70分 10分*7个;总题数:23道总体评价:光学和热学部分很基础,最难的大题是电磁学中的题目!2011年陕西师范大学物理学与信息技术学院研究生入学考试学科代码 850 普通物理(含力学、热学、光学、电磁学)试卷各部分分值与考点分析(注:因为在12年以前,陕师大学硕普通物理考察的是《大学物理》,代码是827,但是之前的真题也是极其重要的,很有参考价值;而在14年前专硕(学科教学物理)考的是马文蔚的《大学物理》913,14年后和学硕用的是同一分卷子,难度增加很多;因此说850和827不管是对陕师大学硕还是专硕考试都是极其有参考价值的,极其重要,希望引起各位同学:声学、光学、凝聚态物理、原子与分子物理、无线电物理、学科教学(物理)等学科)一、选择题(共12个小题,每小题4分)1、位移矢量表达式的额理解2、刚体角动量守恒及其做功的计算3、刚体转动角加速度的理解4、振动方程+语言描述求振动相关问题(绝对的高频考点)5、由y-x图像求解波动函数(高频考点)6、求电势7、电场线概念8、高斯定律+静电感应综合应用求解平行板间电场(要回用高斯定律求常见的均匀带电导体产生的电场)9、毕奥——萨法尔定律求磁感应强度10、安培环路定律概念的理解(要将安培环路定律的内容、计算表达式、简单应用完全掌握)11、磁场中粒子运动问题:洛伦兹力+圆周运动12、双缝干涉简单计算(高频考点,光学部分必考考点)二、填空题(共8个,每个4分)13、曲线运动学有关计算:切线加速度,法向加速度、加速度(绝对的高频考点,12年考题中也出现过)14、力做功的计算:元功、功的计算15、动量定理和圆周运动16、高斯定理求电场强度,求电场力做功的计算17、位移电流的计算(分析历年真题。
陕西师范大学-物理化学-模拟题2

目录第五模块模拟试题 (3)陕西师范大学物理化学模拟试题(一) (3)陕西师范大学物理化学模拟试题(二) (6)第五模块 模拟试题陕西师范大学 物理化学 模拟试题(一)所有答案必须做在答案题纸上,做在试题纸上无效!一、单选题(每题2分,共30分)1. 在298K 及101.325KPa 下的1.00dm 3氢气,等温可逆膨胀到2.00 dm 3,所做功的绝对值为( ) A 、0.418 J B 、0.0418 J C 、70.3J D 、7.11J2. 对于孤立体系的实际过程,下列关系式不正确的是( ) A 、W=0 B 、Q=0 C 、△U=0 D 、△H=03. 一封闭系统进行可逆循环,其热温商之和( ) A 、总是正值 B 、总是负值 C 、是温度的函数 D 、总为零4. 液体A 和B 混合成实际溶液时,当A 和B 之间的作用力大于相同分子之间的作用力时,该溶液对拉乌尔定律将( )A 、产生正偏差B 、产生负偏差C 、不产生偏差D 、无法确定 5. 关于偏摩尔量,下面的叙述不正确的是( ) A 、偏摩尔量是状态函数,其值与物质的量无关 B 、偏摩尔量的值不能小于零 C 、体系的强度性质无偏摩尔量 D 、纯物质的偏摩尔量等于摩尔量6.克拉贝龙方程dP/dT=△H m (相变)/T △V m (相变),其应用条件是( )A 、只适用于纯物质的气液、气固平衡B 、只适用于服从理想气体行为的为气液、气固平衡C 、任何纯物质的相变热不随温度而变的两相平衡D 、任何纯物质两相平衡体系7.含KNO 3和NaCl 的水溶液与纯水达到渗透平衡,其自由度数f 为( ) A 、1 B 、2 C 、3 D 、48.分解反应 A(s)=B(g)+2C(g) 该反应的平衡常数Kp 与分解压力P 的数值之间为( )A 、Kp=P 3B 、Kp>P 3C 、Kp<P 3D 、无法比较9.在一定温度和压力下,某化学反应达到平衡应满足的条件是( )A 、0=∆θGB 、0=∆GC 、θG G ∆=∆D 、θθK RT G ln -=∆ 10.放射性元素B 的半衰期是8h ,16克B 在32h 后还剩( ) A 、8g B 、4g C 、2g D 、1g11.一反应物转化率与其初始浓度无关,该反应的速率方程是( )A 、-dc/dt=kcB 、-dc/dt=kC 、-dc/dt=kc 2D 、-dc/dt=kc 312.有关活化能的下列说法正确的是:( ) A 、活化能与反应本性有关 B 、活化能与反应温度完全无关 C 、活化能与反应途径无关 D 、活化能与反应物浓度有关13.若浓度为m 的H 2SO 4溶液的平均活度系数γ±为,则其活度为:( )A 、41/3γ±mB 、γ±mC 、4γ±3m 3D 、γ±m 314.对Fe(OH)3胶体聚沉能力最强的电解质是:( )A 、NaClB 、MgCl 2C 、AlCl 3D 、Na 2SO 4 15.不同弯曲液面饱和蒸气压之间存在:( ) A 、P 平>P 凹>P 凸 B 、P 凸>P 平>P 凹 C 、P 凹>P 平>P 凸 D 、P 凸>P 凹>P 平二、填空题(每空1分,共10分)1、指出下列过程中系统中哪一个改变值为零(1)H2和O2在密闭绝热钢瓶中反应生成水(2)在一定温度压力下形成饱和溶液K、Kp只是温度的函数,与压力、组成无关,而对其它气体反应仍只为温度2、对理想气体反应的函数,但的值还与压力有关。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2013年招收攻读硕士学位研究生入学考试业务课试题
适用专业名称: 无机化学,有机化学,分析化学,物理化学,高分子化学与物理 考试科目名称: 物理化学 科目代码: 730 注意事项:
1、请将答案直接做到答题纸上,做在试题纸上或草稿纸上无效。
2、除答题纸上规定的位置外,不得在卷面上出现姓名、考生编号或其它标志,否则按违纪处理。
3、本试题共 页,满分 150 分,考试时间180分钟。
物理化学部分(120分)
一、 单选题(20分)
1.热力学基本公式:VP -SdT G +=∆ 可适用的过程是: ( )
A 298K ,101.3KPa 的水蒸发过程
B 电解水制取氢气和氧气
C 理想气体真空膨胀
D )g (NH g H g N 322=+)()(未达平衡 [解析]:选C 。
四个热力学基本公式有着共同的使用条件,为: (1)W f =0,无相变,无化学变化,组成恒定的均相封闭系统的一切变化:(2)无体积功,有相变或化学变化的封闭系统的可逆过程。
A 中过程水蒸发,发生相变,但不是可逆相变;B 过程有体积功(电功);D 过程未达平衡。
2.某溶液由2molA 和1.5molB 混合而成,其体积为420 cm 3,此溶液中组分A 的偏摩尔体积VA=3013mol cm -∙, 则组分B 的偏摩尔体积为: ( ) A 20013mol cm -∙ B 30013mol cm -∙ C 24013mol cm -∙ D 28013mol cm -∙ [解析]:选C 。
本题考查偏摩尔量加和公式:V=V A n A +V B n B ,带入数值得: 420=30⨯2+1.5V B ,则可得出V B =24013mol cm -∙。
3.对于恒沸混合物,下列说法中正确的是: ( ) A 不具有确定的组成 B 平衡时气相与液相组成相同 C 其沸点随外压的改变而改变 D 与化合物一样具有确定的组成 [解析]:选B 。
考查恒沸混合物的性质。
4.NH 4HS 和任意体积的NH 3(g )及H 2S (g )达平衡时有: ( ) A 2f 22C ===,,φ B 1f 21C ===,,φ C 2f 31C ===,,φ D 3f 21C ===,,φ
[解析]:选A 。
考查相率,C=S-R-R ’,S (物种数)为3,R (平衡数目)为1,R ’为0,故C=2,B 、C 、D 均错误;Ф (相数)为2(固相,气相);f+Ф=C+2,可得:f=2。
5.Al2(SO4)3的化学势μ与+3Al ,-24SO 的化学势+μ,
-μ之间的关系为:( ) A -μμμ+=+ B -32μμμ+=+ C -23μμμ+=+ D -μμμ∙=+
[解析]:答案选择B 。
6.等温等压条件下原电池可逆放电,电池反应的焓变rHm ∆与等压可逆热效应p Q 的关系为: ( ) A rHm ∆大于p Q B rHm ∆等于p Q C rHm ∆小于p Q D rHm ∆大于等于p Q
7.当发生极化作用时,两电极的电极电势变化为: ( ) A 阴变小阳变大,ϕϕ B 阴变大阳变小,ϕϕ C 两者都变大 D 两者都变小
[解析]:答案为A 。
参考傅献彩第五版物理化学第十章内容
8.某化学反应为,P B 2A K −→−
+ 实验测得其速率常数K=0.25 -1-1
-3S dm mol ∙⋅)(,则该反应级数为: ( )
A 零级
B 一级
C 二级
D 三级
[解析]:选择C 。
化学反应的级数可以看速率常数K 来辨别。
-1
n -1-3S
dm mol ∙⋅)(
9.恒温恒压下,将一液体分散成小液滴,该过程液体的熵值将:( A )A 增大 B 减小 C 不变 D 无法判断 请加qq :1643292160 一起来研究物理化学
结构化学部分(30分)。
