甲烷与乙烯
甲烷、乙烯的综合运用

56 甲烷、乙烯的综合运用主编人:审核人:审批人:周次13所需时间1课时班级第小组姓名组评【学习目标】1.能熟练的利用甲烷的化学性质进行解题;2.能记住乙烯的主要性质以及它的用途,并加以应用;3.能说出取代反应和加成反应的原理,并区分取代和加成反应。
【学习重点】甲烷和乙烯的性质【学习难点】甲烷和乙烯的性质的利用;取代反应和加成反应。
温馨提示:本学案结甲烷与乙烯的性质,独立思考并完成,请勿参考课本与资料。
【我的地盘我做主】练一练,你还有哪些是不会的呢?一、填空题1.关于甲烷结构的说法中正确的是()A.甲烷的分子式是C H4,5个原子共面B.甲烷分子中,碳原子和氢原子形成了4个不完全相同的碳氢共价键C.甲烷分子的空间构型属于正四面体结构D.甲烷中的任意三个原子都不共面2.关于烃和甲烷的叙述正确的是()A.烃的组成均符合通式Cn H2n+2B.烃类通常都难溶于水C.甲烷在同系物中含碳量最高,因而是清洁能源D.甲烷只能发生取代反应而不能发生其他反应3.下列关于有机化合物的性质与应用不正确的是()A.甲烷和氯气关照条件下发生取代反应,产物是气体与液体的混合物B.通过加成反应,可以以乙烯为原料制备乙醇、氯乙烷等C.乙炔分子中的碳碳键不是碳碳双键,故不可以发生加成反应D.甲烷与氯气反应,试管内黄绿色消失,内壁出现油状液滴4.城市居民使用的石油气的主要成分是丁烷,在使用过程中,常有一些杂质以液态沉积于钢瓶中,这些杂质是()A.甲烷和丙烷B.乙烷与丙烷C.乙烷与戊烷D.戊烷与己烷★5.下列有关同系物的说法中正确的是()A.分子组成相差一个或若干个CH2原子团的有机化合物一定是同系物B.具有相同通式的有机化合物一定是同系物C.互为同系物的有机物分子结构必然相同D.互为同系物的有机物一定具有相同的通式★6.下列物质中,不可能是乙烯的加成产物的是()A.CH3CH3B.CH3CHCl2C.BrCH2CH2BrD.CH3CH2Br★7.下列化学物中既能使溴的四氯化碳溶液褪色,又能在光照下与溴发生取代反应的是()A.乙烷B.乙醇C.丙烯D.乙烯★8.工业获得有关物质的途径不正确的是()A.光照氯气与乙烷[n(Cl2):n(C2H6)=1:1]的混合物制备氯乙烷B.用硫磺制硫酸C.分离煤焦油获得苯、甲苯和二甲苯D.石油的裂解获得乙烯★9.下列说法正确的是()A.乙烯的结构简式可以表示为CH2CH2B.乙醇、乙酸都能发生能发生取代反应C.裂化石油不能使溴的四氯化碳溶液褪色D.液化石油气和天然气的主要成分都是甲烷★★★10.丙烯(C3H6)与某种气态烃组成的混合气体完全燃烧所需O2的体积是混合气体的3倍(气体体积在相同条件下),该烃的分子式可能为()A.CH4B.C2H6C.C2H4D.C3H6二、非选择题1.请写出乙烷的分子式,电子式,结构式,以及结构简式。
检验甲烷和乙烯的方法

检验甲烷和乙烯的方法
检验甲烷和乙烯的方法可以使用气相色谱法或者红外光谱法。
1. 气相色谱法:
气相色谱法是利用气相色谱仪来检测和分析样品中的化合物。
对甲烷和乙烯的检验,可以先通过适当的样品预处理,将样品中的目标化合物从其他化合物中分离和富集。
然后,将富集的样品通过气相色谱仪进行分析。
气相色谱法可以根据目标化合物在固定相和流动相之间的相互作用和分配系数,通过测定在不同条件下化合物的保留时间来分析和确定样品中的甲烷和乙烯的含量。
2. 红外光谱法:
红外光谱法是利用样品中的化学键振动产生的红外辐射来分析化合物的方法。
对甲烷和乙烯的检验,可以使用红外光谱仪对样品进行扫描,然后观察样品在红外波段的吸收谱图。
根据不同的波数和吸收峰的位置,可以确定样品中是否存在甲烷和乙烯,并且可以通过吸收峰的强度来定量分析样品中的甲烷和乙烯的含量。
无论是气相色谱法还是红外光谱法,都可以用于甲烷和乙烯的检验和分析,选择使用何种方法根据实际需求和设备条件而定。
同时,需要注意的是,样品的预处理和仪器的准确校准对于得到准确和可靠的结果也是非常重要的。
实验09甲烷乙烯的化学性质

【同步实验课】甲烷、乙烯的化学性质【实验目的】1.探究甲烷与氯气的取代反应。
2.了解并掌握乙烯的氧化反应和加成反应。
【实验原理】室温、无光照时;甲烷与氯气不发生反应;光照时,甲烷与氯气发生反应生成一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷和氯化氢。
CH4+Cl2−−−→光照CH3Cl+HClCH3Cl+Cl2−−−→光照CH2Cl2+HClCH2Cl2+Cl2−−−→光照CHCl3+HClCHCl3+Cl2−−−→光照CCl4+HCl乙烯与溴发生加成反应,能与酸性高锰酸钾溶液、氧气发生氧化反应【实验试剂】乙烯、氯气、溴的四氯化碳溶液、石灰水、饱和食盐水、酸性高锰酸钾溶液【实验仪器】量筒(50ml)、试管、玻璃导管、铁架台(带铁夹)、酒精灯、胶皮管、集气瓶【实验一】甲烷与氯气发生取代反应实验操作图解操作实验现象实验结论1.取2支50mL的量筒,通过排饱和食盐水的方法先后各收集约10mL甲烷和40mL氯气。
其中1支量筒用预先准备好的黑色纸套套上,另1支量筒放在光亮处(不要放在日光直射的地方,以免引起爆炸)。
片刻后,比较2支量筒中的现象。
1.50mL甲烷和氯气混合气。
2.反应中液面上升3.出现油状液体1.甲烷氯气混合气2.黑纸套住3.液面未上升试管内气体黄绿色逐渐变浅,试管内壁有油状液体出现,且试管内液面上升。
在光照的条件下,甲烷与氯气发生了取代反应,生成气态一氯甲烷及油状液态的二氯甲烷、三氯甲烷、四氯甲烷。
01实验梳理02实验点拨03典例分析04对点训练05真题感悟4.量筒内未出现明显现象试管内无明显变化。
【实验二】乙烯的化学性质实验操作图解操作实验现象实验结论1.点燃纯净的乙烯,观察燃烧时的现象。
在燃烧后的集气瓶中倒入少量澄清石灰水,观察现象。
2.将乙烯通入到盛有酸性高锰酸钾溶液的试管中,观察现象。
3.将乙烯通入盛有溴的四氯化碳溶液的试管中,观察现象。
1.点燃集气瓶中的甲烷2.甲烷燃烧3.倒入少量石灰水4.石灰水变浑浊1.乙烯通入酸性高锰酸钾溶液甲烷在空气中燃烧,发出明亮的火焰,并有黑烟出现。
有关烃燃烧的规律

有关烃燃烧的规律巧解含烃的混合气体计算题一、甲烷、乙烯、乙炔的燃烧对比:由烷、烯、炔的通式,知其W(C)依次增大,故燃烧时分别产生无黑烟、有黑烟、浓烟等现象,W(C)越大黑烟越多。
此性质也可用于典型物质的鉴别。
2.等物质的量的三者完全燃烧时放出热量最多的是乙烯,但火焰温度最高的却是乙炔,氧炔焰的温度可高达3000℃以上。
二、烷烯炔各类烃含碳(或氢)质量分数的变化规律:1.烷烃:C n H2n+2(n≥1)W(C)=12n/(14n+2)×100% 随n的增大,烷烃W(C)逐渐增大,但永远小于85.7%。
甲烷是烷烃中W(H)最高的。
2.烯烃(或环烷烃):C n H2n(n≥2)W(C)=12n/14n×100%=85.7%即烯烃的W(C)是固定不变的。
3.炔烃(或二烯烃):C n H2n-2(n≥2)W(C)=12n/(14n-2)×100% 随n的增大,炔烃W(C)逐渐减小,但总比烯烃的W(C)高,即总大于85.7%。
乙炔是炔烃中含碳量最高的。
三、烃的燃烧规律:烃的可燃性是烃的一个基本性质,有关烃的燃烧计算和比较是中学化学中常见的习题,掌握烃的燃烧规律,对解决这类习题会起到事半功倍的效果。
烃类燃烧可用通式表示:CxHy + (x+y/4)O2 点燃xCO2 + y/2H2O 1.等物质的量的不同烃燃烧时的耗氧规律:(1)耗O2量取决于(x+y/4),(x+y/4)越大,消耗氧气越多。
(2)产生CO2的量取决于x,x越大,产生CO2的量越多。
(3)产生H2O的量取决于y,y越大,产生H2O的量越多。
例1:等物质的量的CH4、C2H4、C2H2,分别在足量氧气中完全燃烧,以下说法正确的是…………………………………………………………()A.C2H2含碳量最高,燃烧生成的CO2最多B.C2H2燃烧时火焰最明亮C.CH4含氢量最高,燃烧生成的水最多D.CH4、C2H4燃烧生成的水质量不同,消耗的氧气不同。
2021年-甲烷制取乙烯
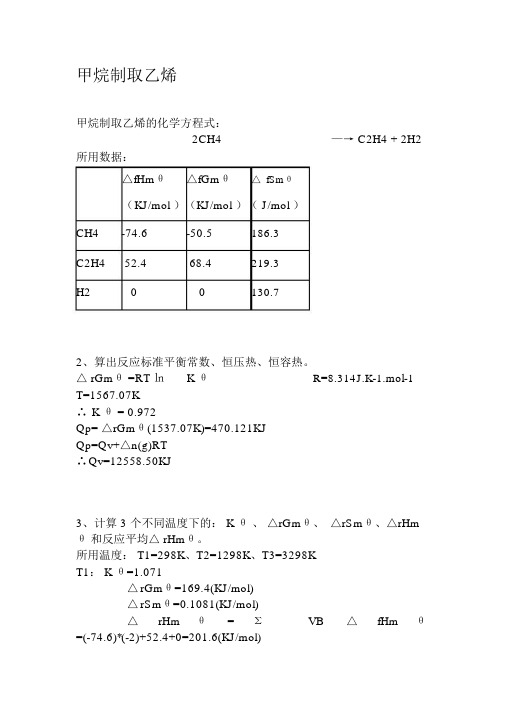
甲烷制取乙烯甲烷制取乙烯的化学方程式:2CH4—→ C2H4 + 2H2所用数据:△fHmθ△fGmθ△ fSmθ(K J/mol )(KJ/mol )( J/mol )CH4-74.6-50.5186.3C2H452.468.4219.3H200130.72、算出反应标准平衡常数、恒压热、恒容热。
△ rGmθ =RT ㏑K θR=8.314J.K-1.mol-1T=1567.07K∴K θ = 0.972Qp= △rGmθ(1537.07K)=470.121KJQp=Qv+△n(g)RT∴Q v=12558.50KJ3、计算 3 个不同温度下的: K θ、△rGmθ、△rSmθ、△rHm θ和反应平均△ rHmθ。
所用温度: T1=298K、T2=1298K、T3=3298KT1: K θ=1.071△rGmθ=169.4(KJ/mol)△rSmθ=0.1081(KJ/mol)△rHmθ=ΣVB△fHmθ=(-74.6)*(-2)+52.4+0=201.6(KJ/mol)反应平均△ rHmθ=288.0207根据基希霍夫公式得:T2: K θ=0.9814.分析在什么条件下有利于此反应?(温度、压力、惰性气体)由于此反应在标准情况下不能进行,根据基希霍夫公式可知,高温高压下有利于此反应进行;5工业上是如何实现此反应的。
(1) 由石油分离生产乙烯是由石油化工裂解而成。
在这个过程中,气态或轻液态烃是加热到 750-950 ℃,诱使许多自由基反应,然后立即淬火冻结的反应。
这个过程中,把大型碳氢化合物转换到较小型的碳氢化合物,并反应出不饱和烃。
(2)由煤合成方法煤合成烯烃( MTO):煤基制烯烃技术,它是C1化工新工艺,是指以煤气化的合成气合成的甲醇为原料,借助类似催化裂化装置的流化床反应形式,生产低碳烯烃的化工技术。
6.此合成物还有哪些工业制法?(发展历史、反应条件等)发展历史:乙烯,被称为“石化工业之母”,其生产能力被看作是一个国家经济实力的体现。
甲烷与乙烯

最简单的有机化合物——甲烷来自石油和煤的两种基本化工原料[考纲要求] 1.了解有机物中碳的成键特征。
2.了解有机化合物的同分异构现象。
3.了解甲烷等烷烃的主要性质。
4.了解乙烯、苯等有机化合物的主要性质。
5.了解乙烯、氯乙烯、苯的衍生物等在化工生产中的重要作用。
知识点一甲烷1.甲烷的结构分子式:________,电子式:____________,结构式:____________,结构简式:________。
2.甲烷的性质(1)物理性质颜色:________,气味:________,密度:______________,比空气____。
溶解性:__________,状态:________。
(2)化学性质问题思考1.实验室收集甲烷时可采用什么方法?为什么?2.能否用甲烷与氯气反应制取纯净的一氯甲烷?3.取代反应与置换反应有何不同?知识点二烷烃1.结构特点碳原子间以________结合,其余价键均与________结合,使每个碳原子的化合价均达到________,因此烷烃又称饱和烃。
2.物理性质(1)均____溶于水且密度比水____。
(2)随碳原子数的增加,熔、沸点逐渐________,密度逐渐________。
(3)碳原子数为1~4时,烷烃为____态,当碳原子数≥5时,烷烃为________态。
3.化学性质烷烃的化学性质与甲烷类似,通常较________,在空气中能________,光照下能与氯气发生__________。
问题思考已知甲烷是正四面体结构,根据烷烃的碳原子连接情况分析,碳原子是否处于一条直线知识点三同系物与同分异构体1.同系物________相似,在分子组成上相差一个或若干个________原子团的物质互称为同系物。
2.同分异构现象化合物具有相同________,但具有不同________的现象。
3.同分异构体具有________现象的化合物互称为同分异构体,如C4H10的两种同分异构体为:知识点四乙烯1.烯烃分子中含有______________的烃叫做烯烃。
甲烷乙烯实验报告

一、实验目的1. 掌握甲烷和乙烯的实验室制取方法。
2. 了解甲烷和乙烯的物理性质和化学性质。
3. 比较甲烷和乙烯在燃烧性质上的差异。
二、实验原理1. 甲烷的制取:甲烷可以通过加热乙酸钠与氢氧化钠的混合物制得,反应方程式为:NaCH3COO + NaOH → CH4↑ + H2O + Na2CO32. 乙烯的制取:乙烯可以通过乙醇与浓硫酸在高温下反应制得,反应方程式为:CH3CH2OH → CH2=CH2↑ + H2O三、实验用品1. 甲烷制取:- 乙酸钠- 氢氧化钠- 碱石灰- 铁架台- 酒精灯- 试管- 水槽- 坩埚钳- 蒸发皿- 石棉网- 镊子- 药匙- 玻璃棒- 火柴- 集气瓶- 玻璃片2. 乙烯制取:- 乙醇- 浓硫酸- 铁架台- 酒精灯- 石棉网- 蒸馏烧瓶- 温度计- 沸石- 碱石灰四、实验步骤1. 甲烷的制取:a. 将1.5g无水乙酸钠和0.4g CaO、0.4g NaOH混合,装入试管中。
b. 将仪器组装好,预热,然后集中火力由管前向管尾加热。
c. 产生的气体先验纯后收集或点燃。
2. 乙烯的制取:a. 将2g乙醇和浓硫酸混合,加入沸石。
b. 将混合物放入圆底烧瓶中,加热至170℃。
c. 收集产生的气体。
五、实验现象1. 甲烷的制取:a. 产生气体,点燃后发出蓝色火焰。
2. 乙烯的制取:a. 产生气体,收集后点燃,发出淡蓝色火焰。
六、实验结果与分析1. 甲烷的制取:a. 成功制得甲烷气体,火焰颜色为蓝色。
b. 甲烷的制取过程简单,实验现象明显。
2. 乙烯的制取:a. 成功制得乙烯气体,火焰颜色为淡蓝色。
b. 乙烯的制取过程需要较高温度,实验现象较不明显。
七、结论1. 成功制取了甲烷和乙烯气体,并观察到了相应的实验现象。
2. 甲烷和乙烯均为可燃气体,燃烧时分别产生蓝色和淡蓝色火焰。
3. 甲烷和乙烯在物理性质和化学性质上存在一定差异,如燃烧火焰颜色不同。
八、注意事项1. 实验过程中要注意安全,防止火灾和爆炸。
除去甲烷中的乙烯用什么方法

除去甲烷中的乙烯用什么方法分离甲烷和乙烯的方法有多种,下面将详细介绍几种常用的方法:1. 吸附分离法:吸附分离法是利用吸附剂对甲烷和乙烯的亲和性差异进行分离的方法。
常见的吸附剂有活性炭、分子筛等。
在压力较高的条件下,将混合气体通过吸附床,甲烷和乙烯会在吸附剂表面发生吸附,由于乙烯的亲和性较强,因此被吸附剂吸附的乙烯量相对较多,而甲烷则较少被吸附。
随后通过改变温度或减小压力等条件,从吸附剂上脱附乙烯和甲烷,实现二者的分离。
这种方法具有操作简单、设备投资低的优点,但是需要进行多次吸附和脱附过程,对吸附剂的选择和再生也有一定要求。
2. 液体吸收法:液体吸收法是利用乙烯在液体中的溶解度较高,而甲烷的溶解度较低的特点进行分离的方法。
通常会选择一种具有高乙烯溶解度的液体作为吸收剂,将混合气体通过吸收塔,乙烯会溶解在液体中,而甲烷则较少被溶解。
然后通过改变温度或减小压力等条件,从液体中析出乙烯和甲烷,实现二者的分离。
这种方法操作简单,且可以实现高纯度的乙烯分离,但吸收剂的选择和再生是一个考虑因素。
3. 分子筛膜分离法:分子筛膜分离法是利用具有特定孔径大小的分子筛材料对不同大小的分子进行筛选和分离的方法。
通过将混合气体通过膜模块,甲烷的分子由于较小,能够通过膜孔,而乙烯的分子则由于较大,无法通过。
通过这种方式,实现了甲烷和乙烯的分离。
该方法具有操作简单、设备体积小的优点,但是对于膜的选择和使用条件的控制要求较高。
4. 催化剂选择氧化法:催化剂选择氧化法是指通过选择性氧化乙烯来将其转化为乙醛、乙烯酸或丙烯酸,使其与甲烷发生反应生成水和二氧化碳等气体,进而将乙烯从混合气体中分离出来的方法。
这种方法需要选用合适的催化剂,并且需要进行多步反应,相对来说比较复杂。
但是,该方法可以实现高效、高纯度的乙烯分离。
综上所述,分离甲烷中的乙烯可以通过吸附分离法、液体吸收法、分子筛膜分离法以及催化剂选择氧化法等方法实现。
不同的方法有各自的优缺点,根据实际情况选择合适的方法进行分离。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
甲烷与乙烯
1.稳定:通常情况下不与强酸、强碱、强氧化剂[如:不使___________________褪色]反应
2.在空气中燃烧:___________________________________________________(________反应)
3.甲烷与氯气(光照):________________________________________________(________反应)
1.在空气中燃烧:__________________________________________________(________反应)
2.使KMnO4(H+)溶液褪色:__________________________________________(________反应)
3.乙烯与溴:______________________________________________________(________反应)
4.乙烯与氢气:____________________________________________________(________反应)
5.乙烯和氯气:____________________________________________________(________反应)
6.乙烯和氯化氢:__________________________________________________(________反应)
7.乙烯和水:______________________________________________________(________反应)
8.乙烯聚合:______________________________________________________(________反应)
【基础练习】
1.通常用于衡量一个国家石油化工发展水平的标志是
A.石油的产量
B.乙烯的产量
C.天然气的产量
D.汽油的产量
2.下列物质中,不能和乙烯发生加成反应的是
A.H2
B.H2O
C.KMnO4
D.Br2
3.能用于鉴别甲烷和乙烯的试剂是
A.溴水
B.酸性高锰酸钾溶液
C.苛性钠溶液
D.四氯化碳溶液
4.下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是
A.乙烷与氯气光照反应
B.乙烯与氯化氢气体混合
C.乙烯与氯气混合
D.乙烯通入浓盐酸
5.相同物质的量的下列烃,完全燃烧时,需要氧气最多的是
A.CH4
B.C2H4
C.C3H6
D.C2H2。
