温度、催化剂对化学平衡移动的影响
化学平衡的移动外界条件对反应平衡的影响

化学平衡的移动外界条件对反应平衡的影响化学平衡是指在封闭系统中,当化学反应达到一种稳定状态时,各种反应物和生成物的浓度保持不变。
在这个平衡状态下,反应的前进速率与反应的逆向速率相等。
然而,外界条件的变化会对反应平衡产生影响,从而改变化学平衡的位置和方向。
一、温度的影响改变温度是移动平衡的外界条件之一,温度的升高或降低会导致反应平衡的位置发生变化。
以放热反应为例,当温度升高时,平衡会向右移动(即生成物增多)以吸收多余的热量;而温度降低时,平衡会向左移动(即反应物增多)以释放多余的热量。
反之,吸热反应的情况则相反。
二、压力的影响对于气相反应而言,改变压力也会对平衡位置产生影响。
根据Le Chatelier原理,增加压力会使平衡向反应物的较少摩尔数方向移动,以减少压力;减少压力则使平衡向反应物的较多摩尔数方向移动,以增加压力。
三、浓度的影响通过改变反应物或生成物的浓度,可以移动反应平衡的位置。
增加反应物浓度会使平衡向生成物方向移动,以消耗多余的反应物;而增加生成物浓度则会使平衡向反应物方向移动,以消耗多余的生成物。
四、催化剂的影响催化剂对平衡的位置没有直接的影响,但它可以加速达到平衡的速率。
催化剂通过提供新的反应途径,降低活化能,从而加快反应速率。
虽然催化剂不改变反应的平衡常数,但它可以使达到平衡的速率更快。
除了上述条件外,光照、溶液pH值的改变等也会对化学反应平衡产生影响。
这些外界条件的改变都可以通过Le Chatelier原理进行解释,即系统会对外界条件的变化做出平衡的调整,以维持平衡状态。
总结起来,化学平衡的移动外界条件对反应平衡具有重要影响。
通过改变温度、压力、浓度等条件,可以迫使反应向有利于外界条件改变的方向进行平衡的移动,从而实现对反应的控制和调节。
这对于化学工业的生产以及实验室中的反应设计和操作具有重要意义。
化学平衡的移动方向影响因素

化学平衡的移动方向影响因素化学平衡是指化学反应在一定条件下达到动态平衡的状态,即化学反应的正反应速率相等。
移动方向是指在平衡状态下,化学反应向正向反应或逆向反应进行的倾向。
在化学平衡中,移动方向的影响因素主要包括温度、浓度、压力和催化剂等。
接下来将对这些因素进行详细的论述。
1. 温度温度是影响化学平衡移动方向的重要因素之一。
根据Le Chatelier原理,当温度增加时,反应被视为吸热反应,系统会通过吸收热量的方式来减小温度。
因此,移动方向会偏向于吸热的反应方向,以吸收更多的热量来降低温度。
反之,当温度降低时,反应被视为放热反应,系统会通过释放热量来增加温度,移动方向会偏向于放热的反应方向,以释放更多的热量。
2. 浓度浓度是化学平衡移动方向的另一个重要因素。
根据Le Chatelier原理,当某一物质的浓度增加时,系统会减小浓度差,以达到平衡。
因此,移动方向会偏向于减小浓度的反应方向。
反之,当某一物质的浓度减小时,系统会增大浓度差,移动方向会偏向于增大浓度的反应方向。
需要注意的是,对于液体和固体物质的浓度变化,对移动方向影响较小,因为它们的浓度变化相对较小。
3. 压力对于气态反应而言,压力是影响移动方向的因素之一。
当压力增大时,分子的碰撞频率增加,系统会通过减少分子数量来降低压力。
因此,移动方向会偏向于减少分子数量的反应方向。
反之,当压力减小时,系统会增加分子数量,移动方向会偏向于增加分子数量的反应方向。
需要注意的是,对于液体和固体物质,压力的变化对移动方向几乎没有影响。
4. 催化剂催化剂是一种能够改变化学反应速率但不参与反应的物质。
在化学平衡中,催化剂可以影响移动方向。
催化剂提供了一个新的反应路径,降低了反应的活化能,从而加快了反应速率。
由于催化剂不改变反应的平衡常数,它在两个反应方向中起到相同的作用。
因此,催化剂对移动方向没有直接的影响。
综上所述,化学平衡的移动方向受到多种因素的影响,包括温度、浓度、压力和催化剂。
温度和催化剂对化学平衡的影响

B.N2(g)+3H2(g) 2NH3(g) (正反应为放热反应)
C.2SO3(g) 2SO2(g)+O2(g) (正反应为吸热反应)
D.H2(g)+I2(g) 2HI(g) (正反应为放热反应)
变式探究2
如图中曲线a表示放热反应X(g)+Y(g) Z(g)+M (g)+N(s),进行过程中X的转化率随时间变化的关系。若要改变起始条件,使反应过程按b曲线进行,可采取的措施是()
③有气体参加的反应达到平衡时,若减小反应器容积时,平衡一定移动
④有气体参加的反应达平衡后,在恒压反应器中充入稀有气体,平衡一定不移动
A.①④B.①②③C.②③④D.①②③④
答案:
例1:C
变式1:A变式2:C变式3:B变式4:C变式5:B变式6:D
A.加催化剂同时升高温度B.加催化剂同时增大压强
C.升高温度同时充入N2D.降低温度同时增大压强
变式探究6
下列对化学平衡移动的分析中,不正确的是()
①已达到平衡的反应C(s)+H2O(l) CO(g)+H2(g),当增加反应物物质的量时,平衡一定向正反应方向移动
②已达到平衡的反应N2(g)+3H2(g) 2NH3(g),当增大N2的浓度时,平衡向正反应方向移动,N2的转化率一定升高
变式探究4
对于反应2A(g)+B(g) 2C(g)△H>0,下列反应有利于生成C的是()
A.低温低压B.低温高压C.高温高压D.高温低压
变式探究5
在密闭容器中,一定条件进行如下反应:
NO(g)+CO(g) 1/2N2(g)+CO2(g)△H=-373.2kJ/mol,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是()
温度、催化剂对化学平衡移动的影响 课件

特列原理只适用于只有一个条件改变的平衡移动情况。
(2)勒夏特列原理中的“减弱”不是“抵消”或“逆转”。正确理解是:
增大某一反应物浓度,平衡向使该反应物浓度减小的方向(正反应
方向)移动;但达到新平衡时这一反应物浓度仍比原平衡时大;增大
压强,平衡向使压强减小的方向(气体分子数减小的方向)移动,但达
到新平衡时压强仍比原平衡时大;升高温度,平衡将向温度降低的
方向(吸热反应方向)移动,但达到新平衡时的温度仍比原平衡时高。
反之亦然。如下图所示。
勒夏特列原理:如果改变影响平衡的条件之一(如温度、压强,以
及参加反应的化学物质的浓度),平衡将向着能够减弱这种改变的
方向移动。
题型一 应用勒夏特列原理解释实际问题
于1884年提出。是一个定性预测化学平衡点的原理,其内容为:如
果改变影响平衡的条件之一(如温度、压强,以及参加反应的化学
物质的浓度),平衡将向着能够减弱这种改变的方向移动。
讨论探究
(1)勒夏特列原理的适用范围是什么?
(2)如何正确理解“减弱”这个词在勒夏特列原理中的含义?
探究提示:(1)适用范围:勒夏特列原理仅适用于已达到平衡的反
量均比t0~t1时间段内的低,所以t0~t1时间段内NH3的百分含量最大。
(4)t6时刻分离出NH3,v(逆)立即减小,而v(正)逐渐减小,在t7时刻二者
相等,反应重新达到平衡,据此可画出反应速率的变化曲线。(5)设
反应前加入a mol N2、b mol H2,达平衡时生成2x mol NH3,则反应
例题1下列事实不能用平衡移动原理解释的是 (
)
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
化学平衡的移动条件

化学平衡的移动条件化学平衡是指当反应物和生成物在一定条件下达到动态平衡状态时,它们的浓度、压力或其他相关物态参数不再发生变化。
为了使化学反应达到平衡状态,可以通过改变温度、压力、浓度和添加催化剂等手段来移动平衡。
本文将讨论影响化学平衡移动的条件以及它们的作用机理。
一、温度的影响温度是影响化学平衡移动的重要因素之一。
根据利奥·香特列定律,当温度发生变化时,平衡反应的正向和逆向反应速率都会发生变化。
对于吸热反应(放热反应),升高温度会使平衡转向生成物一侧,而降低温度则会偏向反应物一侧。
对于放热反应(吸热反应),情况相反。
以氨的合成反应为例:N2(g) + 3H2(g) ⇌ 2NH3(g) + 92.4 kJ该反应是一个放热反应,因此当温度升高时,反应向生成物一侧移动,生成氨的产率增加。
而当温度降低时,反应向反应物一侧移动,生成氨的产率减少。
二、压力的影响压力是影响化学平衡移动的另一个关键因素。
对于气体反应,改变压力会对平衡产生影响。
根据洪特定律,当体积不变的情况下,提高压力会使平衡转向摩尔数较少的一侧,而减小压力则会偏向摩尔数较多的一侧。
以二氧化碳和一氧化碳反应生成一氧化碳和氧化碳的平衡反应为例:CO2(g) + CO(g) ⇌ 2CO(g)该反应为气体反应,增加压力会使平衡向CO2和CO的生成物一侧移动,生成CO的产率增加。
减小压力则会偏向反应物一侧,生成CO的产率减少。
三、浓度的影响浓度也是影响化学平衡移动的重要因素之一。
对于溶液反应,改变物质的浓度会对平衡产生影响。
根据一般来说,增加浓度会使平衡转向生成物一侧,而降低浓度则会偏向反应物一侧。
以还原铁离子为例:Fe3+(aq) + SCN-(aq) ⇌ Fe(SCN)2+(aq)该反应为溶液反应,增加铁离子或硫氰离子的浓度会使平衡向生成配合物Fe(SCN)2+的一侧移动,生成铁离子配合物的产率增加。
减小浓度则会偏向反应物一侧,生成铁离子配合物的产率减少。
温度、催化剂对化学平衡移动的影响课件2022-2023学年上学期高二化学人教版选择性必修1

思:13分钟
前5分钟看资料(阅读教材帮63-65页) 1. 了解影响可逆反应平衡移动的因素有哪些? 2. 可逆反应达到平衡后,温度、催化剂改变,平衡会怎样移动? 3. 什么是勒夏特列原理?怎么利用这一原理判断平衡移动? 后8分钟写学案
在合作中解决问题
时间:5min
讨论重点:
1.看课本时有疑问的地方。
2.反应:A(g)+3B(g) 2C(g) ΔH<0达到平衡后,将反应体系的温度 降低,下列叙述正确的是 A.正反应速率增大,逆反应速率减小,平衡向右移动 B.正反应速率减小,逆反应速率增大,平衡向左移动
√C.正反应速率和逆反应速率都减小,平衡向右移动
D.正反应速率和逆反应速率都减小,平衡向左移动
√A.①②③④⑥ B.④⑤⑥ C.①③④⑤ D.③④⑥
D.B和C不可能都是气体
对点训练 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
2.下列事实中,能用勒夏特列原理解释的是 ①夏天,打开啤酒瓶时会从瓶口逸出气体 ②浓氨水中加入氢氧化钠固 体时产生较多的刺激性气味的气体 ③实验室可用排饱和食盐水的方法 收集氯气 ④将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷 水中,混合气体的颜色变浅⑤使用催化剂可加快SO2转化为SO3的速率 ⑥合成氨时,将氨液化分离,可提高原料利用率
C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化剂效率比乙高 D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高
勒夏特列原理
评
1.定义 如果改变影响平衡的一个因素(如温度、压强及参加反应的物质的浓度), 平衡就向着能够 减弱 这种改变的方向移动。 简单记忆:改变―→减弱这种改变。
勒夏特列原理的应用
温度、催化剂对化学平衡的影响
练习
一定量的混合气体在密闭容器中发生反应: m A (g) + n B (g) p C (g)
达到平衡后,温度不变,将气体体积缩小到原来 的1/2但达到平衡时,C的浓度为原来的1.8倍,则 下列说法正确的是 ( B ) A、m + n > p
B、A 的转化率降低 C、平衡向正反应方向移动 D、C的体积分数增加
合成氨的工艺流程如图2-24 所示。在工业生产中,可以通过以 下途径来提高合成氨的产率。请利 用有关知识分析采取这些措施的原 因。 1.向反应器中注入过量N2。 2.采用适当的催化剂。 3.在高压下进行反应。 4.在较高温度下进行反应。
思考并完成下列表格
2SO2(g) + O2(g)
2SO3(g)度
平衡移动的方向 新平衡建立时
O2浓度较原平衡 大 SO3浓度较原 平衡小 总压强比原平 衡大 平衡温度比旧 平衡高
具
体
抽 象
向右,即O2浓度 减小的方向 减小SO3的浓度 向右,即SO 浓 3 度增大的方向 增大压强 向右,即压强减 小方向 升高温度 向左,即温度降 低的方向 改变一个条件 减弱这种改变
• 总结:
其他条件 不变时:
升高温度 降低温度
化学平衡向吸热的方向移动 化学平衡向放热的方向移动
总的来说:化学平衡的移动能削弱温度改变给可 逆反应所带来的影响,但并不能完全抵消。
四、催化剂对化学平衡的影响
催化剂降低了反应的活 化能,正反应的活化能降低, 逆反应的活化能也降低,正 反应的活化分子百分数增加 几倍,逆反应的活化分子百 分数也增加几倍,正逆反应 速率增加的倍数相等,加催 化剂,不能使平衡发生移动, 只影响到达平衡的时间。
D、升温
《化学反应原理》第二章 第二节 第4课时 温度、催化剂对化学平衡的影响 勒夏特列原理

第4课时温度、催化剂对化学平衡的影响勒夏特列原理[核心素养发展目标] 1.通过实验论证说明温度的改变和催化剂对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型。
2.理解勒夏特列原理,能依据原理分析平衡移动的方向,体会理论对实践的指导作用。
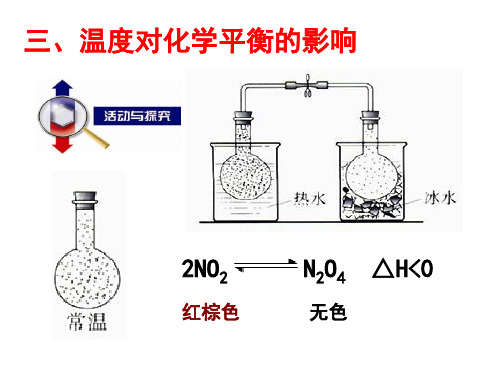
一、温度、催化剂对化学平衡的影响1.实验探究温度对化学平衡的影响(1)常温下,反应2NO2(g)(红棕色)N2O4(g)(无色)ΔH=-56.9 kJ·mol-1达到平衡,按图示装置实验,观察实验现象,填写下表:热水中冰水中实验现象混合气体颜色______ 混合气体颜色________实验结论说明NO2浓度______,平衡向________方向移动,即升高温度,平衡向________反应的方向移动说明NO2浓度______,平衡向______方向移动,即降低温度,平衡向________反应的方向移动(2)从温度对平衡常数K影响的角度解释上述实验平衡的移动方向:该反应为放热反应,升高温度,K________,平衡________移动;降低温度,K________,平衡________移动,与实验结论一致。
2.温度对化学平衡的影响规律(1)改变温度,任意可逆反应的化学平衡一定会发生移动。
(2)当其他条件不变时,升高温度,化学平衡向________的方向移动;降低温度,化学平衡向________的方向移动。
3.催化剂对化学平衡的影响规律(1)催化剂能同等程度的改变____________反应速率。
其图像(v-t图)如图。
(2)当其他条件不变时,催化剂__________改变达到化学平衡状态时反应混合物的组成,催化剂能改变反应达到化学平衡所需的________。
(1)温度可以影响任意可逆反应的化学平衡状态()(2)升高温度,反应速率加快,化学平衡向正反应方向移动()(3)升高温度,反应速率加快,但反应物的转化率可能降低()(4)升高温度,化学平衡常数一定增大()(5)对于可逆反应,改变外界条件使平衡向正反应方向移动,平衡常数一定增大()(6)平衡移动,平衡常数不一定改变,但平衡常数改变,平衡一定发生移动()(7)催化剂能加快反应速率,提高物质单位时间内的产量,也能提高反应物的转化率()1.一定条件下,在密闭容器中,发生反应CO2(g)+H2(g)CO(g)+H2O(g)ΔH>0,达平衡后:(1)容积不变,升高温度,平衡________移动,c(CO2)________,氢气的转化率________,CO 的体积分数________,混合气体的平均相对分子质量________。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
选修4第二章化学反应速率和化学平衡训练5影响化学平衡移动的因素(二)
温度、催化剂对化学平衡移动的影响
[基础过关]
一、勒夏特列原理的应用
1.下列事实不能用勒夏特列原理解释的是() A.光照新制的氯水时,溶液的pH逐渐减小
B.加催化剂,使N2和H2在一定条件下转化为NH3
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2与O2反应生成SO3
2.下列事实不能用勒夏特列原理解释的是() A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存于低温处
D.实验室用排饱和食盐水的方法收集氯气
二、温度对化学平衡移动的影响
3.对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是() A.加入一种反应物B.增大体系的压强
C.升高温度D.使用催化剂
4.如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉。
在一定条件
Ni(CO)4(g),但Ni粉中的下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)323~353 K
453~473 K
杂质不与CO(g)发生反应。
玻璃管内左右两端的温度分别稳定在350 K和470 K,经过足够长时间后,右端的主要物质是()
A.纯Ni(s)和Ni(CO)4(g)
B.纯Ni(s)和CO(g)
C.不纯Ni(s)和CO(g)
D.不纯Ni(s)和Ni(CO)4(g)
5.如图所示,三个烧瓶中分别充满NO2气体并分别放置在盛有下列物质的烧杯(烧杯内有水)中:在(1)中加入CaO,在(2)中不加其他任何物质,在(3)中加入NH4Cl晶体,发现(1)中红棕色变深,(3)中红棕色变浅,下列叙述正确的是()
A.2NO2 ⇌N2O4是放热反应
B.NH4Cl溶于水时放出热量
C.烧瓶(1)中平衡混合气的平均
相对分子质量增大
D.烧瓶(3)中气体的压强增大
三、采取措施使化学平衡定向移动
6.利用反应:2NO(g)+2CO(g)⇌2CO2(g)+N2(g)ΔH=-746.8 kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是() A.降低温度
B.增大压强同时加催化剂
C.升高温度同时充入N2
D.及时将CO2和N2从反应体系中移走
7.COCl2(g)⇌CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施:①升温
②恒容通入惰性气体③增加CO浓度④减压⑤加催化剂⑥恒压通入惰性气体,其中能提高COCl2转化率的是()
A.①②④B.①④⑥C.②③⑤D.③⑤⑥
8.右图曲线a表示放热反应2X(g)⇌Z(g)+M(g)+N(s)进行过程
中X的转化率随时间变化的关系。
若要改变起始条件,使反应
过程按b曲线进行,不可能采取的措施是()
A.升高温度B.X的投入量增加
C.加催化剂D.减小容器体积
9.对于平衡CO2(g)⇌CO2(aq)ΔH=-19.75 kJ·mol-1,为增大二氧化碳气体在水中的溶解度,应采用的方法是()
A.升温增压B.降温减压
C.升温减压D.降温增压
四、条件改变对化学反应速率和化学平衡的综合影响
10.右图是关于反应A2(g)+B2(g)⇌2C(g)+D(g)ΔH<0的平衡移动图像,影响平衡移动的原因可能是()
A.升高温度,同时加压
B.压强不变,降低温度
C.压强、温度不变,充入一些与之不反应的惰性气体
D.温度、压强不变,充入一些A2(g)
11.某密闭容器中发生如下反应:X(g)+3Y(g)⇌2Z(g)ΔH<0。
下图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。
下列说法中正确的是()
A .t
2时加入催化剂
B .t 3时降低了温度
C .t 5时增大了压强
D .t 4~t 5时间内转化率一定最低
[能力提升]
12.现有反应:m A(g)+n B(g) ⇌ p C(g),达到平衡后,当升高温度时,B 的转化率变大;当
减小压强时,混合体系中C 的质量分数减小,则:
(1)该反应的逆反应为______反应(填“吸热”或“放热”),且m +n ______p (填“>”、“=”或“<”)。
(2)减压使容器体积增大时,A 的质量分数________。
(填“增大”、“减小”或“不变”,下同)
(3)若容积不变加入B ,则A 的转化率__________,B 的转化率________。
(4)若升高温度,则平衡时B 、C 的浓度之比c (B )c (C )
将________。
(5)若加入催化剂,平衡时气体混合物的总物质的量____________________________。
13. PCl 3与PCl 5均是有机合成的重要中间体,两者存在以下相互转化关系:
PCl 5(g) ⇌ PCl 3(g)+Cl 2(g) ΔH =a kJ·mol -
1,在210 ℃时,将4 mol PCl 5气体充入2 L 真
(1)已知上述反应在温度较高时才能自发进行,则a ____0(填“>”、“=”或“<”)。
(2)计算从20 s 至40 s 共20 s 的时间内,用PCl 3表示的平均反应速率为__________。
(3)反应进行至60 s 后,将混合物的温度降低,重新达到平衡后氯气浓度将________(填“增大”、“减小”或“不变”)。
(4)欲增大PCl 5的量,可采取的措施有(填序号)_________________________________。
A .降低温度
B .向混合气体中通入Cl 2
C .使用高效催化剂
D .升高温度
(5)如图是210 ℃时容器中PCl 5物质的量的变化曲线,请在该图中补画出该反应在160 ℃时PCl 5物质的量的变化曲线。
14.在一定条件下,可逆反应A+B ⇌m C变化如右图所示。
已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器内压强的变化情况,问:
(1) 温度T1________T2(填“大于”、“等于”或“小于”),
正反应是________反应(填“吸热”或“放热”)。
(2) 如果A、B、C均为气体,则m________2(填“大于”、
“等于”或“小于”)。
(3) 当温度和容积不变时,如向平衡体系中加入一定量的
某稀有气体,则体系的压强_____(填“增大”、“减小”
或“不变”),平衡____移动(填“向正反应方向”、“向逆反应方向”或“不”,下同)。
(4) 当温度和压强不变时,如向平衡体系中加入一定量的某稀有气体,平衡______移动。
[拓展探究]
15.在一容积为2 L的密闭容器中,加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)⇌2NH3(g)ΔH<0。
反应中NH3的物质的量浓度的变化情况如图所示,请回答下列问题:
(1)根据图像,计算从反应开始到平衡时,用NH3表示的平均反应速率v(NH3)=
____________。
(2)该反应达到平衡时H2的转化率为_________________________________________。
(3)反应达到平衡后,第5 min末,若保持其他条件不变,仅改变反应温度,则NH3的
物质的量浓度不可能为__________________________________________________。
(填序号)
a.0.20 mol·L-1b.0.12 mol·L-1
c.0.10 mol·L-1d.0.08 mol·L-1
(4)反应达到平衡后,第5 min末,若保持其他条件不变,只把容器的体积缩小一半,平
衡________移动(填“向逆反应方向”、“向正反应方向”或“不”)。
(5)在第5 min末将容器的体积缩小一半后,若在第8 min末达到新的平衡(此时NH3的
浓度约为0.25 mol·L-1),请在图中画出第5 min末到平衡时NH3浓度的变化曲线。
选修4第二章化学反应速率和化学平衡训练5影响化学平衡移动的因素(二)
温度、催化剂对化学平衡移动的影响
答案
1.B 2.B3.C4.B 5.A6.B7.B8.A9.D10.D 11.A 12.(1) 放热>(2) 增大(3) 增大减小(4) 减小(5) 不变13.(1) >(2) 0.02 mol·L-1·s-1(3) 减小(4) AB
(5)如图所示
14.(1) 大于放热(2) 大于(3) 增大不(4) 向正反应方向
15.(1) 0.025 mol·L-1·min-1(2) 50%
(3) a c(4) 向正反应方向
(5) 如图。
