铁的氧化物、氢氧化物的主要性质
铁的氢氧化物的性质

铁的氢氧化物的性质铁的氢氧化物是一种重要的无机化合物,是由铁和氧化氢所组成的化合物。
在生产和工业上,铁的氢氧化物广泛应用于制备纯净的铁、金属表面处理、防锈涂料、磁性介质等方面。
本文主要介绍铁的氢氧化物的性质。
1. 化学性质铁的氢氧化物主要分为Fe(OH)2和Fe(OH)3两种。
两种氢氧化物都具有强还原性和强碱性。
在空气中,Fe(OH)2会被氧化成Fe(OH)3,因此,通常情况下只存在Fe(OH)3。
(1) 酸碱性由于铁的氢氧化物是一种碱性物质,它可以与酸反应产生水和相应的盐。
例如,Fe(OH)3可以与盐酸反应,生成水和氯化铁:Fe(OH)3 + 3HCl → FeCl3 + 3H2O(2) 氧化性铁的氢氧化物在空气中容易被氧化成Fe2O3,因此长时间储存的Fe(OH)3会逐渐变质。
此外,铁的氢氧化物也可以被还原成铁或Fe2+。
例如,Fe(OH)3在还原性气氛中,可以被还原成黑色的Fe(OH)2。
(3) 沉淀性铁的氢氧化物也是一种沉淀剂。
在水中,Fe(OH)3可以很容易地沉淀出来形成Fen(OH)m的胶状物质,其中n和m分别表示氢氧根离子和铁离子的配位数。
当水中含有过多的碳酸盐离子时,铁的氢氧化物会发生碳酸化反应生成不溶性的FeCO3,这也是防止铁的氢氧化物沉淀的方法之一。
2. 物理性质(1) 外观铁的氢氧化物一般是棕色或红棕色的粉末,也可以是胶状物质。
(2) 溶解性Fe(OH)2在水中不易溶解,而Fe(OH)3则易溶于酸和碱中,但不溶于水。
在NH4OH溶液中,铁的氢氧化物具有良好的溶解性,但是晶体很容易变质。
(3) 密度和熔点Fe(OH)2的密度约为3.4 g/cm3,熔点为842°C;Fe(OH)3的密度约为3.4-3.8 g/cm3,熔点为约300°C。
3. 应用铁的氢氧化物作为一种重要的无机化合物,有广泛的应用。
以下是它的主要用途:(1) 制备纯净的铁铁的氢氧化物可以直接还原制备出纯铁。
2024届高考一轮复习化学课件(人教版):金属及其化合物-铁及其氧化物和氢氧化物

2.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是_①__②__④___(填序号)。
①②原理一样,都是先用氢气将装置中的空气排尽,并使生成的Fe(OH)2处在氢 气的保护中; ④中液面加苯阻止了空气进入; ③由于带入空气中的氧气,能迅速将 Fe(OH)2氧化,因而不能较长时间看到白色 沉淀。
返回
<
>
铁的氢氧化物
必备知识
1.氢氧化铁和氢氧化亚铁的比较
化学式 色、态 与盐酸反应
Fe(OH)2 白 色固体 _F__e(_O__H_)_2+__2_H__+_=_=_=_F_e_2_+_+__2_H__2O__
受热分解
Fe(OH)3 红褐 色固体 _F_e_(_O_H__)3_+__3_H_+__=_=_=_F_e_3_+_+__3_H_2_O__
回答下列问题: (1)仪器a的名称是__恒__压__滴__液__漏__斗__,B中长 玻璃管的作用是_平__衡__气__压__,__辅__助__排__出__装___ _置__B_中__的__空__气___。 (2)装置A中金属离子的检验方法是_取__少___ _量__装__置__A_烧__瓶__中__的__液__体__于__洁__净__试__管__中__,__滴__加__几__滴__K__S_C_N__溶__液__,__无__红__色__出__现__,__再__滴__加__ _H_2_O__2,__溶__液__变__为__红__色__,__则__证__明__存__在__F_e_2_+__。 (3)步骤Ⅲ 装置B中的现象是__白__色__沉__淀__逐__渐__变__为__灰__绿__色__,__最__后__变__为__红__褐__色__,其发生 反应的化学方程式为_4_F_e_(_O_H__)2_+__O__2+__2_H__2O__=_=_=_4_F_e_(_O_H__)3_。
铁的氧化物和氢氧化物

化合价
+2
溶解性
FeO+2HCl=
与酸反应 FeCl2 + H2O
氧化铁
Fe2O3 红棕色粉末
铁红
+3
均不溶于水
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
稳定性
氧化铁用途
四氧化三铁 Fe3O4 黑色晶体
磁性氧化铁
+2 、+3
二、铁的氢氧化物: 1.Fe(OH)2
(1)、 制取:
分组试验
由可溶性的亚铁盐跟碱溶液起反应制得
现象: 白色絮状沉淀能迅速变成灰绿色,最终变成
红褐色。
Fe(OH)2性质
(2) 物理性质:
白色絮状沉淀,不溶水;
(3) 化学性质:
① 与酸反应; ② 易被氧化;
Fe(OH)2制备条件探究
⑴ 滴管口插入硫酸亚铁液面下,再滴入 NaOH溶液;
⑵配液溶液时可用加热的方法尽可能除去溶解氧;
2.在下列几种物质中,只与HCl溶液和NaOH溶液 一种反应的是( B)
A NaHCO3
B Fe2O3
C Al2O3
D Al(OH)3
3.选择一种试剂,鉴别下列四种溶液: MgCI2、 AlCl3、 FeCl2、 FeCl3,
该试剂是什么?为什么?
4.各物质转化关系如图,据图回答:
(1)写出A、B、C、D 、E、F、G的化学式
⑶可在液面加少许汽油或苯等有机溶剂,以隔绝空气。
2.Fe(OH)3
⑴ 物理性质: 红褐色沉淀,不溶水; ⑵ 化学性质:
①与酸反应; ②受热易分解;2Fe(OH)3=△==Fe2O3+3H2O ⑶ 制取:由易溶性的铁盐跟碱溶液起反应制得
铁的氢氧化物有两种FeOH

这是因为白色的氢氧化亚铁被空 气中的氧气氧化成了红褐色的氢 氧化铁。反应的化学方程式分别 为:
FeSO4+2NaOH=Fe(OH)2↓+Na2SO4 4Fe(OH)2+O2+2H2O=4Fe(OH)3
思考与交流
既然Fe(OH)2 容易被空气中的氧气氧化,那么 在制备Fe(OH)2时应采取哪些措施防止其被 氧化?
(2)将溶解亚铁盐的蒸馏水煮沸(除去溶解的氧气);
A、在亚铁盐溶液液面上加隔氧剂(如加 入苯等密度比水小,而又不溶于水的有机溶
剂).装置如下图所示.
由于苯的液封作用,防止了生成的
Fe(OH)2被氧化,因而可较长时间观察到白 色Fe(OH)2沉淀.
B、特殊装置
• 思考:如何操作止水 夹,才能得Fe(OH)2沉 淀,并保存较长时间?
当堂训练:
1.将下列四种化合物溶于稀盐酸,滴
加硫氰化钾溶液没有颜色变化的是:
(A )
A.FeS C.FeCl3
B.Fe2O3 D.Fe2(SO4)3
当堂训练
• 2、判断下列说法正确与否。
(1)铁元素有+2、+3价,故铁的氧化物
只有FeO和Fe2O3两种.
( ×)
(2)铁的氧化物都为黑色固体. ( × )
(3)向FeCl3溶液中加入KSCN溶液,溶液 立刻变成血红色,而非沉淀. ( √ )
(5)FeO在空气中易被氧化为Fe2O3. ( × )
当堂训练:
• 3、除去下列物质中所含的杂质(括号内为杂质),将选 用的试剂和分离方法填在题后的横线上,并写出有关反 应的离子方程式.
• (1)Fe2O3[Fe(OH)3]_加__热_.2_F_e_(O_H_)_3 _==_=_F_e2_O_3_+_3_H_2O_; • (2)Fe2O3(Al2O3)_加2_O_入H_过-_=量_=_=的2_NA_al_OO_2H-+_溶_H液_2O_,_过_滤__._A_l2_O_3;+
【知识解析】铁、铁的氧化物和铁的氢氧化物
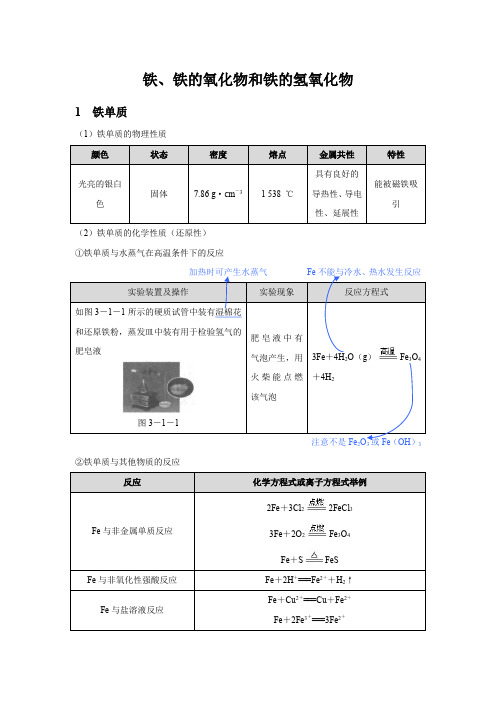
铁、铁的氧化物和铁的氢氧化物1 铁单质(1)铁单质的物理性质(2)铁单质的化学性质(还原性)①铁单质与水蒸气在高温条件下的反应如图3-1-1所示的硬质试管中装有湿棉花和还原铁粉,蒸发皿中装有用于检验氢气的肥皂液图3-1-13Fe+4H2O(g)Fe3O4+4H2②铁单质与其他物质的反应2Fe+3Cl22FeCl33Fe+2O2Fe3O4Fe+S FeS教材延伸(1反应生成Fe 3O 4和H 2CO 和H 2。
(2)从铁与Cl 2、O 2、S 的反应中铁元素化合价的变化情况可以比较Cl 2、O 2、S 的氧化性强弱,即氧化性:Cl 2>O 2>S 。
2 铁的氧化物(1)铁的常见氧化物的性质及用途名师提醒(1)FeO 不稳定,在空气里受热,能迅速被氧化成Fe 3O 4。
(2)“朱门酒肉臭”中的“朱门”是指以Fe 2O 3为原料制备的油漆漆制的门。
(3)Fe 3O 4有固定的组成,属于纯净物,不是混合物。
Fe 3O 4可看成FeO ·Fe 2O 3,所以在书写其与硝酸的反应方程式时可看成硝酸将其中的二价铁氧化成三价铁。
(4)在高温条件下,Fe 与Fe 2O 3可以发生反应,当铁足量时发生反应Fe +Fe 2O 33FeO ,当铁不足时发生反应Fe+4Fe2O33Fe3O4。
(2)铝热反应【实验操作】①把两张圆形滤纸分别折叠成漏斗状套在一起,使四周都是四层。
把内层“纸漏斗”取出,在底部剪一个小孔,用水润湿,再与另一“纸漏斗”套在一起,架在铁架台的铁圈上,干燥使反应完全②把5 g炒干的三氧化二铁粉末和2 g铝粉混合均匀,放在“纸漏斗”中,在混合物上面加③用燃着的木条点燃镁条,观察现象。
【实验记录】热,火星四射;③“纸漏斗”Al与Fe2O3反应,置换出铁,反应方程式为2Al +Fe2O3Al2O3+2Fe教材延伸铝热反应3 铁的氢氧化物(1)Fe (OH )2与Fe (OH )3的性质比较不稳定[比Fe (OH )2稳定],受热易分解,2Fe (OH )3Fe 2O 3+3H 2O(2)Fe (OH )2在空气中转化为Fe (OH )3Fe (OH )2中铁元素的化合价为+2,具有还原性。
铁的氧化物和氢氧化物作业设计(1)

铁的氧化物和氢氧化物A 层1. 铁的氧化物化学式 FeO Fe 2O 3 Fe 3O 4 俗称 — 色态 粉末 粉末 晶体 溶解性 不溶于水 不溶于水 不溶于水 能否与水反应 _______ _______ _______ 铁的价态_______ _______ _______ 与非氧化性酸(如盐酸)反应的离子方程式______________________________________Fe 3O 4+8H +===Fe 2++2Fe 3++4H 2O物质类别 ___________ ___________—共性 高温时,都能被C 、CO 、H 2等还原剂还原,生成单质铁存在 不稳定,在空气中受热易被氧化成Fe 3O 4 赤铁矿 磁铁矿 用途红色油漆和涂料、 炼铁原料炼铁、磁性材料2. 铁的氢氧化物 (1)性质比较化学式 Fe(OH)2 Fe(OH)3 色态 固体 固体 溶解性溶于水 溶于水 与非氧化性酸(如盐酸)反应_______________________________________ 热稳定性—_________________________(2)制备【注意事项】①为了防止Fe 2+被氧化,配制FeSO 4溶液的蒸馏水和NaOH 溶液要煮沸,尽可能除去O 2。
②为了防止滴加NaOH 溶液时带入空气,可将吸有NaOH 溶液的长滴管伸入FeSO 4溶液的液面下,再挤出NaOH 溶液,这样做的目的是防止生成的Fe(OH)2与空气中的氧气接触而被氧化。
③为防止Fe 2+被氧化,还可以向盛有FeSO 4溶液的试管中加入少量的煤油、苯等。
实验原理实验操作实验现象有关化学方程式可溶性铁盐与 可溶性碱反应有 产生_____________________可溶性亚铁盐与 可溶性碱反应______________________________________________________________________________B 层3. 向下列物质中滴加NaOH 溶液产生白色絮状沉淀,并迅速变成灰绿色,最后变成红褐色的是( ) A .FeSO 4 B .Na 2SO 4 C .FeCl 3 D .KCl4. 关于铁的三种氧化物(FeO 、Fe 2O 3、Fe 3O 4),下列叙述中正确的是( ) A .都能与水反应生成氢氧化物B .都是碱性氧化物,都能与盐酸反应生成氯化铁和水C .铁的三种氧化物在高温条件下都能被CO 还原为FeD .四氧化三铁中铁元素有+2价和+3价,它是一种混合物 5. 火星被称为“红色的星球”,这是因为它的岩石和土壤中含有丰富的( ) A .FeO B .Fe 3O 4 C .Fe 2O 3 D .Fe6. 关于Fe(OH)2的实验室制备,下列说法不正确的是 A .常用煮沸的方法除去NaOH 溶液中的O 2B .在FeCl 2溶液的上面加一层苯,目的是为了隔绝空气C .氢氧化钠与硫酸亚铁反应的离子方程式为:Fe 2++2OH -=Fe(OH)2↓ D .若生成的沉淀暴露于空气中,发生的反应是Fe(OH)2+O 2+H 2O===Fe(OH)3 7. 如图为铁的化合物的部分转化关系:(1)请写出下列转化关系的离子方程式 ①______________________________________; ②______________________________________; ③______________________________________。
铁的氢氧化物的性质

如发生摄入或吸入铁的氢氧化物,应 立即就医。在等待专业医疗救助时, 可进行催吐和漱口。
感谢您的观看
THANKS
铁的氢氧化物的性质
目录
• 铁(OH)2的性质 • 铁(OH)3的性质 • 铁的氢氧化物应用 • 铁的氢氧化物的安全性
01
铁(OH)2的性质
物理性质
01
02
03
颜色与外观
铁(OH)2呈绿色或蓝绿 色,固体颗粒状。
溶解性
微溶于水,形成绿色溶液。
稳定性
在空气中不稳定,易被氧 化为铁(OH)3。
化学性质
氧化还原性
酸碱反应
铁(OH)2具有还原性,可被氧化为 铁(OH)3。
铁(OH)2呈碱性,能与酸反应源自成 相应的盐和水。络合反应
铁(OH)2能与某些金属离子形成络 合物。
制备方法
实验室制备
通常通过铁与碱反应或铁盐与碱反 应来制备铁(OH)2。
工业制备
在工业上,通常通过氧化铁红泥与 碱反应来制备铁(OH)2。
络合反应
铁(OH)3可以与某些络 合剂反应生成络合物。
制备方法
氢氧化亚铁制备
将铁与稀硫酸反应生成硫酸亚铁,再加入碱溶液即可制得氢 氧化亚铁。
氢氧化铁制备
将铁与稀硝酸反应生成硝酸铁,再加入碱溶液即可制得氢氧 化铁。
03
铁的氢氧化物应用
在工业上的应用
铁的氢氧化物在工业上主要用于制备 其他铁盐,如硫酸铁、氯化铁等。这 些铁盐在颜料、油漆、染料、农药和 催化剂等领域有广泛应用。
另外,一些含有铁的氢氧化物的化妆品和保健品也受到消费 者的青睐,因为铁元素对人体的健康有益,能够促进血液循 环和能量代谢。
04
铁的氢氧化物的安全性
铁的单质、氧化物、氢氧化物课件2022--2023学年高一上学期化学人教版(2019)必修第一册

_黑__色___晶体
都__不____溶于水,也___不___与水发生反应
常用作油漆、涂料、油 具有磁性,是一种常 —
墨和橡胶的红色颜料 用的磁性材料
(2)化学性质 ①稳定性:FeO不稳定,在空气里受热,能迅速被氧化成________。
碱性 ②与酸反应:FeO和Fe2O3是______氧化物,与盐酸反应的离子方程式分别为 ________________________,___________________________。
FeO+2H+===Fe2++H2O
Fe2O3+6H+===2Fe3++3H2O
Fe3O4
2.铁的氢氧化物 (1)制备
制备Fe(OH)2
制备Fe(OH)3
操作
现象
生成白色絮状沉淀,迅速变为__灰__绿__ 色,最终变为__红__褐__色
生成__红__褐__色沉淀ห้องสมุดไป่ตู้
有关反应 Fe2++2OH-=== Fe(OH)2↓,
名称 化学式 铁元素的化合价
氧化亚铁 __F_eO___ +2价
氧化铁 ___F_e2_O_3 __
+3价
四氧化三铁 __F_e_3O_4 __
+2价、+3价
名称 俗名 色、态 溶解性 用途
氧化亚铁 —
氧化铁 __铁_红___
四氧化三铁 ___磁_性__氧_化_铁____
黑色粉末
_红_棕__色____粉末
第三章 铁—金属材料
第一节铁及其化合物
第一课时铁的单质、氧 化物、氢氧化物
目录 CONTENT
一、铁的单质 二、铁的氧化物
三、铁的氢氧化物
课前导入
一、铁的单质
自然界中铁的存在形式
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铁的氧化物、氢氧化物的主要性质
铁是一种广泛应用的金属元素,在工业、建筑和生活中有着广泛的用途。
在自然界中,铁主要以氧化物和氢氧化物的形式存在。
本文将介绍铁的氧化物和氢氧化物的主要性质。
一、铁的氧化物性质
1. 一般性质
铁的氧化物是铁和氧反应生成的产物,它们有着广泛的应用。
铁的氧化物有多种形式,如黑色的FeO、红色的Fe2O3和Fe3O4等。
这些氧化物基本上都是不溶于水的,但它们通常可以在酸性或碱性溶液中溶解。
2. 化学性质
铁的氧化物在化学反应中表现出不同的性质,比较常见的有以下几种。
(1)还原性
铁的氧化物可以通过还原反应还原成纯铁或者其他具有还原性的物质。
例如,在高温下与氢气反应,氧化铁可以还原成纯铁和水。
Fe2O3 + 3H2 → 2Fe + 3H2O
(2)氧化性
铁的氧化物可以与其他化合物发生氧化反应,产生较稳定的化合物。
例如,FeO可以与氧气反应生成稳定的Fe2O3。
4FeO + O2 → 2Fe2O3
(3)酸碱性
不同的铁氧化物在酸性和碱性环境中表现出不同的性质。
例如,Fe2O3在酸性环境中可溶于酸,而在碱性环境中不溶。
二、铁的氢氧化物性质
1. 一般性质
铁的氢氧化物是一种碱性物质,它们可以和酸反应产生
盐和水。
铁的氢氧化物在水中溶解度较低,但与酸或盐类反应后可以变得更易溶。
铁的氢氧化物常常作为催化剂和吸附剂应用于化工、水处理等领域。
2. 化学性质
铁的氢氧化物在化学反应中表现出不同的性质,比较常
见的有以下几种。
(1)酸碱性
铁的氢氧化物是一种碱性物质,它们可以与酸作用产生
盐和水。
例如,Fe(OH)2与硝酸反应可以产生Fe(NO3)2和水。
Fe(OH)2 + 2HNO3 → Fe(NO3)2 + 2H2O
(2)氧化性
铁的氢氧化物可以通过氧化反应转化成铁的氧化物或者
其他化合物。
例如,Fe(OH)2可以通过空气氧化成Fe2O3。
4Fe(OH)2 + O2 → 2Fe2O3 + 4H2O
(3)还原性
铁的氢氧化物可以通过还原反应转化为纯铁或其他还原
性物质。
例如,Fe(OH)2可以通过与氢气反应还原为纯铁和水。
Fe(OH)2 + H2 → Fe + 2H2O
总之,铁的氧化物和氢氧化物分别具有不同的性质和应用。
在工业生产中,这些性质和应用被广泛应用于炼钢、水处理、催化剂制备等领域。
了解铁的氧化物和氢氧化物的性质,对于控制化工过程、提高能源利用效率具有重大意义。
