09 第九章 氧化
第09讲 氧化还原反应的配平、缺项配平及计算(讲义)(解析版)

第九讲氧化还原反应的配平、缺项配平及计算1.氧化还原反应配平原则(1)一般配平原则(2)“缺项”配平原则对于化学反应方程式,所缺物质往往是酸、碱或水、补项的两原则(3)陌生化学方程式书写步骤特别强调:1.理解并记忆常见氧化剂或还原剂对应的反应产物。
2.运用“有升必有降”找出隐含反应物或生成物。
3.运用电子得失守恒时要看清化学式中变价元素的原子个数(特别是同种物质中的同种元素有不同化合价的升降变化)。
4.运用电荷守恒时,要准确把握H+与OH-的使用符合题中反应环境。
课堂检测011.24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。
已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则铬(Cr)元素在还原产物中的化合价为( )A .+2B .+3C .+4D .+5答案:B【解析】题目中指出被还原的是铬元素,则得电子的物质是K 2Cr 2O 7,失电子的物质是Na 2SO 3,其中硫元素的化合价从+4→+6,而铬元素的化合价将从+6→+n (设化合价为n )。
根据得失电子守恒可得,0.05 mol·L -1×0.024 L×(6-4)=0.02 mol·L -1×0.020 L×2×(6-n ),解得n =3。
2.取x g 铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL 的NO 2气体和672 mL 的N 2O 4气体(都已折算到标准状况),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀的质量为17.02 g 。
则x 等于( )A .8.64B .9.20C .9.00D .9.44 答案:B【解析】反应流程为⎭⎬⎫Mg Cu ――→浓HNO 3 ⎩⎪⎨⎪⎧Mg 2+、Cu 2+――→NaOH ⎩⎪⎨⎪⎧Mg (OH )2Cu (OH )2NO 2、N 2O 4 x g =17.02 g -m (OH -),而OH -的物质的量等于镁、铜失去电子的物质的量,等于浓HNO 3得电子的物质的量,即n (OH -)=8.96 L 22.4 L·mol -1 ×1+0.672 L 22.4 L·mol -1 ×2×1=0.46 mol ,所以x g =17.02 g -0.46 mol×17 g·mol -1=9.20 g 。
09第九章 电分析化学法导论

9-5-1 浓差极化
有电流通过时,电 极表面电活性物质的 消耗若得不到有效补 充,电极电位将变得 与平衡电位不同。此 称浓差极化
平衡电位 指由Nernst方程按 本体溶液浓度计算 得到的电位。
9-5-1 浓差极化
对于还原反应,浓差极化将使电极电位变得更负。对于氧化反应, 浓差极化将使电极电位变正。
AgCl /Ag AgCl /Ag
'
RT ln aCl F
甘汞电极 Hg Hg2Cl2(s) KCl(a=xmol/L)
SCE 0.242
将Pt插入汞与甘汞的糊状物中,内充液多为饱和KCl,也可为0.1 或1.0mol/LKCl。内充液一般用Hg2Cl2饱和。盐桥为充满内充液的 多孔陶瓷。
9-5-3 超电位
由于极化,使实际电位和可逆电位之间存在差异 ,此差异即为 超电位 对于阳极和阴极,分别有阳极超电位a和阴极超电位c。对于单个 电极,超电位为浓差超电位和电化学超电位之和
= 浓差+电化
9-5-3 超电位
影响因素: a) 电流密度,
b) T,
c) 电极化学成份不同,不同。与电活性物质和电极材料 亲和力有关
≈ 右 - 左≈ c - a
当E>0,为原电池;E<0为电解池。
9-2 液接电位与盐桥
9-2-1 液接电位 Ej
因各离子迁移速度不同而产生 对于类型1的1:1型电解质接界:
RT a1 E j t t ln F a2
设a1=0.01,a2=0.1。则t+=0.83、t-=0.17, 25 ℃时
09第九章氧化反应

常用共氧化试剂——催化量OsO4与H2O2或氯酸盐等 氧化试剂共同使用:
OsO4首先进攻位阻小的碳中心,随后其他氧化剂将生成 的Os2+离子氧化为OsO4 ,反应循环进行
原因:毒性和价格因素
三、碳碳双键臭氧化反应:
臭氧能氧化碳碳双键得臭氧化产物,产物加入 锌粉还原可得醛或酮,强还原剂则得醇
9.1 醇的氧化
负载下的氧化剂氧化:
负载氧化是工业上最常用的氧化方法,好处有:
操作简单,反应快速、完全,环境友好 相对于普通氧化,氧化活性和选择性更高
负载氧化一般将氧化剂(常用高价金属阳离子) 附着于具有大表面积的支撑物(如硅胶和树脂 等)上,实现氧化和再生
9.2 碳碳双键的氧化
9.1 醇的氧化
针对铬酸缺陷的解决方案:
换用溶剂体系:
Jones(琼斯)试剂(铬酐-硫酸-丙酮),使用时将 醇的丙酮溶液滴入配好的铬酐-硫酸中
PCC(吡啶-氯铬酸盐,Corey氧化法),铬酐的盐 酸溶液中加吡啶得到的结晶。该试剂仍具有一定酸 性,使用范围小
Sarett(萨雷特)试剂(铬酐-双吡啶配合物),将 铬酐加入吡啶中,是最常使用的铬酸氧化剂
PDC(吡啶-双铬酸盐),将吡啶加入中性的铬酐水 溶液得到的吡啶双铬酸盐(Sarett试剂区别?), 中性试剂,可替代PCC。
9.1 醇的氧化
改善氧化条件:
在醛刚生成时利用蒸馏等手段加以分离,使其脱离 氧化剂的接触,从而避免进一步氧化
Sarett(萨雷特)试剂:
特别适用于分子中含有对酸敏感的基团(如缩 醛)或易氧化基团(如碳碳双键)的醇类
无水条件得到反式,有水条件得到顺式
五、双键的催化氧化:
天津大学生讲义物化学第九章课件ppt

二、生物氧化的特点
(1)场所:在细胞内进行。 (2)条件:在体温和近于中性pH及有水的
环境中进行。
(3)催化剂:在一系列酶、辅酶和某些传
递体的作用下进行。
(4)能量:是逐步释放的,氧化过程所释
放的能量通常先贮存在一些特殊的高能化合 物(如ATP)中。
精品jing
天津大学生物化学第九章课件ppt
第九章 生物氧化2
第一节 生物氧化的特点 第二节 生物氧化的一般原理 第三节 氧化磷酸化作用-ATP的生成
第一节 生物氧化的特点1
一、与非生物氧化或燃烧的化学本质相同 二、生物氧化的特点 三、生物氧化进行的场所 四、生物氧化的类型 五、生物氧化的方式
一、与非生物氧化或燃烧化学本质相同
2.用分离出的电子传递体进行重组实验。 NADH可以使NADH脱氢酶还原,但不 能直接使细胞色素b、c 或aa3还原。同 样,还原型NADH脱氢酶不能直接与细 胞色素c作用,必须经过COQ和细胞色素 c1后,才能再细胞色素c起作用。
不同种类的细胞色素在典型的线粒体呼吸 链中其顺序是:
NADH→FMN→CoQ → b → c1 → c → aa3 → O2 Eo -0.32 - 0.03 + 0.1 +0.07 +0.22 +0.25 +0.29 +0.816
FAD
- 0.18Biblioteka ~P 3ADP~P
~P
3ATP
三、呼吸链中传递体的顺序2
FMNH2 FADH2
3.铁硫蛋白类(Fe-S)1
铁硫蛋白在线粒 体内膜上往往和 其他递氢体或电 子传递体(如黄 素酶或细胞色素) 结合成复合物而 存在。复合物内 的铁硫蛋白称为 铁硫中心。
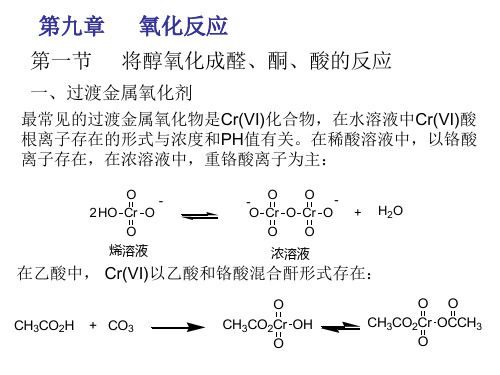
09 第九章 氧化还原反应

化学与材料科学学院
殷焕顺
2.离子--电子法(ion-electron method)
配平原则:整个反应中氧化剂和还原剂得失电子 数相等;反应前后各元素的原子总数相等。
例如:酸性条件下 K2Cr2O7 与KI反应 (1) 写出基本离子反应 (氧化还原产物) Cr2O72- + I- → Cr3+ + I2 (2) 把离子方程式分成氧化和还原两个半反应 氧化半反应:2I- →I2 还原半反应:Cr2O72- → 2Cr3+
化学与材料科学学院
殷焕顺
练习:写出电池符号。 Cu(s)+Cl2(105Pa) = Cu2+(1mol· -1)+Cl-(1mol· -1) L L (-) Cu | Cu2+(1mol/L) || Cl-(1mol/L) | Cl2(105Pa) | Pt (+) 写出原电池的电极反应和电池反应 (-) Pt| H2 (105Pa)| H+(1.0M)||Ag+(1.0 M)|Ag(+) 正极: Ag++e ⇌ Ag(还原反应) 负极: H2 ⇌ 2H+ +2e (氧化反应) 电池反应: 2Ag++H2 ⇌ 2H++2Ag
化学与材料科学学院
殷焕顺
三、氧化还原反应式的配平 (balancing of oxidation-reduction equation ) 两种方法:
氧化数法
(the oxidation number method)
离子——电子法
(ion-electron method)
化学与材料科学学院
殷焕顺
化学与材料科学学院
殷焕顺
从电势看金属活性顺序
电对
K+/ K Ca 2+/Ca Na+/Na Mg2+/Mg Al3+/Al Zn2+/Zn Fe2+/Fe Sn2+/Sn
高等有机第九章-氧化
HO
O
与Collins试剂作用类似的另一个Cr(VI)试剂是氯化铬酸吡啶盐 (PCC)。将CrO3溶于盐酸,加入吡啶生成一固体试剂PCC : 吡啶
O N Cr Cl O OH
CrO3 +
HCl (浓)
PCC在等比例条件下即可将醇氧化成醛酮:
CH3 (H3C)2C CHCH2CH2CHCH2CH2OH
O H3 C H3 C H CH3
OH
H2SO4
MeOH
(CH3 )2C
CHCH3
OCH3
76%
O H Ph Ph H
HCl 苯
OH H Ph
Cl Ph H
93% 生成顺式产物说明经历碳正离子中间体,顺式产物为主,可能由 于分子内氢键使顺式更稳定。 (如果没有形成碳正离子,则-OH和-Cl应为反式)
碱性条件下,亲核试剂优先进攻位阻小的位置。而酸性条件下 情况较复杂,质子与氧原子结合削弱了C-O键,使其易被弱亲 核试剂开环。如在过渡态中C-O键大部分完整,则亲核试剂将 进攻取代基少的碳;如过渡态中C-O键断裂基本完成,由于取 代基可稳定过渡态中生成的正电中心,反应具有相反的区域选 择性。
O R R H H R R b
R + R MnO4
-
R
O O
R
O Mn O
H2O OH R
OH OH
R
乙酮醇也是上述反应的常见产物,乙酮醇是由环状中间体氧化生成。
R H O O Mn O O H R H O O Mn O O H R R OH + MnO2 O
R
R
两种产物的比例由PH值决定,碱性条件有利于乙二醇产物。
KMnO4也可在有机溶剂中使用,但需加相转移催化剂。 KMnO4氧 化5-癸二酸和环癸酸的产物有羧酸、二酮、a-羟基酮、二醇。各 种产物的比例受氧化剂用量的影响。
第九章_氧化反应-课件

O +
H
H
94%
H H O
6%
◆柔性较高的分子氧化时立体化学结果预测视情况而定。
H3COCO 3-乙酰氧基环己烯
m-CPBA CH2Cl2,0℃
OCOCH3
OCOCH3
O+
O
90%
反式 60
: 顺式 40
OH
OH
m-CPBA
HO
CH2Cl2,0℃
O+
O
3-羟基环己烯 98%
顺式 92
:
8
(2) 高锰酸钾氧化法 ◆KMnO4能使烯烃在碱性体系中氧化得到顺式双羟基化合物。
促进反应完全; ◆改善试剂反应活性和选择性; ◆减少或消除环境污染; ◆试剂再生如树脂再生。
因此,试剂的固载化技术越来越引起人们注意,成为现代 有机合成化学的一个热点。
(1)硅胶固载的Cr(Ⅵ)氧化剂
H2CrO4/SiO2体系:在适当溶剂中于室温下能对伯醇、仲醇 和苄醇进行有效氧化,得到相应的醛或酮。
C 3 (H C 2 ) 1 C 0 H H 2 hOC 3 (H C 2 ) 1 C 0 H O
7 7 %
9 6 %
C3H
C H 3 C H = C C H 2 O H
O 2 ,P t C 7 H 1 6
CH2OH
OH
C3HHO H O
O2,Pt
C H 3 C H = C C H O H OH
OH H
新氧化体系的特点:
RCHO
①反应快—在所有情况下完成反应不超 过1min; ②没有过氧化物羧酸生成; ③伯脂肪醇、二醇,烯丙醇和苄醇均被选择性氧化生成相应的醛类化合物; ④α,β-不饱和醇的氧化没有双键异构现象; ⑤分子中存在伯醇羟基和仲醇羟基(包括仲苄基醇)时,伯醇羟基发生选择
09第九章 诊断制剂(兽医生物制品学)

特异性检测:以新制菌素与标准菌素,对10匹健康马作点眼试验, 用量为2~3滴,5匹马左眼点标准菌素,右眼点新制菌素,另5匹马相反, 点眼后3、6、9、24h检查,全部试验马对两种菌素须均无反应。
阳性血清的 各种稀释度
1:10 1:25 1:50 1:75 1:100
1:10
0 0 10 20 40
抗原稀释度
1:50 1:100 1:150 1:200 1:300 1:400 1:500
补 体 结 合 反 应 结 果(溶 血,%)
0
0
0
0
10
20
40
0
0
0
0
10
30
60
0
0
0
10 20
40
60
第九章 诊断制剂
利用微生物、微生物提取物或动物血清等材料制成的,用于传染病、 寄生虫病血清学和变态反诊断应用的制品,称为诊断用生物制剂 (diagnosticum),也称为诊断液。主要包括诊断抗原、诊断抗体(血清)和标 记抗体等三大类。
诊断生物制剂用于诊断的原理,是基于抗原和抗体能特异性结合这一 基本特性,故诊断中可以用已知抗原检测未知抗体,或用已知抗体检测未 知抗原。
(2)制造要点
将种子菌液接种肝汤琼脂培养基上37C培养2~7天,或液体通气培养36h,用 0.5%石炭酸生理盐水洗下培养物,70~80C水浴中加热灭菌lh,离心去上清, 菌体悬浮于0.5%石炭酸生理盐水,再离心沉淀洗一次。菌体悬浮于0.5%硫酸水 溶液中,121C加热30~40min,促使菌体水解。室温或冰箱放置12~24h,吸 取上清液,用NaOH液调整为pH6.8~7.0,再静置沉淀未水解部分。上清液用蔡 氏滤器过滤后75~80C加温热,凯氏法测定总氮量(用标准水解素作对照),用灭 菌蒸馏水稀释滤液,使其最终总氮量为0.4~0.5mg/ml(或与标准的水解素相同)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
氧化
◆从广义上来讲,凡是有机物分子中碳原子失去电子,
碳原子总的氧化态增高的反应称为氧化反应。
◆从狭义上讲,凡使反应物分子中的氧原子数增加,
氢原子数减少的反应称为氧化反应。
◆有机合成中氧化方法主要有三种,即催化氧化和催
化脱氢、化学氧化、电解氧化。此外,生物氧化在有 机合成中的应用也日益受到人们的重视。
二、催化脱氢
有机化合物在催化剂作用下,受热裂解脱氢,生成不饱和的氧化 产物的过程。
300° C , Pd 110° C , Pd
脱氢反应过程通常认为:有机反应物首先被吸附在催化剂表面, 继而将氢原子转移给催化剂,最后脱氢产物脱离催化剂表面而完成反应。
催化脱氢反应的催化剂有:铂、钯、镍、铜、金属氧化物及硫、硒 等非金属。
四、三氧化铬
广泛作为温和氧化剂使用,用于将醇氧化为醛、酮。 将三氧化铬加入到吡啶溶液中得到Collin’s试剂;将 吡啶加入到三氧化铬的盐酸溶液中得到橙色结晶氯 化铬酐-吡啶配合物(PCC)。
Collin's试 剂
CH2OH
CHO
五、二甲亚砜(DMSO)
为温和的氧化剂,主要用于: ⑴ 将醇氧化成醛、酮 ⑵将卤代烃或磺酸酯氧化成羰基化合物
(4)合成实例
①甲苯氧化制备苯甲酸
CH3 COOH
Co(Ac)2 1.5O2 H2O
反应温度150℃~170℃,压力1MPa,催化剂用量0.01%~0.015%。 主要副产物是苯甲酸苄酯。
②异丙苯过氧化氢(CHP)
CH3 CH3 CH CH3 C OOH
O2
CH3
反应不需要催化剂,反应温度在110℃左右,不超过 120℃.
+ Co
2+
H+ X .
H.
②链的传递 自由基R与氧作用生成过氧化物。
R. + O2 R O O. R O OH + R R H + R O O.
③链的终止 链传递过程中生成的有机过氧化物在反应 条件下是稳定的,则该有机过氧化物也是最终产物,如 若该过氧化物不稳定,在一定条件下可进一步分解生成 醇、醛、酮或羧酸等化合物。
催化脱氢反应通常在高温下进行。可将反应物与催化剂在较高沸点 的溶剂中反应,也可将反应物的蒸汽连续通过高温下的催化剂来制取脱 氢产物。
环状化合物不饱和程度越高,则脱氢芳构化反应越容易进行,而饱 和的环状化合物则较难进行脱氢反应。
终止 反应历程:三步— —链引发、链增长和链 引发剂和催化剂的种类 底物的结构 空气液相催化氧化 主要影响因素 链终止剂 氧化深度 间歇釜式反应器 反应器 、填料塔和板式塔 塔式氧化反应器:空塔 应、脱附和反扩散 反应历程:五步— —扩散、吸附、表面反 催化剂的种类 空气气 固相接触催化氧化 助催化剂和载体 反应器列管式固定床反应器 流化床反应器
CH3
MnO2 , 65% H2 SO4 40℃
CHO
对α,β-不饱和醇选择性氧化
OH HO HO OH
MnO2
HO
O
三、重铬酸钠(Na2Cr2O7)
铬化合物是常用的通用型强氧化剂,较常用的铬化合物是重铬酸 盐和铬酐。由于重铬酸钠比较容易潮解,但它价格便宜,且在水中的 溶解度大,加上中性或碱性条件下,重铬酸钠的氧化性能较弱,因此, 工业生产上重铬酸钠常在各种浓度的硫酸中使用。
③精对苯二甲酸
液相空气氧化:
济南化工新材料有限公司 60万吨/年 PTA(PureTerephthalicAcid)装置钛设 备国产化项目 钛钢复合塔(¢6900X46000mm) 净重:235T
2.气相空气氧化
是指气态有机物与空气的混合物在高温(300500C)下通过固体 催化剂,发生的氧化反应。 它具有反应速度快,生产效率高,工艺简单,便于自动控制,不 需要使用任何溶剂,对设备没有腐蚀等特点。 气相空气催化氧化一般分为扩散、吸附、表面反应、脱附、反扩 散五个步骤。
高温高空速:V2O5 , 400℃~470℃ 流化床: 只适用于萘,催化剂V2O5-K2SO4-SiO2 ,反应温 度340℃~385℃
萘 邻 二 甲 苯 原 料
⑵乙烯气相氧化制备环氧乙烷
CH2=CH2 Ag 1/2 O2
H2C O CH2
反应温度220℃~260℃,压力1~2MPa 注意:目前无法用该反应制备烷基环氧烷。
催化剂 对于气相催化氧化反应来说,催化剂通常由主活性组分、辅 助成分和载体组成。
⑴芳烃气相空气氧化制备苯酐
O
4.5O2
O
O O CH3
3O2
CH3 O
O
催化剂: V-O或 V-Mo-O系列 低温低空速: V2O5-K2SO4-SiO2 , 350℃~360℃ 固 定 床 中温高空速: V2O5-TiO2-Sb2O3, 350℃~400℃
1.芳环或杂环铡链氧化成羧基
多环芳烃容易氧化开环成芳酸,特别是连有氨基或羟基等强给 电子基的芳环更容易被氧化。
NO2
KMnO4 OH -
NO2 COOH COOH
NH2
KMnO4 OH -
COOH COOH
2.芳环侧链氧化成羧基
芳环侧链不论长短均被氧化成羧基,且较长的铡链比甲基更易被 氧化。
KMnO4 OH -
R. + R. R R R O O R
+ R O O . R.
生成醇:
ROOH RO RH RO ROH OH R
生成醛:
H 2+ R
C
H
OO
Co
RCHO
OH
3+
Co
生成酸:
RCHO Co
3+
RCO
O
H
Co
2+
RCO
O R
O2
R
C
OO
O OO
C
O
R'H
R O R
C
OOH
R'
R
C
O
OOH
Co
2+
C
第二节
化学氧化
人们习惯上把空气和氧以外的其它氧化剂统称为化 学氧化剂。使用化学氧化剂所进行的氧化反应就称为化 学氧化。化学氧化是工业上主要的氧化方法。 化学氧化具有选择性高,生产过程简单,反应条件 温和的特点。化学氧化在精细化工的生产上有着广泛的 应用。
化学氧化剂大致可分为以下几类: 1.金属元素高价化合物 例KMnO4、MnO2、Na2Cr2O7、FeCl3等。 2.非金属元素的高价化合物 例HNO3、H2SO4、NaClO等。 3.无机富氧化物 例H2O2、O3、过碳酸钠等。 4.非金属元素 例卤素和硫磺。 5.有机富氧化合物 例有机过氧酸
O
OH
Co
3+
R
C
O
R'H
RCOOH
R'
(2)氧化催化剂
催化剂的作用是促进自由基的生成速度。催化剂大多 数是过渡金属的水溶性或油溶性的有机酸盐,常用的有醋 酸钴、丁酸钴、醋酸锰等。此外,有的还加入三聚乙醛或 乙醛、丁酮、无机或有机溴化物等作为氧化促进剂,以提 高催化剂的催化能力。
(3)影响催化氧化的主要因素
二、二氧化锰(MnO2)
二氧化锰氧化性能温和,它可以是高锰酸钾氧化时的副产物, 也可以是天然的软锰矿粉。 用作氧化剂的二氧化锰有两种:一种是二氧化锰与硫酸的混合 物,另一种是活性二氧化锰。工业上较常用的是二氧化锰和硫酸的 混合物。
二氧化锰可使氧化反应停留在中间阶段,因此可用它 来制备醛、酮或羟基化合物。
①催化剂和氧化促进剂
空气液相催化反应催化剂在反应中的主要作用是促使游离 基的生成以缩短诱导期和加快反应速度。同时能促进过氧化 物的分解速度。 ②反应物的结构
伯醇通常较仲醇容易被氧化,当多元醇分子中同时存在 有伯羟基和仲羟基时,一般是伯羟基优先被氧化。
CH3CHCH2OH OH
Pt /C , H2O
O2 ,20°C
N
N
O
七、硝酸(HNO3)
硝酸是一种通用性氧化剂。稀硝酸的氧化性要高于浓硝酸。由 于硝酸氧化后产物是气体NO2和N2O3,不留在反应体系中,分离比 较简便。
第一节
催化氧化和催化脱氢
一、催化氧化
在没有催化剂的情况下,有机物在室温下与空气接 触,就能发生缓慢的氧化反应,这种现象称为自动氧化。 在催化剂存在下进行的氧化反就应称为催化氧化。 氧化反应根据反应温度和反应物聚集状态不同,又 可分为液相催化氧化和气相催化氧化反应。
1.液相空气氧化
液相空气氧化是液态有机物在催化剂存在下,通入空气 进行的催化氧化反应。
一、高锰酸钾(KMnO4)
高锰酸钾是一种通用型的强氧化剂。高锰酸钾在酸性、中性及 碱性条件下均具有氧化性,介质的PH值不同,氧化性不同。在酸性 介质中,Mn7+ 还原为Mn2+,在中性或碱性介质中被还原为Mn4+。
由于高锰酸钾酸性介质条件下,反应选择性差,反应条 件不易控制。因此工业生产中很少在酸性条件下用高锰酸钾 作催化剂进行氧化。
六、有机过氧酸(RCOOOH)
有机过氧酸由相应的羧酸或酸酐与过氧化氢反应得到。有机过 氧酸性质不稳定,放置过程中会分解失氧。
1.烯烃的环氧化
烯烃在适当的无水隋性有机溶剂中于低温或室温下与有机过 氧酸反应,生成相应的环氧化物。
C
+
Байду номын сангаас
H O
O O C R
C O + RCOOH C
C
过氧酸对烯键 的进攻方向受到 烯键附近极性取代 基及溶剂的影响
CH 3
CH 2CH 2CH 3
KMnO4 OH -
