一种改善层状锰酸锂性能的方法
层状锰酸锂-

1结构特性LiMnO:有4利l结构形式13],其中单斜LiMn02 (m-LiMn02和正交LiMn02 (o-LiMn02)有层状结构,前者为a-NaFe02型结构,后者为岩盐结构。
在热力学平衡条件下,m-LiMnO:没有o-LiMn02稳定,原因是:① Mn3十之间的反铁磁相4_作用;②Jahn-Teller畸变的影响;③离子半径和电荷影响!al 层状LiMnO:的问题有:①属热力学亚稳定,Mn3十不稳定,中等温度下就易向高价转化,形成类尖inW结构的Lie } Mn2 }O4;②Mn3十(tZSeS)引起的Jahn-Teller效应使O排列发生畸变,难形成理想的密堆积,影响结构的稳定!4t .③充放电过程中会发生单斜结构向菱形结构的转化,引起体积变化,使容量下降。
(B)二维扩散路径之层狀结构金属氧化物在嵌入式化合物中,具有层狀结构的LiMO2(M = Co、Ni、Mn等),氧離子形成了立方最密堆积结构,而Li+和M3+则交错占据(111)面的八面体位置,如图(2-8a)[25],图中阴影部份为M3+的位置,白色部分为Li+所占据的位置。
而图2-6中所列的层狀LiMO2之中,LiTiO2在合成上有其困难度[26];LiVO2在充电时(即锂嵌出时),会破坏阳離子的规则排列[26-27];LiCrO2由于铬价數不易改变,导致难以充电[28];LiNiO2的Ni易变成Ni2+,故合成不易,大部分制备所得的LiNiO2都含有少量的Ni在锂離子层中。
这些残留的Ni会影响到其结构的稳定性,进而降低电池的循环寿命[29-31]。
而LiCoO2只要制备过程中条件适当地控制,便很容易得到稳定的层狀结构[17],因此LiCoO2也是目前商品化锂離子电池正极材料的主流。
但由于全世界的Co矿存量少,加上其为战略性物质,因此限制其在大型化电池上的应用。
因此,逐渐有期待以Mn作为其替代物的趋势。
o-LiMnO2层狀结构,在充放电过程中会逐渐相变化成尖晶石相,因为Mn3+的Jahn-Teller Distortion效应的影响,造成结构扭曲(如图2-8b),使比电容量先增后渐衰减,增加电池设计上之困扰。
层状锰基富锂正极材料的合成及其电化学性能优化

层状锰基富锂正极材料的合成及其电化学性能优化锂离子电池中广泛使用的正极材料大多数含价格昂贵的Co、Ni等金属元素,这一直阻碍了高能量密度锂离子电池的快速发展与应用。
因此,开发高能量密度,低生产成本的正极材料以及改进相关的制备技术成为该领域的关键课题。
为此,本论文开展了层状锰基富锂正极材料的合成及其电化学性能优化研究。
主要研究内容及结论归纳如下:1.以单斜相Li2Mn03(m-Li2MnO3)纳米棒为原料,采用原位形成的硬脂酸锂热解还原法合成了纳米棒状xLi2MnO3.(1-x)LiMnO2(x=0.91,0.78,0.67,0.54,0.42 和 0.32)层状结构的纯锰富锂正极材料(直径为100-200 nm,长度为400-1000 nm)。
该系列纯锰富锂固溶体中,m-Li2MnO3组分因能抑制层状向相尖晶石的相转变而可稳定材料的层状结构,m-LiMnO2组分能提高材料的可逆比容量但使循环稳定性变差。
当x=0.54时该固溶体具有合适的Li2MnO3/LiMnO2含量,可平衡Mn 的价态和缓解Janhn-Teller效应,表现出最佳的循环性能和倍率性能(首周放电比容量为250.9 mAh g-1,50周循环后的容量保持率为105.3%)。
上述层状结构的xLi2MnO3·(l-x)LiMn02固溶体是一类高比容量、电化学稳定性且成本低廉的新型纯锰富锂正极材料,具有良好的实际应用前景。
2.采用固相反应法分别合成了纳米片,纳米棒和纳米颗粒状m-Li2MnO3,然后用硬脂酸锂热解还原法将其活化为组成比例接近但形貌不同的xLi2MnO3·(1-x)LiMnO2层状富锂正极材料。
其中,纳米片状pLM-RR的平均厚度为~35nm,平均直径为~200nm;纳米棒状rLM-RR的平均直径为~150 nm,长度为400-1000 nm;纳米颗粒状gLM-RR的平均尺寸为~50 nm。
尽管pLM-RR(223.7 mAh g-1)和rLM-RR(225.8 mAh g-1)的首周可逆放电容量比gLM-RR(228.8 mAh g-1)的略小,但在随后的50周充放电循环过程中pLM-RR和rLM-RR的放电比容量、容量保持率和倍率性能均高于gLM-RR。
熔融法合成层状锰酸锂及改性研究

m l n eh .I o i gmo i c t n w sas tde n ti p p r. h y t ei ue a d p p ain c n io o et g m to i d t d p n df ai a losu i i s a e T e s nh ss o t n r a t o d t nf r s i o d h r e r o i ly rd L Mn 2w 8 p m z d T e s u tr f h a ls a h rceie yme 8o R n lme t a yi . h a ee i 0 B t ie . h t cu e o e smpe Sc a a tr d b  ̄1 fX D a d ee n n ss T e oi r t W z l a e crc e c rp r e f h a ls w r tde . e d t fts s o sta e ly r i 0 a ih s c l t h mi p o et so es mp e ee s i T aa o t h w tt a ee L Mn 2 h s hg p ie e o l a i t u d h e h h d e
熔 融 法 合成 层 状锰 酸 锂 及 改 性研 究
王承位 , 高德 淑 , 丁燕怀, 刘 黎, 蒋 晶
( 潭 大 学 化 学 学 院 , 南 湘 潭 4 10 ) 湘 湖 l15
层状锰酸锂材料的改性方法与制作流程
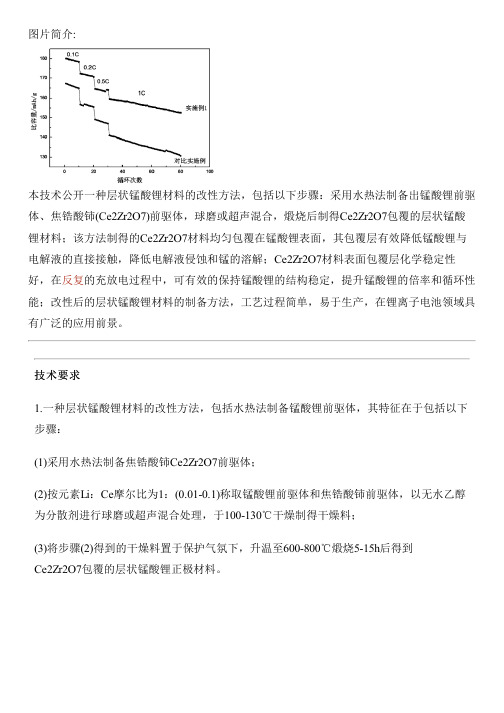
图片简介:本技术公开一种层状锰酸锂材料的改性方法,包括以下步骤:采用水热法制备出锰酸锂前驱体、焦锆酸铈(Ce2Zr2O7)前驱体,球磨或超声混合,煅烧后制得Ce2Zr2O7包覆的层状锰酸锂材料;该方法制得的Ce2Zr2O7材料均匀包覆在锰酸锂表面,其包覆层有效降低锰酸锂与电解液的直接接触,降低电解液侵蚀和锰的溶解;Ce2Zr2O7材料表面包覆层化学稳定性好,在反复的充放电过程中,可有效的保持锰酸锂的结构稳定,提升锰酸锂的倍率和循环性能;改性后的层状锰酸锂材料的制备方法,工艺过程简单,易于生产,在锂离子电池领域具有广泛的应用前景。
技术要求1.一种层状锰酸锂材料的改性方法,包括水热法制备锰酸锂前驱体,其特征在于包括以下步骤:(1)采用水热法制备焦锆酸铈Ce2Zr2O7前驱体;(2)按元素Li:Ce摩尔比为1:(0.01-0.1)称取锰酸锂前驱体和焦锆酸铈前驱体,以无水乙醇为分散剂进行球磨或超声混合处理,于100-130℃干燥制得干燥料;(3)将步骤(2)得到的干燥料置于保护气氛下,升温至600-800℃煅烧5-15h后得到Ce2Zr2O7包覆的层状锰酸锂正极材料。
2.根据权利要求1所述的一种层状锰酸锂材料的改性方法,其特征在于水热法制备锰酸锂前驱体的步骤为:按元素Li:Mn摩尔比为(2.5-5):1称取锂源、三氧化二锰置于高压反应釜中,按20-50%的固含量加入去离子水,搅拌均匀后,在140-220℃下恒温10-40h,自然冷却,过滤洗涤3-10次后,于100-150℃干燥后得到锰酸锂前驱体。
3.根据权利要求1所述的一种层状锰酸锂材料的改性方法,其特征在于步骤(1)水热法制备焦锆酸铈前驱体的步骤为:按元素Ce:Zr摩尔比为1:1称取铈源、锆源完全溶解在去离子水中配成混合溶液,滴加氨水,控制混合溶液pH值在8-11,搅拌反应1-3h,转移至高压反应釜中,于180-220℃下恒温反应10-20h,自然冷却,过滤洗涤3-10次后,于100-130℃干燥后得到焦锆酸铈前驱体。
高温固相法合成锰酸锂锂离子电池正极材料实验的改进与建议

高温固相法合成锰酸锂锂离子电池正极材料实验的改
进与建议
1.改进合成方法:可以尝试使用湿法合成或者溶胶-凝胶法合成锰酸锂。
这些方法可以改善物质的吸附和分散性,并且可以控制材料的粒径和形貌,从而提高材料的电化学性能。
2.改进前驱物:较高纯度的前驱物可以增加物质的纯度和均一性,从而提高材料的电化学性能。
可以采用更好的合成方法,如液相沉积或水热法等,来制备更高纯度的前驱物。
3.改进烧结条件:选择更适合的烧结条件和温度可以减少材料中残余的结晶和缺陷,从而提高其性能。
可以在氧气或氮气气氛下进行烧结,并且在较低的温度下烧结,以减少材料的缺陷。
4.改进材料的成分:除了锰酸锂,可以添加一些其他的金属离子或掺杂元素,以改善材料的导电和稳定性。
例如,钒、钴、镍等金属可以用于改善材料的电化学性能。
5.测试方法的改进:可以使用更严格和准确的测试方法,以评估材料的性能和电化学性能。
例如,可以使用电化学阻抗谱分析方法来评估材料的交流阻抗,并使用循环伏安法来研究材料的可逆性和循环稳定性。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
说明书摘要本发明涉及一种采用Co、Al、Cr掺杂对层状锰酸锂进行改性的方法及由此得到的锂离子正极材料。
由本发明方法生产的改性正极材料与改性前相比,能显著改善的循环性能,降低首次充放电过程中的不可逆容量;其中Co和Al是掺杂效果较好的元素。
51.一种改性层状锰酸锂的制作方法,其特征在于包括如下步骤:(1)m-LiMnO2的制备Mn2O3的制备:以电解MnO2为原料在高温下煅烧,温度分别控制在500℃、600℃、700℃、800℃、900℃,烧结时间为15h,然后将样品随5炉冷却至室温。
a-NaMnO2的合成:将Mn2O3和无水Na2CO3按摩尔比1:1混合,用球磨机充分研磨,然后于卧式电阻炉中进行烧结,在氩气保护下进行升温至指定温度(710℃)后恒温24h,样品随炉冷却。
m-LiMnO2的制备:按摩尔比8:1称取一定质量的LiBr和a-NaMnO2,10将LiBr在一定的正己醇中完全溶解,配置为4mol/L的溶液,然后加入a-NaMnO2摇匀,在145℃-154℃下加热回流8h。
冷却至室温,将混合液过滤,沉淀物用n-正己醇和乙醇洗涤,然后干燥备用。
(2)m-LiMnO2的改性在制备a-NaMnO2的原料中按比例加入一定量的掺杂元素(Co、Al、Cr),其他条件与(1)中的相同,得到的样品为a-NaM0.1Mn0.9O2(M代表15Co、Al、Cr),然后通过离子交换法制得掺杂的层状锰酸锂。
2.如权利要求1所述的Mn2O3的制备中,煅烧环境一直处于密闭状态下不与空气接触直至冷却至室温3.如权利要求1所述的m-LiMnO2的制备过程中溶解LiBr需适当加热20才能保证完全溶解。
4.如权利要求1所述的m-LiMnO2的制备回流过程中需匀速搅拌。
5.如权利要求1所述m-LiMnO2的制备和m-LiMnO2的改性最后一步沉淀物洗涤先用正己醇洗涤少量多次,最后用乙醇洗涤3次即可。
一种改善层状锰酸锂性能的方法技术领域5本发明涉及一种锂离子电池正极材料的改性制备以及性能的提升。
背景技术目前,锂离子电池已广泛应用于各种数字设备及各种电动设备上,市场上衡量锂离子的性能指标包括容量的大小和循环性能的高低等。
循环性能是指电池多次充放电循环之后的容量保持率。
锂离子蓄电池的发展关键10是电极材料的发展。
目前,与锂离子蓄电池负极的发展相比较,正极材料的发展稍显缓慢,正极材料主要集中在:钴系、锰系、镍系的氧化物锂盐上。
层状结构的LiCO2电极性能良好,是当前市场上广泛采用的正极材料。
但钴储量有限,价格较高,同时长期使用钴,对环境污染大。
因此急需LiCO2的替代材料出现。
锰酸锂具有资源丰富、无污染、价格便宜、耐过充过放、15热稳定性好等优点,被人们视为最有发展前途的正极材料之一。
特别对于动力电池,锰酸锂具有诱人的前景。
锰酸锂中目前研究最多的是尖晶石锰酸锂。
其理论比容量是148mAh/g,实际比容量只有110mAh/g左右,电压平台为3.9V。
但它除容量偏低外,循环性能也不够理想,特别是高温下(电池工作温度有时高达50℃以上)容量衰减严重。
层状锰酸锂(m-LiMnO2)20理论容量高达285mAh/g,,差不多是尖晶石LiMn2O4的2倍。
但未经掺杂的m-LiMnO2循环性能很差,充放电过程中不可逆容量大。
文献报道掺杂是提高循环性能最好的方法。
层状锰酸锂是当前世界锂离子蓄电池正极材料的研究热点,而我国尚处于起步阶段,少见文献报道,我国锰储量居世界第二,因此,研究开发层状锰酸锂很有意义。
本文对层状锰酸锂的制备条25件和改性进行了探索性研究。
发明内容本发明要解决的技术问题是提出一种层状锰酸锂的制备方法,并对其改性,改善了层状锰酸锂的循环性能。
本发明的技术方案是:采用掺杂的方法对层状锰酸锂进行改性,并对其电化学性能进行评估。
本发明与现有技术对比所具有的有益效果是:增加了正极材料的可逆5容量,并提高电池的循环性能。
附图说明图1 是不同温度下制备的Mn2O3样品的X射线衍射图谱;图2 是a-NaMnO2及m-LiMnO2的X射线衍射图;图3 是掺杂型层状锰酸锂的X射线衍射图谱;10图4 是800℃下处理的Mn2O3的SEM图;图5 是m-LiMnO2的SEM图。
图6 是m-LiMnO2的首次充放电曲线。
图7 是m-LiMnO2的循环曲线。
图8 是掺杂型m-LiMnO2的放电曲线。
15图9 是掺杂型10%Al3+的LiMnO2的循环曲线。
图10 是掺杂型10% Cr3+和Co3+及不掺杂的LiMnO2的循环曲线对比。
具体实施方式具体实施方式一20样品的表征用X射线衍射技术(XRD)对样品进行物相分析。
采用的是日本Rigaku 公司生产的X射线自动衍射仪。
用扫描电镜观察样品表面形貌。
仪器采用JEOL公司的JSM-5600LV型电子扫描显微镜,电子加速电压为20KV。
电化学性能测试25正极的制作:将电活性的m-LiMnO2、导电碳黑、粘结剂PVDF(聚偏二氟乙烯)、溶剂NMP(N-甲基吡咯烷酮)按一定的比例混合均匀,然后将其均匀涂在0.016mm的铝箔上,烘干后将其压成一定厚度,并裁成直径为1.4cm的薄圆片。
负极制作:将0.3mm厚的金属锂片用冲切模具切成直径1.5cm的圆片,然后进行平整。
以上操作均在充满纯Ar的手套箱内进行。
隔膜为Celgard2320 PP/PE/PP三层微孔复合隔膜,隔膜厚度为20μm。
电解液为51mol/L的LiPF6的EC+DMC+DEC(体积比1:1:1)的溶液。
实验电池采用CR2025型扣式电池,组装的电池在BS9300可充电池性能检测装置上进行恒流充放电的测试。
充放电条件:充放电均以恒流方式进行,除特别注明外,充电电流为100.1C(C=m×Q0,Q0=285mAh/g),终止电压为4.5V;放电电流为0.1C;放电电压为2.5V具体实施方式二XRD分析从不同温度下制得的Mn2O3样品的X射线衍射图谱可知:900℃下制备15的样品主要物相为Mn3O4,500℃以下制备的样品中电解MnO2分解不完全;600℃、700℃、800℃制备的样品均为单一的Mn2O3晶相,其中800℃下制备的样品物相最纯,颗粒比较粗糙,粒度较大,更有利于固相反应中的结晶,故采用800℃恒温15h加热制备的Mn2O3作为a-NaMnO2合成的前驱体较为合适。
600℃、800℃、900℃下样品的X射线衍射图谱如图1所示。
20a-NaMnO2样品经X射线衍射证实是单一的a-NaMnO2晶相,如图2所示。
m-LiMnO2图谱(图2)与文献提供的图谱吻合得很好,证实其物相为层状LiMnO2晶相。
样品经X射线衍射证实为单一的LiMnO2晶相。
图2是样品m-LiMnO2的X射线衍射图谱。
掺杂型m-LiMnO2的XRD图谱与未掺杂m-LiMnO2的图谱非常相似,如图3所示。
图谱中没有出现掺杂物质的衍射峰,说明掺杂原子已进入层25状锰酸锂的晶格之中。
具体实施方式三SEM形貌分析从Mn2O3样品的SEM图可以看出800℃下加热15h的样品颗粒分布均匀,表面光滑,没有明显的结块,平均粒径为0.5μm,如图4所示。
图5是m-LiMnO2的SEM图,可以明显看出层状锰酸锂具有典型的层状结构,颗粒大小分布不是很均匀,平均粒径约3-4μm。
掺杂型m-LiMnO2 5的表面形貌与未掺杂的m-LiMnO2相差不大。
具体实施方式四电化学测试图6和图6给出了未掺杂m-LiMnO2的首次充放电曲线和循环寿命曲10线,可以看出其充电比容量高达260mAh/g以上,而放电比容量只有130mAh/g左右,而且放电电压平台不明显,平均值在3V左右。
不可逆容量几乎是总容量的一半,说明未掺杂m-LiMnO2在初次循环过程中,锂离子几乎能全部脱出,但只有约一半能回嵌,形成了Li0.5MnO2。
电池的循环性能不好,容量衰减严重,4个循环后就衰减了14.2%,10个循环后就衰减了1530%。
层状锰酸锂在循环过程中结构从单斜结构变为菱形结构,晶格参数c/a比变化较大,因而体积发生了较大的变化,反复循环导致层状锰酸锂的结构发生了严重的塌陷,锂离子进出通道受阻,因而容量衰减明显。
说明未掺杂m-LiMnO2离实际应用有很大差距,必须进行改性。
掺杂了10%的Co3+、Al3+以及Cr3+的样品,做成扣式电池,检测结果如图8所示。
与未掺杂的m-LiMnO2的充放电曲线(图6)相比较可以发现,掺杂的m-LiMnO2 20的充放电性能都有明显提高,充电容量有一定的下降,而放电容量有明显的提高,充放电效率显著提高。
其中以掺杂Co3+和Al3+的m-LiMnO2的充放电性能最好:充电容量达200mAh/g以上,放电容量在180mAh/g以上,不可逆容量大幅度降低(只有20mAh/g左右)。
掺杂后m-LiMnO2的循环性25能有大幅度的提高(图9,图10)。
这说明掺杂可稳定m-LiMnO2的结构。
层状m-LiMnO2掺杂后,原来Mn3+占据的过渡金属位部分被杂原子替代,Mn3+浓度降低,从而在一定程度上抑制了Jahn-tellen效应,提高了其循环性能。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。
对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
图1不同温度下制备的Mn 2O 3样品的X 射线衍射图谱图2 a-NaMnO 2及 m-LiMnO 2的X 射线衍射图图3掺杂型层状锰酸锂的X射线衍射图谱图4 800℃下处理的Mn2O3的SEM图图5 m-LiMnO2的SEM图图6 m-LiMnO2的首次充放电曲线图7 m-LiMnO2的循环曲线图8 掺杂型m-LiMnO2的放电曲线图9 掺杂型10%Al3+的LiMnO2的循环曲线图10 掺杂型10%Cr3+和Co3+及不掺杂的LiMnO2的循环曲线对比。
