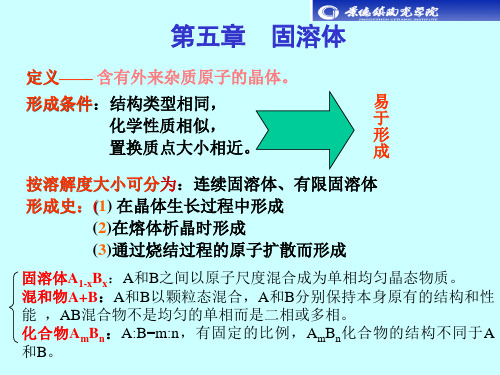
固溶体
固溶体的制备

固溶体的制备固溶体是指由两种或多种物质组成的均匀固体混合物。
在固溶体中,溶质以原子、离子或分子的形式分散在溶剂中,形成一个整体。
制备固溶体的过程可以通过溶解、熔融、固相反应等方式进行。
一、溶解法制备固溶体溶解法是制备固溶体的常用方法之一。
其基本原理是将溶质溶解在溶剂中,通过控制温度、浓度等条件使溶质均匀分散在溶剂中,并形成固溶体。
选择适当的溶剂和溶质。
溶剂的选择应考虑其溶解度、相容性以及对溶质的溶解能力。
溶质的选择应根据所需的固溶体性质和应用来确定。
然后,将溶质逐渐加入溶剂中,并通过搅拌、加热等方式促进其溶解。
在溶解过程中,要控制温度和溶质的添加速度,以防止结晶和析出现象的发生。
将溶液冷却或蒸发,使溶质重新结晶,并形成固溶体。
通过控制冷却速度和结晶条件,可以调控固溶体的晶体结构和性质。
二、熔融法制备固溶体熔融法也是制备固溶体的常用方法之一。
其基本原理是将溶质和溶剂一起加热至熔点,使其熔化并混合均匀,然后冷却使其重新结晶形成固溶体。
选择适当的溶剂和溶质,并按一定的摩尔比例混合。
溶剂的选择应考虑其与溶质的相容性和熔点的匹配程度。
然后,将混合物加热至熔点,使其熔化。
在加热过程中,要控制温度和加热速度,以防止过度热分解或氧化。
将熔融物冷却至室温,使其重新结晶形成固溶体。
通过控制冷却速度和结晶条件,可以调控固溶体的晶体结构和性质。
三、固相反应法制备固溶体固相反应法是制备固溶体的另一种常用方法。
其基本原理是将溶质和溶剂的粉末混合均匀,然后经过高温反应,使其发生固相反应生成固溶体。
选择适当的溶剂和溶质,并按一定的摩尔比例混合。
溶剂的选择应考虑其与溶质的反应性和相容性。
然后,将混合物放入高温炉中进行反应。
在反应过程中,要控制反应温度和反应时间,以保证反应的完全进行。
将反应产物冷却至室温,并进行适当的处理,如研磨、筛分等,以得到所需的固溶体。
总结起来,固溶体的制备方法包括溶解法、熔融法和固相反应法。
不同的方法适用于不同的材料和需求。
第5章固溶体
§5-3 间隙型固溶体
1.定义:杂质原子进入晶格的间隙位置而形成的固溶体。
2.影响因素 (1)溶质原子的大小和溶剂晶体空隙大小 溶质原子的半径小和溶剂晶体结构空隙大容易形成间隙型 固溶体。例:MgO只有四面体空隙可以填充,TiO2结构中还有 1/2 八面体空隙孔可以利用,CaF2中有1/2“立方体空隙”可以被 利用。沸石由硅、铝氧四面体组成的架状结构比长石开敞得多, 有很多大小均一的空洞和孔道为阳离子和水分子所占据,结合 很松,水可以可逆的脱附,阳离子也容易发生可逆的离子交换。 片沸石结构式为 Ca4[(AlO2)8(SiO2)28]•24H2O: 则晶体形成间隙固溶体的次序必然是: 片沸石>CaF2>TiO2&g. 按溶质原子在溶剂晶格中的位置划分: a. 置换型固溶体:晶体中一种离子被杂质原子置换。 Cr2O3→Al2O3 , MgO-CoO,PbZrO3-PbTiO3 ,在金
属氧化物中,主要发生在金属离子位置上的置换。
b. 填隙型固溶体:杂质原子进入晶格中的间隙位置。 金属和H、B、C、N等形成的固溶体都是间隙式固 溶体。
点为490℃,发生相变时,晶格常数剧烈变化,在常温下发生 开裂。PbZrO3 是一种反铁电体,居里点为230℃。两者结构 相同,Zr4+、Ti4+离子尺寸相差不多,能在常温生成连续固溶 体Pb(ZrxTi1-x)O3,x=0.1~0.3。在斜方铁电体和四方铁电体的 边界组成Pb(Zr0.54Ti0.46)O3处,压电性能、介电常数都达到最 大值,烧结性能也很好,被命名为PZT陶瓷。
1)高价置换低价产生阳离子空位: Al2O3―→2AlMg.. +VMg''+ 3Oo 2)低价置换高价产生阴离子空位:
03-固溶体

三、固溶体的表示方法
1、最常用的方法——分子式
以原晶体(溶剂)的分子式为基础,将取代元素和 被取代元素写在一起,并用下脚标标出取代的量。
例如: MgxCo1-xO , Pb(ZrxTi1-x)O3 ,La1-xSrx CoO3 2、固溶体实质上属于杂质缺陷的范畴,表示缺陷 的符号和原则都适用于固溶体。
(2)氧化物加热时吸收氧
室温下,淡绿色的NiO是绝缘体,加热时被氧化 成黑色半导体。
该产物有与NiO相同的岩盐结构。在该结构中, Ni2+, Ni3+和Ni离子空位分布在八面体空隙的位置。
2、填隙阴离子
混合价阳离子同样可伴随嵌入填隙阴离子而形成。 几种高Tc超导体材料就是这种类型的固溶体。
例如:YBCO(Y123):YBa2Cu3O
四、固溶体的特点
固溶体是一个均匀的相。它不同于溶剂(原始 晶体),也不同于机械混合物,更不同于化合物。 1、固溶体与化合物
A和B形成: 化合物 A和B的比例确定 结构完全不同于A或B的结构 性质确定不变 固溶体 A和B的比例有一定范围 结构与原始晶体一致 性质随组成的变化而变化
2、固溶体与机械混合物 固溶体——均匀的单相,性质不同于A也不同于B
一、X射线粉末衍射
一、X射线粉末衍射(XRD)
• 劳厄方程 劳厄把晶体X射线的衍射归结为晶体 内每个原子对X射线的散射,当所有原子 的散射发生相长干涉时便产生最大的衍 射。通过推导,得到最大衍射条件 2d sin = n (n为整数) ——劳厄方程
一、X射线粉末衍射(XRD)
2、定性的物相分析—指纹标记法 每一种晶体物质都有其特定的X射线谱图
Relative intensity / a.u
(111)
第三章 固溶体

rZr 4 0.072nm nm PbZrO3-PbTiO3体系:rTi 4 0.061 0.072 0.061 15.28% 15% 0.072
Jiangsu University
材料科学基础
Jiangsu University
材料科学基础
(2)ZrO2是一种高温耐火材料,熔点2680℃,但发生相变时
单斜四方
伴随很大的体积收缩,这对高温结构材料是致命的。若加 入CaO,则和ZrO2形成固溶体,无晶型转变,体积效应减少, 使ZrO2成为一种很好的高温结构材料。
1200C
Jiangsu University
Jiangsu University
材料科学基础
5.形成固溶体后对晶体性质的影响
• 1、 稳定晶格,阻止某些晶型转变的发生
• 2、活化晶格
• 3、固溶强化
• 4、形成固溶体后对材料物理性质的影响
Jiangsu University
材料科学基础
1、稳定晶格,阻止某些晶型转变的发生
(1) PbTiO3是一种铁电体,纯PbTiO3烧结性能极差,居里 点为490℃,发生相变时,晶格常数剧烈变化,在常温下 发生开裂。PbZrO3是一种反铁电体,居里点为230℃。两 者结构相同,Zr4+、Ti4+离子尺寸相差不多,能在常温生 成连续固溶体Pb(ZrxTi1-x)O3,x=0.1~0.3。在斜方铁电体 和四方铁电体的边界组成Pb(Zr0.54Ti0.46)O3处,压电性能、 介电常数都达到最大值,烧结性能也很好,被命名为PZT 陶瓷。
Jiangsu University
固溶体

固溶体
掺杂、溶解
M gVO M g O A l2 O 3 2 ' 2
A l O
O
A l M gO 2x
x
3x(x0~2) 2
原子(离子)尺度
与主相Al2O3相同 均匀单相
2019/6/6
3
固溶体、化合物、机械混合物
形成方式 反应式
化学组成 混合尺度
结构 相组成
化合物 化学反应
M g O A l2 O 3 A lM g 2 O 4 AlMg2O4
原子(离子)尺度 AB2O4型结构-新相
单相
2019/6/6
4
固溶体、化合物、机械混合物
形成方式 反应式
化学组成 混合尺度
结构 相组成
机械混合物 简单的机械混合 MgOAl2O3 均匀混合
MgOAl2O3
晶体颗粒态 MgO结构+Al2O3结构 两相(或多相),有界面
r1 r2 r1
<15%
形成连续固溶体
15%~30% 形成有限固溶体
>30%
不能形成固溶体
如:MgO-CoO固溶体,溶质-溶剂晶体可
按任意比例无限互溶
(MgXCo1-X)O,X=0~1, (rMg2+= 0.08nm; rCo2+=0.074nm)
结构相同 半径相似
【电例负】性半相径近差别大电:价M相gO同-CaO系SS----有限
Z r
i
O
2019/6/6
20
小结:期在不等价置换固溶体中,可能出现的四种 “组分缺陷”
高价置换低价
阳离子出现空位 阴离子进入间隙 低价置换高价
C2 a K C C C lK l V a K 2 C C C2 a K C C C lK lC a li C C
固溶体

Pb(ZrxTi1-x)O3, x = 0 ~ 1 连续变化。
又称为连续固溶体或完全互溶固溶体
11
有限固溶体 杂质原子在固溶体中的溶解度是有限的,存
在一个溶解度极限。 也称为不连续固溶体或部分互溶固溶体。 例如MgO-CaO体系,虽然两者都是NaCl结构,
MgO-CaO两结构不同,只能形成有限固溶体 或不形成固溶体。
24
4.2.3 离子电荷
离子价相同或离子价态和相同,可形成连续 固溶体。例如:
钠长石Na[AlSi3O8]—钙长石Ca[Al2Si2O8]中, 离子电价总和为+5价:
N a Si4 C a 2 A l3
25
复合钙钛矿型压电陶瓷材料(ABO3型)中,
35
许多存在1种以上氧化态的过渡金属化合物是
非整比的,可看做是一种固溶体。如方铁矿Fe1-xO
Fe123xFe32x O
事实上,方铁矿的实际结构比Fe2+、Fe3+和阳
离子空位遍布于岩盐的八面体阳离子位置要复杂得
多,而代之以缺陷簇的形成。
1 2
O2
FeO 2FeFe
+ VF"e
+ OO
36
2. 填隙阴离子
在CaO稳定的立方氧化锆中有阴离子空位
Zr1xCax O2+x (0≤x≤0.2)
CaO
ZrO2
Ca
" Zr
+ VO
耐火材料和氧离子传导的固体电解质。
38
4. 填隙阳离子
典型代表是“填充硅石”。 硅石(石英、磷石英或方石英)的结构可以
通过Si4+被Al3+部分代替而修饰,与此同时,碱金 属阳离子就进入硅石骨架中正常空着的间隙位置。
固溶体的名词解释

固溶体的名词解释固溶体是一种物质的混合体,由两种或多种元素或化合物按一定比例混合,形成具有一定晶体结构的固体态。
固溶体中的组成物质分子或离子在晶格中能够均匀分布,形成一种完全溶解的状态。
1. 固溶体的形成固溶体的形成一般需要具备两个条件:相容性和体相互溶解度。
相容性是指不同组分之间具有相似晶体结构,具备相近的离子半径、电荷大小和电子结构。
体相互溶解度是指两种或多种组分在固态下相互溶解的程度。
当两种组分的晶体结构相似且溶解度较大时,可以形成固溶体。
2. 固溶体的分类根据组成物质的性质,固溶体可以分为金属固溶体、无机物固溶体和有机物固溶体。
金属固溶体是由两种或多种金属元素组成的固体溶液。
金属固溶体在晶格中以金属原子为基本元素,具有高电子浓度和导电性。
常见的金属固溶体有黄铜(由铜和锌组成)、铝青铜(由铜和铝组成)等。
无机物固溶体是由两种或多种无机物质组成的固体溶液。
无机物固溶体中的组成物质可以是离子或分子。
例如,常见的陶瓷材料中的氧化物固溶体,如钛酸钡与钛酸铅的固溶体。
有机物固溶体是由两种或多种有机物质组成的固体溶液。
有机物固溶体具有较低的熔点和热稳定性,具有较高的溶解度和流动性。
例如,聚合物的共混物即为有机物固溶体。
3. 固溶体的性质固溶体的性质受到组成物质性质的影响,同时也受到其晶体结构、元素溶解度以及晶格缺陷等因素的影响。
首先,固溶体可以改变其物理性质。
由于固溶体中不同组分的原子或分子能够均匀分布在晶格中,使得固溶体的密度、硬度、熔点、导电性、磁性等性质与纯物质有所不同。
其次,固溶体也能够改变化学性质。
不同组分之间的相互作用可以改变其化学反应性能,使其在溶液中具有不同的化学反应特性。
最后,固溶体还能够影响其热力学性质。
由于组分之间的相互作用,固溶体的形成会导致热力学系统的状态发生变化,如混合熵的增加和反应平衡位置的改变。
总之,固溶体是一种混合物体,由两种或多种元素或化合物按一定比例混合形成,具有特定的晶体结构和一系列独特的物理、化学和热力学性质。
固溶体

42
由硅、铝氧四面体组成的片沸石,结构式为
Ca4[(AlO2)8(SiO2)28].24H2O,有很多大小均一的空
洞和孔道为阳离子和水分子所占据,结合很松,
水可以可逆的脱附,阳离子也容易发生可逆的离
子交换。
43
则晶体形成间隙固溶体的次序是:
片沸石(空洞和孔道)
CaF2 (1/2“立方体空隙” )
② 、有序固溶体
14
无序固溶体
各组元原子的分布是随机的
在热力学处于平衡 状态的固溶体中, 溶质原子的分布宏 观上是均匀的。
15
有序固溶体
组元原子在晶体点阵中不是随机分布的,
而是出现某种倾向性排列,如异类原子互相
吸引形成有规则的排列结构。
Ordering 固溶体的有序化
16
2. 影响固溶体形成的因素
MgO(四面体空隙)
44
> >
(2)保持结构中的电中性:
① 、原子填隙
② 、离子填隙
45
① 、原子填隙
例如: C在Fe中形成的间隙固溶体;
过渡元素与C、B、N、Si等形成的碳化物、
硼化物、氮化物、硅化物等本质上是固溶体。
46
在金属结构中,C、 B、N、 Si占据“四孔” 和“八孔”,称金属硬质材料,它们有高硬或 超硬性能,熔点极高。 例如:HfC(碳化铪) m.p=3890℃; TaN(氮化钽) m.p=3090℃;
Na Si Ca Al
4 2
3
26
复合钙钛矿型压电陶瓷材料(ABO3型)中,
Pb Fe Nb O3 PbZrO3
3 1 2 5 1 2
是
Fe Nb 2Zr
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
资源加工与生物工程学院
2. 间隙型固溶体(填隙型固溶体):溶质 原子位于点阵的间隙中。
金属和非金属元素H、B、C、N等形成的固溶 体都是间隙型。如:Fe-C系的α固溶体中,碳原子 位于铁原子的bcc点阵的八面体间隙中。
金属化合物,如YF3进入CaF2结构中形成间 隙型固溶体,F-位于立方体间隙位置。
PbTiO3与PbZrO3也可形成无限固溶体,化学式为: Pb(ZrxTi1-x)O3,x=0~1。
第三章 晶体结构缺陷——3.3 固溶体
二、置换型固溶体
资源加工与生物工程学院
(一) 形成置换型固溶体的主要影响因素 1. 原子或离子尺寸的影响——Hume-Rothery
经验规则 2、晶体结构类型的影响 3、离子类型和键性 4、电价因素
(一) 根据外来组元在主晶相中所处位置 1. 置换型固溶体:溶质原子位于点阵结点上,置 换( (替代型固溶体)替代)部分溶剂原子。
金属和金属形成的固溶体都是置换式的。如, Cu-Zn系中的α和η固溶体都是置换式固溶体。
金属氧化物中,主要发生在金属离子位置上 的置换,如:MgO-CaO,MgO-CoO,PbZrO3PbTiO3,Al2O3-Cr2O3等。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
1. 原子或离子尺寸的影响 ——Hume-Rothery经验规则
r1、r2——分别代表半径大和半径小的溶剂(主晶相)或
溶质(杂质)原子(或离子)的半径:
这是形成连续固溶体的必要条
r r1 r2 15% :溶质与溶剂之间能形成连续固溶体;
资源加工与生物工程学院
四、形成固溶体后对晶体性质的影响
1. 稳定晶格,阻止晶型转变 2. 活化晶格 3. 固溶强化 4. 形成固溶体后对材料物理性质的影响
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
1. 稳定晶格,阻止晶型转变
(1) PZT陶瓷 铁电体PbTiO3烧结性能极差,居里点490℃,相变时晶格 常数剧烈变化导致开裂;反铁电体PbZrO3,居里点230℃。两 者结构相同,Zr4+、Ti4+离子尺寸相差不多,能在常温生成连 续固溶体Pb(ZrxTi1-x)O3,在斜方铁电体和四方铁电体边界组成 Pb(Zr0.54Ti0.46)O3处,压电性能、介电常数都达到最大值,烧 结性能很好,命名为PZT陶瓷。
实际应用:对未知组成固溶体进行定量分析
第三章 晶体结构缺陷——3.3 固溶体
五、固溶体的研究方法
资源加工与生物工程学院
(一) 固溶体组成的确定 (二) 固溶体类型的大略估计 (三) 固溶体类型的实验判别
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
(一) 固溶体组成的确定
1. 点阵常数与成分的关系——Vegard定律
2、活化晶格
资源加工与生物工程学院
形成固溶体使晶格结构畸变而处于高能活化状态, 有利于化学反应进行
Al2O3熔点高(2050℃),不利于烧结,若加入TiO2,可 使烧结温度下降到1600℃。
原因:Al2O3
与TiO2形成固溶体,Ti4+置换Al3+(
Ti
• A
l
),
同时产生正离子空位,加快扩散,有利于烧结进行。
3 电价因素
资源加工与生物工程学院
外来杂质原子进入间隙时,必然引起晶体结构中电
价不平衡,这时可通过部分离子置换来保持电价平衡。
形成间隙阴离子:高价置换低价
YF3 CaF2 YC•a 2FF Fi'
形成间隙阳离子:低价置换高价
CaO ZrO2 CaZr Cai•• 2OO
第三章 晶体结构缺陷——3.3 固溶体
如:钠长石与钙长石形成的连续固溶体中,随着钠长 石向钙长石的过渡,其密度及折光率均递增。通过测定未 知组成固溶体的性质进行对照,反推该固溶体的组成。
第三章 晶体固溶体类型
1. 具有NaCl结构的氧化物晶体中,只有四面体间隙位 置 , 不 可 能 生 成 间 隙 型 固 溶 体 , 例 如 MO , NaCl 、 GaO、SrO、CoO、FeO、KCl等;
3. 离子类型和键性 化学键性质相近,即取代前后离子周围离子
间键性相近,容易形成固溶体。 4. 电价因素
(1)等价置换
硅酸盐晶体中,常发生复合离子的等价置换,
如 Na++Si4+=Ca2++Al3+ , 使 钙 长 石 Ca[Al2Si2O6] 和 钠 长 石 Na[AlSi3O8] 能 形 成 连 续 固 溶 体 。 又 如 , Ca2+=2Na+,Ba2+=2K+常出现在沸石矿物中。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
1. 理论密度计算
理论密度d理 (含有杂质的晶)胞固体溶积体V的晶胞质量W
(1)先写出可能的缺陷反应方程式;
由(2此)可根据见缺,陷固反应溶方体程化式写学出式固的溶写体可法能至的关化学重式要。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
(2)稳定化ZrO2
ZrO2是高温耐火材料,熔点2680℃,但发生相变时
单斜 1200C四方
伴随7~9%体积收缩,导致开裂。若加入CaO,则和ZrO2 形成固溶体,无晶型转变,体积效应减少,使ZrO2成为一 种很好的高温结构材料。
第三章 晶体结构缺陷——3.3 固溶体
第三章 晶体结构缺陷——3.3 固溶体
(2)不等价置换 高价置换低价:形成阳离子空位
资源加工与生物工程学院
Al2O3 MgO2AlM• g VMg 3OO
低价置换高价:形成阴离子空位
CaO ZrO2 CaZr VO•• OO
第三章 晶体结构缺陷——3.3 固溶体
(二) 注意事项
资源加工与生物工程学院
4、形成固溶体后对材料物理性质的影响
固溶体晶胞参数及其电学、热学、磁学等 物理性质随成分而连续变化。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
例如:立方结构晶体,晶胞参数与固溶体组 成关系为:
(ass)n=(a1)nc1+(a2)nc2
式中 ass、a1、a2 —— 固溶体、溶质、溶剂的晶胞参数; c1、c2 —— 溶质、溶剂的浓度; n —— 描述变化程度的一个任意幂。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
实际应用:铂、铑单独做热电偶材料使用,熔 点为1450℃,而将铂铑合金做其中一根热电偶, 铂做另一根热电偶,熔点为1700℃,若两根热电 偶都用铂铑合金而只是铂铑比例不同,熔点达 2000℃以上。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
(二)实例
资源加工与生物工程学院
对于同样外来杂质原子,形成填隙式固溶体可能性或固溶 度大小顺序是:
沸石>CaF2>TiO2>MgO 原因 MgO间隙位置:全部氧四面体空隙;
TiO2间隙位置:1/2八面体空隙 CaF2间隙位置: 1/2立方体空隙 沸石结构:架状硅酸盐结构,具有隧道型空隙
第三章 晶体结构缺陷——3.3 固溶体
第三章 晶体结构缺陷——3.3 固溶体
一、固溶体的分类
资源加工与生物工程学院
(一) 根据外来组元在主晶相中所处位置 —— 置换型固溶体 间隙型固溶体
(二)根据外来组元在主晶相中的固溶度 —— 连续型(无限型、完全互溶型)固溶体 有限型(部分互溶型)固溶体。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
(二) 根据外来组元在主晶相中的固溶度 1. 有限固溶体(不连续固溶体、部分互溶固溶 体):固溶度小于100%。
两种晶体结构不同或相互取代的离子半径差别较大, 只能生成有限固溶体。如MgO-CaO系统,虽都是NaCl 型 结 构 , 但 阳 离 子 半 径 相 差 较 大 , rMg2+=0.080nm , rCa2+=0.108nm,取代只能到一定限度。
2. 具有八面体间隙的金红石结构,或具有更大间隙的 萤石型结构,有可能生成间隙型固溶体。例如CaF2, ZrO2,UO2等。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
(三) 固溶体类型的实验判别
写出生成不同类型固溶体的缺陷反应方程, 根据缺陷方程计算出杂质浓度与固溶体密度的关 系,并画出曲线,然后把这些数据与实验值相比 较,哪种类型与实验相符合即是什么类型。
溶质与溶剂晶体结构类型相同,能形成连续
固溶体这。也是形成连续固溶体的必要条件, NiO-Mg而O 都不具是有充面分心必立要方条结件构。, 且 Δr<15% ,
可形成连续固溶体;
MgO-CaO两结构不同,只能形成有限型固溶 体或不形成固溶体。
第三章 晶体结构缺陷——3.3 固溶体
资源加工与生物工程学院
以上几个主要影响因素,并非同时起作用,在某 些条件下,有的因素会起主要因素,有的会不起主 要作用。例如,rSi4+=0.026nm,rAl3+=0.039nm,相差 达45%以上,电价又不同,但Si-O、Al-O键性接 近,键长亦接近,仍能形成固溶体,在铝硅酸盐中, 常见Al3+置换Si4+形成置换固溶体的现象。
TiO
2
2
3Al2O3
Ti
• Al
1 3
VAl
2O O
Al 2-4xTixO3 3
第三章 晶体结构缺陷——3.3 固溶体
3. 固溶强化
资源加工与生物工程学院
