第一章 化学热力学基础 习题解答
第一章 热力学第一、二定律试题及解答

第一章 热力学第一定律一、选择题1.下述说法中,哪一种正确( )(A)热容C 不是状态函数; (B)热容C 与途径无关;(C)恒压热容C p 不是状态函数;(D)恒容热容C V 不是状态函数。
2.对于内能是体系状态的单值函数概念,错误理解是( )(A) 体系处于一定的状态,具有一定的内能;(B) 对应于某一状态,内能只能有一数值不能有两个以上的数值;(C) 状态发生变化,内能也一定跟着变化;(D) 对应于一个内能值,可以有多个状态。
3.某高压容器中盛有可能的气体是O 2 ,Ar, CO 2, NH 3中的一种,在298K 时由5dm3绝热可逆膨胀到6dm3,温度降低21K ,则容器中的气体( )(A) O 2 (B) Ar (C) CO 2 (D) NH 34.戊烷的标准摩尔燃烧焓为-3520kJ·mol -1,CO 2(g)和H 2O(l)标准摩尔生成焓分别为-395 kJ·mol -1和-286 kJ·mol -1,则戊烷的标准摩尔生成焓为( )(A) 2839 kJ·mol -1 (B) -2839 kJ·mol -1 (C) 171 kJ·mol -1 (D) -171 kJ·mol -15.已知反应)()(21)(222g O H g O g H =+的标准摩尔反应焓为)(T H m r θ∆,下列说法中不正确的是( )。
(A).)(T H m r θ∆是H 2O(g)的标准摩尔生成焓 (B). )(T H m r θ∆是H 2O(g)的标准摩尔燃烧焓 (C). )(T H m r θ∆是负值 (D). )(T H m r θ∆与反应的θm r U ∆数值相等 6.在指定的条件下与物质数量无关的一组物理量是( )(A) T , P, n (B) U m , C p, C V(C) ΔH, ΔU, Δξ (D) V m , ΔH f,m (B), ΔH c,m (B)7.实际气体的节流膨胀过程中,下列那一组的描述是正确的( )(A) Q=0 ΔH=0 ΔP< 0 ΔT≠0 (B) Q=0 ΔH<0 ΔP> 0 ΔT>0(C) Q>0 ΔH=0 ΔP< 0 ΔT<0 (D) Q<0 ΔH=0 ΔP< 0 ΔT≠08.已知反应 H 2(g) + 1/2O 2(g) →H 2O(l)的热效应为ΔH ,下面说法中不正确的是( )(A) ΔH 是H 2O(l)的生成热 (B) ΔH 是H 2(g)的燃烧热(C) ΔH 与反应 的ΔU 的数量不等 (D) ΔH 与ΔH θ数值相等9.为判断某气体能否液化,需考察在该条件下的( )(A) μJ-T > 0 (B) μJ-T < 0 (C) μJ-T = 0 (D) 不必考虑μJ-T 的数值10.某气体的状态方程为PV=RT+bP(b>0),1mol 该气体经等温等压压缩后其内能变化为( )(A) ΔU>0 (B) ΔU <0 (C) ΔU =0 (D) 该过程本身不能实现11.均相纯物质在相同温度下C V > C P的情况是()(A) (∂P/∂T)V<0 (B) (∂V/∂T)P<0(C) (∂P/∂V)T<0 (D) 不可能出现C V>C P12.理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和体系的焓变必定是()(A) T可逆> T不可逆, V可逆> V不可逆, ΔH可逆>ΔH不可逆(B) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆<ΔH不可逆(C) T可逆< T不可逆, V可逆> V不可逆, ΔH可逆<ΔH不可逆(D) T可逆< T不可逆, V可逆< V不可逆, ΔH可逆>ΔH不可逆13.1mol、373K、1atm下的水经下列两个不同过程达到373K、1atm下的水汽:(1)等温可逆蒸发,(2)真空蒸发。
第一章化学热力学习题参考答案
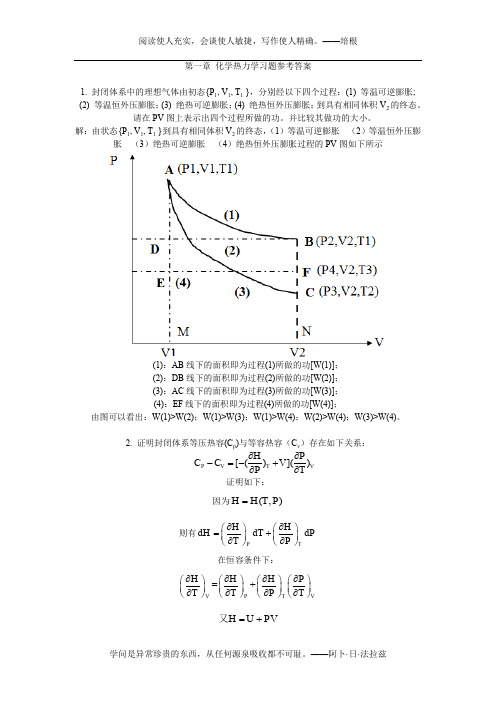
第一章 化学热力学习题参考答案1. 封闭体系中的理想气体由初态{P 1, V 1, T 1 },分别经以下四个过程:(1) 等温可逆膨胀;(2) 等温恒外压膨胀;(3) 绝热可逆膨胀;(4) 绝热恒外压膨胀;到具有相同体积V 2的终态。
请在PV 图上表示出四个过程所做的功。
并比较其做功的大小。
解:由状态{P 1, V 1, T 1 }到具有相同体积V 2的终态,(1)等温可逆膨胀 (2)等温恒外压膨胀 (3)绝热可逆膨胀 (4)绝热恒外压膨胀过程的PV 图如下所示(1):AB 线下的面积即为过程(1)所做的功[W(1)];(2):DB 线下的面积即为过程(2)所做的功[W(2)];(3):AC 线下的面积即为过程(3)所做的功[W(3)];(4):EF 线下的面积即为过程(4)所做的功[W(4)];由图可以看出:W(1)>W(2);W(1)>W(3);W(1)>W(4);W(2)>W(4);W(3)>W(4)。
2. 证明封闭体系等压热容(C p )与等容热容(C v )存在如下关系:[()]()P V T V H P C C V P T∂∂-=-+∂∂ 证明如下:因为(,)H H T P = 则有∂∂⎛⎫⎛⎫=+ ⎪ ⎪∂∂⎝⎭⎝⎭P TH H dH dT dP T P 在恒容条件下:V =+P P T V H H H P T T T ∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫ ⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭H U PV =+又U ()则 V V P T VPV H H P T T T P T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫+=+ ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ U ()=+移项得: P V T V VH H P PV T T P T T ∂∂∂∂∂⎛⎫⎛⎫⎛⎫⎛⎫⎛⎫-- ⎪ ⎪ ⎪ ⎪ ⎪∂∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭⎝⎭ =V P V T V H P C C P T ⎡⎤∂∂⎛⎫⎛⎫-=- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦=V P V T VH P C C P T ⎡⎤∂∂⎛⎫⎛⎫-- ⎪ ⎪⎢⎥∂∂⎝⎭⎝⎭⎣⎦即3. 令 H = H(T, P) 和 S = S(T, P), 根据热力学关系式推导以下关系式:(1)2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)2211[()]T P P P T P C V S dT dP T T ∂∆=+-∂⎰⎰ 解答:(1)式证明:()()因为 p T H H dH dT dp T p∂∂=+∂∂ () (1)T H CpdT dp p ∂=+∂ dH TdS Vdp =+又()()T T H S T V p p∂∂=+∂∂则 (2) ()()T P S V p T ∂∂=-∂∂且有麦克斯韦关系式 (3) 将(2)和(3)式代入(1)式得:[()]p P V dH C dT T V dp T ∂=+-+∂ 积分得:2211[()]T P P P T P V H C dT T V dP T∂∆=+-+∂⎰⎰ (2)式证明:因为()()(4)P T S S dS dT dP T P∂∂=+∂∂ 将(3)式代入(4)式得:()[()](5)P p S V dS dT dP T T ∂∂=+-∂∂据dH TdS VdP =+得:()P H T S ∂=∂,即()()P P H T T T S∂∂=∂∂ 因而有:1()()(6)P P P C S H T T T T∂∂==∂∂ 将(6)式代入(5)式得:[()](7)P P C V dS dT dP T T∂=+-∂对(7)式积分得:2211[()]T P P P T P C V S dT dP T T∂∆=+-∂⎰⎰4. 证明卡诺循环中证明:卡诺循环P-V 图如下: Q 2卡诺循环经如下过程(理想气体)1、等温可逆膨胀22U 0T Q W ∆=+=,2222121ln V T V V Q W PdV nRT V =-==⎰ 2、绝热可逆膨胀1,112()Q V U Q W C T T ∆=+=-,,10,Q Q U W =∆=,113222311Q V V nRT V W PdV V γγ-⎡⎤⎛⎫⎢⎥==- ⎪-⎢⎥⎝⎭⎣⎦⎰3、等温可逆压缩Q 211U 0T Q W ∆=+=4411313ln VT V V Q W PdV nRT V =-==⎰ 4、绝热可逆压缩2,221()Q V U Q W C T T ∆=+=-220,,Q Q U W =∆=,214213411Q V V nRT V W PdV V -⎡⎤⎛⎫⎢⎥=-=- ⎪-⎢⎥⎝⎭⎣⎦⎰γγ 12,1,2,Q Q U U W W ∆=-∆=-可知则 12144323,V V V V V V V V ==则有即或:根据绝热可逆过程方程PV =常数可得:1423V V V V = 整个循环过程中:2,11,221T Q T Q T T W W W W W W W =+++=+2211,T T W Q W Q ==又2421131232221ln ln =ln V V nRT nRT V V Q Q W V Q Q nRT V η++==故有1423V V V V =又1221222=Q Q T T W Q Q T η+-==所以有5. 理想气体从始态(P 1, V 1, T 1)到终态 (P 2, V 2, T 2),设计三条不同路径,计算熵变,并证明三条路径所得结果一致。
第一章化学热力学基础参考答案

第一章2.计算下行反应的标准反应焓变△r Hθm:解:①2Al(s) + Fe2O3(s) → Al2O3(s) + 2Fe(s)△f Hθm(kJ•mol-1) 0 -824.2 -1675.7 0 △r Hθm=△f Hθm(Al2O3,s)+2△f Hθm(Fe,s)-2△f Hθm(Al,s)- △f Hθm(Fe2O3 ,s)= -1675.7 + 2×0 - 2×0 - (-824.2)= - 851.5 (kJ•mol-1)②C2H2 (g) + H2(g) → C2H4(g)△f Hθm(kJ•mol-1) 226.73 0 52.26△r Hθm = △f Hθm(C2H4 ,g) - △f Hθm(C2H2,g) - △f Hθm(H2,g)= 52.26 - 226.73 - 0= -174.47 (kJ•mol-1)3. 由下列化学方程式计算液体过氧化氢在298 K时的△f Hθm(H2O2,l):① H2 (g) + 1/2O2 (g) = H2O (g) △r Hθm = - 214.82 kJ•mol-1② 2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1③ 2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1④ 2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1⑤ H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1解:方法1:根据盖斯定律有:[(方程①-方程②+方程③-方程⑤)×2-方程④]÷2可得以下方程⑥H2(g)+O2(g)=H2O2(l) △r Hθm△r Hθm=[(△r Hθ1-△r Hθ2+△r Hθ3-△r Hθ5) ×2-△r Hθ4] ÷2={[-214.82-(-926.92)+(-1070.6)-51.46] ×2-(-498.34)} ÷2=[(-409.96)×2+498.34] ÷2=(-321.58) ÷2= -160.79(kJ•mol-1)△f Hθm(H2O2 ,l)= △r Hθm= -160.79 kJ•mol-1方法2:(1)由①可知H2O的△f Hθm(H2O,g)= - 214.82 kJ•mol-1(2)根据④计算O的△f Hθm(O,g)2O(g) = O2 (g) △r Hθm = - 498.34 kJ•mol-1△r Hθm = △f Hθm(O2 ,g)- 2△f Hθm(O,g)= 0 - 2△f Hθm(O,g)= - 498.34 kJ•mol-1△f Hθm(O,g)= 249.17 kJ•mol-1(3) 根据②求算△f Hθm(H,g)2H(g) + O(g) = H2O (g) △r Hθm = - 926.92 kJ•mol-1△f Hθm(kJ•mol-1) 249.17 - 214.82△r Hθm = △f Hθm(H2O,g) - 2△f Hθm(H,g) -△f Hθm(O,g)= - 214.82 - 2△f Hθm(H,g)- 249.17= - 926.92△f Hθm(H,g)= 231.465 kJ•mol-1(4) 根据③求算△f Hθm(H2O2 ,g)2H(g) + 2O(g) = H2O2 (g) △r Hθm = - 1070.6 kJ•mol-1△f Hθm(kJ•mol-1) 231.465 249.17△r Hθm = △f Hθm(H2O2 ,g) - 2△f Hθm(H,g) -2△f Hθm(O,g)=△f Hθm(H2O2 ,g) -2×231.465 - 2×249.17= - 1070.6△f Hθm(H2O2 ,g)= - 109.33 kJ•mol-1(5) 根据⑤求算△f Hθm(H2O2 ,l)H2O2 (l) = H2O2 (g) △r Hθm= 51.46 kJ•mol-1△f Hθm(kJ•mol-1) -109.33△r Hθm = △f Hθm(H2O2 ,g) - △f Hθm(H2O2 ,l)= -109.33 - △f Hθm(H2O2 ,l)= 51.46△f Hθm(H2O2 ,l)= -160.79 kJ•mol-14. 在373 K,101.3 kPa下,2.0 mol H2和1.0 mol O2反应,生成2.0 mol的水蒸气,总共放热484 kJ的热量,求该反应的△r H m和△U。
第一章-热力学第一、二定律试题及答案

第一章热力学第一定律一、选择题1 •下述说法中,哪一种正确()(A)热容C 不是状态函数; (B)热容C 与途径无关;(C)恒压热容C P 不是状态函数;(D)恒容热容C V 不是状态函数。
2•对于内能是体系状态的单值函数概念,错误理解是()(A) 体系处于一定的状态,具有一定的内能;(B) 对应于某一状态,内能只能有一数值不能有两个以上的数值; (C) 状态发生变化,内能也一定跟着变化; (D) 对应于一个内能值,可以有多个状态。
3.某高压容器中盛有可能的气体是 O 2 ,Ar, CO 2, NH 3中的一种,在298K 时由5dm3绝热可逆膨胀到6dm3,温度降低21K ,则容器中的气体()(A) 02 (B) Ar (C) CO 2 (D) NH 34 •戊烷的标准摩尔燃烧焓为 -3520Jmol -1,CO^)和 出0(1)标准摩尔生成焓分别为 -395 kJ mol -1和-286kJ mol -1,则戊烷的标准摩尔生成焓为()(A) 2839 kJ mol -1 (B) -2839 kJ mol -1 (C) 171 kJ mol -1 (D) -171 kJ mol -115.已知反应H 2(g)02(g) H 2O(g)的标准摩尔反应焓为 r H m(T),下列说法中不正确的是2()。
6 •在指定的条件下与物质数量无关的一组物理量是()(A) T , P, n (B) U m , C P , C V(C) 出,AU,沁(D) V m , AH f,m (B), △H c,m (B)7 •实际气体的节流膨胀过程中,下列那一组的描述是正确的()(A) Q=0△ H=0 △ P< 0△ T^ 0(B) Q=0 △ H<0 △ P> 0 △ T>0(C) Q>0 △ H=0 △ P<0 △ T<0 (D) Q<0△ H=0 △ P< 0 △ T^0&已知反应H 2(g) + 1/2O 2(g) THO(I)的热效应为△H ,下面说法中不正确的是( )(A)△ H 是H 2O(|)的生成热(B) △ H 是H 2(g)的燃烧热(C) AH 与反应 的AU 的数量不等 (D) AH 与厶日^数值相等9 •为判断某气体能否液化,需考察在该条件下的()(A) 0-丁> 0(B) 詔-T V 0(C) 0-T = 0(D)不必考虑 0-T 的数值10.某气体的状态方程为 PV=RT+bP(b>0),1mol 该气体经等温等压压缩后其内能变化为((A) AJ>0(B) AU <0 (C) AU =0(D) 该过程本身不能实现(A). r H m (T )是H 2O(g)的标准摩尔生成焓 (B). r H m (T )是H 2O(g)的标准摩尔燃烧焓 (C). r H m (T)是负值 (D). r H m (T)与反应的r U m 数值相等11 •均相纯物质在相同温度下C V > C P的情况是( )(A) (?P/?T)V<0(B) (?V/?T)P<0(C) (?P/?V)T<0(D)不可能出现 C V>C P12•理想气体从相同始态分别经绝热可逆膨胀和绝热不可逆膨胀到达相同的压力,则其终态的温度,体积和体系的焓变必定是( )(A) T可逆> T不可逆, V 可逆> V 不可逆, AH可逆>AH 不可逆(B) T可逆< T不可逆, V 可逆< V 不可逆, AH可逆<AH 不可逆(C) T可逆< T不可逆, V 可逆> V 不可逆, AH可逆<AH 不可逆(D) T可逆< T不可逆, V可逆< V 不可逆, AH可逆>AH不可逆13. 1mol、373K、1atm下的水经下列两个不同过程达到373K、1atm下的水汽:(1)等温可逆蒸发,(2)真空蒸发。
物理化学 答案 第一章_习题解答

-
知此气体的 Cp,m=29.10 J·K 1,求过程的ΔU、ΔH、Q 和 W 。 解: (1)等容
ΔU = n ⋅ Cv ,m (T2 − T1 ) = 1 × (29.1 − 8.314) × 75 = 1559 J ΔH = n ⋅ C p ,m (T2 − T1 ) = 1 × 29.1 × 75 = 2183 J
η = −Wr / Q1 = (T1 − T2 ) / T1 = (500 − 300) / 600 = 40%
第二个卡诺热机效率
η ′ = −Wr / Q1′ = (T1 − T2′) / T1 = (500 − 250) / 600 = 50%
∵
η =η′
∴两个热机的效率不相同
(2)第一个热机吸收的热量: Q1 =
γ =1.4,试求 Cv,m。若该气体的摩尔热容近似为常数,试求在等容条件下加热该气体至 t2=
80℃所需的热。 解:∵ γ =
C p,m Cv , m
=
Cv , m + R Cv , m
= 1.4
∴ Cv, m =
R
γ
=
8.314 = 20.79 J ⋅ K -1 ⋅ mol-1 0.4
Qv = n ⋅ Cv ,m ⋅ ΔT = =
4
3 3 ⎧ ⎧ ⎪V1 = 5dm ⎪V2 = 6dm Q (可 ) = 0 ⎯⎯⎯⎯ → ⎨ ⎨ ⎪T1 = 298.15 K ⎪T2 = 278.15 K ⎩ ⎩
由理想气体绝热可逆过程方程式可知
T2 / T1 = (V1 / V2 ) Cv ,m =
R / Cv , m
(完整版)第一章热力学的基本规律课后作业及答案

解:已知理想气体的物态方程为 体胀系数1 VV T p压强系数1 PP T V等温压缩系数T1V pV nRTnR 1 pV T ,nR 1pV TV1 ’ n RT 、 1( 2 )p TV p p由此得到d PP T dTVp dT—dTTP 2 P 1___ T 2dTT 1—T 2 T_1TT11lnV(―dT d p)T P⑷积分pV CT1.3测得一块铜块的体胀系数和等 温压缩系数分别为4.85 10 5K 1和T 7.8*10 7P n 1,和T 可近似Q W 7.47 103 J1.5在25 C 下,压强在0至lOOOP n 之间,测得水的体积为3 6 2 3V (18.066 0.715 10 p 0.046 10 p )cm mol如果保持温度不变,将 1mol 的水从1 p n 加压至1000 p n ,求外界所做的功。
保持温度不变,将1mol 的水由1p n 加压至1000p n ,外界所做的功为在上述计算中我们已将过程近似看作准静态过程。
定容比热容可由所给定压比热容算出维持体积不变,将空气由 0 C 加热至20 C 所需热量Q v 为Q 口6仃2 T 1) 34.83 0.706 103 20J 4.920 105 J(b) 维持压强不变,将空气由 0 C 加热至20 C 所需热量Q p 为Q p m 1 c p (T 2 T 1) 34.83 0.996 1 03 20J 6.938 105 J(c) 若容器有裂缝,在加热过程中气体将从裂缝漏出,使容器内空气质量发生变化•根据理想气体的物 态方程解将题中给出的体积与压强关系记为 由此易得V a bp cp 2dV (b2cp)d p(1)V B V A P *V B V Ap(b2cp)d p1000 1,2 2 3-bp -cp 2 3“33.1J mol1.6在0 C 和15下,空气的密度为 今有27m 3的空气,试计算:(a) 若维持体积不变,将空气由 (b) 若维持压强不变,将空气由 (c) 若容器有裂缝,外界压强为 解(a)由题给空气密度可以算得1.29kg m 3。
普通化学第一章检测题及答案
普通化学第一章(化学热力学基础)模拟试题1.填空题(1)物理量Q(热量)、T(热力学温度)、V(系统体积)、W(功),其中属于状态函数的是;与过程有关的量是。
(2)QV = △U 的应用条件是;;。
(3)在封闭体系中,公式△H = QP的适用条件是。
(4)已知CO2(g)的△fHmθ(298.15K)= -394 kJ/mol,CO2(g)= C(石墨)+O2(g)反应的△fHm(298.15K)为kJ/mol(5)已知反应C(石墨)+ O2(g)= CO2(g),△rHmθ(298.15 K)=-394 kJ·mol和C(金刚石)+O2(g)= CO2 (g),△rHmθ(298.15 K)= -396 kJ·mol问金刚石的△fHmθ(298.15 K)= kJ/mol。
(6)纯物质完美晶体,在时熵值为零。
(7)液态苯气化为气态苯的过程△rS 值,气体在催化剂上吸附过程△rS值。
(8)某放热反应的 B v>0,则在升高温度(p不变)时化学平衡的移动方向为;在增大压力(T不变)时平衡移动方向;加入隋性气体(T,p 不变)时平衡移动方向是。
(9)两个体积相同、温度相等的球形容器中,装有同一种气体,当连接两容器的活塞打开时,△S值。
(10)理想气体的吉布斯函数(G )在向真空膨胀时。
(11)在恒温恒压下,化学反应的△rHm -T△rSm > 0,则反应。
(12)熵减小的反应在低温下可自动进行,此反应的△rHm 。
(13)在等温等压条件下,某反应的Kθ=1,则△rGmθ的值为。
(14)在等温下,若化学平衡发生移动,其平衡常数。
(15)温度T时,在抽空的容器中发生下面的分解反应:NH4HS(s) NH3(g) +H2S(g),测得此平衡体系的总压力为p,则平衡常数Kθ的表达式为。
(16)在恒温恒压下,化学反应的△rHm= T△rSm,则化学反应。
2.选择题(1)内能是体系的状态函数,若某一体系从一始态出发经过一循环过程又回到始态,则体系内能的增量是()。
第 1章 化学热力学基础习题解答(一)
根据反应 ,该反应的标准摩尔焓就是CH3COOH(l)的标准摩尔燃烧焓[变],而
7.关于热力学第二定律,下列说法不正确的是(D)
A .第二类永动机是不可能制造出来的
B.把热从低温物体传到高温物体,不引起其他变化是不可能的
C.一切实际过程都是热力学不可逆过程
2.热力学能是系统的状态函数,若某一系统从一始态出发经一循环过程又回到始态,则系统热力学能的增量是(A)
A.ΔU=0B.ΔU>0C.ΔU<0
U2=U1,U2—U1=0
3.对于封闭系统来说,当过程的始终态确定后,下列各项中(A)无确定值。
A. QB. Q+WC.W (当Q=0时)D.Q (当W=0时)
2. 的应用条件是恒容;W/=0;封闭系统。
3.已知反应
(i)
(ii)
则反应(iii) 的 为206.2kJ﹒mol-1。
反应(iii)=反应(ii)—反应(i)
4.已知298.15K时C2H4(g)、 及 的标准摩尔燃烧焓[变] (298.15K)分别为-1411 ,-1560 及-285.8 ,则 反应的标准摩尔焓[变] 为-136.8 kJ﹒mol-1。
第1章化学热力学基础(一)
一、选择题(均为单选题,将正确选项填在各题后的括号内)
1.系统的下列各组物理量中都是状态函数的是(C)
A.T,P,V,QB.m,Vm,Cp,ΔVC.T,P,V, nD.T,P,U,W
原因:A中T,P,V是,Q不是,是过程量;B中Vm,Cp是,m不是,ΔV是状态函数的
变化,D中T,P,U是,W不是
的燃烧反应就是 的生成反应
4.反应 的标准摩尔焓[变] (T)即是 的标准摩尔生成焓[变] (T)。(×)
物理化学《化学热力学基础》习题及答案
物理化学《化学热力学基础》习题及答案1-2 选择题1、273K ,θp 时,冰融化为水的过程中,下列关系是正确的有(B )A.0<WB.p Q H =∆C.0<∆HD.0<∆U2、体系接受环境做功为160J ,热力学能增加了200J ,则体系(A )A.吸收热量40JB.吸收热量360JC.放出热量40JD.放出热量360J3、在一绝热箱内,一电阻丝浸入水中,通以电流。
若以水和电阻丝为体系,其余为环境,则(C )A.0,0,0>∆=>U W QB.0,0,0>∆==U W QC.0,0,0>∆>=U W QD.0,0,0<∆=<U W Q4、任一体系经一循环过程回到始态,则不一定为零的是(D )A.G ∆B.S ∆C.U ∆D.Q5、对一理想气体,下列关系式不正确的是(A )A.0=⎪⎭⎫ ⎝⎛∂∂p T UB.0=⎪⎭⎫ ⎝⎛∂∂T V H C.0=⎪⎪⎭⎫ ⎝⎛∂∂T p H D.0=⎪⎪⎭⎫ ⎝⎛∂∂T p U 6、当热力学第一定律写成pdV Q dU -=δ时,它适用于(C )A.理想气体的可逆过程B.封闭体系的任一过程C.封闭体系只做体积功过程D.封闭体系的定压过程7、在一绝热刚壁体系内,发生一化学反应,温度从21T T →,压力由21p p →,则(D )A.0,0,0>∆>>U W QB.0,0,0<∆<=U W QC.0,0,0>∆>=U W QD.0,0,0=∆==U W Q 8、理想气体定温定压混合过程中,下列体系的性质不正确的是(C )A.0>∆SB.0=∆HC.0=∆GD.0=∆U9、任意的可逆循环过程,体系的熵变(A )A.一定为零B.一定大于零C.一定为负D.是温度的函数10、一封闭体系从B A →变化时,经历可逆R 和不可逆IR 途径,则(B )A.IR R Q Q =B.T Q dS IRδ> C.IR R W W = D.TQ T Q IR R =11、理想气体自由膨胀过程中(D )A.0,0,0,0=∆>∆>=H U Q WB.0,0,0,0>∆>∆=>H U Q WC.0,0,0,0=∆=∆><H U Q WD.0,0,0,0=∆=∆==H U Q W12、2H 和2O 在绝热定容的体系中生成水,则(D )A.0,0,0=∆>∆=孤S H QB.0,0,0>∆=>U W QC.0,0,0>∆>∆>孤S U QD.0,0,0>∆==孤S W Q13、理想气体可逆定温压缩过程中,错误的有(A )A.0=∆体SB.0=∆UC.0<QD.0=∆H14、当理想气体反抗一定外压做绝热膨胀时,则(D )A.焓总是不变的B.热力学能总是不变的C.焓总是增加的D.热力学能总是减小的15、环境的熵变等于(B 、C ) A.环体T Q δ B.环体T Q δ- C.环环T Q δ D.环环T Q δ-16、在孤立体系中进行的变化,其U ∆和H ∆的值一定是(D )A.0,0<∆>∆H UB.0,0=∆=∆H UC.0,0<∆<∆H UD.不能确定H U ∆=∆,017、某体系经过不可逆循环后,错误的答案是(A )A.0=QB.0=∆SC.0=∆UD.0=∆H18、C 6H 6(l)在刚性绝热容器中燃烧,则(D )A.0,0,0=<∆=∆Q H UB.0,0,0=>∆=∆W H UC.0,0,0==∆≠∆Q H UD.0,0,0=≠∆=∆W H U19 、下列化学势是偏摩尔量的是( B ) A.Zn V T B n F ,,⎪⎭⎫ ⎝⎛∂∂ B.Z n p T B n G ,,⎪⎭⎫ ⎝⎛∂∂ C.Z n V S B n U ,,⎪⎭⎫ ⎝⎛∂∂ D.Z n p S B n H ,,⎪⎭⎫ ⎝⎛∂∂ 20、在℃10-,θp ,1mol 过冷的水结成冰时,下述表示正确的是( C )A.00,0,0>∆>∆>∆<∆孤环体,S S S GB.00,0,0<∆<∆<∆>∆孤环体,S S S GC.00,0,0>∆>∆<∆<∆孤环体,S S S GD.00,0,0<∆<∆>∆>∆孤环体,S S S G21、下述化学势的公式中,不正确的是( D ) A.B B Z n p T n Gμ=⎪⎪⎭⎫ ⎝⎛∂∂,, B.m B pS T ,-=⎪⎭⎫ ⎝⎛∂∂μ C.m B TV p ,=⎪⎪⎭⎫ ⎝⎛∂∂μ D.Z n p T B n U ,,⎪⎪⎭⎫ ⎝⎛∂∂ 22、在373.15K ,101.325Pa ,)(2l O H μ与)(2g O H μ的关系是( B )A.)()(22g O H l O H μμ>B.)()(22g O H l O H μμ=C.)()(22g O H l O H μμ<D.无法确定23、制作膨胀功的封闭体系,pT G ⎪⎭⎫ ⎝⎛∂∂的值( B ) A.大于零 B.小于零 C.等于零 D.无法确定24、某一过程0=∆G ,应满足的条件是( D )A.任意的可逆过程B.定温定压且只做体积中的过程C.定温定容且只做体积功的可逆过程D.定温定压且只做体积功的可逆过程25、1mol 理想气体经一定温可逆膨胀过程,则( A )A.F G ∆=∆B.F G ∆>∆C.F G ∆<∆D.无法确定26、纯液体在正常相变点凝固,则下列量减少的是( A )A.SB.GC.蒸汽压D.凝固热27、右图中哪一点是稀溶液溶质的标准态的点( B )A.a 点B.b 点C.c 点D.d 点28、在θp 下,当过冷水蒸气凝结为同温度的水,在该过程中正、负号无法确定的是( D )A.G ∆B.S ∆C.H ∆D.U ∆29、实际气体的化学势表达式为θθμμp f RT T ln)(+=,其中标准态 化学势为( A )A.逸度θp f =的实际气体的化学势B.压力θp p =的实际气体的化学势C.压力θp p =的理想气体的化学势D.逸度θp f =的理想气体的化学势30、理想气体的不可逆循环,G ∆( B )A.0<B.0=C.0>D.无法确定31、在βα,两相中含A 、B 两种物质,当达平衡时,正确的是( B )A.ααμμB A =B.ααμμA A =C.βαμμB A =D.ββμμB A =32、多组分体系中,物质B 的化学势随压力的变化率,即)(,B Z B Z n T p ≠⎪⎪⎭⎫ ⎝⎛∂∂μ的值( A ) A.0> B.0< C.0= D.无法确定33、℃10-、标准压力下,1mol 过冷水蒸汽凝集成冰,则体系、环境及总的熵变为( B )A.0,0,0<∆<∆<∆univ sur sys S S SB.0,0,0>∆>∆<∆univ sur sys S S SC.0,0,0>∆>∆>∆univ sur sys S S SD.0,0,0<∆>∆<∆univ sur sys S S S34、p-V 图上,1mol 单原子理想气体,由状态A 变到状态B ,错误的是( B )A.Q U =∆B.Q H =∆C.0<∆SD.0<∆U35、体系经不可逆过程,下列物理量一定大于零的是( C )A.U ∆B.H ∆C.总S ∆D.G ∆36、一个很大的恒温箱放着一段电阻丝,短时通电后,电阻丝的熵变( D )A.0>B.0<C.0=D.无法确定37、热力学的基本方程Vdp SdT dG +-=可使用与下列哪一过程( B )A.298K ,标准压力的水蒸发的过程B.理想气体向真空膨胀C.电解水制备氢气D.合成氨反应未达平衡38、温度为T 时,纯液体A 的饱和蒸汽压为*A p ,化学势为*A μ,在1θp 时,凝固点为0f T ,向A 溶液中加入少量溶质形成稀溶液,该溶质是不挥发的,则A p 、A μ、f T 的关系是( D )A.f f A A A A T T p p <<<0,**,μμB.f f A A A A T T p p <<>0,**,μμC.f f A A A A T T p p ><>0,**,μμD.f f A A A A T T p p >>>0,**,μμ39下列性质不符合理想溶液通性的是: ( D )A. ∆mix V =0B. ∆mix S >0C. ∆mix G <0D. ∆mix G >040、从A 态到B 态经不可逆过程ΔS 体是: ( D )A.大于零B.小于零C.等于零D.无法确定41、常压下-10℃过冷水变成-10℃的冰,在此过程中,体系的ΔG 与ΔH 如何变化: ( D )A. ΔG<0,ΔH>0B. ΔG>0,ΔH>0C. ΔG=0,ΔH=0D. ΔG<0,ΔH<042、某绝热封闭体系在接受了环境所做的功之后,其温度:( A )A.一定升高B.一定降低C.一定不变D.不一定改变43、对于纯物质的标准态的规定,下列说法中不正确的是: (C)A. 气体的标准态就是温度为T ,压力为100kPa 下具有理想气体性质的纯气体状态。
第01章--热力学基本定律--习题及答案
第一章 热力学基本定律习题及答案§ 1. 1 (P10)1.“任何系统无体积变化的过程就一定不做功。
”这句话对吗?为什么?解:不对。
体系和环境之间以功的形式交换的能量有多种,除体积功之外还有非体积功,如电功、表面功等。
2. “凡是系统的温度下降就一定放热给环境,而温度不变时则系统既不吸热也不放热。
”这结论正确吗?举例说明。
答:“凡是系统的温度下降就一定放热给环境”不对:体系温度下降可使内能降低而不放热,但能量可以多种方式和环境交换,除传热以外,还可对外做功,例如,绝热容器中理想气体的膨胀过程,温度下降释放的能量,没有传给环境,而是转换为对外做的体积功。
“温度不变时则系统既不吸热也不放热”也不对:等温等压相变过程,温度不变,但需要吸热(或放热), 如P Ө、373.15K 下,水变成同温同压的水蒸气的汽化过程,温度不变,但需要吸热。
3. 在一绝热容器中,其中浸有电热丝,通电加热。
将不同对象看作系统,则上述加热过程的Q 或W 大于、小于还是等于零?(讲解时配以图示) 解:(1)以电热丝为系统:Q<0,W>0(2)以水为系统:Q>0,W=0(忽略水的体积变化) (3)以容器内所有物质为系统:Q=0,W>0(4)以容器内物质及一切有影响部分为系统:Q=0,W=0(视为孤立系统)4. 在等压的条件下,将1mol 理想气体加热使其温度升高1K ,试证明所做功的数值为R 。
解:理想气体等压过程:W = p(V -V ) = pV -PV = RT -RT = R(T -T ) = R5. 1mol 理想气体,初态体积为25dm , 温度为373.2K ,试计算分别通过下列四个不同过程,等温膨胀到终态体积100dm 时,系统对环境作的体积功。
(1)向真空膨胀。
(2)可逆膨胀。
(3)先在外压等于体积50 dm 时气体的平衡压力下,使气体膨胀到50 dm ,然后再在外压等于体积为100dm 时气体的平衡压力下,使气体膨胀到终态。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章 化学热力学基础1-1 气体体积功的计算式 dV P W e ⎰-= 中,为什么要用环境的压力e P ?在什么情况下可用体系的压力体P ?答: 在体系发生定压变化过程时,气体体积功的计算式 dV P W e ⎰-= 中,可用体系的压力体P 代替e P 。
1-2 298K 时,5mol 的理想气体,在(1)定温可逆膨胀为原体积的 2 倍; ( 2 )定压下加热到373K;(3)定容下加热到373K 。
已知 C v,m = 28、28J·mol -1·K -1。
计算三过程的Q 、W 、△U 、△H 与△S 。
解 (1) △U = △H = 0kJ V V nRT W Q 587.82ln 298314.85ln 12=⨯⨯==-= 11282.282ln 314.85ln -⋅=⨯==∆K J V V nR S (2) kJ nC Q H m P P 72.13)298373(,=-==∆kJ nC U m V 61.10)298373(,=-=∆W = △U – Q P = - 3、12 kJ112,07.41298373ln )314.828.28(5ln -⋅=+⨯==∆K J T T nC S m P (3) kJ nC Q U m V V 61.10)298373(,=-==∆kJ nC H m P 72.13)298373(,=-=∆W = 0112,74.31298373ln 28.285ln -⋅=⨯==∆K J T T nC S m V 1-3 容器内有理想气体,n=2mol , P=10P θ,T=300K 。
求 (1) 在空气中膨胀了1dm 3,做功多少? (2) 膨胀到容器内压力为 lP θ,做了多少功?(3)膨胀时外压总比气体的压力小 dP , 问容器内气体压力降到 lP θ时,气体做多少功?W f dl p A dl p dVδ=-⋅=-⋅⋅=-⋅外外外解:(1)此变化过程为恒外压的膨胀过程,且Pa P e 510=J V P W e 1001011035-=⨯⨯-=∆-=-(2)此变化过程为恒外压的膨胀过程,且Pa P e 510=nRT P nRT P nRT P V V P V P W e 109)10()(12-=--=--=∆-=θθθθ J 6.4489300314.82109-=⨯⨯⨯-= (3) VnRT P dP P P e =≈-= 1221ln ln 12121P P nRT V V nRT dV V nRT dV P W V V V V e ==-=-=⎰⎰ kJ PP 486.11101ln 300314.82-=⨯⨯⨯=θθ1-4 1mol 理想气体在300K 下,1dm 3定温可逆地膨胀至10dm 3,求此过程的 Q 、W 、△U 及△H 。
解: △U = △H = 0J V V nRT W Q 1.574310ln 300314.81ln 12=⨯⨯==-= 1-5 1molH 2由始态25℃及P θ可逆绝热压缩至 5dm -3, 求(1)最后温度;(2)最后压力; ( 3 ) 过程做功。
解:(1) 3511178.2410298314.81-=⨯⨯==dm P nRT V 12,12ln lnT T C V V R m V -= 298ln 314.82578.245ln 314.82T ⨯-= K T 3.5652=(2) Pa V nRT P 53222104.91053.565314.81⨯=⨯⨯⨯==- (3) )2983.565(314.85.21)(12,-⨯⨯⨯-=--=∆-=T T nC U W m VJ 8.5555-=1-6 40g 氦在3P θ 下从25℃加热到50℃,试求该过程的△H 、△U 、Q 与W 。
设氦就是理想气体。
( He 的M=4 g·mol -1 )解: J nC Q H m P P 3.519625314.825440)298323(,=⨯⨯⨯=-==∆ J nC U m V 8.311725314.823440)298323(,=⨯⨯⨯=-=∆ W = △U – Q P = -2078、5J1-7 已知水在100℃ 时蒸发热为2259、4 J·g -1,则100℃时蒸发30g 水,过程的△U 、△H 、 Q与W 为多少?(计算时可忽略液态水的体积)解: mol n 67.11830== J H Q 67782304.2259=⨯=∆=J nRT PV V V p W g l g 9.5178373314.867.1)(-=⨯⨯-=-=-≈--= J W Q U 1.62603=+=∆1-8 298K 时将1mol 液态苯氧化为CO 2 与 H 2O ( l ) ,其定容热为 -3267 kJ·mol -1 , 求定压反应热为多少?解: C 6H 6 (l) + 7、5O 2 (g) → 6CO 2 (g) +3 H 2O ( l )kJ g RT Q Q B V P 7.327010)5.76(298314.83267)(3-=⨯-⨯⨯+-=+=∑-ν 1-9 300K 时2mol 理想气体由ldm -3可逆膨胀至 10dm -3 ,计算此过程的嫡变。
解: 11229.3810ln 314.82ln -⋅=⨯==∆K J V V nR S 1-10.已知反应在298K 时的有关数据如下C 2H 4 (g) + H 2O (g) → C 2H 5OH (l)△f H m Ө /kJ·mol -1 52、3 -241、8 -277、6C P , m / J·K -1·mol -1 43、6 33、6 111、5计算(1)298K 时反应的△r H m Ө 。
(2)反应物的温度为288K,产物的温度为348K 时反应的△r H m Ө 。
解(1) △r H m Ө = -277、6 + 241、8 - 52、3 = -88、1 kJ·mol -1(2) 288K C 2H 4 (g) + H 2O (g) → C 2H 5OH (l) 348K↓△H 1 ↓△H 2 ↑△H 3298K C 2H 4 (g) + H 2O (g) → C 2H 5OH (l) 298K△r H m Ө = △r H m Ө ( 298K ) + △H 1 + △H 2 + △H 3= -88、1 + [( 43、6 + 33、6 ) ×(298-288) + 111、5×( 348-298)]×10-3= - 81、75 kJ·mol -11-11 定容下,理想气体lmolN 2由300K 加热到600K ,求过程的△S 。
已知11,,)006.000.27(2--⋅⋅+=mol K J T C N m P解: T R C C m P m V 006.069.18,,+=-= ⎰+=∆600300006.069.18dT TT S 175.14)300600(006.0300600ln 69.18-⋅=-+=K J 1-12 若上题就是在定压下进行,求过程的嫡变。
解: ⎰+=∆600300006.000.27dT TT S 151.20)300600(006.0300600ln 00.27-⋅=-+=K J 1-13 101、3kPa 下,2mol 甲醇在正常沸点337、2K 时气化,求体系与环境的嫡变各为多少?已知甲醇的气化热△H m = 35、1kJ·mol -1解: 132.2082.337101.352-⋅=⨯⨯=∆=∆K J T H n S m 体系 12.2082.337351002-⋅-=⨯-=∆-=∆K J T H n S m 环境环境 1-14 绝热瓶中有373K 的热水,因绝热瓶绝热稍差,有4000J 的热量流人温度为298K 的空气中,求(1)绝热瓶的△S 体;(2)环境的△S 环;(3)总熵变△S 总。
解:近似认为传热过程就是可逆过程172.103734000-⋅-=-=∆K J S 体系 142.1329874000-⋅==∆K J S 环境 △S 总 = △S 体 + △S 环 = 2、70J·K -11-15 在298K 及标准压力下,用过量100%的空气燃烧 1mol CH 4 , 若反应热完全用于加热产物,求燃烧所能达到的最高温度。
CH 4 O 2 CO 2 H 2O (g) N 2△f H m Ө /k J ·mol -1-74、81 0 -393、51 - 241、82C P , m / J·K -1·mol -1 28、17 26、75 29、16 27、32解; 空气中 n (O 2) = 4mol , n (N 2) = n (O 2) ×(79%÷21%)= 15molCH 4(g) +2 O 2 → CO 2 (g) + 2H 2O (g)△r H m Ө ( 298K ) = 2×(-241、82) + (-393、51) – (-74、81) = - 802、34 kJ 反应后产物的含量为:O 2 CO 2 H 2O (g) N 2n / mol 2 1 2 15- 802、34×103 + ( 2×28、17+ 15×27、32 + 26、75 + 2×29、16 )(T-298) = 0 T = 1754K1-16.在110℃、105Pa 下使 1mol H 2O(l) 蒸发为水蒸气,计算这一过程体系与环境的熵变。
已知H 2O(g) 与H 2O(l)的热容分别为1、866 J·K -1·g -1与4、184 J·K -1·g -1,在100℃、105Pa 下H 2O(l)的的汽化热为 2255、176 J·g -1。
解: 1mol H 2O(l , 110℃, 105Pa ) ----→ 1mol H 2O(g , 110℃, 105Pa ) ↓∆H 1 , ∆S 1 ↑∆H 3 , ∆S 31mol H 2O(l , 100℃, 105Pa ) ----→ 1mol H 2O(g , 100℃, 105Pa ) ∆H 2 , ∆S 2123H H H H ∆=∆+∆+∆体系37338338337318[ 4.1842255.176 1.866]dT dT =⨯⨯++⨯⎰⎰ 18[4.184(373383)2255.176 1.866(383373)]=⨯⨯-++⨯-= 40、176 kJ123S S S S ∆=∆+∆+∆体系3732255.17638318[4.184ln 1.866ln ]383373373=⨯⨯++⨯ = 107、7 J·K -1140176104.9110273Q Q H S J K T T T -∆∆==-=-=-=-⋅+环境体系体系环境环境环境环境 1-17 1mol ideal gas with C v,m = 21J·K -1·mol -1,was heated from 300K to 600K by (1)reversible isochoric process; (2)reversible isobaric process 、 Calculate the △U separately 、解:(1)由题知△U = n C v,m △T = 1×21×(600-300)= 6300(J)(2) 对i 、g 由于△U 只就是温度的函数,所以△U2 = △U1 = 6300(J)1-18 Calculate the heat of vaporization of 1mol liquid water at 20℃, 101、325kPa、△vap H mӨ(water) = 40、67 kJ·mol-1, C p,m(water) = 75、3 J·K-1·mol-1, C p,m(water vapor) =33、2 J·K-1·mol-1 at 100℃, 101、325kPa、解: 1mol H2O(l , 20℃, 105Pa ) ----→1mol H2O(g , 20℃, 105Pa )↓∆H1 , ↑∆H3 ,1mol H2O(l , 100℃, 105Pa ) ----→1mol H2O(g , 100℃, 105Pa )∆H2H+ nCp,m(g) △T △H =△H1 + △H2 +△H3 = nCp,m(l) △T+ n△vapθm= 1×75、3×(100-20)×10-3+ 1×40、67 + 1×33、2×(20-100)×10-3= 44、04 kJ。
