凝胶过滤层析脱盐
凝胶层析法(凝胶过滤)脱盐和分离蛋白质-1

凝胶层析法(凝胶过滤)脱盐和分离蛋白质-1原理凡盐析所获得的粗制蛋白质(盐析得到的IgG)中均含有硫酸铵等盐类,这类将影响以后的纯化,所以纯化前均应除去,此过程称为“脱盐”(desalthing)。
脱盐常用透析法和凝胶过滤法,这两种方法各有利弊。
前者的优点是透析后析品终体积较小,但所需时间较长,且盐不易除尽;凝胶过滤法则能将盐除尽,所需时间也短,但其凝胶过滤后样品体积较大。
所以,要根据具体情况选择使用。
凝胶达滤后样品体积不会太增加,所以选用凝胶过滤法。
凝胶过滤(gel filtration),又称为凝胶层析(gel chromatograph y)、分子筛过滤(molecularsieve filtration)、凝胶渗透层析(gel osmotic chromatography)等。
它是20世纪60年代发展起来的一种层析技术。
其基本原理是利用被分离物质分子大小不同及固定相(凝胶)具有分子筛的特点,将被分离物质各成分按分子大小分开,达到分离的方法。
凝胶是由胶体粒子构成的立体网状结构。
网眼里吸满水后凝胶膨胀呈柔软而富于弹性的半固体状态。
人工合成的凝胶网眼较均匀地分布在凝胶颗粒上有如筛眼,小于筛眼的物质分子均可通过,大于筛眼的物质分子则不能,故称为“分子筛”。
凝胶之所以能将不同分子的物质分开是因为当被分离物质的各成分通过凝胶时,小于筛眼的分子将完全渗入凝胶网眼,并随着流动相的移动沿凝胶网眼孔道移动,从一个颗粒的网眼流出,又进入另一颗粒的网眼,如此连续下去,直到流过整个凝胶柱为止,因而流程长、阻力大、流速慢;大于筛眼的分子则完全被筛眼排阻而不能进入凝胶网眼,只能随流动相沿凝胶颗粒的间隙流动,其流程短、阻力小、流速快,比小分子先流出层析柱;小分子最后流出。
分子大小介于完全排阻不能进入或完全渗入凝胶筛眼之间的物质分子,则居中流出。
这样被分离物质即被按分子的大小分开。
用于凝胶层析的凝胶均为人工合成的产品,主要有交联葡聚糖(商品名为Sephadex)、琼脂糖(商品名为Sepharose)、聚丙烯酰胺凝胶(商品名为Bio–gel)及具有一定网眼的细玻璃珠等和这些凝胶的衍生物。
凝胶过滤层析

C. Sephadex G-150(分级范围, 5,000-400,000 D)
凝胶粒度的影响
凝胶粒度的大小对分离效果有直接的影响。一般来说,细粒凝胶柱 流速低,但洗脱峰窄,分辨率高,多用于精制分离或分析等。粗粒 凝胶柱流速高,但洗脱峰平坦,分辨率低,多用于粗制分离,脱盐 等。 在一般柱层析中,使用干颗粒直径在70μ m左右较合适。对于在水中 保存的凝胶如琼脂粉凝胶颗粒直径应在150μ m左右。凝胶颗粒大小 要均匀,这样流速稳定,效果较好
层析柱 ( a )自制简易层祈柱( 1 .玻璃 管;2.橡皮塞;3.尼龙网); (b)普通商品柱; (c)双底板层析柱(1.洗脱液进 出口; 2. 多孔底板; 3 .柱床; 4 .恒温水进口; 5 .恒温水出口; 6.可调节的塞子)
4、样品的准备
样品的粘度:粘度大产生介质吸附, 一般要求样品粘度小于0.01Pa· s
选择凝胶时,应使样品中大分子组的分子量大于其排阻限,而小 分子组的分子量小于渗入限。也就是说大分子的分配系数Kd=0, 小分子的Kd=1。这样能取得最好的分离效果。
例题:从某蛋白质溶液(MW=5500D)中除去无机盐,应选择下 列哪种凝胶最合适?
A. Sephadex G-15(分级范围, <1,500 D) B. Sephadex G-25(分级范围,1000-5000 D)
凝胶过滤层析
定义
凝胶过滤层析是生化分离常用色谱技术的一种。 利用具有网状结构的凝胶的分子筛作用,根据被分离物 质的分子大小不同来进行分离,也被称为体积排阻层 析(size exclusion chromatography)、分子筛层 析(Molecular Sieve Chromatography)、凝胶渗 透层析(Gel Permeation Chromatography)
[精品]实验凝胶过滤法使蛋白质脱盐
![[精品]实验凝胶过滤法使蛋白质脱盐](https://img.taocdn.com/s3/m/feb49b23ba1aa8114431d994.png)
4.收集检查 用刻度离心管收集洗出液,每管收集1ml。 边收集边进行蛋白质与铵盐的检查。 (1)取洗出液2滴加入白瓷板穴中,加入钠 氏试剂1滴,如有铵盐洗脱下来,则有黄红色沉 淀。 (2)取洗出液2滴置小试管中,加入磺柳酸 1滴,如有蛋白质洗脱下来,则有白色混浊或沉 淀出现。
1)NH4+检查
2)蛋白质检查
(二)连接层析装置
1. 先将层析柱垂直固定在铁架台上。 2. 按下图将各部位连接起来。
洗 脱 液 连 接 软 管 层 析 柱
连 接 软 管 收 集 容 器
(三)装柱与层析
1.装柱 向层析柱中注入少量洗 脱液(去离子水),将凝胶 浆液沿玻棒缓慢倾入柱中 (注满)。凝胶自然沉积约 1~2cm 高度后打开下端出 水口,待凝胶床面上升到约 3/4柱高停止。关闭出水口, 静置。
生物化学实验之--
实验三
凝胶过滤法使蛋白质脱盐
山东师范大学生命科学学院
【实验目的】
学习凝胶过滤法分离纯化蛋白质的原 理与操作技术
【实验原理】
凝胶层析又称分子筛层析、排阻层析或 凝胶过滤,是以凝胶为载体,根据蛋白质的 大小和形状,即蛋白质的相对分子质量进行 分离和纯化。 该方法广泛用于生将烧杯中的洗脱液与层 析柱接通,然后拧松螺旋夹,让洗脱液滴下冲洗 层析柱,以除杂质并使柱床均匀密实(此步也称 作平衡)。适当时间后(流下的洗脱液体积一般 。 为柱床体积的2~3倍),再拧紧螺旋夹。 洗柱过程中注意调整流速约2ml/min。
3.加样与洗脱 用刻度吸管吸取 1ml 样品(蛋白质-硫酸 铵溶液),其尖头小心沿层析柱内壁伸到床面 之上,慢慢将样品加到凝胶床面上(不可搅动 床面),此时能看到床面上样品与洗脱液之间 有一清晰界面。拧松螺旋夹,待样品全部进入 凝胶柱中 , 接通洗脱液,开始洗脱并收集洗出 液。
实验五 蛋白质脱盐

实验五蛋白质脱盐——凝胶过滤法【实验目的】了解凝胶过滤层析技术的工作原理,掌握凝胶过滤层析技术,获得脱盐后的目的蛋白质溶液【实验原理】目的蛋白质用盐析法从细胞裂解中沉淀分离后,其中尚有大量的硫酸铵,需要脱盐才能获得较纯的样品。
常用的脱盐方法有透析法、电透析法和凝胶过滤法。
透析法及电透析法耗时长,样品稀释度大,不易放大进行大规模生产,所以工业生产中应用较少。
凝胶过滤层析脱盐过程中盐分子和蛋白质分子大小差异巨大,蛋白质溶液中小分子的盐分子随着层析流动相进入孔径较小的固定相致辞使其在层析中的迁移速率小,而蛋白质因分子尺寸较大,不能随流动相进入固定相中,因此在层析柱中的迁移速率大,首先从层析术中流出,实现脱盐。
用凝胶过滤法脱盐时,为了使盐同蛋白质充分地分离,除了应选用足够长的层析柱之外,还应对样品的体积加以限制。
样品的体积如果过大就导致蛋白质带同盐带不能分开。
一般来就,样品体积不超过床体积的30%。
这一数据的确定是根据盐和蛋白质的分离体积(Vsep)决定的。
两种物质分离体积的定义为,当两种物质的混合物在凝胶过滤层析柱上能够完全分离时的最小体积(参看图一)。
它在数值上等于:Vsep=V eB-V eAC1/2 V由于种种原因(例如样品在柱中的微小振动、固定相和流动相之间的不平衡,样品在柱中发生的纵向扩散等),产生的洗脱峰总是比理论值要宽得多。
如果上柱用的样品体积等于Vsep时,由于上述原因,两种物质的洗脱曲线会重叠造成分离失败(如图二所示),因此,上样体积应Vsep,但是上样体积过小会造成样品过度稀释。
为了提高脱盐样品的得率,上样体积一般15-20%床体积。
一般脱盐层析柱,应为粗短型柱,以提高脱的工作效率。
用凝胶过滤层析技术对白质溶液进行脱盐处理时,样品的浓度对分离效果,没有影响,但是,如果样品浓度过大,就会造成样品粘度增大,引起层析带和洗脱速率不稳定,造成洗脱曲线变宽和扭曲。
在选用洗脱液时,应考虑蛋白质的稳定性和蛋白质同层析介质之间的非特异性吸附作用,所以一般选用离子强度大于0.02的磷酸缓冲液或Tris-HCl缓冲液,如果脱盐后的蛋白质溶液要进行冷冻干燥处理时,应选用可以挥发的缓冲物质制备洗脱液,例如,乙酸铵、碳酸氢铵、乙酸乙烯二胺盐等。
凝胶层析脱盐技术应用

外, 由于生物大分 子都 是在溶液 中发 挥作用 的, 液相 色谱 能 够 保证 这样一个溶液环境 , 一定程度的保证 了大分子的生物
活性 。
1 研 究背 景 及 目的
本 次实验 的 目的在于佐证理论应 用与层析 技术 的可 行 性, 体会理论 应用 于新技术 即新技术 的开发的思路 , 同时掌 握分子筛层析 的实验技术 。 凝胶层 析脱盐技术是 以蛋白质精分 级建立 的分子筛层 析技术 , 比透析 技术 , 相 分子筛能够在 短时间 内完成更 多量
子 的 每种 特 性 都 可 以应 用 于 层 析 的方 法 来 进 行 分 离 纯化 。另
凝胶颗粒 内部而受到交 大阻滞作用 , 移动较慢 , 流出层析 后 柱。 中等大小 的分子则在二者之间流出。 层析介质一定时, 分
子量一定 的物质 流出凝胶层析柱 的时 间是一定 的, 因此凝胶 过滤可 以用于分离 、 鉴定及 制备 。 样品的分离效果可 以通过检验 2 0 m处的紫外光 吸收 8n 值及加入 B C2 a l检测沉淀 的生成情况来确定 ,最终可以通过 比较蛋 白峰与盐峰 的分离情况来判断分离效果。 况 , 别要 检查到各 反 吹管路 、 特 阀门状态 、 温度显示 是否正
— —
4 — 3 —
石 河子科技
3 仪 器 与试 剂
测系统 , 调节好 流速和收集系统 , 待平衡完成 后即可使用 。 43 盐析法 分离提取麦清蛋 白 .
实验材料 : 新鲜小麦种 子、 交联 葡聚糖凝胶 G 2 一5
实验仪器 : — 0 J 10架盘药物天平 P
厂
常熟市双杰测试 仪器
常 。巡 检 记 录 应 包 括 检查 项 现象。需要将 管路卸下将探头疏 通并进行管路
凝胶过滤层析的基本操作

凝胶过滤层析的基本操作①凝胶介质的选择根据待分离蛋白质的分子量选择具有相应分离范围的凝胶。
对于未知蛋白,应选用分离范围较宽的凝胶,如用Sephacryl S-300。
对于分子量在3~5kDa的蛋白质,脱盐时应选用Sephadex G 50或G 25;而对于小分子量多肽物质(1~5kDa),脱盐则应选用Sephadex G 10或Sephadex G 15。
②凝胶介质的处理和装柱商品凝胶一般是干粉,使用前应用水溶胀。
一般情况下,1份凝胶加十份水,自然溶胀至少24小时。
溶胀后,将上清中细小的凝胶碎块弃除,重新搅拌悬起,待凝胶沉淀后,再次弃去凝胶碎块,重复数次,直到液相澄清为止。
为加速溶胀,可将凝胶煮沸一小时,该法同时具有灭菌的作用。
凝胶过滤层析柱的长与直径的比例应为50~100:1。
装柱时柱体要垂直,先在柱内加入约1/3柱床体积的水或缓冲液,然后沿柱一侧将缓冲液中的凝胶(凝胶:缓冲液=3:1)搅拌均匀,缓慢并连续地一次性注入柱内。
装柱过程中,要避免柱内缓冲液流干,注意保持柱体凝胶均匀无气泡和裂缝。
装完后,可用2 ml蓝色葡聚糖溶液检查柱体的均匀性。
如柱体均匀,可见蓝色区带均匀平稳地通过凝胶,不留任何条纹。
要保持凝胶和缓冲液温度一致,以减少气泡的产生。
③上样凝胶过滤柱层析对于样品的体积有严格的要求。
样品体积不应超过柱床体积的1~5 %,如超过5 %,则会导致分离效率降低,低于1 %则分离效率也不会提高,所以蛋白质样品应尽可能浓缩至10~20 mg/ml。
样品本身对洗脱液的相对粘度不能超过2,样品粘度过高,会使层析区带不稳定,或流速不规律,区带变宽或扭曲。
上样前样品应经0.2 μm 孔径滤膜过滤或10,000 g离心5 min,去除残渣,加样时避免破坏柱体表面,保持其表面均匀平整。
④洗脱洗脱液应保持一定的离子强度以消除凝胶中含有的游离羧基和硫酸根等与蛋白质的结合作用。
Sephadex和Sepharose CL凝胶层析所用的洗脱液的离子强度至少应为0.02 mol/L;Sephacryl凝胶应为0.05 mol/L。
用Sephadex+G-25+凝胶过滤层析脱盐和缓冲液置换应用报告
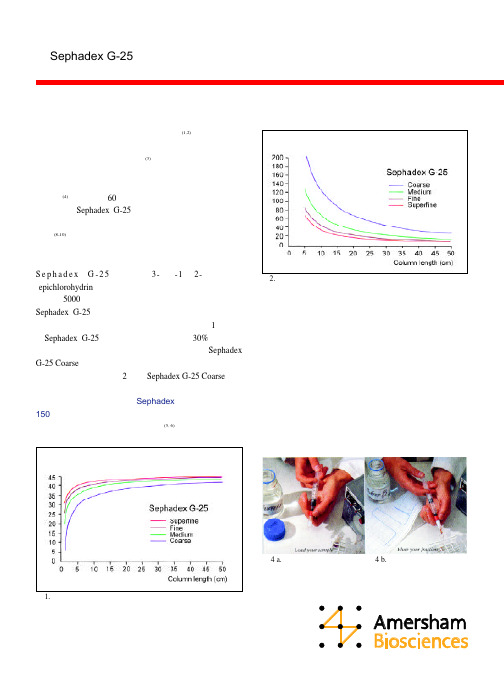
图 6. Sephadex G-25 SF从标记了 125I的胰岛素中去除胰岛素 和氯氨T。
2. 6 L生化制剂样品: 用Sephadex G-25 (超细) 填充的BPG 450柱纯化植物中抽提的过敏源,去除低分子量杂质(7)。 柱体积 25 L,样品体积可高达24% 柱体积。流速66 cm / hr。柱床高 15 cm,循环时间很短,仅 17 分钟;样品 稀释仅 1.4 倍。以上两个例子可见用 Sephadex G-25 脱 盐,短层析柱一样能达到很好的效果,并可缩短生产 周期,增加产量。
生产量(克/升,小时)
选择脱盐介质要考虑的因素
S e p h a d e x G -25 介质用带 3- 氯 -1 ,2- 环氧丙烷 (epichlorohydrin) 交联葡聚糖加工成珠状的介质。适合分 子量在 5000 以下的生物分子的脱盐及缓冲液置换工作。 Sephadex G-25 有粗、中、细、超细四种不同颗粒大小可 选择。颗粒越小分辨率越高,但流速也越慢。图1 说明不 同Sephadex G-25介质一般上样体积平均在30%柱体积左 右。样品在粒径粗的介质中更容易扩散,所以 Sephadex G-25 Coarse (粗) 的上样量在四种介质中最少。但是由于 粗颗粒介质流速快,图 2 显示 Sephadex G-25 Coarse (粗) 在每个单位时间、单位柱床体积所纯化的产品,即生产率 最高。在优化条件下,每升Sephadex 介质、每小时可达 150 克蛋白。也就是说,选择最合适的脱盐介质,主要是 要达到分辨率与生产率的最佳结合 (5, 6)。
表 1. 用Sephadex G-25大规模脱盐的例子
柱尺寸
粒度
(长×内径,厘米)
应用
上样 (%) 一次操作 参考文献 时间 (分)
凝胶过滤层析脱盐

2.点击“方法”, 打开界面,点击界 面左下方选项,分 析输入参数。
39
点击“方法”,再 点击下方的“采样 控制”,将采样结 束时间改为180分 钟,点击“采用”。
40
记录图谱 保存路径
点击“电压范 围”及“时间 范围”调整电 压值范围1~10 和时间值范围 0~10。(放大 查看)
合适型号的凝胶。蛋白质脱盐一般选用Sephadex G -25。 凝胶的前处理: 凝胶干粉在使用前需充分溶胀,并脱气。溶胀时间和方
法见上表。凝胶使用完后经处理可重新使用,而且凝胶
的价格比较昂贵,故使用完毕需回收。 层析柱的选择:当用同样体积的层析柱分离两种以上物质时,长的层析柱
比短的分辨率要高,一般理想的层析柱的直径与长度之比
36
N 2000 生化工作站使用方法:
基本的液相层析由流路系统、层析分离系统、检 测系统、数据处理系统等部分组成。在本实验中 流路系统为恒流泵、层析分离系统为层析柱、检 测系统为紫外检测仪、数据处理系统为N2000生化 工作站(包括数据采集器及N2000数据分析软件)。 数据采集器、N2000数据分析软件及电脑部分的安 装连接已经完成并编好号安放在固定的位置,使 用时注意数据线与仪器的配套。鼠标保存在教师 处,请使用者到教师处登记领取,用毕交回。
峰高
0
4
8
12
16
20
24
28
32
36
40
44
48
52
56
60
64
流速0.4
流速0.7
流速1.4
管数
9
洗脱峰收集方法:越靠近峰顶,收集液越纯。
10Leabharlann 试剂和器材主要仪器
恒流泵(点击查看操作方法) 紫外检测仪 N2000生化工作站软件 电脑
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
29
七. 回收凝胶
关闭恒流泵, 旋松密封圈调 节螺帽,取出 下端柱头,回 收杯放在柱子 下端,打开恒 流泵,等待凝 胶流出。最后 将柱头凝胶洗 入回收杯。
30
分离效果例举
基线平稳,洗脱峰又高 又窄,分离效果好。
完全分离。但峰拖尾, 说明样品有扩散。
峰之间重叠,分离 失败
31
思考题
2
凝胶 颗粒
凝 胶颗 粒
大小分子在固定相中洗脱 行为与洗脱体积示意图
固 定 相
大分子:全排阻,不能进网 小分子: 全进入 , 中等分子 :部分进入 , 孔从颗粒间隙流 洗脱体积 下, 洗脱体积Ve Vt 洗脱体积V0 分配系数 Kav = 洗脱体积 ml/min Ve Vt V0 V0
3
常用凝胶的种类及性质
下端柱头结构
密封圈调节螺帽 的作用: 旋松时密封圈 直径缩小,便于 取出;旋紧时密 封圈被压扁,直 径变大,防止柱 体漏液。
滤膜 密封圈 垫圈
密封圈调 节螺帽
17
二 . 层析柱的安装
洗净层析柱,垂直固定在柱架上:
18
层析柱的安装
旋松密封圈调节螺丝 取下柱头。检查滤膜 是否存在,将柱头装 进玻璃柱体内。
37
操 作 步 骤
将数据采集器通道1 (或通道2)的导线 按颜色分别接在紫 外检测仪背面“记 录仪”的接口上, 要接牢固。
打开电脑,双 击桌面的“N 2000 在线生化 工作站”,选 择通道,进入 工作站界面。
38
3.点击“数据采 集”,进入层析 图谱界面
1.点击“实验信 息”,输入相关 的信息
凝胶过滤层析脱盐
在进行离子交换层析纯化之前,样品要 求尽可能去除盐分子。
凝胶过滤层析简介
概念:以葡聚糖凝胶为固定相,以水溶液为流动相, 当水溶 性生物大分子通过层析柱时,根据它们分子大小不同而 进行分离的技术。
原理: 凝胶颗粒内部具有多孔网状结构, 被分离的混合物流过层析柱时,比凝 胶孔径大的分子不能进入凝胶孔内, 在凝胶颗粒之间的空隙向下移动,洗 脱体积小,最先被洗脱出来;比网孔 小的分子能不同程度的自由出入凝胶 孔内外,在柱内经过的路程较长,洗 脱体积大,最后被洗脱出来。由此达 到分离。
经丙酮沉淀后干燥的CHOM溶解时需要 一点时间,耐心搅拌溶解。 样品液体积要严格控制在20毫升以下
25
五.
加样
1.MOV
加样前确认仪器管道连接、 流速设定、分析参数等是否正 确, 基线是否平稳,然后加样:
基线平稳
1. 关闭恒流泵,关紧止水夹,剪裁 一直径略小于柱子内径的圆形滤 纸片(要求对样品无吸附作用), 放入柱内,让其自由下降紧贴在 凝胶床面。小心吸去多余的液体, 凝胶床面上留下薄薄的一层液体 即可。
12
液相层析系统的组成:
基本的液相层析由流路系统、层析分离系统、 检测系统、数据处理系统等部分组成。在本实验中: 1.流路系统: 恒流泵及输液管道 2.分离系统: 层析柱 3.检测系统: 紫外检测仪 4.数据采集处理系统: 数据采集器 N2000色谱工作站分析软件 5.输出系统: 电脑显示器及打印机
举例说明凝胶过滤层析主要应用于哪些方面。 凝胶过滤层析的哪些操作直接影响分离效果。 查资料计算:在5.0×60cm凝胶柱中脱盐时,就理论值而 言,最多加样体积是多少毫升? 凝胶过滤分离大分子的机理是什么?能否用Sephadex G75柱分离分子量为8万和10万Da的蛋白质?为什么? 在处理Sephadex时,能否剧烈搅拌,能否直接在电炉上加 热溶胀?用过的凝胶怎样保存?
0.02mol/L, pH6.5磷酸缓冲液
11
操作步骤
液相层析系统的组成……13 层析柱的结构……………15 层析柱的安装…………..18 装柱………………………20 装柱效果举例…………..23 检测仪的准备…………..24 加样………………………26 层析检测过程示意图…..28 洗脱峰收集方法………..29 凝胶回收………………..30 分离效果例举…………..31 紫外检测仪的使用………32 N 2000 生化工作站使用…35
吸水量/(ml/g)
膨胀度 溶胀时间/h (床体积)/ (常温) (ml/g)
G-10
G-25 G-50 G-75 G-100
1.0±0.1
2.5±0.2 5.8±0.3 7.5±0.5 10.0±1
2 ~ 3
4 ~ 6 9 ~ 11
3
3 3
12 ~ 15
15 ~ 20
24
72
4
分级范围的含义举例
5cm 10cm
凝胶 沉降 面 缓慢 上升
20
装
柱
不断补充凝胶,维持液面在 5cm标记线处。直到凝胶沉 降面上升到10cm标记线时, 停止加入凝胶,夹紧止水夹.
将柱子出水管道接入紫外检 测仪的进液管(接紧)。接 通恒流泵,设定流量为 1ml/min ,打开止水夹,在 此流速下用平衡液平衡柱子。 平衡时间大约2个柱体积(Vt)。
紧上 密紧 封柱 圈头 调螺 节帽 螺后 丝记 。住 旋
19
三. 装 柱
夹紧止水夹,往 柱内加入约1/3柱 体积的蒸馏水, 检查是否漏水。 打开止水夹,检 查出水是否通畅, 重新夹紧。 距柱顶端约10cm 及约5cm处画线 标记。柱口加一 小漏斗,灌入摇 匀的Sephadex G -25凝胶至5cm 标记线。 打开止水夹, 随着蒸馏水 的流出,柱 上液面下降, 柱底部凝胶 沉降面上升。
四. 检测仪器的准备
打开紫外检测仪,预热。按照“N 2000 生化工作 站使用方法”及“核酸蛋白检测仪使用方法”连 接导线、设置参数,调整好仪器。点击“基线查 看”观察基线。
24
样品的准备:
用20ml 0.02mol/L, pH6.5磷酸缓冲液溶 解CHOM沉淀。若溶解后的溶液混浊,要 用滤纸滤去不溶物。收集滤液上 Sephadex G-25凝胶层析柱脱盐。
峰高
0
4
8
12
16
20
Байду номын сангаас
24
28
32
36
40
44
48
52
56
60
64
流速0.4
流速0.7
流速1.4
管数
9
洗脱峰收集方法:越靠近峰顶,收集液越纯。
10
试剂和器材
主要仪器
恒流泵(点击查看操作方法) 紫外检测仪 N2000生化工作站软件 电脑
Ø16×400mm 层析柱
材料
试剂
葡聚糖凝胶G-25( SephadexG-25)
26
加 样 2. 用滴管将样品全部加入柱内 后,立即点击 “数据采集”。 3. 打开止水夹,样品流入柱床。 4. 待柱面样品剩下薄薄的一层 时,快速关紧止水夹。 5. 同上操作加入少量平衡液洗 下柱壁残留的样液。 6. 最后小心加入4-5厘米高度 的平衡液,上紧柱头螺帽, 启动恒流泵,开始层析。
27
返回上 级菜单
32
参考资料
赵永芳《生物化学技术原理与应用》
余冰宾《生物化学实验指导》 谢宁昌《生物化学实验多媒体教程》 以及网上免费下载的教学资料
33
紫外检测仪(核酸蛋白检测仪)使用:
面板功能键介绍
操作步骤
34
读数窗:显 示实时数值
选择280nm波长
电源开关 A调零: 基线微调 灵敏度旋 钮 工作灯
8
洗脱流速:凝胶过滤层析的分离效果对洗脱流 速很敏感。流速快,分离效果不好。但流速太 慢,也会因为样品扩散加剧而影响分离效果。 一般用1.0ml/min。适当的流速最好视具体情况 而定。
流速与分离效果、分析周期关系 柱床:1:10cm 加样体积:0.5ml
40 38 36 34 32 30 28 26 24 22 20 18 16 14 12 10 8 6 4 2 0
型号 分离范围 /Da
(球蛋白)
分子量
(球蛋白)
排阻程度/Kav
洗脱体积
洗脱顺序
G-25
1000 ~ 5000
>5000
1000 ~ 5000 <1000
完全排阻 Kav=0
部分进入 0<Kav<1 完全进入 Kav=1
V0
Ve Vt Vt=V0+Ve
最快出峰
随后出峰 最后出峰
5
凝胶过滤层析的应用
光量旋钮 在灵敏度旋钮置 T100%位置且有平衡 液流过时操作:逆 时针方向关闭,读 数窗显示0,顺时针 打开,直至读数窗 显示100 ,调好后 层析过程不得再变 动。
35
操作步骤
接通紫外检测仪电源,工作灯亮。选择波长。仪器 “灵 敏度”旋钮选择“100%T”,预热1小时以上。 将层析柱下端出水管连接检测仪的进样管道,让层析 平衡液流通。用一烧杯接着仪器出水管口。 调节“光量”旋钮,使读数窗数值显示“100”。此后, 光量旋钮不再变动。 调节“灵敏度”旋钮到0.5A位置(是具体情况选择)。 调节“A调零”旋钮,使读数窗数值显示“0”。 观察数值是否稳定,如果稳定则可开始上样。 使用完毕,直接把恒流泵的输液管接到仪器进样口, 输入蒸馏水冲洗比色池1分钟,再输入空气排尽比色池 内的水,关闭电源,在仪器使用记录本上记录使用情 况。
六. 层析检测过程示意图
样品
N2000 生化工作站 (数据采集)
计算机
(N2000分析软件)
层
光信号转为电 信号
数据处理 图谱输出
析
柱
组分 组分的分 离洗脱
紫外 检测仪
洗脱组分的 紫外吸收检测
组分流出
收集器 收集洗脱峰
28
