四大基本反应类型题目
基本反应类型

基本反应类型知识小结:1、物质化学变化中的基本反应类型有四种:分解反应:A=B+C+∙∙∙∙∙∙; 化合反应:A+B+∙∙∙∙∙∙=C ;置换反应:A+BC=AC+B ; 复分解反应:AB+CD=AD+CB 。
2、以上四种基本反应类型中特别要重视置换反应的判断。
一定要是“单质跟化合物反应生成另一种单质和化合物”,才属于置换反应。
3、不是所有的化学反应都可以用四种基本反应加以分类。
有的化学反应既可属于基本反应之一,也可能属于氧化还原反应,因为这是两种不同的分类方法。
例题分析:1、下列各反应中,不属于置换反应的是:2、下列化学反应中,既不属于化合与分解反应,也不属于置换与复分解反应的是:3、下列叙述中正确的是:A :化合反应的反应物一定是单质;B :分解反应的反应物不一定都是化合物;C :置换反应的产物中一定有金属单质;D :复分解反应的反应物都是化合物。
4、写出下列转化关系图(1)(2)(4)(6)(7)各转化反应的化学方程式,并注明反应类型。
5、写出生成物中有水的化合反应、分解反应、置换反应和复分解反应的化学方程式各一个。
提高练习:1、 下列各反应中属于置换反应的是:2、将碳酸钠晶体(Na2CO3·10H2O)加热后变成白色粉末,这个反应属于:A:分解反应;B:化合反应;C:置换反应;D:复分解反应。
、下列化学反应中既不属于分解与化合反应,也不属于置换与复分解反应的是:34、下列各反应中一定没有单质参加的反应是:A:化合反应;B:分解反应;C:置换反应;D:复分解反应。
5、写出下列各反应的化学方程式,并注明反应类型。
(1)铁片跟稀盐酸:(2)三氧化硫溶于水:(3)将碱式碳酸铜加热:(4)碳酸钠溶液跟氢氧化钙溶液混合:6、写出生成物中有二氧化碳的化合反应、分解反应、置换反应和复分解反应各一个化学反应方程式。
精编版初中四大基本反应类型练习(含答案)

初中化学四大基本反应类型一、初中常见化学反应类型归纳(1)化合反应:A、单质+ 单质→ 化合物例如:B、单质+ 化合物→ 化合物例如:C、化合物+ 化合物→ 化合物例如:D、多种物质生成一种物质例如:NH3 + CO2 + H2O =NH4HCO3(2)分解反应:A、氧化物的分解例如:B、酸的分解(含氧酸)例如:H2CO3→C、不溶性碱的分解例如:Mg(OH)2→D、某些盐的分解例如: CaCO3 →(3)置换反应A、非金属+ 金属氧化物→ 金属+ 金属氧化物例如:C、+ CuO →B、金属(H前面)+ 酸(稀盐酸、稀硫酸)→ 盐+ 氢气例如:C、金属(一般不选K、Na、Ca)+ 盐溶液→ 另一金属+ 另一种盐例如:D、水与其它单质的反应例如:2Na + 2H2O=2NaOH + H2↑,C + H2O =CO + H2(4)复分解反应A、金属氧化物+ 酸→ 盐+水例如:B、碱+ 酸→ 盐+ 水例如:C、碱+ 盐→ 另一种碱+ 另一种盐例如:D、盐+ 盐→ 两种新盐例如:E、盐+ 酸→ 另一种盐+ 另一种酸例如:二、化学反应发生的条件化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。
(1)外界条件例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温,氯酸钾分解制氧气需要加热和催化剂,像点燃、加热、高温、通电、催化剂都是外界条件。
(2)金属活动性顺序表(注重基础)A按金属活动性由强到弱的顺序写出14种常见金属的活动性顺序表。
K Ca (H)B、排在氢前面的金属置换酸中的氢生成氢气。
C、排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
(一般不使用K、Ca、Na)D、Fe与排在其后的金属的盐溶液反应也只能生成亚铁盐。
(3)复分解反应发生的条件A、反应物:在上面的复分解反应类型中C、D两类的反应物一般要求均可溶;B、生成物:一般要有或或水生成。
一、化合反应(一)、金属+ 氧气-------- 金属氧化物1、镁在空气中燃烧:2、铁在氧气中燃烧:3、铝在空气中燃烧:4、铜在空气中受热:5、汞在空气中受热:(二)、非金属+ 氧气-------- 非金属氧化物6、氢气在空气中燃烧:7、红磷在空气中燃烧:8、硫粉在空气中燃烧:9、碳在氧气中充分燃烧:10、碳在氧气中不充分燃烧:(三)、金属氧化物+ 水-------- 碱(可溶性)11、生石灰溶于水:12、氧化钠溶于水:(四)、非金属+ 水-------- 非金属氧化物13、二氧化碳和水反应:14、二氧化硫溶于水:15、三氧化硫溶于水:(五)、其他16、二氧化碳通过灼热碳层:17、一氧化碳在氧气中燃烧(煤气燃烧):18、钠在氯气中燃烧:19、氯气在氢气中点燃(共价化合物的形成、制备盐酸):20、无水硫酸铜作干燥剂:二、分解反应21、氧化汞受热分解:22、双氧水制氧气(实验室制备氧气):23、加热高锰酸钾(实验室制备氧气):24、加热氯酸钾(有少量的二氧化锰)(实验室制备氧气):25、水在直流电的作用下分解:26、碳酸不稳定而分解:27、高温煅烧石灰石(二氧化碳工业制法):28、硫酸铜晶体受热分解:29、碱式碳酸铜(铜绿)受热分解:30、碳酸氢铵受热分解(碳酸氢铵长期暴露空气中会消失):三、置换反应(一定属于氧化还原反应)(一)、金属单质+ 酸-------- 盐+ 氢气31、锌和稀硫酸反应(实验室制氢气):32、铁和稀硫酸反应:33、铝和稀硫酸反应:34、镁和稀硫酸反应:35、锌和稀盐酸:36、铁和稀盐酸:37、铝和稀盐酸:38、镁和稀盐酸:(二)、非金属单质+金属氧化物-------- 金属单质+ 水39、氢气还原氧化铜:40、氢气还原氧化铁:41、氢气还原四氧化三铁:42、木炭还原氧化铜:43、焦炭还原氧化铁:44、水蒸气通过灼热碳层:(三)、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐45、铁和硫酸铜溶液反应(湿法炼铜、镀铜原理):46、锌和硫酸亚铁溶液反应:47、锌和硫酸铜溶液反应(镀铜):48、铜和硝酸汞溶液反应:49、铜和硝酸银溶液反应(镀银):四、复分解反应(一)、碱性氧化物(金属氧化物)+酸-------- 盐+ 水50、氧化铁和稀盐酸反应:51、氧化铁和稀硫酸反应:52、氧化铜和稀盐酸反应:53、氧化铜和稀硫酸反应:54、氧化镁和稀硫酸反应:55、氧化钙和稀盐酸反应:56、氧化钠和稀盐酸反应:(二)、酸+ 碱-------- 盐+ 水【中和反应】57、盐酸和烧碱起反应:58、盐酸和氢氧化钾反应:59、盐酸和氢氧化铜反应:60、盐酸和氢氧化钙反应:61、盐酸和氢氧化铁反应:62、氢氧化铝药物治疗胃酸过多:63、硫酸和烧碱反应:64、硫酸和氢氧化钾反应:65、硫酸和氢氧化铜反应:66、硫酸和氢氧化铁反应:67、硫酸和氢氧化钡反应:68、硝酸和烧碱反应:(三)、酸+ 盐-------- 另一种酸+ 另一种盐69、石灰石(或大理石)与稀盐酸反应:70、碳酸钠与稀盐酸反应(泡沫灭火器的原理):71、碳酸镁与稀盐酸反应:72、盐酸和硝酸银溶液反应:73、硫酸和碳酸钠反应:74、硫酸和氯化钡溶液反应:(四)、碱+ 盐-------- 另一种碱+ 另一种盐75、氢氧化钠与硫酸铜:76、氢氧化钠与氯化铁:77、氢氧化钠与氯化镁:78、氢氧化钠与氯化铜:79、氢氧化钙与碳酸钠:80、氢氧化钠与硝酸铵:(五)、盐+ 盐----- 两种新盐81、氯化钠溶液和硝酸银溶液:82、硫酸钠和氯化钡:其他(不属于四种基本反应类型)(一)有机物的燃烧83、甲烷在空气中燃烧(甲烷和天然气的燃烧):84、酒精(乙醇)在空气中燃烧(氧炔焰、焊接切割金属):(二)还原剂和氧化物反应85、一氧化碳还原氧化铜:86、一氧化碳还原氧化铁:(三)酸性氧化物+碱-------- 盐+ 水87、氢氧化钠和二氧化碳反应(苛性钠暴露在空气中变质)(除去二氧化碳):88、氢氧化钠吸收二氧化硫气体(处理硫酸工厂的尾气SO2):89、氢氧化钠吸收三氧化硫气体:90、二氧化碳通过澄清石灰水(消石灰放在空气中变质)(检验二氧化碳):91、氢氧化钙(熟石灰,消石灰)吸收二氧化硫:一、化合反应(一)、金属+ 氧气-------- 金属氧化物1、镁在空气中燃烧:2Mg+O22MgO(剧烈燃烧,耀眼白光,放热,生成白色固体)2、铁在氧气中燃烧:3Fe+2O2 Fe3O4 (剧烈燃烧,火星四射,放热,生成黑色固体)3、铝在空气中燃烧:4Al+3O2 2Al2O3(银白金属变为白色固体)4、铜在空气中受热:2Cu+O22Cu(红色金属变为黑色固体)5、汞在空气中受热:2Hg+O22HgO(由银白液体,生成红色固体)(二)、非金属+ 氧气-------- 非金属氧化物6、氢气在空气中燃烧:2H2+O2 2H2O(淡蓝火焰,放热,生成使无水CuSO4变蓝的液体)7、红磷在空气中燃烧:4P+5O2 2P2O5(剧烈燃烧,放热,放出大量白烟)8、硫粉在空气中燃烧:S+O2SO2 (剧烈燃烧,放热,生成有刺激味气体;在空气中淡蓝色火焰,在氧气中蓝紫色火焰)9、碳在氧气中充分燃烧:C+O2 CO2(剧烈燃烧,发出白光,放热,生成使澄清石灰水变浑浊的气体)10、碳在氧气中不充分燃烧:2C+O22CO(三)、金属氧化物+ 水-------- 碱(可溶性)11、生石灰溶于水:CaO+H2O==Ca(OH)2 (放热)12、氧化钠溶于水:Na2O+H2O==2NaOH (放热)(四)、非金属+ 水-------- 非金属氧化物13、二氧化碳和水反应:CO2+H2O==H2CO3(二氧化碳通入紫色石蕊试液,溶液变红,说明二氧化碳溶于水显酸性)14、二氧化硫溶于水:SO2+H2O==H2SO315、三氧化硫溶于水:SO3+H2O==H2SO4(五)、其他16、二氧化碳通过灼热碳层:C+CO2 2CO17、一氧化碳在氧气中燃烧(煤气燃烧):2CO+O2 2CO2(蓝色火焰)18、钠在氯气中燃烧:2Na+Cl22NaCl(剧烈燃烧,黄色火焰)19、氯气在氢气中点燃(共价化合物的形成、制备盐酸):H2+Cl22HCl (苍白色火焰,瓶口白雾)20、无水硫酸铜作干燥剂:CuSO4+5H2O==CuSO4·5H2O (白色固体变蓝)二、分解反应21、氧化汞受热分解:2HgO2Hg+O2↑ (红色固体变为银白液体,生成使带火星木条复燃的气体)22、双氧水制氧气(实验室制备氧气):2H2O22H2O+O2↑23、加热高锰酸钾(实验室制备氧气):2KMnO4K2MnO4+MnO2+O2↑24、加热氯酸钾(有少量的二氧化锰)(实验室制备氧气):2KClO32KCl+3O2↑25、水在直流电的作用下分解:2H2O2H2↑+O2↑26、碳酸不稳定而分解:H2CO3==H2O+CO2↑27、高温煅烧石灰石(二氧化碳工业制法):CaCO3CaO+CO2↑28、硫酸铜晶体受热分解:CuSO4·5H2O CuSO4+5H2O(蓝色晶体变为白色粉末)29、碱式碳酸铜(铜绿)受热分解:Cu2(OH)2CO32CuO+H2O+CO2↑(绿色固体变黑色固体,生成使澄清石灰水变浑浊气体和使无水CuSO4变蓝的液体)30、碳酸氢铵受热分解(碳酸氢铵长期暴露空气中会消失):NH4HCO3NH3↑+H2O+CO2↑(白色固体消失,有刺激性气味的气体生成,且能使湿润的PH试纸变蓝,生成使澄清石灰水变浑浊气体)三、置换反应(一定属于氧化还原反应)(一)、金属单质+ 酸-------- 盐+ 氢气31、锌和稀硫酸反应(实验室制氢气):Zn+H2SO4==ZnSO4+H2↑32、铁和稀硫酸反应:Fe+H2SO4==FeSO4+H2↑(溶液由无色变为浅绿色)33、铝和稀硫酸反应:2Al+3H2SO4==Al2(SO4)3+3H2↑34、镁和稀硫酸反应:Mg+H2SO4==MgSO4+H2↑35、锌和稀盐酸:Zn+2HCl==ZnCl2+H2↑36、铁和稀盐酸:Fe+2HCl==FeCl2+H2↑(溶液由无色变为浅绿色)37、铝和稀盐酸:2Al+6HCl==2AlCl3+3H2↑38、镁和稀盐酸:Mg+2HCl==MgCl2+H2↑(二)、非金属单质+金属氧化物-------- 金属单质+ 水39、氢气还原氧化铜:H2+CuO Cu+H2O(黑色固体逐渐变为红色,生成使无水硫酸铜变蓝的液体)40、氢气还原氧化铁:3H2+ Fe2O32Fe+3H2O (红色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体)41、氢气还原四氧化三铁:4H2+ Fe3O43Fe+4H2O (黑色固体逐渐变为银白色,生成使无水硫酸铜变蓝的液体)42、木炭还原氧化铜:C+2CuO 2Cu+CO2↑(黑色固体逐渐变为红色,生成使澄清石灰水变浑浊的气体)43、焦炭还原氧化铁:3C+2Fe2O34Fe+3CO2↑44、水蒸气通过灼热碳层:C + H2O(g)H2+CO (产物是水煤气的主要成分)(三)、金属单质+ 盐(溶液)------- 另一种金属+ 另一种盐45、铁和硫酸铜溶液反应(湿法炼铜、镀铜原理):Fe+CuSO4==FeSO4+Cu(银白色金属表面覆盖一层红色物质)46、锌和硫酸亚铁溶液反应:Mg+FeSO4==Fe+MgSO4(溶液由浅绿色变为无色)47、锌和硫酸铜溶液反应(镀铜):Zn+CuSO4==ZnSO4+Cu(青白色金属表面覆盖一层红色物质)48、铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg49、铜和硝酸银溶液反应(镀银):Cu+2AgNO3==2Ag+Cu(NO3)2(红色金属表面覆盖一层银白色物质)四、复分解反应(一)、碱性氧化物(金属氧化物)+酸-------- 盐+ 水50、氧化铁和稀盐酸反应:Fe2O3+6HCl==2FeCl3+3H2O51、氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O(红色固体(铁锈)溶解,溶液呈黄色)52、氧化铜和稀盐酸反应:CuO+2HCl==CuCl2+H2O(黑色固体溶解、溶液呈蓝色)53、氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O(黑色固体溶解、溶液呈蓝色)54、氧化镁和稀硫酸反应:MgO+H2SO4==MgSO4+H2O(白色固体溶解)55、氧化钙和稀盐酸反应:CaO+2HCl==CaCl2+H2O(白色固体溶解)56、氧化钠和稀盐酸反应Na2O+2HCl==2NaCl+H2O(白色固体溶解)(二)、酸+ 碱-------- 盐+ 水【中和反应】57、盐酸和烧碱起反应:HCl+NaOH==NaCl+H2O58、盐酸和氢氧化钾反应:HCl+KOH==KCl+H2O59、盐酸和氢氧化铜反应:2HCl+Cu(OH)2==CuCl2+2H2O(蓝色沉淀溶解,溶液呈蓝色)60、盐酸和氢氧化钙反应:2HCl+Ca(OH)2==CaCl2+2H2O61、盐酸和氢氧化铁反应:3HCl+Fe(OH)3==FeCl3+3H2O(红褐色沉淀溶解,溶液呈黄色)62、氢氧化铝药物治疗胃酸过多:3HCl+Al(OH)3==AlCl3+3H2O63、硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O64、硫酸和氢氧化钾反应:H2SO4+2KOH==K2SO4+2H2O65、硫酸和氢氧化铜反应:H2SO4+Cu(OH)2==CuSO4+2H2O66、硫酸和氢氧化铁反应:3H2SO4+2Fe(OH)3==Fe2(SO4)3+ 6H2O67、硫酸和氢氧化钡反应:H2SO4+Ba(OH)2==BaSO4↓+2H2O(生成不溶解于稀硝酸的白色沉淀,应用于检验硫酸根)68、硝酸和烧碱反应:HNO3+NaOH==NaNO3+H2O(三)、酸+ 盐-------- 另一种酸+ 另一种盐69、石灰石(或大理石)与稀盐酸反应(二氧化碳的实验室制法,除水垢):CaCO3+2HCl==CaCl2+H2O+CO2↑70、碳酸钠与稀盐酸反应(泡沫灭火器的原理): Na2CO3+2HCl==2NaCl+H2O+CO2↑71、碳酸镁与稀盐酸反应: MgCO3+2HCl==MgCl2+H2O+CO2↑72、盐酸和硝酸银溶液反应:HCl+AgNO3==AgCl↓+HNO3(生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子)73、硫酸和碳酸钠反应:Na2CO3+H2SO4==Na2SO4+H2O+CO2↑74、硫酸和氯化钡溶液反应:H2SO4+BaCl2==BaSO4↓+2HCl(生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根)(四)、碱+ 盐-------- 另一种碱+ 另一种盐75、氢氧化钠与硫酸铜:2NaOH+CuSO4==Cu(OH)2↓+Na2SO4(蓝色沉淀生成、上部为澄清溶液)76、氢氧化钠与氯化铁:3NaOH+FeCl3==Fe(OH)3↓+3NaCl(溶液黄色褪去,有红褐色沉淀生成)77、氢氧化钠与氯化镁:2NaOH+MgCl2==Mg(OH)2↓+2NaCl(有白色沉淀生成)78、氢氧化钠与氯化铜:2NaOH+CuCl2==Cu(OH)2↓+2NaCl(溶液蓝色褪去,有蓝色沉淀生成)79、氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH80、氢氧化钠与硝酸铵:NaOH + NH4NO3 ==NaNO3+NH3↑+H2O(生成使湿润石蕊试纸变蓝色的气体,应用于检验溶液中的铵根离子)(五)、盐+ 盐----- 两种新盐81、氯化钠溶液和硝酸银溶液:NaCl+AgNO3==AgCl↓+NaNO3(生成不溶于稀硝酸的白色沉淀,常应用于检验氯离子)82、硫酸钠和氯化钡:Na2SO4+BaCl2==BaSO4↓+2NaCl(生成不溶于稀硝酸的白色沉淀,常应用于检验硫酸根)其他(不属于四种基本反应类型)(一)有机物的燃烧83、甲烷在空气中燃烧(甲烷和天然气的燃烧):CH4+2O2CO2+2H2O(蓝色火焰,放热,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体)84、酒精(乙醇)在空气中燃烧(氧炔焰、焊接切割金属):C2H5OH+3O22CO2+3H2O (蓝色火焰,放热,有黑烟,生成使石灰水变浑浊气体和使无水CuSO4变蓝的液体)(二)还原剂和氧化物反应85、一氧化碳还原氧化铜:CO+CuO Cu+CO286、一氧化碳还原氧化铁:3CO+Fe2O32Fe+3CO2 (黑色固体逐渐变红色,生成使澄清石灰水变浑浊的气体)(三)酸性氧化物+碱-------- 盐+ 水87、氢氧化钠和二氧化碳反应(苛性钠暴露在空气中变质)(除去二氧化碳):2NaOH+CO2==Na2CO3+H2O88、氢氧化钠吸收二氧化硫气体(处理硫酸工厂的尾气SO2):2NaOH+SO2==Na2SO3+H2O89、氢氧化钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O90、二氧化碳通过澄清石灰水(消石灰放在空气中变质)(检验二氧化碳):Ca(OH)2+CO2==CaCO3↓+H2O91、氢氧化钙(熟石灰,消石灰)吸收二氧化硫:Ca(OH)2+SO2==CaSO3↓+H2O。
四大基本反应类型
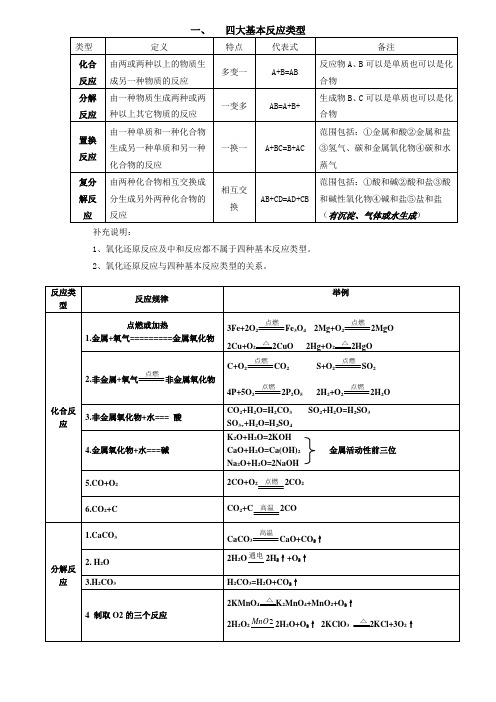
CO2+H2O=H2CO3SO2+H2O=H2SO3
SO3++H2O=H2SO4
4.金属氧化物+水===碱
K2O+H2O=2KOH
CaO+H2O=Ca(OH)2金属活动性前三位
Na2O+H2O=2NaOH
5.CO+O2
2CO+O2 2CO2
6.CO2+C
CO2+C 2CO
2、氧化还原反应与四种基本反应类型的关系。
反应类型
反Hale Waihona Puke 规律举例化合反应点燃或加热
1.金属+氧气=========金属氧化物
3Fe+2O2 Fe3O42Mg+O2 2MgO
2Cu+O2 2CuO 2Hg+O2 2HgO
2.非金属+氧气 非金属氧化物
C+O2 CO2S+O2 SO2
4P+5O2 2P2O52H2+O2 2H2O
复分解反应
1.酸+碱=盐+H2O
NaOH+HCl=NaCl+H2O Ca(OH)2+2HCl=CaCl2+2H2O
Ba(OH)2+H2SO4=BaSO4↓+2H2O
2.酸+盐=新酸+新盐
Na2CO3+2HCl=2NaCl+H2O+CO2↑
NaHCO3+HCl= NaCl+H2O+CO2↑
CaCO3+2HCl= CaCl2+H2O+CO2↑
3.盐+盐=新盐+新盐
初中化学四大基本反应类型

初中化学考点——四大基本反应类型四大基本反应类型是:化合反应、分解反应、置换反应、复分解反应一、化合反应:由两种或两种以上的物质生成另一种物质的反应,叫化合反应1、非金属单质与氧气生成非金属氧化物。
如2H2+O2点燃H2O2、金属与氧气反应生成金属氧化物。
如3Fe+2O2点燃Fe3O43、金属氧化物与水反应,生成相应的碱。
如CaO+H2O= Ca(OH)2注:K2O、Na2O、BaO、CaO能与水反应,生成相应的碱,其他不能。
4、非金属氧化物与水反应,生成相应的酸。
如CO2+H2O= H2CO3注:能发生此反应的非金属氧化物有CO2、SO2、SO35、其它如2CO+ O2点燃2CO2二、分解反应:由一种物质生成两种或两种以上其他物质的化学反应叫做分解反应。
1、不溶性碳酸盐高温分解如CaCO3高温CaO+CO2↑2、不溶性碱受热分解如Cu(OH)2△CuO + H2O注:除KOH、NaOH、Ba(OH)2之外,都能分解生成相应的氧化物和水3、某些酸式盐受热分解(了解)如 2NaHCO3=====Na2CO3+CO2↑+H2O4、某些碱式盐受热分解(了解)如 Cu2(OH)2CO3△ 2CuO+CO2↑+H2O其它如:水的电解、双氧水分解、高锰酸钾受热分解、氯酸钾受热分解三、置换反应:一种单质和一种化合物生成另一种单质和另一种化合物的反应叫做置换反应。
1、活泼金属与酸反应(金属为金属活动顺序中氢以前的金属,酸不包括浓硫酸和硝酸)例如:Fe+2HCl=FeCl2+H2↑Mg+ 2HCl = MgCl2+ H2↑H2SO4 + Fe = FeSO4+ H2↑2HCl + Zn = ZnCl2 + H2↑ H2SO4 + Zn = ZnSO4+ H2↑注:这里的酸,一般只稀盐酸和稀硫酸。
硝酸与金属反应不生成氢气。
2、金属与盐反应,生成新盐与新金属。
盐(含较不活泼金属)+金属(较活泼)——金属(较不活泼)+盐(含较活泼金属)例如:Fe+CuSO4===FeSO4+Cu 2AgNO3+ Cu= Cu(NO3)2 +2 Ag注:反应物中的盐须溶于水,金属须比盐中金属活泼,钾、钙、钠三种金属不跟盐溶液发生置换反应。
初中化学四大基本反应类型

初中化学四大基本反应类型一、化合反应1、镁在空气中燃烧:2Mg + O2 =点燃= 2MgO现象:(1)发出耀眼的白光(2)放出热量(3)生成白色粉末2、铁在氧气中燃烧:3Fe + 2O2 =点燃= Fe3O4现象:(1)剧烈燃烧,火星四射(2)放出热量(3)生成一种黑色固体注意:瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底。
3、铜在空气中受热:2Cu + O2 =△= 2CuO 现象:铜丝变黑。
4、铝在空气中燃烧:4Al + 3O2 =点燃= 2Al2O3现象:发出耀眼的白光,放热,有白色固体生成。
5、氢气中空气中燃烧:2H2 + O2 =点燃= 2H2O现象:(1)产生淡蓝色火焰(2)放出热量(3)烧杯内壁出现水雾。
6、红(白)磷在空气中燃烧:4P + 5O2 =点燃= 2P2O5现象:(1)发出白光(2)放出热量(3)生成大量白烟。
7、硫粉在空气中燃烧:S + O2 =点燃= SO2现象:A、在纯的氧气中发出明亮的蓝紫火焰,放出热量,生成一种有刺激性气味的气体。
B、在空气中燃烧(1)发出淡蓝色火焰(2)放出热量(3)生成一种有刺激性气味的气体。
8、碳在氧气中充分燃烧:C + O2 =点燃= CO2现象:(1)发出白光(2)放出热量(3)澄清石灰水变浑浊9、碳在氧气中不充分燃烧:2C + O2 =点燃= 2CO10、二氧化碳通过灼热碳层:C + CO2 =高温= 2CO(是吸热的反应)11、一氧化碳在氧气中燃烧:2CO + O2 =点燃= 2CO2现象:发出蓝色的火焰,放热,澄清石灰水变浑浊。
12、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):CO2 + H2O === H2CO3现象:石蕊试液由紫色变成红色。
注意:酸性氧化物+水→酸如:SO2 + H2O === H2SO3 SO3 + H2O === H2SO4 13、生石灰溶于水:CaO + H2O === Ca(OH)2(此反应放出热量)注意:碱性氧化物+水→碱氧化钠溶于水:Na2O + H2O =2NaOH氧化钾溶于水:K2O + H2O=2KOH氧化钡溶于水:BaO + H2O=Ba(OH)214、钠在氯气中燃烧:2Na + Cl2=点燃= 2NaCl15、无水硫酸铜作干燥剂:CuSO4 + 5H2O ==== CuSO4•5H2O二、分解反应:1、水在直流电的作用下分解:2H2O= 通电= 2H2↑+ O2 ↑现象:(1)电极上有气泡产生。
精编版初中四大基本反应类型练习(含答案)

(2)金属活动性顺序表(注重基础)
A 按金属活动性由强到弱的顺序写出 K Ca
14 种常见金属的活动性顺序表。 (H)
B、排在氢前面的金属置换酸中的氢生成氢气。
C、排在前面的金属能把排在后面的金属从它的盐溶液中置换出来。
(一般不使用
Na)
D、 Fe 与排在其后的金属的盐溶液反应也只能生成 亚铁盐 。
A 、 金属氧化物 + 酸 → 盐 + 水 例如:
B、 碱 + 酸 → 盐 + 水 例如: C、 碱 + 盐 → 另一种碱 + 另一种盐 例如:
D、 盐 + 盐 → 两种新盐 例如: E、 盐 + 酸 → 另一种盐 + 另一种酸 例如: 二、化学反应发生的条件 化学反应能否发生与反应物质本身的性质(内因)和外界条件(外因)有关。 (1)外界条件 例如,燃烧需要点燃,氢气还原氧化铜需要加热,水分解需要通电,碳酸钙分解需要高温, 氯酸钾分解制氧气需要加热和催化剂,像点燃、加热、高温、通电、催化剂都是外界条件。
(二)、非金属 + 氧气 -------- 非金属氧化物 6、氢气在空气中燃烧: 7、红磷在空气中燃烧: 8、硫粉在空气中燃烧: 9、碳在氧气中充分燃烧: 10、碳在氧气中不充分燃烧:
(三)、金属氧化物 + 水 -------- 碱(可溶性) 11、生石灰溶于水: 12、氧化钠溶于水:
(四)、非金属 + 水 -------- 非金属氧化物 13、二氧化碳和水反应: 14、二氧化硫溶于水: 15、三氧化硫溶于水:
初中化学四大基本反应类型
四种基本反应类型
化合反应 由两种或两种以上的
定 物质生成另
种物
义 质的反应。
四大基本反应类型附实例--简单易记
类型
定义
代表式
特者两种以上的物质,生成另一种物质的反应
A+B→C
多变一
可能变化
(就某些反应中某些元素而言)
反应物A、B
即可代表单质,
又可代表化合物
;A、B为单质
CO2+H2O=H2CO3;NH3+HCl=NH4Cl
A、B为化合物
分解反应
由一种物质生成两种或者两种以上其他物质的反应
A→B+C
一变多
可能变化
(就某些反应中某些元素而言)
生成物中的B、C
即可代表单质,
又可代表化合物
;B、C为单质
;H2CO3=CO2+H2O
B、C为化合物
置换反应
由一种单质跟一种化合物反应生成另一种单质和另一种化合物的反应
A+BC→
B+AC
一换一
肯定变化
(就所有反应中某些元素而言)
A、B必为单质
反应范围:
金属和酸金属和盐氢气碳和金属氧化物碳和水蒸气co2cucuo2c2高温fe2hclh2fecl2feh2so4h2feso4ab必为单质bcac必为化合物复分解反应有两种化合物互相交换成分生成另外两种化合物的反应abcdadcb互相交换肯定不变就所有反应所有反应中所有元素所有元素而言反应物生成物均为化合物反应范围
①金属和酸
②金属和盐
③氢气、碳和金属氧化物
④碳和水蒸气
Fe+2HCl=H2↑+FeCl2
Fe+H2SO4=H2↑+FeSO4
A、B必为单质,BC、AC必为化合物
复分解反应
有两种化合物互相交换成分,生成另外两种化合物的反应
四大基本反应类型题目
四大基本反应类型一、判断下列物质能否反应,能反应则写出化学反应方程式铁和盐酸铜和盐酸氧化铜和硫酸氧化钙和水氧化铜和水氧化钠和水铜和氧化铁碳和氧化铁碳和氧化铜氧化铜和氢气硫酸铜和盐酸碳酸钙和盐酸氯化钡和硫酸氯化钡和盐酸二氧化碳和烧碱二氧化碳和澄清石灰水硝酸和硫酸钡盐酸和碳酸钙硫酸和纯碱火碱和氯化钠苛性钠和氯化铜硝酸银和盐酸盐酸和氢氧化铁硝酸银和硫酸氢氧化钡和硫酸铜二、判断下列物质能否发生转化,能转化则写出化学方程式铁转化成氯化铁铜氯化铜镁氯化镁氧化铜铜氧化铜氢氧化铜氧化钙氢氧化钙氧化铜氯化铜氯化钡硫酸钡碳酸纳二氧化碳碳酸钠氯化钠三、完成下列习题1.下列反应,属于复分解反应的是()A.2Fe2O3+3C 高温4Fe+3CO2↑B.3Fe+2O点燃Fe3O4C.H2CO3 = H2O+CO2↑D.K2CO3+CaCl2 = CaCO3↓+2KCl2.下列化学反应属于化合反应的是()A.C+O2点燃CO2B.Zn+2HCl = ZnCl+H2↑C.C+2CuO 高温2Cu+CO2↑D.CaCO高温CaO+CO2↑3.下列化学反应属于置换反应的是()A.NaOH+HCl = NaCl+H2OB.CO+CuO △Cu+CO2C.Zn+H2SO4=ZnSO4+H2↑D.CuO+H2SO4=CuSO4+H2O4.下列化学反应中,属于分解反应的是()A.2H2+O点燃2H2OB.2KMnO4△K2Mn4+MnO2+O2↑C.Fe2O3+3CO高温2Fe+3CO2D.CaCO3+2HCl=CaCl2+CO2↑+H2O5、 在H 2SO 4 、O 2 、Fe 、H 2O 、Ca(OH)2 中选择适当的物质按要求写方程式:(1) 化合反应_______________________________________________________________; (2) 分解反应_______________________________________________________________; (3) 置换反应______________________________________________________________ ; (4) 复分解反应____________________________________________________________。
化学四大基本反应类型
一、知识梳理1.化学基本反应类型化合反应:多变一的反应分解反应:一变多的反应置换反应:A+BC → B+AC复分解反应:AB+CD → AD+CBII置换反应的发生与否,取决于金属活动性顺序,强者置换弱者金属活动性顺序K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au 活动性顺序逐渐减弱3.氧化还原反应凡是有化合价变化这一特征的反应都是氧化还原反应。
【说明】氧化还原反应不属于化学四大基本反应类型化合反应:多变一的反应可能是分解反应:一变多的反应氧化还原反应置换反应:A+BC → B+AC 一定是复分解反应:AB+CD → AD+CB 一定不是【注】a.化合价降低的物质是氧化剂,具有氧化性,发生还原反应。
b.化合价上升的物质是还原剂,具有还原性,发生氧化反应。
c.有单质生成的分解反应一定是氧化还原反应。
d.有单质参与反应的化合反应一定是氧化还原反应。
二、例题精讲例1、X、Y、Z是三种金属,根据下列有关方程式可知,三金属的活动性正确的是( ) A.Z+YSO4→ZSO4+Y B. X+YSO4→XSO4+YC. Z+H2SO4→ZSO4+H2D. X+H2SO4不反应A X>Y>ZB Z>Y>XC Z>X>YD X>Z>Y【举一反三】1.有X、Y、Z、W四种金属,已知用X制的容器不能盛放Z的盐溶液,X与Y的盐溶液不反应,只有W在自然界中能以单质的形式存在。
这四金属的活动性正确的是()A Z>Y>X>WB X>Z>Y>WC Y>X>Z>WD Y>Z>X>W例2、对于有单质和化合物生成的反应,有下列几种说法:①一定是置换反应②可能是分解反应③一定是分解反应④可能是化合其中正确的说法是()A ②B ②④C ③④D ②③例3、下列方法①金属溶于酸②碳酸盐溶于酸③氧化物溶于碱④氢氧化物溶于水⑤氧化物溶于水。
肯定得不到盐的是()A ①②B ④⑤C ③④⑤D 只有④例4、以镁为原料(其它反应物自选),依次按照下列反应类型写出反应的方程式,且要求前一个反应的生成物之一为下一个反应的反应物之一。
(完整版)初一化学四大化学反应类型练习题
(完整版)初一化学四大化学反应类型练习题初一化学四大化学反应类型练题 (完整版)一、选择题1. 下列哪一项是化学反应中产生新物质的重要特征?A. 物质的颜色变化B. 物质的形状变化C. 物质的质量变化D. 物质的温度变化2. 氧气和氢气燃烧生成的产物是:A. 水B. 二氧化碳C. 氨气D. 氮气3. 铁片放入盐酸中产生的气体是:A. 氧气B. 氢气C. 二氧化碳D. 氯气4. 青蛙进入氧气中会发生的变化是:A. 青蛙会变绿B. 青蛙会溶解C. 青蛙会叫得更大声D. 青蛙会更活跃5. 空气中二氧化碳的浓度增加会引发的环境问题是:A. 大气温度下降B. 水中鱼类减少C. 植物生长增加D. 地震活动增多二、判断题1. 燃烧是一种化学反应:√2. 溶解是一种化学反应: ×3. 酸和碱反应产生盐和水:√4. 浓度越大的酸越弱: ×5. 金属与非金属反应会生成盐:√三、填空题1. 氧气的化学符号是____。
2. 氢气与氧气反应生成____。
3. 酸性溶液的pH值小于____。
4. 铁放入水中会____。
四、简答题1. 请简要解释化学反应的定义和特征。
2. 举例说明一种酸和碱的反应产物是什么。
3. 铁锈是如何形成的?4. 什么是氧化反应和还原反应?举例说明。
请根据题目给出的选项选择正确答案,并在填空题和简答题上填写出正确的答案。
答题时,仅填写答案序号或填写对应的答案即可。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
四大基本反应类型一、判断下列物质能否反应,能反应则写出化学反应方程式
铁和盐酸
铜和盐酸
氧化铜和硫酸氧化钙和水氧化铜和水氧化钠和水铜和氧化铁碳和氧化铁碳和氧化铜氧化铜和氢气硫酸铜和盐酸碳酸钙和盐酸氯化钡和硫酸氯化钡和盐酸
二氧化碳和烧碱
二氧化碳和澄清石灰水硝酸和硫酸钡
盐酸和碳酸钙
硫酸和纯碱
火碱和氯化钠
苛性钠和氯化铜
硝酸银和盐酸
盐酸和氢氧化铁
硝酸银和硫酸
氢氧化钡和硫酸铜
二、判断下列物质能否发生转化,能转化则写出化学方程式
铁转化成氯化铁铜氯化铜
镁氯化镁
氧化铜铜
氧化铜氢氧化铜氧化钙氢氧化钙氧化铜氯化铜氯化钡硫酸钡碳酸纳二氧化碳碳酸钠氯化钠
三、完成下列习题
1.下列反应,属于复分解反应的是()
A.2Fe2O3+3C 高温4Fe+3CO2↑
B.3Fe+2O2点燃Fe3O4
C.H2CO3 = H2O+CO2↑
D.K2CO3+CaCl2 = CaCO3↓+2KCl
2.下列化学反应属于化合反应的是()
A.C+O2点燃CO2
B.Zn+2HCl = ZnCl+H2↑
C.C+2CuO 高温2Cu+CO2↑
D.CaCO3高温CaO+CO2↑
3.下列化学反应属于置换反应的是()
A.NaOH+HCl = NaCl+H2O
B.CO+CuO △Cu+CO2
C.Zn+H2SO4=ZnSO4+H2↑
D.CuO+H2SO4=CuSO4+H2O
4.下列化学反应中,属于分解反应的是()
A.2H2+O点燃2H2O
B.2KMnO4△K2Mn4+MnO2+O2↑
C.Fe2O3+3CO高温2Fe+3CO2
D.CaCO3+2HCl=CaCl2+CO2↑+H2O
5、 在H 2SO 4 、O 2 、Fe 、H 2O 、Ca(OH)2 中选择适当的物质按要求写方程式:
(1) 化合反应_______________________________________________________________;
(2) 分解反应_______________________________________________________________;
(3) 置换反应______________________________________________________________ ;
(4) 复分解反应____________________________________________________________。
6、下列反应中,不属于四个基本反应类型的反应是( )
A Zn + 2AgNO 3 ==Ag + Zn(NO 3)2 ;
B Cu 2O + CO == 2Cu + CO 2 ;
C 2Mg + O 2 == 2MgO ;
D Fe 2O 3 + 6HC l ==2FeC l 3 + 3 H 2O
7、在同一容器内有X 、Y 、Z 、Q 四种物质,在合适的条件下反应,反应前后各物质的质量如表,该反应属于( )
A 化合反应 ;
B 分解反应
C 置换反应 ;
D 复分解反应。
8、在一个密闭的容器内
有X 、Y 、Z 、Q 四种物
质,在一定条件下充分
反应,测得反应前后的
各物质的质量如下:
试推断该密闭容器中发生的化学反应基本类型为( )
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
9、判断下列物质之间能否发生置换反应,能的写出方程式,不能反应的简述原因。
Mg + H 2SO 4
Cu + H 2SO 4 Hg + HC l Al +HCl Fe + Hg(NO 3)2
Ag + CuSO 4 10.下列复分解反应不能发生的是( )
A.NaNO3和KCl
B.Na2CO3和HCl
C.BaCl2和H2SO4
D.HNO3和Ca(OH)2
11、判断下列物质之间能否发生复分解反应,能反应的写出反应化学方程式:
KNO 3 + HCl
KCl + Na 2CO 3 NaOH + K 2SO 4 CaC l 2 + K 2CO 3
12.分别将下列各组物质,同时放入水中,能发生复分解反应的是( )
A.氯化钠和硫酸钾
B.硫酸铜和氢氧化铁
C.碳酸钠和氯化钡
D.氯化钠和硝酸钾
13.下列每一组内各物质两两间均能发生化学反应的是( )
A.硫酸铜溶液、碳酸钠溶液、石灰水
B.碳酸钙、盐酸、铝
C.氯化铁、稀硫酸、氯化钠溶液
D.氯化铜溶液、硝酸银溶液、硫酸钠溶液
14、最近中国科学家以二氧化碳和金属钠为原料,在高温高压条件下成功制成了金刚石,同时生成了氧化钠,首次实现了从二氧化碳到金刚石的逆转变。
写出该反应的方程式
__________________________________,并指出反应的基本类型_________________。
15.用化学方法制备高纯硅的反应原理是:SiCl4+2H2高温Si+4HCl ,该反应属于( )
A.化合反应
B.置换反应
C.分解反应
D.复分解反应
16、下列物质之间可以发生多少个化学反应?并写出能发生的反应的化学方程式
Fe 、Cu 、HC l 、CO 2、Fe 2O 3、Cu(NO 3)2、Ca(OH)2
17、通过下列反应,一定有单质生成的是( )
A .化合反应
B .分解反应
C .置换反应
D .复分解反应
18、下列各类反应中,反应物和生成物均无单质的是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
19、海藻中含有丰富的NaI ,用氯气(Cl2)从中提取碘(I2)时可利用反应2NaI+Cl2==2NaCl+I2,这一反应属于( )
A.分解反应
B.化合反应
C.置换反应
D.复分解反应
20、下列有关化学反应的基本类型的说法正确的是( )
A .反应物有多种的反应是化合反应
B .生成物有多种的反应是分解反应
C .两种化合物相互交换成分,生成另两种化合物的反应是复分解反应
D .生成物中一种是单质,另一种是化合物的反应就是置换反应
21.火柴头上主要含有氯酸钾、二氧化锰、硫磺和玻璃粉等。
火柴杆上涂有少量的石蜡(化学式为C25H32)。
火柴盒两边的摩擦层是由红磷和玻璃粉调和而成的。
火柴头在火柴盒上划动时产生的热量使磷燃烧,放出的热量使氯酸钾分解,产生的氧气与硫反应,放出的热量使石蜡引燃,最终使火柴杆着火,请按先后顺序依次写出有关的反应方程式:
(1)_________________________ ; (2)_______________________
(3)_________________________ ; (4)________________________
在上述的反应中,不属于化学反应的基本反应类型的是(填序号,下同)___________; 属于化合反应的是___________________;属于分解反应的是_____________________。
22、右图是某个化学反应前、后的微观模拟图。
请根据图
示回答:
① 该化学反应中,参加反应的和与反应后生成
的各粒子间的个数比为_________;
②该反应的基本反应类型为____________;
③该反应中的生成物________(填“可能”或“不可能”)属于氧化物。
23、由A 、B 、C 、D 四种元素组成的单质或化合物相互间可以发生如下反应:
①2B 2C===B 2↑+C 2↑②A+2BD==AD 2+B 2↑③3A+2C 2===A 3C 4④A(CB)2+2BD==AD 2+2B 2C
其中属于置换反应的是( )
A.①②
B.②
C.③④
D.④
通电。
