病毒灭活苗制作过程
vero细胞灭活疫苗生产流程

vero细胞灭活疫苗生产流程Vero细胞灭活疫苗是一种常见的疫苗制备方法,以下是其生产流程的相关参考内容:第一步:病毒分离和培养首先,需要从感染病人体内或其他受感染物质中分离出目标病毒株。
这可以通过对病人样本进行处理、传代和筛选得到。
然后,将所得病毒株接种到一种称为Vero细胞的培养物中,这是一种来自非洲绿猴肾脏的细胞系。
第二步:病毒扩增和收获在与Vero细胞的培养中,病毒将感染并复制。
在感染发生后的一定时间内,细胞培养物中会积累大量病毒颗粒。
这时,通过监测病毒的生长曲线和细胞的病毒感染率,确定合适的时间点进行收获。
第三步:病毒灭活收获病毒后,需要对其进行灭活处理,以确保疫苗的安全性。
常见的灭活方法包括化学灭活和物理灭活。
化学灭活是通过加入一种化学物质,如甲醛或β-晶状糖蛋白醛缩合物,来破坏病毒颗粒的结构和功能。
物理灭活可以通过热处理或放射线照射来破坏病毒核酸或蛋白质。
第四步:疫苗制剂的形成灭活后的病毒需要与其他辅助成分结合形成疫苗制剂。
这些成分可能包括佐剂(如氢氧化铝)、防腐剂(如2-苯氧乙醇)、稳定剂(如蔗糖)和缓冲剂(如磷酸盐缓冲液)。
添加这些成分有助于提高疫苗的稳定性、抗原性和保存性能。
第五步:疫苗包装制剂后的疫苗需要进行包装,以确保其在运输和储存过程中的稳定性。
通常,疫苗会被分装到玻璃瓶或注射器中,并在包装过程中进行灭菌处理。
在包装和存储过程中,疫苗需要控制在适当的温度范围内,以保持疫苗的活性。
第六步:质检和批准在疫苗生产的每个阶段都需要进行质量控制和质检。
这包括对感染病毒、灭活处理、制剂和包装进行测试,以确保疫苗的纯度、安全性和有效性。
只有通过了全面的质检和评估流程后,疫苗才能获得相关的批准和上市许可。
总结:以上就是Vero细胞灭活疫苗生产流程的相关参考内容。
这个流程涵盖了病毒分离和培养、病毒扩增和收获、病毒灭活、疫苗制剂的形成、疫苗包装以及最终的质检和批准过程。
这些步骤共同确保了疫苗制备的安全性和有效性,并为疾病的预防和控制提供了可靠的工具。
病毒灭活苗制作过程

病毒灭活苗制作过程随着生物工程技术和生物化学、分子生物学的发展,兽用生物制品的动物疫苗种类,类型上均有重要的进展,各种新疫苗不断研制成功。
大体分为:灭活疫苗、弱毒疫苗、单价疫苗、多价疫苗、混合疫苗、同源疫苗、亚单位疫苗、基因工程疫苗。
灭活疫苗:又称死疫苗。
将细菌或病毒利用物理的或化学的方法处理,使其丧失感染性或毒性,而保持免疫原性,接种动物后能产生主动免疫的一类生物制品。
灭活疫苗分为组织灭活疫苗、培养物灭活疫苗。
其特点是:易于保存运输,疫苗稳定,便于制备多价或多联苗。
其缺点是:注射剂量大,多次注射,不产生局部免疫力。
弱毒疫苗:又称活疫苗。
微生物的自然强毒株通过物理的、化学的和生物的方法,使其对原宿主动物丧失致病力,或引起亚临床感染,但以保持良好的免疫原性、遗传特性的毒株用以制备的疫苗,此外,也有从自然界筛选的自然毒株,同样有人工育成弱毒株的遗传特性,同样可以制备弱毒疫苗,如:鸡新城疫LaSota疫苗。
灭活疫苗和弱毒疫苗的利和害,发展重与轻,学者历来都有争论,现将两者的优缺点简介见灭活疫苗与弱毒活疫苗比较灭活疫苗优点:比较安全,不发生全身性副作用,不出现返祖现象,有利于制备多价多联的混合疫苗;制品稳定,受外界条件影响小,有利于运输保存。
缺点接种次数多,剂量多而大,免疫途径必须注射,不产生局部免疫,需要高浓度抗原物质,生产成本高。
弱毒活疫苗优点:一次免疫接种即可成功,可采取自然感染途径接种(如注射、滴鼻、饮水、喷雾、划痕等),可引起整个免疫应答,产生广普性免疫及局部和全身性抗体,免疫持久,有利于消除局部野毒,产量高,生产成本低。
缺点: 残毒在自然界动物群体中持续传递后毒力有增强返祖危险,疫苗中存在的污染毒有可能扩散;存在不同抗原的干扰现象,从而影响免疫效果;要求在低温条件下运输储存。
单(价)疫苗:利用同一种微生物菌(毒)株或同一种微生物中的单一血清型的菌(毒)株增殖培养物制备的疫苗称为单(价)疫苗。
佐剂及灭活疫苗的制作

佐剂及灭活疫苗的制作一、选取病毒株在制备灭活疫苗时,需要选择合适的病毒株。
通常情况下,选择病毒株需要考虑以下几个方面:病毒的毒力、流行性和稳定性等。
二、繁殖病毒繁殖病毒是生产灭活疫苗的关键步骤之一、病毒可以在细胞培养物中繁殖,通常选择猴肾细胞等。
此外,还可以使用鸡胚等进行病毒繁殖。
三、灭活病毒通过将繁殖好的病毒暴露于灭活剂,如甲醛、β-普鲁兰、二乙二硫磷等,可以灭活病毒。
灭活剂的选择需要考虑到其能够有效灭活病毒同时又不破坏病毒表面抗原。
四、纯化病毒将灭活的病毒经过纯化处理,可以去除不必要的杂质,提高灭活疫苗的纯度。
常用的方法有超速离心、凝胶过滤和柱层析等。
五、选择佐剂佐剂是用于增强灭活疫苗的免疫原性的物质。
常见的佐剂有铝盐和油水乳剂等,它们可以激活免疫系统,促进抗原的吸收和提高抗原的持久性。
六、灭活疫苗将灭活的病毒与佐剂混合后,可以制备灭活疫苗。
灭活疫苗在注射给人体后,通过刺激免疫系统产生抗体和记忆性T细胞等免疫应答,从而提高人体对病毒的免疫能力。
七、灭活疫苗的质量控制灭活疫苗的质量控制是确保疫苗安全有效的重要环节。
常见的质量控制方法有:病毒滴度测定、病毒变异性测定、灭活效果检测、病毒残留测定等。
总结起来,制作灭活疫苗主要包括选取合适的病毒株、繁殖病毒、灭活病毒、纯化病毒、选择佐剂、灭活疫苗以及进行质量控制等一系列步骤。
这些步骤的顺序和操作方法都需要精确控制,以确保最终产品的质量和安全性。
同时,不同的灭活疫苗也可能会有一些差异性,因此实际制备时需要根据具体的病毒株和制备工艺进行调整。
灭活疫苗的的生产工艺过程

灭活疫苗的的生产工艺过程
灭活疫苗的生产工艺过程通常包括以下几个步骤:
1. 病毒培养:首先,科学家们需要大量培养目标病毒株。
病毒通常在细胞培养基中培养,并提供营养物质以促进其繁殖。
培养时间和条件会因不同的病毒而有所不同。
2. 病毒灭活:培养的病毒需要被灭活,以防止在接种过程中引发疾病。
病毒可以通过热处理、化学处理或辐射等方法进行灭活。
灭活后的病毒仍能保留其免疫原性,但不再有致病能力。
3. 病毒纯化:接下来,灭活的病毒需要经过纯化过程,以去除其他细胞残渣和杂质。
纯化常常包括离心、滤过和超速离心等步骤,以分离病毒颗粒。
4. 抗原浓缩:疫苗中的病毒抗原需要进行浓缩,以提高疫苗的效力。
这一步骤可以通过离心、滤过或柱层析等技术实现。
5. 疫苗制剂:浓缩的病毒抗原需要与适当的辅助物质(如佐剂)混合,以增强免疫反应。
这些辅助物质通常包括佐剂、防腐剂和稳定剂等,以保护病毒抗原不受破坏。
6. 疫苗填充和包装:最后,疫苗需要被装入适当的容器中,如玻璃瓶或注射器。
疫苗容器需要经过严格的无菌处理,以确保疫苗不受细菌或其他微生物的污染。
需要注意的是,不同类型的灭活疫苗在生产工艺上可能会有所差异。
灭活疫苗的生产需要严格遵循相关的质量管理体系和生物安全规定,确保疫苗的质量和安全性。
病毒性疫苗制造技术

病毒性疫苗制造技术任务一灭活苗的制造流程菌种的选择(强毒株) → 菌液培养→ 灭活↓↓配苗(5份菌液+1份铝胶配苗) ←浓缩工序一菌种与种子培养选取毒力强、免疫原性好的1~3个品系菌株,按规定定期复壮和鉴定,将合格菌种增殖培养并经无菌检验、活菌计数达到标准后作为种子液。
种子液保存于2~8℃冷暗处,在有效期内用于菌苗生产种子使用。
大肠杆菌病的菌种应采集动物心血、腹水、肝渗出物、气囊附着物或正常动物的肠道内容物作为接种物。
如用含大肠杆菌的病料,首先对大肠杆菌进行分离、鉴定,符合要求方可作为菌种使用。
工序二菌液的培养用于规模化细菌培养的方法很多,有手工式、机械化或自动化等方式。
可供菌体培养的方法有:固体表面培养法、液体静置培养法、液体深层通气培养法和透析培养法。
一般固体培养易获得高浓度细菌悬液,含培养基成分少,易稀释成不同的浓度,但生产量较小。
因此,大量生产疫苗时常用液体培养法。
实例大肠杆菌的菌液培养方法(1).将生化结果典型的菌种接种于伊红美兰琼脂平板或麦康凯琼脂平板上,置37℃温箱中培养18~24h,挑取单个典型菌落接种于琼脂斜面,置37℃温箱中培养18~24h,经显微镜检查无杂菌污染者,即可作为种子培养物。
(2).取5ml马丁肉汤加入琼脂斜面洗下菌苔作为一级种子,用灭菌吸管按5%的量将一级种子接种于马丁肉汤中,置37℃培养18~24h后作为二级种子。
(3).二级种子可以接种到营养琼脂培养基或马丁肉汤中做进一步扩大培养。
如接种到营养琼脂培养基表面,37℃培养24~48h后,加入灭菌生理盐水,用灭菌接种环或特制的刮子将菌苔刮下,倾入灭菌的离心管中,低速离心5min (500r/min),使其中可能掺杂的琼脂块下沉。
吸取上层细菌悬浮液加入盛有玻璃珠的灭菌瓶中,用手或振荡器振荡30min,使细菌均匀分散,取少量菌液装于灭菌试管中供计数用,其余细菌将灭活(强毒细菌须在杀菌后,再行计数)。
如接种于马丁肉汤培养基,经37℃培养24~48h后,直接取少量菌液供计数用,其余细菌则灭活。
病毒性疫苗制造技术

病毒性疫苗制造技术任务一灭活苗的制造流程菌种的选择(强毒株) → 菌液培养→ 灭活↓↓配苗(5份菌液+1份铝胶配苗) ←浓缩工序一菌种与种子培养选取毒力强、免疫原性好的1~3个品系菌株,按规定定期复壮和鉴定,将合格菌种增殖培养并经无菌检验、活菌计数达到标准后作为种子液。
种子液保存于2~8℃冷暗处,在有效期内用于菌苗生产种子使用。
大肠杆菌病的菌种应采集动物心血、腹水、肝渗出物、气囊附着物或正常动物的肠道内容物作为接种物。
如用含大肠杆菌的病料,首先对大肠杆菌进行分离、鉴定,符合要求方可作为菌种使用。
工序二菌液的培养用于规模化细菌培养的方法很多,有手工式、机械化或自动化等方式。
可供菌体培养的方法有:固体表面培养法、液体静置培养法、液体深层通气培养法和透析培养法。
一般固体培养易获得高浓度细菌悬液,含培养基成分少,易稀释成不同的浓度,但生产量较小。
因此,大量生产疫苗时常用液体培养法。
实例大肠杆菌的菌液培养方法(1).将生化结果典型的菌种接种于伊红美兰琼脂平板或麦康凯琼脂平板上,置37℃温箱中培养18~24h,挑取单个典型菌落接种于琼脂斜面,置37℃温箱中培养18~24h,经显微镜检查无杂菌污染者,即可作为种子培养物。
(2).取5ml马丁肉汤加入琼脂斜面洗下菌苔作为一级种子,用灭菌吸管按5%的量将一级种子接种于马丁肉汤中,置37℃培养18~24h后作为二级种子。
(3).二级种子可以接种到营养琼脂培养基或马丁肉汤中做进一步扩大培养。
如接种到营养琼脂培养基表面,37℃培养24~48h后,加入灭菌生理盐水,用灭菌接种环或特制的刮子将菌苔刮下,倾入灭菌的离心管中,低速离心5min (500r/min),使其中可能掺杂的琼脂块下沉。
吸取上层细菌悬浮液加入盛有玻璃珠的灭菌瓶中,用手或振荡器振荡30min,使细菌均匀分散,取少量菌液装于灭菌试管中供计数用,其余细菌将灭活(强毒细菌须在杀菌后,再行计数)。
如接种于马丁肉汤培养基,经37℃培养24~48h后,直接取少量菌液供计数用,其余细菌则灭活。
灭活、减毒疫苗工艺流程
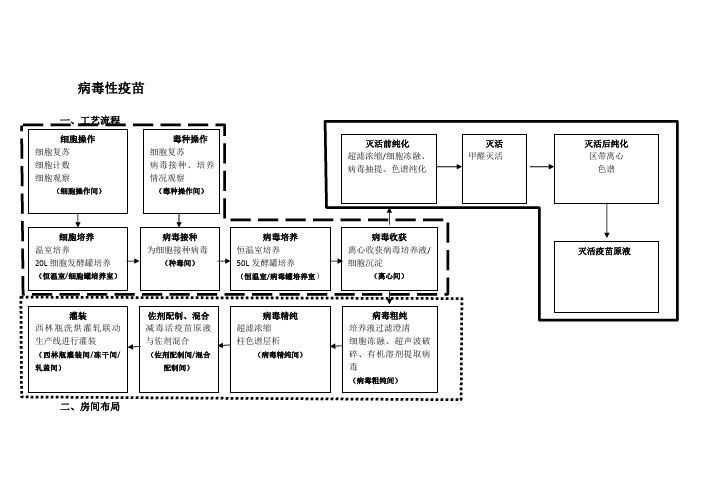
病毒性疫苗(一)疫苗原液生产区:1、细胞操作间(C级洁净度,无毒区)。
进行细胞复苏,细胞CO2培养箱培养,为细胞大量培养做准备;检测细胞恒温室、发酵罐中细胞生长状态。
2、细胞培养恒温室(C级洁净度,无毒区)。
使用转瓶机进行细胞培养,为病毒接种准备细胞。
3、细胞罐培养间(C级洁净度,无毒区)。
利用20L发酵罐进行细胞大量培养,为病毒接种准备细胞。
4、毒种操作间(C级洁净度,有毒区)。
复苏含有毒种的细胞,为毒种的扩增做准备;检测病毒感染后细胞的生长状态。
5、种毒间(C级洁净度,有毒区)。
将病毒按照适宜比例接种于细胞恒温室、细胞发酵罐培养得到的细胞中。
6、病毒培养恒温室(C级洁净度,有毒区)。
将种毒后的细胞置于温室中转瓶培养。
7、病毒罐培养室(C级洁净度,有毒区)。
种毒后的细胞在50L发酵罐中大量培养,培养至适宜程度,将发酵物泵入离心间。
8、离心间(C级洁净度,有毒区)。
使用大容量冷冻离心机,将病毒发酵罐内发酵物进行离心,分离上清液与细胞沉淀。
9、病毒粗纯间(C级洁净度,有毒区)。
对于分泌于细胞培养液中的病毒,使用超滤膜包过滤澄清细胞上清液,得到粗纯后的病毒液;对于胞内病毒,利用细胞冻融、超声破碎技术破碎细胞,释放病毒,并使用有机溶剂抽提法抽提得到病毒。
10、病毒精纯间(B级洁净度,有毒区)。
对粗纯后的病毒液进行超滤浓缩等操作,得到减毒活疫苗原液。
9、灭活前纯化间(C级洁净度,有毒区)。
对灭活疫苗进行纯化(粗纯、精纯)10、灭活间(C级洁净度,有毒区)。
灭活病毒11、灭活后纯化间(B级洁净度,无毒区)。
灭活后疫苗纯化间。
(二)减毒疫苗西林瓶分装单元1、西林瓶灌装间(三)减毒活疫苗中试生产辅助区1、称量间(C级洁净度,无毒区)。
存放减毒活疫苗原液中试生产所需的试剂;利用不同精度的电子天平称量所需的试剂,用于后续生产或溶液配制。
2、配液间(C级洁净度,无毒区)。
将称量的试剂配制成溶液,或对原液进行稀释等,用于后续减毒活疫苗的中试生产。
组织灭活苗的制备过程

组织灭活苗的制备过程
1、病料采集
2、病料处理
3、配苗
4、灭活
一、材料:脾脏、淋巴结等组织、甲醛、硫
柳汞、恒温箱、剪刀、漏斗、镊子、三
角烧瓶、烧杯、移液器、匀浆机、纱布
二、步骤:
1、无菌处理:去除被膜、大血管、脂肪、
筋膜,称重。
剪成1平方厘米大小的小块,匀浆。
2、无菌检验,测定病毒效价
3、生理盐水4-6倍稀释,搅拌均匀
4、过滤。
纱布4-8层进行过滤,取上清液
5、灭活剂配制:计算甲醛用量,使甲醛最
终浓度达到0.5%。
(用甲醛的目的是使蛋白变性)。
6、缓慢加入甲醛,边加边搅拌。
用三角烧
瓶盛装。
7、牛皮纸扎好三角烧瓶,放入恒温箱内,
38摄氏度下放置24小时。
(病毒苗24
小时,细菌苗48小时。
)
8、分装灭菌瓶,每瓶100毫升。
9、成品检验:要求无菌、达到一定的效价、
安全等。
10、保存:4摄氏度冰箱保存,用时摇匀。
注:若长久保存,需加入硫柳汞(防腐剂)。
固体硫柳汞配制成1%浓度的水剂,加入到灭活苗中的终浓度为万分之一;也可加入有治疗作用的双抗(如青链霉素)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
病毒灭活苗制作过程
随着生物工程技术和生物化学、分子生物学的发展,兽用生物制品的动物疫苗种类,类型上均有重要的进展,各种新疫苗不断研制成功。
大体分为:灭活疫苗、弱毒疫苗、单价疫苗、多价疫苗、混合疫苗、同源疫苗、亚单位疫苗、基因工程疫苗。
灭活疫苗:又称死疫苗。
将细菌或病毒利用物理的或化学的方法处理,使其丧失感染性或毒性,而保持免疫原性,接种动物后能产生主动免疫的一类生物制品。
灭活疫苗分为组织灭活疫苗、培养物灭活疫苗。
其特点是:易于保存运输,疫苗稳定,便于制备多价或多联苗。
其缺点是:注射剂量大,多次注射,不产生局部免疫力。
弱毒疫苗:又称活疫苗。
微生物的自然强毒株通过物理的、化学的和生物的方法,使其对原宿主动物丧失致病力,或引起亚临床感染,但以保持良好的免疫原性、遗传特性的毒株用以制备的疫苗,此外,也有从自然界筛选的自然毒株,同样有人工育成弱毒株的遗传特性,同样可以制备弱毒疫苗,如:鸡新城疫LaSota疫苗。
灭活疫苗和弱毒疫苗的利和害,发展重与轻,学者历来都有争论,现将两者的优缺点简介见灭活疫苗与弱毒活疫苗比较
灭活疫苗
优点:比较安全,不发生全身性副作用,不出现返祖现象,有利于制备多价多联的混合疫苗;制品稳定,受外界条件影响小,有利于运输保存。
缺点接种次数多,剂量多而大,免疫途径必须注射,不产生局部免疫,需要高浓度抗原物质,生产成本高。
弱毒活疫苗
优点:一次免疫接种即可成功,可采取自然感染途径接种(如注射、滴鼻、饮水、喷雾、划痕等),可引起整个免疫应答,产生广普性免疫及局部和全身性抗体,免疫持久,有利于消除局部野毒,产量高,生产成本低。
缺点: 残毒在自然界动物群体中持续传递后毒力有增强返祖危险,疫苗中存在的污染毒有可能扩散;存在不同抗原的干扰现象,从而影响免疫效果;要求在低温条件下运输储存。
单(价)疫苗:利用同一种微生物菌(毒)株或同一种微生物中的单一血清型的菌(毒)株增殖培养物制备的疫苗称为单(价)疫苗。
单苗对单一血清型微生物所致的病有免疫保护效能,但单价苗仅能对多血清型微生物所致病中的对应型有保护作用,而不能使免疫动物获得完全的免疫保护。
多价疫苗:指同一种微生物中若干血清型菌(毒)株的增殖培养物制备的疫苗。
多价疫苗能使免疫动物获得完全的保护力,且可适于不同地区使用。
混合疫苗:又称多联疫苗。
指利用不同种类的微生物的增殖培养物按免疫学原理、方法组合而成。
接种动物后能产生相应疾病的免疫保护,具有减少接种次数,使用方便等优点,是一针防多病的生物制剂。
制作过程
1.匀浆
取患病个体的肝、脾、肾(有时取症状明显部位)在研钵中研磨成匀浆,研磨需灭菌,尽量保证无菌操作。
研磨中添加适量的已灭菌的生理盐水。
2.反复冻融
将匀浆放入-40℃冷冻,待冷冻完全后拿到室温融化,如此反复冻融3次以上。
3.离心
冻融后的匀浆在50ml离心管,8000r离心机中离心15min。
取上清放于已灭菌的空瓶中并稀释后添加抗生素。
4.灭活
根据稀释后的体积添加4‰~7‰福尔马林灭活。
37℃放置36h-48h。
5.离心
50ml离心管,8000r离心机中离心15min将加入福尔马林产生的沉淀去除,收集上清。
再次将上清静置过夜,离心收集上清。
如此反复2~3次。
6.抽滤
将上清液经0.22um滤膜过滤除菌。
收集滤液。
7.检测活性
将疫苗接BHI平板过夜,看是否有菌长出,若有菌生长则添加抗生素或重新抽滤。
将无菌的疫苗注射实验动物观察死亡情况。
