单克隆抗体Gazyva(obinutuzumab)注射液使用说明书
注射用奥加伊妥珠单抗说明书

核准日期:年月日注射用奥加伊妥珠单抗说明书请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:注射用奥加伊妥珠单抗商品名称:贝博萨® / Besponsa®英文名称:Inotuzumab Ozogamicin for Injection汉语拼音:Zhusheyong Aojiayituozhu Dankang【成份】活性成份:奥加伊妥珠单抗。
奥加伊妥珠单抗是一种靶向CD22 的抗体-药物偶联物(ADC),由三个部分组成:1) 重组人源化免疫球蛋白G 亚型 4 (IgG4)kappa 抗体伊珠单抗,可特异性识别人CD22;2) N-乙酰-γ-刺孢霉素,可导致双链DNA 断裂;以及3) 可酸解的连接子,由4-(4'4-乙酰苯氧基)-丁酸(AcBut) 和3-甲基-3-巯基丁烷酰肼(被称为二甲酰肼,将N-乙酰-γ-刺孢霉素与伊珠单抗共价结合)组成。
奥加伊妥珠单抗的分子量约为160 kDa。
与每个伊珠单抗分子结合的刺孢霉素衍生物的平均数量大约 6 个(分布范围为2–8 个)。
奥加伊妥珠单抗是通过抗体与小分子成分化学结合产生的。
抗体由哺乳动物(中国仓鼠卵巢)细胞产生,而半合成刺孢霉素衍生物则是通过微生物发酵、然后合成改性产生的。
化学名称:人源化IgG4单克隆抗体与N-乙酰刺孢霉素的偶联物(通过连接子),平均负载量为每摩尔抗体负载6摩尔刺孢霉素衍生物。
化学结构式:分子量:奥加伊妥珠单抗的聚糖组成及每个伊珠单抗分子结合的刺孢霉素衍生物的数量不均一。
因此,无确定的分子量。
对于具有G0F / G0F糖型和6个刺孢霉素衍生物的奥加伊妥珠单抗分子,理论分子量为159,256 Da。
辅料:氨丁三醇、蔗糖、聚山梨酯80和氯化钠。
【性状】本品为白色至类白色块状物或粉末。
【适应症】本品适用于复发性或难治性前体B细胞急性淋巴细胞性白血病(ALL)成年患者。
【规格】1.0 mg/瓶。
【用法用量】推荐剂量•在每次给药前预先处理(参见下文)。
古塞奇尤单抗注射液(特诺雅)说明书
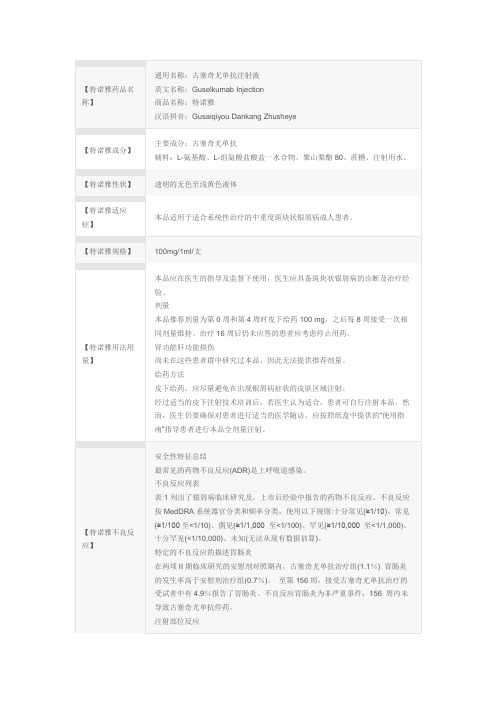
【特诺雅药品名称】通用名称:古塞奇尤单抗注射液英文名称:Guselkumab Injection商品名称:特诺雅汉语拼音:Gusaiqiyou Dankang Zhusheye【特诺雅成分】主要成分:古塞奇尤单抗辅料:L-氨基酸、L-组氨酸盐酸盐一水合物、聚山梨酯80、蔗糖、注射用水。
【特诺雅性状】透明的无色至浅黄色液体【特诺雅适应症】本品适用于适合系统性治疗的中重度斑块状银屑病成人患者。
【特诺雅规格】100mg/1ml/支【特诺雅用法用量】本品应在医生的指导及监督下使用,医生应具备斑块状银屑病的诊断及治疗经验。
剂量本品推荐剂量为第0周和第4周时皮下给药100 mg,之后每8周接受一次相同剂量维持。
治疗16周后仍未应答的患者应考虑停止用药。
肾功能肝功能损伤尚未在这些患者群中研究过本品。
因此无法提供推荐剂量。
给药方法皮下给药。
应尽量避免在出现银屑病症状的皮肤区域注射。
经过适当的皮下注射技术培训后,若医生认为适合,患者可自行注射本品。
然而,医生仍要确保对患者进行适当的医学随访。
应按照纸盒中提供的“使用指南”指导患者进行本品全剂量注射。
【特诺雅不良反应】安全性特征总结最常见的药物不良反应(ADR)是上呼吸道感染。
不良反应列表表1列出了银屑病临床研究及,上市后经验中报告的药物不良反应。
不良反应按MedDRA系统器官分类和频率分类,使用以下规则:十分常见(≥1/10)、常见(≥1/100至<1/10)、偶见(≥1/1,000 至<1/100)、罕见(≥1/10,000 至<1/1,000)、十分罕见(<1/10,000)、未知(无法从现有数据估算)。
特定的不良反应的描述胃肠炎在两项II期临床研究的安慰剂对照期内,古塞奇尤单抗治疗组(1.1%) 胃肠炎的发生率高于安慰剂治疗组(0.7%)。
至第156周,接受古塞奇尤单抗治疗的受试者中有4.9%报告了胃肠炎。
不良反应胃肠炎为非严重事件,156 周内未导致古塞奇尤单抗停药。
注射用伊尼妥单抗说明书

注射用伊尼妥单抗说明书警告:心脏毒性:抗HER2单抗药物会导致亚临床和临床心力衰竭,其发生率和严重程度在合并蒽环类抗生素治疗的患者中最高。
在给予本品治疗前以及治疗过程中需对左心室功能进行评估。
在临床显著的左心室功能下降的转移性乳腺癌患者中,应停用本品。
输注相关反应及肺部反应:抗HER2单抗药物会导致严重的并可能致命的输注相关反应和肺部反应。
症状多发生于其输注过程中或24小时内。
对于发生呼吸困难或临床显著的低血压患者,应当立即停止输注本品,并对患者进行监控直至症状完全消失。
发生过敏、血管性水肿、间质性肺炎或者急性呼吸窘迫综合征的患者应停止输注。
胚胎毒性:孕期使用抗HER2单抗药物会导致羊水过少并继发造成胎儿肺发育不全、骨骼异常和新生儿死亡。
药品名称:通用名称:注射用伊尼妥单抗英文名称:Inetetamab for Injection商品名称:赛普汀成份:活性成份为伊尼妥单抗,是重组抗人表皮生长因子受体-2人源化单克隆抗体,由悬浮培养于无菌培养基中的哺乳动物细胞(中国仓鼠卵巢细胞CHO)生产,为IgG1/k型免疫球蛋白分子。
辅料:盐酸组氨酸、组氨酸、蔗糖、聚山梨酯20。
适应症:本品适用于HER2阳性的转移性乳腺癌:与长春瑞滨联合治疗已接受过1个或多个化疗方案的转移性乳腺癌患者。
用法用量:HER2检测在使用本品治疗前,应进行HER2状态的检测。
免疫组化(IHC)检测显示阳性(+++)或免疫组化检测显示可疑阳性(++)同时荧光原位杂交(FISH)检测结果阳性的患者可以使用本品。
推荐剂量和给药方法伊尼妥单抗的推荐初始负荷剂量为4mg/kg,静脉滴注90分钟以上;维持剂量为2mg/kg,每周1次,如果在首次滴注时患者耐受性良好,后续滴注可改为30分钟。
严禁静脉推注或快速静脉注射。
长春瑞滨的推荐剂量为25 mg/m2,第1,8,15天静脉滴注,在伊尼妥单抗输注后当天应用,每28天为1个周期。
有关长春瑞滨用药的详细信息,请参见长春瑞滨的药品说明书。
帕妥珠单抗注射液说明书

限,尚无针对重度肾功能不全患者的推荐剂量(见【药代动力学】中特殊人群中的药代动 力学)。
肝功能不全患者:帕妥珠单抗在肝功能不全患者中的安全性和有效性尚未研究。 使用、处理和处置的特殊说明
稀释说明 为避免用药错误,务必检查药瓶标签以确保所制备和使用的药品是帕妥珠单抗。帕妥 珠单抗仅供单次使用,静脉输注。帕妥珠单抗不含抗菌防腐剂,必须确保已制备输液的无 菌性。帕妥珠单抗应由专业医疗人员采用无菌技术制备静脉输注溶液: 从西林瓶中抽出 14mL 帕妥珠单抗浓缩液,注入于 250mL 0.9%氯化钠 PVC 或非 PVC 聚烯烃输液袋中稀释。请勿将生理盐水从输液袋中抽出。 起始剂量需要使用两瓶帕妥珠单抗,稀释后溶液浓度约为 3.0mg/mL,后续剂量使用一 瓶帕妥珠单抗,稀释后溶液浓度约为 1.6mg/mL。 应轻轻倒置输液袋以混匀溶液,请勿振摇,避免起泡。 注射用药物在给药前应进行目视检查,以查看有无颗粒和变色。 一旦制备好输液,应立即输注。 配伍禁忌 不得使用 5%葡萄糖溶液稀释帕妥珠单抗,因其在 5%葡萄糖溶液中的化学和物理性质 不稳定。 未观察到帕妥珠单抗与聚氯乙烯、聚乙烯或非 PVC 聚烯烃袋之间存在不相容性。 帕妥珠单抗不得与其他药物混合或使用其他药物稀释。 未使用/过期药品的处置 尽量避免药品在环境中的释放。不应将药品丢弃于废水或生活垃圾中。 应根据当地相关规定处置任何未使用的药品或废料。 【不良反应】 由于临床试验是在各种不同条件下进行的,所以在一种药物临床试验中观察到的不良 反应发生率不能直接与另一种药物临床试验中的发生率进行比较,可能也无法反映临床实
抗A、抗B血型定型试剂(单克隆抗体)说明书

抗A、抗B血型定型试剂(单克隆抗体)抗A、抗B血型定型试剂(单克隆抗体)使用说明书•【药品名称】通用名称:抗A、抗B血型定型试剂(单克隆抗体)汉语拼音:Kang-A、Kang-B Xuexingdingxingshiji(Dankelongkangti) •【成份】本品主要成份为:分泌抗人A型和抗人B型血型抗原单抗的杂交瘤细胞培养上清液并补加一定量小鼠腹水抗体•【性状】抗A:浅蓝色澄明液体。
抗B:浅黄色澄明液体。
•【适应症】专用于鉴定人ABO血型。
•【规格】10ml/支•【用法用量】【用法与用量】(1)平板法(玻片法):本品与受检者全血或10%红细胞生理氯化钠悬液按1:1使用,不必再稀释,按照有无凝集判定结果。
(2)试管法:本品与受检者5%红细胞生理氯化钠悬液按1:1使用,不必再稀释,摇匀,10000r/min离心1分钟或室温静置1小时,按照有无凝集判定结果。
血型抗A试剂抗B试剂A+-B-+O--AB++•【注意事项】(1)对含有较多自身冷凝集素的受检者,在鉴定血型时往往被误定为AB血型,遇到此种情况,需用37°C生理氯化钠溶液洗涤受检者红细胞2~3次,以去除吸附在红细胞上的冷凝集素,然后再鉴定血型。
(2)在做配型试验时,如发现有不配合现象,则取受检者血清,用已知A或B血型红血胞进行反定型试验,以核实原鉴定的血型是否正确。
(3)用立即试管法不能测出亚型(如Ax),需延长作用时间。
(4)本品如出现浑浊或变色则不能使用,若开瓶使用时间较长后,最好用已知A、B、O血晕型红细胞检查结果是否与已知血型相符,以防制品污染、变质失效,而造成鉴定错误。
(5)在有效期内使用。
•【孕妇及哺乳期妇女用药】【孕妇及哺乳用药】•【贮藏】2~8°C避光保存【注意】药物说明书里面有三种标识,一般要注意一下:1.第一种就是禁用,就是绝对禁止使用。
2.第二种就是慎用,就是药物可以使用,但是要密切关注患者口服药以后的情况,一旦有不良反应发生,需要马上停止使用。
达雷妥尤单抗注射液说明书

核准日期:达雷妥尤单抗注射液(皮下注射)说明书本品为附条件批准上市,请仔细阅读说明书并在医师指导下使用。
【药品名称】通用名称:达雷妥尤单抗注射液(皮下注射)商品名称:兆珂速®/DARZALEX FASPRO®英文名称:Daratumumab Injection(Subcutaneous Injection)汉语拼音:Daleituoyou Dankang Zhusheye(Pixia Zhushe)【成份】主要成份:达雷妥尤单抗辅料:重组人透明质酸酶(rHuPH20)、L-组氨酸、L-组氨酸盐酸盐一水合物、L-蛋氨酸、聚山梨酯20、山梨醇(E420)和注射用水。
【性状】溶液澄清至乳白色,无色至黄色。
【适应症】本品联合硼替佐米、环磷酰胺和地塞米松适用于新诊断的原发性轻链型淀粉样变患者。
本方案不适合也不推荐用于患有NYHA IIIB级或IV级心脏疾病或Mayo IIIB期的原发性轻链型淀粉样变患者。
基于替代终点血液学完全缓解率结果附条件批准上述适应症。
本适应症的完全批准将取决于生存获益相关临床终点的结果。
【规格】1800mg(15 ml)/瓶【用法用量】本品不用于静脉给药,应仅使用规定剂量进行皮下注射给药。
本品应由医务人员给药,首次给药应在配有急救设施的条件下进行。
务必对药瓶标签进行检查,以确保按照处方给予患者适当的制剂和剂量。
应给予注射前和注射后药品,以降低达雷妥尤单抗输注相关的全身或局部反应的风险。
见下文“推荐的合并用药”和【注意事项】。
在开始本品治疗前,先对患者进行血型鉴定和红细胞抗体筛查。
用法用量与硼替佐米、环磷酰胺和地塞米松联合用药的给药方案(4周为一个周期)根据表1中的给药方案,本品建议的剂量为1,800 mg,给药时间约为3 -5分钟。
表1:本品联合硼替佐米、环磷酰胺和地塞米松(4周为一个周期)用于原发性轻链型淀粉样变的给药方案a每2周一次给药方案的首次给药时间为第9周。
伊匹木单抗注射液-详细说明书与重点

依奇珠单抗注射液Ixekizumab 英文名称: IxekizumabInjection。
【成分】依奇珠单抗(由CHO细胞生产的重组人源化单克隆抗体),辅料:枸橼酸钠、无水枸橄酸、氯化钠、聚山梨酯80、注射用水【性状】本品为澄清至乳光,无色至微黄色至微棕色溶液,基本无可见颗粒。
【适应症】本品用于治疗适合系统治疗或光疗的中度至重度斑块型银屑病成人患者。
【规格】80mg/mL(自动注射器)。
【用法用量】皮下注射。
依奇珠单抗注射液通过皮下注射给药。
依奇珠单抗治疗1周:可见皮损PASI 至基线平均改善为30%;依奇珠单抗治疗2周:PASI自基线平均改善达到54%(另外,有接近25%接受依奇珠单抗治疗的患者在第2周时实现了PASI75应答率);依奇珠单抗治疗60周,55%的患者达到PASI100;持续用药,皮损清除效果可稳定维持至少4年,。
该项研究仍在持续进行,相信不远的未来可看到更久的临床数据。
4.依奇珠单抗注射液给药剂量是多少。
剂量形式和规格:80mg/mL(自动注射器)。
斑块状银屑病:推荐剂量在第0周时为160mg(两次80mg注射),然后在第2,4,6,8,10和12周时为80mg,然后每4周为80mg。
银屑病关节炎:1.在第0周通过皮下注射(两次80mg注射)推荐剂量为160mg,然后每4周注射80mg。
2.对于同时存在中度至重度斑块状银屑病的银屑病关节炎患者,使用给药方案治疗斑块状银屑病。
3.依奇珠单抗注射液可以单独给药或与常规DMARD(例如甲氨蝶呤)组合给药。
斑块状银屑病:通过皮下注射给药。
推荐剂量在第0周时为160mg(两次80mg注射),然后在第2,4,6,8,10和12周时为80mg,然后每4周为80mg。
银屑病关节炎:1.在第0周通过皮下注射(两次80mg注射)推荐剂量为160mg,然后每4周注射80mg。
2.对于同时存在中度至重度斑块状银屑病的银屑病关节炎患者,使用给药方案治疗斑块状银屑病。
汉贝泰(贝伐珠单抗)注射液说明书

核准日期:2021年11月30日修改日期:2022年07月18日2022年09月16日2022年10月14日汉贝泰®(贝伐珠单抗)是安维汀®(贝伐珠单抗)的生物类似药1贝伐珠单抗注射液说明书请仔细阅读说明书并在医师指导下使用【药品名称】通用名:贝伐珠单抗注射液商品名:汉贝泰®英文名:Bevacizumab Injection汉语拼音:Beifazhu Dankang Zhusheye【成份】活性成份:贝伐珠单抗(人源化抗-VEGF单克隆抗体)100 mg(4 ml)/瓶,每瓶含贝伐珠单抗100mg,不含防腐剂,以一次性小瓶包装。
本品中辅料的组成如下:α,α-海藻糖二水合物,磷酸二氢钠一水合物,无水磷酸氢二钠,聚山梨酯20和无菌注射用水。
【性状】本品为静脉注射用无菌溶液,pH 5.9~6.3,澄清至微带乳光、无色至棕黄色液体。
【适应症】转移性结直肠癌1生物类似药是指支持此生物制品获得上市批准的数据已证明该生物制品与国家药品监督管理局批准的参照药高度相似,并且没有临床意义上的差异。
本品说明书与原研产品说明书保持一致。
贝伐珠单抗联合以氟嘧啶为基础的化疗适用于转移性结直肠癌患者的治疗。
晚期、转移性或复发性非小细胞肺癌贝伐珠单抗联合以铂类为基础的化疗用于不可切除的晚期、转移性或复发性非鳞状细胞非小细胞肺癌患者的一线治疗。
复发性胶质母细胞瘤贝伐珠单抗用于成人复发性胶质母细胞瘤患者的治疗。
肝细胞癌本品联合阿替利珠单抗治疗既往未接受过全身系统性治疗的不可切除肝细胞癌患者。
【规格】100 mg(4 ml)/瓶,每瓶含贝伐珠单抗100mg,浓度为25mg/ml,装量为4ml。
【用法用量】贝伐珠单抗应该由专业卫生人员采用无菌技术稀释后才可输注。
贝伐珠单抗采用静脉输注的方式给药,首次静脉输注时间需持续90分钟。
如果第一次输注耐受性良好,则第二次输注的时间可以缩短到60分钟。
如果患者对60分钟的输注也具有良好的耐受性,那么随后进行的所有输注都可以用30分钟的时间完成。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
单克隆抗体Gazyva(obinutuzumab)注射液使用说明书2013年第一版Gazyva(obinutuzumab)注射液使用说明书2013年第一版新生物制品批准日期:2013年11月1日;公司:Genentech药物是第一个具有突破性的治疗指定获得FDA批准Gazyva是具有突破性的治疗指定获得FDA批准第一个药物。
这个指定被承办单位请求和在递交给FDA支持上市批准的生物制品许可申请后很快被授权。
在承办单位请求时如果初步临床证据表明药物可能对有严重或危及生命疾病患者可能提供超过可得到治疗重大改善时,FDA可以指定某个药物是突破性治疗。
优先审评,孤儿产品指定FDA的药物评价和研究中心血液学和肿瘤学产品室主任Richard Pazdur,M.D.说:“今天的批准代表对有CLL患者一个重要的新添加治疗”“这个批准反映对突破性治疗指定程序的承诺,允许我们与公司合作加快发展,审查和提供重要的新药物。
”。
/drugsatfda_docs/label/2013/125486s000lbl.pdf处方资料重点这些重点不包括安全和有效使用GAZYVA所需所有资料。
请参阅GAZYVA完整处方资料。
GAZYVA(obinutuzumab)注射剂,为静脉输注美国初次批准:2013适应证和用途GAZYVA(obinutuzumab)是一种针对CD20溶细胞抗体和适用于与苯丁酸氮芥[chlorambucil]联用,为有既往未治疗过慢性淋巴性白血病患者的治疗。
(1,14)剂量和给药方法(1)用糖皮质激素,对乙酰氨基酚[acetaminophen]和抗组织胺预先给药。
(2.2)(2)为静脉输注稀释和给药。
不要静脉推注或丸注。
(2.1)(3)对6个疗程推荐剂量(28天疗程):1)在疗程1第1天100 mg2)在疗程1第2天900 mg3)在疗程1第8和15天1000 mg4)在疗程2-6第1天1000 mg (2.1)剂型和规格1000 mg/40mL (25 mg/mL)单次使用小瓶. (3)禁忌证无。
警告和注意事项(1)输注反应:患者用糖皮质激素,对乙酰氨基酚和抗组织胺预先给药。
输注期间严密监视. 对反应中断或终止输注。
(2.2,5.3)(2)肿瘤溶解综合征:预料肿瘤溶解综合征;用抗高尿酸血症药物预先给药和充分水化尤其是对有高肿瘤负荷和/或高循环淋巴细胞计数患者。
纠正电解质异常,提供支持性医护和监视肾功能和液体平衡。
(5.4)(3)中性粒细胞减少:对感染监视。
(5.6)(4)血小板减少:监视血细胞计数和出血。
出血的处理可能需要血液制品支持。
(5.7) (5)免疫接种:不要给活病毒疫苗GAZYVA给予前或期间。
(5.8)不良事件最常见不良事件(发生率≥10%)是:输注反应,中性粒细胞减少,血小板减少,贫血,发热,咳嗽,和肌肉骨骼疾病。
(6)完整处方资料1 适应证和用途GAZYVA,与苯丁酸氮芥联用,适用为有既往未治疗过慢性淋巴性白血病(CLL)患者的治疗[见临床研究(14.1)].2 剂量和给药方法2.1 推荐给药方案● 每次输注前预先给药[见剂量和给药方法(2.2)]。
● 只通过专用管线静脉输注给予[见剂量和给药方法(2.5)]。
● 不要静脉推注或丸注。
● 在定期间隔监视血细胞计数。
● GAZYVA只应由卫生保健专业人员给予与适当医学支持处理如发生可能致命性严重输注反应[见警告和注意事项(5.3)]。
推荐剂量:GAZYVA的每次剂量是静脉给予1000 mg,除第1疗程首次注射例外,是在第1天(100 mg)和第2天(900 mg)。
如GAZYVA的一次计划给药被丢失,尽可能尽快给予丢失剂量和相应调整给药时间表,如果适当,患者没有完成第疗程第1天给药可进至第1疗程第天剂量。
如果1例患者输注期间经受任何疾病输注反应,调整输注如下[见警告和注意事项(5.3)]:● 4级(危及生命):立即停止输注和永久地终止GAZYVA治疗。
● 3级(严重):中断输注和处理症状。
症状解决,考虑在不超过以前速率一半再开始GAZYVA输注(输注反应发生时所用速率)和,如患者不经历任何进一步输注反应症状,可能在增量和间隔对治疗疗程给药适当恢复输注速率递增。
如在再挑战时患者经受3级输注相关症状永久终止治疗。
● 1-2级(轻至中度:减低输注速率或中断输注和治疗症状。
症状解决时,继续或恢复输注和,如患者不经历任何进一步输注反应症状,可能在对治疗疗程给药适当的增量和间隔输注速率递增恢复。
2.2 推荐预先给药在表2中概述推荐减低输注反应风险的预先给药[见警告和注意事项(5.3)]。
GAZYVA静脉输注期间可能发生低血压。
每次GAZYVA输注前12小时和自始至终和对给药后头1小时考虑不给抗高血压治疗[见警告和注意事项(5.3)]。
对患者有高肿瘤负荷和/或高循环绝对淋巴细胞计数(大于25 × 109/L),为肿瘤溶解综合征的预防治疗开始前12-24小时预先给药抗高尿酸血症药物(如,别嘌呤醇[allopurinol])和确保充分水化[见警告和注意事项(5.4)]。
2.3 预先给药对抗-微生物预防强烈建议中性粒细胞减少患者治疗期自始至终接受抗微生物预防。
应考虑抗病毒和真菌预防。
2.4 对毒性中断治疗如患者经受感染,3或4级全血细胞减少,或≥2级非血液学毒性考虑中断治疗。
2.5 配制和给药配制用无菌术准备为输注溶液如下:● 给药前肉眼观察有无颗粒物质和变色。
● 稀释入一个0.9%氯化钠PVC或非-PVC聚烯烃输注袋,不要使用其他稀释剂例如葡萄糖(5%)。
●为第1疗程准备在第1天(100 mg)和第2天(900 mg)输注溶液:○ 从小瓶抽吸40 mL GAZYVA溶液。
○ 为立即给药稀释4 mL GAZYVA(100 mg)入100 mL0.9%氯化钠输注袋。
○ 在相同时间稀释剩余的36 mL(900 mg)入250 mL 0.9%氯化钠输注袋为第2天使用和贮存在2°C至8°C(36°F至46°F)共24小时。
在允许稀释袋在室温放置至室温,立即使用。
○ 清楚地标记每个输注袋。
● 准备为疗程1第8和15天和疗程26第1天输注溶液:○ 从小瓶抽吸40 mL的GAZYVA溶液○ 稀释40 mL(1000 mg)入250 mL 0.9%氯化钠输注袋。
● 通过轻轻倒置混合稀释液。
不要摇动或冻结。
● 对微生物稳定性,稀释后GAZYVA输注溶液应立即使用。
在适当无菌条件下稀释。
如果不立即使用,溶液可用前贮存在冰箱在2°C至8°C(36°F至46°F)直至24小时。
产品可在最终浓度0.4 mg/mL至4 mg/mL给药。
给药● 只为静脉输注给药。
● 不要静脉推注或丸注。
● GAZYVA不要与其他药物混合。
● 未观察到GAZYVA和聚氯乙烯(PVC)或非-PVC聚烯烃袋和给药组件间不兼容性[见如何供应/贮存和处置(16.1)]。
3 剂型和规格1000 mg/40mL(25 mg/mL)单次使用小瓶.4 禁忌证无。
5 警告和注意事项5.1 乙型肝炎病毒再激活用抗-CD20抗体例如GAZYVA治疗患者可能发生乙型肝炎病毒(HBV)再激活,在某些病例中导致暴发性肝炎,肝衰竭和死亡。
曾报道在患者是乙型肝炎表面抗原(HBsAg)阳性和还有在患者是HBsAg阴性但是乙型肝炎核心抗体(抗-HBc)阳性中再激活HBV。
也还在再激活似乎已解决乙型肝炎感染患者(即,HBsAg阴性,抗-HBc 阳性,和乙型肝炎表面抗体[抗-HBs]阳性)。
HBV再激活被定义为HBV复制突然增加表现为血清HBV DNA水平迅速增加或既往HBsAg阴性和抗-HBc阳性人们中检测到HBsAg。
HBV复制的再激活常常接着肝炎,即,转氨酶水平增高和,在严重病例,胆红素水平增加,肝衰竭,和死亡。
开始用GAZYVA治疗前通过测定HBsAg和抗-HBc为HBV感染筛选所有患者。
对显示乙型肝炎感染证据的患者(HBsAg阳性[不管抗体状态]或HBsAg阴性但抗-HBc阳性),咨询在处理乙型肝炎有经验的医生关于监视和对HBV抗病毒治疗考虑。
用GAZYVA治疗期间和后几个月监视当前或以前HBV感染证据患者对临床和肝炎或HBV再激活的实验室征象。
对其他针对CD20溶细胞抗体治疗完成后曾报道HBV再激活。
当接受GAZYVA患者发生HBV再激活时,立即终止GAZYVA和任何同时化疗,和开始适当治疗。
HBV再激活解决患者GAZYVA的再恢复应与处理乙型肝炎有经验医生讨论。
有关发生HBV再激活患者中恢复GAZYVA安全性存在数据不充分。
5.2 进行性多灶性白质脑病在用GAZYVA治疗患者中观察到JC病毒感染导致进行性多灶性白质脑病(PML),可能致命性。
在任何患者存在新发病或与现存在神经学表现变化考虑PML的诊断。
PML的评价包括,但不限于,咨询神经学家,脑MRI,和腰穿。
发生PML患者中终止GAZYVA 治疗和考虑终止或减低任何同时化疗或免疫抑制治疗。
5.3 输注反应GAZYVA可能致严重和危及生命输注反应。
对首次1000 mgGAZYVA输注,2/3患者经受输注反应。
随后输注也可能发生输注反应。
症状可能包括低血压,心动过速,呼吸困难,和呼吸症状(如,支气管痉挛,喉和喉咙刺激,喘息,喉头水肿)。
其他常见症状包括恶心,呕吐,腹泻,高血压,潮红,头痛,发热,和畏寒[见不良事件(6.1)]。
对输注反应当需要患者用对乙酰氨基酚,抗组织胺和糖皮质激素预先给药,开始医学处理(如,糖皮质激素,肾上腺素,支气管扩张剂,和/或氧)。
整个输注期间密切监视患者。
接受GAZYVA24小时内曾发生输注反应[见剂量和给药方法(2)]。
对有任何4级输注反应患者,包括但不限于过敏性反应,急性危及生命呼吸症状,或其他危及生命输注反应:停止GAZYVA输注。
永久终止GAZYVA治疗。
对有1,2或3级输注反应患者:对3级反应中断GAZYVA直至症状解决。
对1或2级反应中断或减低输注速率和处理症状[见剂量和给药方法(2)]。
对预先存在心或肺情况患者,输注和输注后阶段始终更频监视引为他们可能处在经受更严重反应风险。
低血压可能输注反应作为一部分。
每次GAZYVA输注期间前考虑不给抗高血压治疗12小时,和给药后头1小时直至血压稳定。
对处在高血压危象风险增加患者,考虑获益相比在此提示的不给其高血压药物风险。
5.4 肿瘤溶解综合征急性肾衰竭,高钾血症,低钙血症,高尿酸血症,和/或高磷血症来自首次输注后12-24小时内可能发生的肿瘤溶解综合征(TLS)。
有高肿瘤负荷和/或高循环淋巴细胞计数(> 25 × 109/L)患者是处在TLS更大风险和GAZYVA前12-24小时开始应接受用抗高尿酸血症药适当预防(如,别嘌呤醇)和水化[见剂量和给药方法(2.2)]。
