组蛋白的修饰 PPT
合集下载
组蛋白修饰

核小体的组成
核小体是染色质(体)的基本结构单位,由DNA和 组蛋白(histone)构成。由4种组蛋白H2A、H2B、 H3和H4, 每一种组蛋白各二个分子,形成一个组 蛋白八聚体,约200 bp的DNA分子盘绕在组蛋白八 聚体构成的核心结构外面,形成了一个核小体。
组蛋白与核小体
组蛋白与核小体
组蛋白修饰
组蛋白修饰
组蛋白修饰
组蛋白修饰
蛋白修饰种类
一. 组蛋白的乙酰化 二. 组蛋白的甲基化 三. 组蛋白的磷酸化 四. 组蛋白的泛素化 五. 组蛋白的SUMO化
一、组蛋白的乙酰化
乙酰化修饰是通过组蛋白乙酰化酶的催化作用实现 的。组蛋白乙酰化酶将乙酰CoA的乙酰基转移到组蛋 白N末端尾区内赖氨酸侧链的ԑ-氨基。
完整的中期染 色体
核小体
核小体是染色体的基本结 构单位,由DNA和组蛋白 (histone)构成,是染色 质(染色体)的基本结构 单位。
核小体由相对伸展的连接 DNA相连,形成串珠状 (称为一级结构)
核小体
二级结构是由一系列核小 体盘绕成螺旋并排列形成 30nm 纤维,在间期染色 质和有丝分裂染色体中都 可见到。
非组蛋白是指细胞核中组蛋白以外的酸性蛋白质。非组蛋 白不仅包括以DNA作为底物的酶,也包括作用于组蛋白的一 些酶, 如组蛋白甲基化酶。此外还包括DNA结合蛋白、组蛋 白结合蛋白和调节蛋白。由于非组蛋白常常与DNA或组蛋白 结合, 所以在染色质或染色体中也有非组蛋白的存在, 如染 色体骨架蛋白。
组蛋白的性质和分类
组蛋白的性质和分类
组蛋白(histones)是真核生物体细胞染色质中的碱性蛋白 质,富含精氨酸和赖氨酸等碱性氨基酸,精氨酸和赖氨酸 加起来约为所有氨基酸残基的1/40。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯讲解学习

组蛋白修饰及其功能
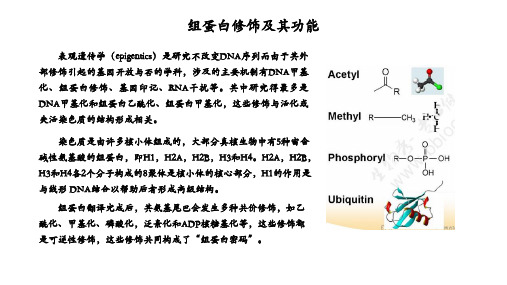
表观遗传学(epigentics)是研究不改变DNA序列而由于其外 部修饰引起的基因开放与否的学科,涉及的主要机制有DNA甲基 化、组蛋白修饰、基因印记、RNA干扰等。其中研究得最多是 DNA甲基化和组蛋白乙酰化、组蛋白甲基化,这些修饰与活化或 失活染色质的结构形成相关。
染色质是由许多核小体组成的,大部分真核生物中有5种富含 碱性氨基酸的组蛋白,即H1,H2A,H2B,H3和H4。H2A,H2B, H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是 与线形 DNA结合以帮助后者形成高级结构。
组蛋白翻译完成后,其氨基尾巴会发生多种共价修饰,如乙 酰化、甲基化、磷酸化,泛素化和ADP核糖基化等,这些修饰都 是可逆性修饰,这些修饰共同构成了“组蛋白密码”。
1. 组蛋白乙酰化
核心组蛋白乙酰化反应多发生在核心组蛋白 N端碱性氨基 酸集中区的特定 Lys 残基。组蛋白乙酰化由组蛋白乙酰转移酶 (histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)协调进行。HAT通过将乙酰辅酶 A 的乙酰 基转移到 Lys 的NH+,中和掉一个正电荷。 HDAC使组蛋白去乙 酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因的 转录受到抑制。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色 体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心 组蛋白乙酰化,进而使DNA与组蛋白结合减弱,核小体释放,转录因子和RNA聚合酶可以 与DNA上特异的启动子结合,启动靶基因的转录。
表观遗传学(epigentics)是研究不改变DNA序列而由于其外 部修饰引起的基因开放与否的学科,涉及的主要机制有DNA甲基 化、组蛋白修饰、基因印记、RNA干扰等。其中研究得最多是 DNA甲基化和组蛋白乙酰化、组蛋白甲基化,这些修饰与活化或 失活染色质的结构形成相关。
染色质是由许多核小体组成的,大部分真核生物中有5种富含 碱性氨基酸的组蛋白,即H1,H2A,H2B,H3和H4。H2A,H2B, H3和H4各2个分子构成的8聚体是核小体的核心部分,H1的作用是 与线形 DNA结合以帮助后者形成高级结构。
组蛋白翻译完成后,其氨基尾巴会发生多种共价修饰,如乙 酰化、甲基化、磷酸化,泛素化和ADP核糖基化等,这些修饰都 是可逆性修饰,这些修饰共同构成了“组蛋白密码”。
1. 组蛋白乙酰化
核心组蛋白乙酰化反应多发生在核心组蛋白 N端碱性氨基 酸集中区的特定 Lys 残基。组蛋白乙酰化由组蛋白乙酰转移酶 (histone acetyltransferase,HAT)和组蛋白去乙酰化酶(histone deacetylase,HDAC)协调进行。HAT通过将乙酰辅酶 A 的乙酰 基转移到 Lys 的NH+,中和掉一个正电荷。 HDAC使组蛋白去乙 酰化,与带负电荷的DNA紧密结合,染色质致密卷曲,基因的 转录受到抑制。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色 体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心 组蛋白乙酰化,进而使DNA与组蛋白结合减弱,核小体释放,转录因子和RNA聚合酶可以 与DNA上特异的启动子结合,启动靶基因的转录。
表观遗传学 第三章 组蛋白修饰

表观遗传学第三章组 蛋白修饰
,
汇报人:
目录 /目录
01
点击此处添加 目录标题
04
组蛋白修饰的 酶类
02
表观遗传学概 述
05
组蛋白修饰的 作用机制
03
组蛋白修饰的 种类
06
组蛋白修饰与 疾病的关系
01 添加章节标题
02 表观遗传学概述
表观遗传学的定义
表观遗传学是研究基因型未发生变化但基因的表达却发生了可遗传变化的科学。 表观遗传学主要关注DN甲基化、组蛋白修饰和非编码RN等对基因表达的影响。 表观遗传学在生物体发育、肿瘤发生和神经科学等领域有广泛应用。 表观遗传学可以通过研究基因表达的可遗传变化来揭示遗传信息与环境因素之间的相互作用。
sirtuins两类具 有不同的生物学 功能和底物特异
性。
研究意义:组蛋 白去乙酰化酶在 多种生物学过程 中发挥重要作用 如细胞分化、肿 瘤发生等是当前 表观遗传学研究
的热点之一。
组蛋白甲基化酶
定义:能够催化组蛋白甲基化反应的酶类
作用机制:通过甲基化组蛋白的特定位点 调控基因的表达
种 类 : 包 括H MTs 和 HM Ts e 等
研究意义:组蛋 白泛素化在表观 遗传学中具有重 要的研究意义对 于理解生物发育、 细胞分化和疾病 发生机制等方面 具有重要意义。
04 组蛋白修饰的酶类
组蛋白乙酰化酶
定义:组蛋白乙 酰化酶是一类能 将乙酰基团转移 至组蛋白特定位 点的酶
作用:调控基因 表达影响细胞分 化、发育和肿瘤 发生等过程
种 类 : 包 括 H Ts 和 K Ts 等 不 同 亚 型具有不同的底 物特异性和功能
与其他修饰的关系:组蛋白磷酸化可以与其他修饰如甲基化、乙酰化等相互影响共同参与基 因表达的精细调控。
,
汇报人:
目录 /目录
01
点击此处添加 目录标题
04
组蛋白修饰的 酶类
02
表观遗传学概 述
05
组蛋白修饰的 作用机制
03
组蛋白修饰的 种类
06
组蛋白修饰与 疾病的关系
01 添加章节标题
02 表观遗传学概述
表观遗传学的定义
表观遗传学是研究基因型未发生变化但基因的表达却发生了可遗传变化的科学。 表观遗传学主要关注DN甲基化、组蛋白修饰和非编码RN等对基因表达的影响。 表观遗传学在生物体发育、肿瘤发生和神经科学等领域有广泛应用。 表观遗传学可以通过研究基因表达的可遗传变化来揭示遗传信息与环境因素之间的相互作用。
sirtuins两类具 有不同的生物学 功能和底物特异
性。
研究意义:组蛋 白去乙酰化酶在 多种生物学过程 中发挥重要作用 如细胞分化、肿 瘤发生等是当前 表观遗传学研究
的热点之一。
组蛋白甲基化酶
定义:能够催化组蛋白甲基化反应的酶类
作用机制:通过甲基化组蛋白的特定位点 调控基因的表达
种 类 : 包 括H MTs 和 HM Ts e 等
研究意义:组蛋 白泛素化在表观 遗传学中具有重 要的研究意义对 于理解生物发育、 细胞分化和疾病 发生机制等方面 具有重要意义。
04 组蛋白修饰的酶类
组蛋白乙酰化酶
定义:组蛋白乙 酰化酶是一类能 将乙酰基团转移 至组蛋白特定位 点的酶
作用:调控基因 表达影响细胞分 化、发育和肿瘤 发生等过程
种 类 : 包 括 H Ts 和 K Ts 等 不 同 亚 型具有不同的底 物特异性和功能
与其他修饰的关系:组蛋白磷酸化可以与其他修饰如甲基化、乙酰化等相互影响共同参与基 因表达的精细调控。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯
组蛋白密码学说的完善: 1. 更好地开发新药。研究组蛋白密码对药物开发具有战略
意义,多种组蛋白修饰酶已成为相关疾病治疗的靶目标。比如,组蛋白去乙酰酶
(HDACs)抑制剂已应用于临床治疗多种肿瘤; 2. 深入探讨遗传调控和表观遗传调控相互作用的网络与不同生物学表型之间的关系;
3. 在控制真核基因选择性表达的网络体系内进一步深入理解染色质结构、调控序列以
②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核
小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管);
③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表
达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用;
及调控蛋白之间交互作用的内在机制; 4. 建立基因表达的调控网络数据库及其分析系统。总之,随着越来越多组蛋白核心结
构区域和修饰方式的确定,组蛋白密码在基因调控过程中的作用会越来越明确。
局部乙酰化举例
当DNA与核小体尚未解开缠绕时,转录激活因子如糖皮质激素受体可以和DNA上相应 的反应元件(GRE)结合。当结合至GRE之后,糖皮质激素募集共激活因子如CBP到染色
体上的靶转录基因区。此时,共激活因子利用HAT活性使得结合在DNA启动子区域的核心
组蛋白的修饰作用ppt课件

组蛋白的修饰作用
1
一、组蛋白的定义:
组蛋白是染色体的结构蛋白,与DNA构成核小体。它分为 H1、H2A、H2B、H3和H4等5种。
2
二、组蛋白的特征:
1、进化上的极端保守性: 其保守程度比较:H1<H2A 、H2B<H3 、H4;
2、无组织特异性: 鸟、鱼、两栖类的红细胞染色体不含H1而含H5,精细胞
DNA复制和重组过程发挥着直接的作用。组蛋白H1被细胞周期 蛋白依赖的激酶磷酸化是其主要的修饰作用。组蛋白H1的磷酸 化能够影响DNA二级结构的改变和染色体凝集状态的改变。另 外,组蛋白H1的磷酸化需要DNA复制,并且激活DNA复制的蛋 白激酶也促进组蛋白H1的磷酸化。因此,组蛋白H1的磷酸化与 DNA复制存在一个协同发生的机制。
12
直到1996年,James Brownell 和David Allis 成功的纯化和鉴定 了一种组蛋白乙酰转移酶(Histone acetyltransferase HAT ),该 酶是从供体乙酰辅酶A上将乙酰基团转移到核心组蛋白上。
进一步研究得出HAT的两种作用机制: 1)使组蛋白H1、H2A、H4的氨基末端乙酰化,形成α-乙酰丝氨 酸;通常组蛋白在细胞质内合成后输入细胞核之前发生这一修 饰作用。 2)在组蛋白H2A、H2B、H3 和 H4 的氨基末端区域的某些专一位 置形成N6-乙酰赖氨酸。通常发生在蛋白质的赖氨酸(K)上。如下 图1所示:
由组蛋白甲基化的特定模式识别及结合核小体的蛋白质共同产 生的,并进一步修饰染色质或直接影响转录。
2、组蛋白的甲基化对促进DNA甲基化具有一定的作用。 DNA甲基化在转录水平可影响基因表达、参与真核生物胚胎发 育调节、参与基因组印记和X染色体失活及影响DNA与蛋白质 的相互作用。
1
一、组蛋白的定义:
组蛋白是染色体的结构蛋白,与DNA构成核小体。它分为 H1、H2A、H2B、H3和H4等5种。
2
二、组蛋白的特征:
1、进化上的极端保守性: 其保守程度比较:H1<H2A 、H2B<H3 、H4;
2、无组织特异性: 鸟、鱼、两栖类的红细胞染色体不含H1而含H5,精细胞
DNA复制和重组过程发挥着直接的作用。组蛋白H1被细胞周期 蛋白依赖的激酶磷酸化是其主要的修饰作用。组蛋白H1的磷酸 化能够影响DNA二级结构的改变和染色体凝集状态的改变。另 外,组蛋白H1的磷酸化需要DNA复制,并且激活DNA复制的蛋 白激酶也促进组蛋白H1的磷酸化。因此,组蛋白H1的磷酸化与 DNA复制存在一个协同发生的机制。
12
直到1996年,James Brownell 和David Allis 成功的纯化和鉴定 了一种组蛋白乙酰转移酶(Histone acetyltransferase HAT ),该 酶是从供体乙酰辅酶A上将乙酰基团转移到核心组蛋白上。
进一步研究得出HAT的两种作用机制: 1)使组蛋白H1、H2A、H4的氨基末端乙酰化,形成α-乙酰丝氨 酸;通常组蛋白在细胞质内合成后输入细胞核之前发生这一修 饰作用。 2)在组蛋白H2A、H2B、H3 和 H4 的氨基末端区域的某些专一位 置形成N6-乙酰赖氨酸。通常发生在蛋白质的赖氨酸(K)上。如下 图1所示:
由组蛋白甲基化的特定模式识别及结合核小体的蛋白质共同产 生的,并进一步修饰染色质或直接影响转录。
2、组蛋白的甲基化对促进DNA甲基化具有一定的作用。 DNA甲基化在转录水平可影响基因表达、参与真核生物胚胎发 育调节、参与基因组印记和X染色体失活及影响DNA与蛋白质 的相互作用。
组蛋白的修饰

H3-K9,H3-K27,H4-K20 的甲基化与染色体的
钝化过程有关。
H4-K9 的甲基化可能与大范围的染色质水平
的抑制有关。
H3-K4,
H3-K36, H3-K79 位的甲基化与染色 体转录激活过程有关,其中H3-K4的单甲基化 修饰可以对抗H4-K9甲基化所导致的基因抑 制。
组蛋白赖氨酸甲基化
甲基化与癌
将能使组蛋白特异性修饰的酶比喻为“写手
( writers )”,将能除去组蛋白修饰的酶 比喻为“擦皮( erasers )”,将能识别组 蛋白特异性修饰并与其结合的蛋白比喻为 “读者( readers )”,这样就构成了“书 写(writing)”,“阅读(reading )”和 “涂去( erasing )”的环路,调节局部染 色质的生物学活性和基因表达。
组蛋白的甲基化
核小体
在哺乳动物基因组中,组蛋白则可以有很多修饰形式.。一 个核小体由两个 H2A,两个 H2B,两个 H3 ,两个 H4组成的八 聚体和 147bp缠绕在外面的 DNA组成 . 组成核小体的组蛋白 的核心部分状态大致是均一的,游离在外的 N- 端则可以受 到各种各样的修饰,包括组蛋白末端的乙酰化,甲基化, 磷酸化,泛素化,ADP核糖基化等等,这些修饰都会影响基 因的转录活性。
组蛋白上的甲基化修饰
组蛋白赖氨酸甲基化
组蛋白精氨酸甲基化
组蛋白精氨酸甲基化
组蛋白精氨酸甲基化位点都在 H3 组蛋白上,为 H3-R2, H3R4, H3-R17, H3-R26, 它们都可以增强转录。 真核细胞中,甲基化精氨酸有三种: NG- 单甲基化精氨酸(MMA)
NGNG(不对称)- 二甲基化精氨酸(aDMA)
组蛋白的泛素化与去泛素化
• Ubp-M is essential for Ser-10 H3 phosphorylation mediated by the Aurora B kinase and is required for chromosome segregation during mitosis.
12
DNA damage repair
Schematic depiction of histone ubiquitination
Methods. 2011 Jul; 54(3): 315–9325.
Histone deubiquitinating enzyme(DUBs)
✓ H2A deubiquitination USP 16: HOX gene silencing, DNA damage repair
Histone ubquitination&deubquitination
1
The structure of nucleosome
组蛋白是一种11-15KDa 的碱性蛋白,与DNA相 互作用构成核小体。 核心组蛋白的尾巴伸出 来,受到广泛的修饰。
2
Ubquitin
泛素(ubiquitin,Ub)是 高度保守的、含76个氨 基酸的蛋白质,分子量 为8.5 kDa,在真核生物 体内广泛存在。 泛素分子氨基端1-72位 点的氨基酸残基形成一 个紧密球状结构,紧靠 羧基端的4个氨基酸残基 是随机盘绕的(randomcoiled)。
deubquitinase • Histone modifications crosstalk • Involved in multiple cellular events---gene expression
regulation、DNA damage response and repair、 female X chromosome inactive and so on
12
DNA damage repair
Schematic depiction of histone ubiquitination
Methods. 2011 Jul; 54(3): 315–9325.
Histone deubiquitinating enzyme(DUBs)
✓ H2A deubiquitination USP 16: HOX gene silencing, DNA damage repair
Histone ubquitination&deubquitination
1
The structure of nucleosome
组蛋白是一种11-15KDa 的碱性蛋白,与DNA相 互作用构成核小体。 核心组蛋白的尾巴伸出 来,受到广泛的修饰。
2
Ubquitin
泛素(ubiquitin,Ub)是 高度保守的、含76个氨 基酸的蛋白质,分子量 为8.5 kDa,在真核生物 体内广泛存在。 泛素分子氨基端1-72位 点的氨基酸残基形成一 个紧密球状结构,紧靠 羧基端的4个氨基酸残基 是随机盘绕的(randomcoiled)。
deubquitinase • Histone modifications crosstalk • Involved in multiple cellular events---gene expression
regulation、DNA damage response and repair、 female X chromosome inactive and so on
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化等)-于凯资料
组蛋白修饰的生物学意义
尤其是组蛋白乙酰化、甲基化修饰能为相关调控蛋白提供其在组蛋白上的附着位点,改变染色质结 构和活性。一般来说,组蛋白乙酰化能选择性的使某些染色质区域的结构从紧密变得松散,开放某 些基因的转录,增强其表达水平。而组蛋白甲基化既可抑制也可增强基因表达。乙酰化修饰和甲基 化修饰往往是相互排斥的。在细胞有丝分裂和凋亡过程中,磷酸化修饰能调控组蛋白共价修饰间的关系
组蛋白的其他修饰方式 相对而言,组蛋白的甲基化修饰方式是最稳定的,所以最适合作为稳定的表观遗传信息。而 乙酰化修饰具有较高的动态,另外还有其他不稳定的修饰方式,如磷酸化、腺苷酸化、泛素 化、ADP核糖基化等等。这些修饰更为灵活的影响染色质的结构与功能,通过多种修饰方式 的组合发挥其调控功能。
组蛋白修饰及其功能(乙酰化,甲基化,磷酸化 等)-于凯
组蛋白乙酰化调节转录的机制
组蛋白乙酰化引起染色质结构改变及基因转录活性变化的至少包括以下几个方面: ①组蛋白尾部赖氨酸残基的乙酰化能够使组蛋白携带正电荷量减少,降低其与带负电荷的 DNA链的亲和性,导致局部 DNA与组蛋白八聚体解开缠绕,从而促使参与转录调控的各种 蛋白因子与DNA特异序列结合,进而发挥转录调控作用; ②组蛋白的N末端尾巴可与参与维持染色质高级结构的多种蛋白质相互作用,更加稳定了核 小体的结构。而组蛋白乙酰化却减弱了上述作用,阻碍了核小体装配成规则的高级结构(如 螺线管); ③组蛋白乙酰基转移酶(HAT)对相关转录因子或活化因子进行乙酰化修饰以调节基因的表 达。如 CBP/P300对P53的乙酰化可增强其特异性 DNA结合能力、转录激活能力,并延长其 半衰期。
2. 组蛋白的甲基化
组蛋白甲基化是由组蛋白甲基化转移酶(histone methyl transferase,HMT)完成的。甲基化可发生在组 蛋白的赖氨酸和精氨酸残基上,而且赖氨酸残基能够 发生单、双、三甲基化,而精氨酸残基能够单、双甲 基化,这些不同程度的甲基化极大地增加了组蛋白修 饰和调节基因表达的复杂性。
组蛋白的修饰作用
甲基化转移酶简介
甲基化转移酶分为组蛋白赖氨酸甲基转移酶(HKMT)、组蛋 白精氨酸甲基转移酶(HRMT)2个家族;而多数蛋白甲基转移酶都 包含有SET结构域,含有SET结构域的蛋白主要功能是调节基因活 性,但具体机制还不甚明确。 核小体组蛋白在异染色体基因沉默中发挥关键作用,已有 研究表明很多含有SET结构域的蛋白,如人Suv39H1和裂殖酵母
组蛋白甲基化的功能: 1、组蛋白的甲基化有抑制或激活双重效应,这些效应是 由组蛋白甲基化的特定模式识别及结合核小体的蛋白质共同产 生的,并进一步修饰染色质或直接影响转录。 2、组蛋白的甲基化对促进DNA甲基化具有一定的作用。 DNA甲基化在转录水平可影响基因表达、参与真核生物胚胎发 育调节、参与基因组印记和X染色体失活及影响DNA与蛋白质 的相互作用。
H3K4的甲基化还可促进H3K9的乙酰化。相反,H3K9的甲基化
抑制了H3S10的磷酸化,并且抑制H3K9、H3K14的乙酰化,从 而导致基因沉默。
图3、组蛋白尾部不同修饰的交互作用类型
思考题:组蛋白的修饰及其在转录调控中的作用。(中科院03、10年考题)
Thank you very much!
组蛋白的修饰作用
一、组蛋白的定义:
组蛋白是染色体的结构蛋白,与DNA构成核小体。它分为 H1、H2A、H2B、H3和H4等5种。
二、组蛋白的特征:
1、进化上的极端保守性: 其保守程度比较:H1<H2A 、H2B<H3 、H4; 2、无组织特异性:
鸟、鱼、两栖类的红细胞染色体不含H1而含H5,精细胞
图1所示:
图1、组蛋白的乙酰化与去乙酰化过程
组蛋白乙酰化的生物学功能:
1)可改变蛋白质分子表面的电荷,影响核小体的结构,从
组蛋白修饰
的。
组蛋白乙酰化酶
(3)Hatl、Elp3、Hpa2和其他乙酰化酶
Hatl 最初被把它归为 B型组蛋白乙酰化酶,它主要涉及细 胞质组蛋白乙酰化,这些组蛋白与DNA共同参与细胞核中 染色质的形成。Hatl可以乙酷化组蛋白H4的N端第12位赖 氨酸,第12位赖氨酸也是之前发现的新合成的组蛋白乙酰 化过程中的主要位点。 Elp3是酵母A型乙酰化酶,似乎可以直接影响转录起始和 延伸,因为它是RNA聚合酶E全酶的组成部分。Elp3能够 乙酰化全部4个核心组蛋白。Elp3的作用机制可能与GenS 类似。Elp3在多种真核生物中的同源性以及进化保守性说 明它是非常重要的。
完整的中期染 色体
核小体
核小体是染色体的基本结 构单位,由 DNA 和组蛋白 (histone )构成,是染色 质(染色体)的基本结构 单位。 核小体由相对伸展的连接 DNA相连,形成串珠状 (称为一级结构)
核小体
二级结构是由一系列核小 体盘绕成螺旋并排列形成 30nm 纤维,在间期染色 质和有丝分裂染色体中都 可见到。 30nm的纤维状结构中的 |←二级结构→|← 一级结构 →| DNA 的压缩包装比约为 40 。 纤丝本身再进一步压缩后, 成为常染色质的状态时, DNA的压缩包装比约为 1000 。有丝分裂时染色质 进一步压缩为染色体,压 缩包装比高达 8400 ,即只 有伸展状态时长度的万分 之一。
组蛋白修饰
组蛋白修饰
组蛋白修饰
组蛋白修饰
组蛋白修饰种类
一. 二. 三. 四. 五.
组蛋白的乙酰化 组蛋白的甲基化 组蛋白的磷酸化 组蛋白的泛素化 组蛋白的SUMO化
一、组蛋白的乙酰化
乙酰化修饰是通过组蛋白乙酰化酶的催化作用实现 的。组蛋白乙酰化酶将乙酰CoA的乙酰基转移到组蛋 白N末端尾区内赖氨酸侧链的ԑ-氨基。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
组蛋白修饰与DNA 甲基化之间相互作用模式
组蛋白甲基化在生命体中的作用
组蛋白上的甲基化, 不仅在真核细胞染色质的遗传 外修饰中占有中心地位, 对细胞分化、发育、基因 表达、基因组稳定性及癌症研究等均有深远的影响. 其他类型的甲基化及甲基化酶在生命体中也有十分 重要的作用。组蛋白甲基化的异常或甲基化酶的突 变常会导致疾病的发生。
谢谢观赏!
H3-K9,H3-K27,H4-K20 的 甲 基 化 与 染 色 体 的 钝化过程有关。
H4-K9 的 甲 基 化 可 能 与 大 范 围 的 染 色 质 水 平 的抑制有关。
H3-K4, H3-K36, H3-K79 位的甲基化与染色 体转录激活过程有关,其中H3-K4的单甲基化 修饰可以对抗H4-K9甲基化所导致的基因抑 制。
甲基和亚胺基,进而转化为瓜氨酸,因此这一过程常被称
为去亚胺基化(demination)或瓜氨酸化(citrullination )
另一个酶是JmjC区域包含带白6(JmjC domain-containing 6 protein,JMJD6),它能够特异地将精氨酸上的甲基通过 羟基化的过程转化为甲醛,进而实现甲基的脱离。
甲基化的定义
甲基化(英语:Methylation)是指向底物分子引入甲基的 过程,一般是指由甲基转移酶催化以甲基取代氢原子。
在生物系统内,甲基化是由酶来催化。甲基化可以涉及在 重金属的修饰、基因表现的调整、蛋白质功能调整、及核 糖核酸(RNA)的代谢。
组蛋白上的甲基化修饰
组蛋白赖氨酸甲基化 组蛋白精氨酸甲基化
组蛋白赖氨酸甲基化
组蛋白赖氨酸甲基化修饰是由组蛋白赖氨酸 甲基转移酶和组蛋白去甲基化酶 (Histone demethylases)两大酶类所催化。
组 蛋 白 赖 氨 酸 甲 基 转 移 酶 (HKMTs) 能 够 特 异 地使组蛋白赖氨酸发生甲基化修饰, 并可能 使修饰位点出现不同的甲基化状态, 如单甲 基化(me1)、双甲基化(me2)和三甲基化 (me3)。
核小体
在哺乳动物基因组中,组蛋白则可以有很多修饰形式.。一 个核小体由两个H2A,两个H2B,两个H3,两个H4组成的八 聚体和147bp缠绕在外面的DNA组成. 组成核小体的组蛋白 的核心部分状态大致是均一的,游离在外的N-端则可以受 到各种各样的修饰,包括组蛋白末端的乙酰化,甲基化, 磷酸化,泛素化,ADP核糖基化等等,这些修饰都会影响基 因的转录活性。
组蛋白上的甲基化修饰
组蛋白精氨酸甲基化是一种相对动态的标记, 精氨酸甲基化与基因激活相关,而H3和H4靶 精氨酸的甲基化丢失与基因沉默相关。
组蛋白 赖氨酸甲基 化似乎是基 因表达调控 较为稳定的 修饰,作用 也较复杂。
组蛋白甲基化与组蛋白乙酰化 及DNA 甲基化的联系
关于组蛋白修饰与DNA甲基化之间的相互作用, 目 前 有 以 下 几 种 推 测 : 甲 基 化 的 CpG 连 接 蛋 白 (MBD)募集组蛋白去乙酰化酶复合物,使得组蛋 白尾端便于被HMTs甲基化;染色体上,组蛋白被 高度乙酰化,含有MBD的HMTs可直接结合组蛋白 并将其甲基化;甲基化的组蛋白尾端可募集 DNMTs,导致DNA甲基化,使基因长期沉默。
JHDM是另外一类含JmjC结构域的组蛋白去甲基化酶,它能够 特异性地移去组蛋白上的甲基。JHDM 蛋白现有3 个亚家族: JHDM1、JHDM2和JHDM3。JHDM1能去除H3K36me2和H3K36me1 上的甲基;JHDM2能特异性地去除组蛋白H3K9me2和H3K9me1 上的甲基;JHDM3(也称为JMJD2)能够移去H3K9me3、H3K9me2、 H3K36me3 H3K36me2上的甲基。现在又发现JARID能够清除 H3K4me3和H3K4me2 上的甲基,JMJD3和UTX 能够特异性地去 除H3K27上的甲基。
组蛋白赖氨酸甲基化
组蛋白去甲基化酶能够催化组蛋白赖氨酸发生去甲基化反 应。目前发现的组蛋白去甲基化酶有两类: LSD1 和JHDM。
赖氨酸特异性去甲基酶1(Lysine-specific demethylase1, LSD1), 它是一种氨基酸氧化酶, 能够移去H3K4上的甲基, 抑制基因表达。LSD1的去甲基功能有一定的选择性,它能够 移去H3K4me2和H3K4me1上的甲基,但不能移去H3-K4me3 上 的甲基。
组蛋白上的甲基化修饰
组蛋白赖氨酸甲基化 组蛋白精氨酸甲基化
组蛋白赖氨酸甲基化修饰位点
组 蛋 白 赖 氨 酸 甲 基 化 主 要 发 生 在 组 蛋 白 H3 和H4上。目前研究较多的有6个位点, 其中 有5个存在于H3组蛋白,它们分别位于N-末端 (H3K4、H3K9、H3K27 和H3K36)和球状区域 中(H3K79),另一个位于H4组蛋白赖氨酸N 末 端的K20,还可发生在H1的N端。
大家学习辛苦了,还是要坚持
继续保持安静
组蛋白上的甲基化修饰
组蛋白赖氨酸甲基化 组蛋白精氨酸甲基化
组蛋白精氨酸甲基化
组蛋白精氨酸甲基化
组蛋白精氨酸甲基化
催化组蛋白精氨酸去甲基酶主要有两个:一个是肽基精氨
酸去亚胺基酶4(peptide
arginine
deiminase
4,PADI/PAD4),பைடு நூலகம்能将蛋白质内 单 甲 基 化 的精氨酸脱去加
甲基化与癌
将能使组蛋白特异性修饰的酶比喻为“写手 (writers)”,将能除去组蛋白修饰的酶 比喻为“擦皮(erasers)”,将能识别组 蛋白特异性修饰并与其结合的蛋白比喻为 “读者(readers)”,这样就构成了“书 写(writing)”,“阅读(reading )”和 “涂去(erasing)”的环路,调节局部染 色质的生物学活性和基因表达。
