芳烃稠环化合物
有机化学--第八章芳烃

8.4.1取代反应
1.卤化
在三卤化铁等催化剂作用下,苯与卤素作用生成 卤(代)苯,此反应称为卤化反应。例如:
对于不同的卤素,与苯环发生取代反应的活性次序 是:氟>氯>溴>碘。其中氟化反应很猛烈;碘化反应不 仅较慢,同时生成的碘化氢是还原剂,从而使反应成为 可逆反应,且以逆反应为主。因此氟化物和碘化物通常 不用此法制备。
Br+ + FeBr4-
Br+
3.磺化反应的机理
苯用浓硫酸磺化,反应很慢。若用发烟硫酸磺化, 在室温即可进行。故认为磺化试剂很可能是三氧化硫(也 有人认为是+SO3H)。在硫酸中也能产生三氧化硫:
SO3因为极化使硫原子显正性,通过硫原子进攻苯环。磺 化反应是可逆的。在浓硫酸中,磺化反应机理可能如下:
苯的二元取代物,因取代基在环上的相对位次不同, 有三种(位置)异构体。三元和三元以上的取代苯,因取 代基的位次不同和取代基自身的异构而使异构现象较为 复杂。
8.1.2 命名
①单环芳烃的命名是以苯环为母体,烷基作为取代基,称为某烷 基苯(“基”字常省略)。当苯环上连有两个或多个取代基时,可 用阿拉伯数字标明 其相对位次。若苯环上仅有两个取代基,也常 用邻、间、对或o-(ortho)、m-(meta)、p-(para)等字头表示。例 如:
1
2
3
1.苯环上C—H伸缩振动 2.苯环的C=C伸缩振动 3.二取代苯C—H面外弯曲振动 (770~735)
8.4单环芳烃的化学性质
苯环平面的上下方有π电子云,与σ 键相比,平行重叠的π电子云结合较 疏松,因此在反应中苯环可充当一个电子源,与缺电子的亲电试剂发生反应, 类似于烯烃中π键的性质。但是苯环中π电子又有别于烯烃,π键共振形成的大 π键使苯环具有特殊的稳定性,反应中总是保持苯环的结构。苯的结构特点 决 定 苯 的 化 学 行 为 , 它 容 易 发 生 亲 电 取 代 反 应 ( elcctrophilic substulion reaction)而不是加成反应。
白油中稠环芳烃

白油中稠环芳烃
2. 润滑性能:稠环芳烃在白油中起到润滑剂的作用,能够减少摩擦和磨损,提高机械设备 的工作效率和寿命。
3. 绝缘性能:稠环芳烃具有良好的电绝缘性能,可用于电气设备和电缆的绝缘材料。
4. 溶解性:稠环芳烃在白油中具有良好的溶解性,可用作溶剂,用于溶解和分散其他化合 物。
白油中稠环芳烃
白油是一种无色、无味、无臭的石油炼制产品,主要由碳氢化合物组成。其中,稠环芳烃 是指具有多个苯环连接在一起的芳香烃类化合物。
在白油中,稠环芳烃是一类常见的成分,其含量和种类会因白油的来源和制备方法而有所 不同。稠环芳烃在白油中的含量较高时,可能会对白油的性质和用途产生一定的影响。
稠环芳பைடு நூலகம்具有以下特点和用途:
需要注意的是,稠环芳烃在一些特定条件下可能会对环境和人体健康产生潜在的风险。因 此,在使用和处理白油及其含有的稠环芳烃时,需要遵循相关的安全操作规范,并采取适当 的措施来保护环境和人体健康。
芳烃稠环化合物

芳烃稠环化合物是由两个或多个芳香环稠合在一起形成的化 合物,这些芳香环可以是苯环、萘环、蒽环等。这些化合物 通常具有较高的化学稳定性和热稳定性,因此在化学工业、 材料科学和制药等领域有广泛的应用。
分类
要点一
总结词
芳烃稠环化合物可以根据其结构特征和组成进行分类。
要点二
详细描述
根据其结构特征,芳烃稠环化合物可以分为单环芳烃稠环 化合物、双环芳烃稠环化合物和多环芳烃稠环化合物等。 根据其组成,芳烃稠环化合物可以分为碳基芳烃稠环化合 物和杂环芳烃稠环化合物等。其中,碳基芳烃稠环化合物 是最常见的类型,主要由碳原子组成,而杂环芳烃稠环化 合物则含有其他非碳元素,如氮、氧、硫等。
探索稠环芳烃在药物设计、生 物标记和诊断试剂等方面的潜
在应用。
展望
拓展应用领域
随着研究的深入,稠环芳烃有望在更 多领域得到应用,如能源、环保、催 化等。
绿色化学发展方向
发展环境友好、资源高效的合成方法, 实现稠环芳烃的可持续发展。
跨学科合作
加强化学与其他学科(如生物学、物 理学、医学等)的交叉合作,从多角 度挖掘稠环芳烃的潜在价值。
面临的挑战
合成难度大
芳烃稠环化合物的合成过程复杂,需要经过多步 反应和精细的化学调控,合成效率有待提高。
分离纯化困难
由于芳烃稠环化合物的结构复杂,其分离纯化过 程较为困难,需要采用高效的分离技术和方法。
稳定性差
芳烃稠环化合物通常稳定性较差,容易发生氧化、 水解等反应,需要采取有效的保护措施。
05
02
芳烃稠环化合物的合成 方法
化学合成法
01
02
03
苯胺氧化法
通过苯胺的氧化反应,将 苯环稠合成芳烃稠环化合 物。
主要成分为多环、稠环芳烃及其衍生物

主要成分为多环、稠环芳烃及其衍生物
多环、稠环芳烃及其衍生物是一类化学物质,由多个芳环或稠环结构组成,具有独特的化学性质和广泛的应用领域。
本文将从多环、稠环芳烃的定义、结构特点、合成方法、应用领域等方面进行介绍。
多环、稠环芳烃是指由多个芳环或稠环结构组成的有机化合物。
其主要特点是分子中存在多个芳环或稠环结构,这些环之间通过共用原子或键相连接。
多环、稠环芳烃的结构复杂多样,其中包括许多具有重要生物活性和药用价值的化合物。
多环、稠环芳烃的合成方法多种多样,常见的方法包括芳香烃的环化反应、芳香烃的偶联反应、芳香烃的加氢反应等。
其中,芳香烃的环化反应是最常用的合成方法之一。
该反应通过在适当的条件下,使芳香烃分子内的某些原子或键发生重排或重组,从而形成多环、稠环芳烃。
多环、稠环芳烃在生物医药、材料科学、环境保护等领域具有广泛的应用价值。
在生物医药领域,许多多环、稠环芳烃具有良好的药物活性,可以用于研发新药。
例如,多环芳烃类化合物阿霉素是一种广谱抗肿瘤药物,已被广泛用于临床治疗各种恶性肿瘤。
在材料科学领域,多环、稠环芳烃具有优异的光电性能和导电性能,可用于制备光电材料和导电材料。
在环境保护领域,多环芳烃类化合物苯并[a]芘是一种常见的环境污染物,其存在会对人体健康和生态环境产生不良影响,因此需要加强对其的监测和治理。
多环、稠环芳烃及其衍生物是一类具有特殊结构和重要应用价值的化合物。
通过合理的合成方法和应用研究,可以进一步发掘其潜在的生物活性和应用价值,为人类社会的发展做出更大的贡献。
稠环芳烃编号方式

稠环芳烃编号方式简介稠环芳烃是一类化合物,由多个苯环通过共用原子而形成。
它们在有机化学领域具有重要的地位,具有广泛的应用前景。
为了方便对各种稠环芳烃进行分类和命名,科学家们制定了一套编号方式,以便更好地理解和研究这些化合物。
稠环芳烃的定义稠环芳烃是指由至少三个芳香环组成的化合物。
这些芳香环之间通过共用原子相连,形成了稠密的环状结构。
稠环芳烃具有独特的物理和化学性质,常用于药物合成、材料科学等领域。
稠环芳烃编号方式稠环芳烃的编号方式采用了IUPAC系统,即国际纯粹与应用化学联合会制定的规范。
根据这套系统,稠环芳烃的命名是基于其分子结构的。
基本原则稠环芳烃编号方式的基本原则如下:1.从最长的稠环开始编号,使得编号的原子数最小。
2.选择使得编号的原子序数最小的第一个原子。
3.如果有多个相同的原子,选择使得编号的原子序数和原子序数最小的第一个原子。
4.如果有多个相同的原子序数和原子序数的原子,选择使得编号的原子序数和原子序数最小的第一个原子。
编号示例为了更好地理解稠环芳烃编号方式,我们来看一个具体的例子。
考虑以下化合物:这个化合物由三个芳香环组成,我们需要对其进行编号。
首先,我们从最长的稠环开始编号。
在这个例子中,最长的稠环由6个原子组成,我们将其编号为1-6。
接下来,我们选择使得编号的原子序数最小的第一个原子。
在这个例子中,我们选择了1号原子作为起点。
然后,我们继续按照原子序数和原子序数的大小进行编号。
在这个例子中,我们选择了2号原子作为下一个编号。
最后,我们继续按照原子序数和原子序数的大小进行编号,直到所有的原子都被编号。
根据上述编号方式,这个化合物的编号应为1-2-3-4-5-6。
名称表示除了编号方式外,稠环芳烃还可以通过名称来表示。
根据IUPAC系统,稠环芳烃的命名是基于其结构和编号的。
稠环芳烃的名称通常由两部分组成:前缀和后缀。
前缀表示稠环的结构,后缀表示芳香环的数量。
例如,对于上述编号为1-2-3-4-5-6的化合物,其名称为”benzo[a]pyrene”。
芳烃稠环化合物
CS2 150℃
C6H5NO2 250℃
O C CH3
+
O C CH3
OH
O C CH3 3/1
可见: 酰基化是合成萘的β-取代物的又一条途径。
O
C CH3 Cl2,NaOH 60~70 ℃
COOH + CHCl3
E:氯甲基化:
+
HCHO
ZnCl2 HCl
CH2Cl
α-氯甲基萘
F、萘亲电取代反应的定位规则
[14]轮烯: π电子数满足Hückel规则
HH
环内质子的化学位移为δ=0 ppm,
HH
环外质子化学位移为δ=7.6 ppm
有芳香性
[16]轮烯
[18]轮烯
HH
H
H
H
H HH
H
H
HH H
H
H H
H H
18-轮烯
π电子数满足Hückel规则, 由于环较大,环内氢没有 拥挤,因此有芳香性
其它环状共轭多烯
1,2,5,6-二苯并蒽
1,2,3,4-二苯并菲
八、芳烃的来源:煤、石油
1、从煤焦油中苯、萘等。 2、芳构化
烷烃、环烷烃在一定温度压力, 催化剂 作用下环化去氢转化为芳烃—铂重整。
3 、从石油裂解产品中分离
芳烃的鉴别:
1、
发烟 H2SO4 R
×
5
4
萘
有一个取代基时,可用α、β命名,也可用阿 拉伯数字标明取代基位置。
环上有两个或两个以上取代基时,必须编号。 编号须从任一α位开始,编完一个环,再编另 一环,并考虑取代基的位次。
CH3 H3C
1-甲基萘
α-
2-萘磺酸
各类环烃知识点总结
环烃第一节 脂环烃 一、脂环烃的命名环烃:由碳和氢两种元素组成的环状化合物。
分类环烷烃 脂环烃 环烯烃 环烃 环炔烃芳香烃 单环 多环脂环烃命名与相应脂肪烃相同,只是在名称前加“环”。
C H C H C H C H 3C H 3C H 3CH 3环丙烷 1-甲基-3-乙基环己烷 4-甲基-5-乙基环己烯 1.当环上有取代基时,取代基小时用环作为母体。
当环与长碳链相连时,用碳链作为母体。
把环作为取代基。
环丙基环己烷 3-甲基-4-环戊基庚烷2.桥环烃:共用两个或两个以上碳原子的多环化合物。
共用碳为桥头碳:⑴ 编号 从一桥头碳沿最长的桥编到另一桥头碳,再沿次长桥编到原桥头碳,依次编下去。
⑵ 书写:取代基写在前,再写“某环”,再在[]内写桥头碳间的原子数,数字间用“.”隔开,最后写环上所有碳的烷烃的名称。
二环[1.1.0]丁烷 2,7,7-三甲基二环[2.2.1]庚烷二、 结构环烷烃中的碳为sp 3杂化。
对环丙烷为例进行分析如下,在环丙烷中,三原子在同一平面上,夹角为60°,但是C 为sp 3杂化正常的键角应为109.5°,故C-C 键电子云重叠方向不可能是沿两原子连线方向,必然有一定的偏离,即未达到最大重叠,所成σ键不稳定,这种不稳定的σ键常称之为张力。
12345CH 31C H 22C H 3CH 4C H 25C H 26C H 37C H 383124123456789角张力:由于键角的偏移引起的张力,称为角张力。
三元以上的环也存在同一问题,但是C 原子可以不在同一平面内,而是尽可能使张力减小,一般来说,五元、六元环最稳定。
三、 性质1.物理性质 同烷烃相似,不溶于水,比重比水小,沸点比相应烷烃略高。
2. 化学性质⑴ 催化氢化 三元环、四元环容易开环加氢,五元环、六元环比较稳定难于开环。
⑵ 与Br 2反应:注意反应的条件,在光照条件下发生自由基取代反应。
H 2Ni Pt C H 3C H2C H 3+/50℃80℃H 2Ni Pt C H 3C H 2C H 2C H 3+/200℃250℃Br2CCl 4C H 2C H 2C H 2BrBr+C H 2C H 2C H 2C H 2BrBr+CCl 4△++hγhγBrBrBrH BrH +++hγBrBrH +或高温或高温或高温Br 2Br 2Br 2Br 2⑶ 与卤化氢反应: 常温下环丙烷可以与氯化氢,溴化氢反应,环丁烷常温下不发生此反应。
有机物种类
有机物种类有机物种类繁多,可分为烃和烃的衍生物两大类。
根据有机物分子的碳架结构,还可分成开链化合物、碳环化合物和杂环化合物三类。
根据有机物分子中所含官能团的不同,又分为烷、烯、炔、芳香烃和卤代烃、醇、酚、醚、醛、酮、羧酸、酯等等。
按碳的骨架1、链状化合物这类化合物分子中的碳原子相互连接成链状,因其最初是在脂肪中发现的,所以又叫脂肪族化合物。
其结构特点是碳与碳间连接成不闭口的链。
2、环状化合物环状化合物指分子中原子以环状排列的化合物。
环状化合物又分为脂环化合物和芳香化合物。
(1)脂环化合物:不含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环的化合物。
如环丙烷、环己烯、环己醇等。
(2)芳香化合物:含芳香环(如苯环、稠环或某些具有苯环或稠环性质的杂环)的带有环的化合物。
如苯、苯的同系物及衍生物,稠环芳烃及衍生物,吡咯、吡啶等。
按组成元素1、烃。
仅含碳和氢两种元素的有机物称为碳氢化合物,简称烃。
如甲烷、乙烯、乙炔、苯等。
甲烷是最简单的烃。
2、烃的衍生物。
烃分子中的氢原子被其他原子或者原子团所取代而生成的一系列化合物称为烃的衍生物。
如卤代烃、醇、氨基酸、核酸等。
按官能团官能团:决定化合物特殊性质的原子或原子团称为官能团或功能基。
含有相同官能团的化合物,其化学性质基本上是相同的。
常见官能团碳碳双键、碳碳三键、羟基、羧基、醚键、醛基、羰基等。
同系物:结构相似,分子组成上相差一个或若干个“CH₂”原子团的有机物称为同系物。
且必须是同一类物质(含有相同且数量相等的官能团,羟基例外,酚和醇不能成为同系物,如苯酚和苯甲醇)。
由于结构相似,同系物的化学性质相似;它们的物理性质,常随分子量的增大而有规律性的变化。
生活中常见的、与人类关系密切的有机物主要有:糖、蛋白质、脂肪等,因为它们是我们每天在食物中摄取的主要营养成份;其它的还有:塑料、尼龙、橡胶、棉布、纸张、烟酒等等。
有机物是生命产生的物质基础,所有的生命体都含有机化合物,如脂肪、氨基酸、蛋白质、糖、血红素、叶绿素、酶、激素等。
稠环芳烃编号方式
稠环芳烃编号方式
【原创实用版】
目录
1.稠环芳烃的定义与性质
2.稠环芳烃的编号方式及其规则
3.稠环芳烃编号方式的实际应用
4.稠环芳烃编号方式的重要性
正文
稠环芳烃是一类具有特殊物理和化学性质的有机化合物,其分子结构中含有两个或两个以上的苯环。
由于稠环芳烃的结构复杂,对其进行编号和命名十分重要。
本文将详细介绍稠环芳烃的编号方式。
稠环芳烃的编号方式主要遵循以下规则:
1.选择分子中最大的苯环作为主环。
主环的编号通常从距离支链最近的碳原子开始,按照顺时针或逆时针方向进行。
2.对于主环上带有支链的情况,需要将支链所在的碳原子编号为 1,以便区分不同的取代基。
3.若分子中存在多个苯环,则需要按照分子中各苯环的大小进行编号。
编号时,从最大的苯环开始,依次编号较小的苯环。
4.对于某些具有特定结构的稠环芳烃,其编号方式可能需要参照IUPAC(国际纯粹与应用化学联合会)的命名规则进行。
稠环芳烃编号方式在实际应用中具有重要意义。
例如,在化学研究、材料科学和药物设计等领域,准确地描述稠环芳烃的结构和性质有助于科研人员更好地理解和利用这类化合物。
此外,对于化学品生产和安全管理等方面,正确的编号方式也有助于提高工作效率和防止事故发生。
稠环化合物红外光谱解析
稠环化合物红外光谱解析一、引言稠环化合物是一类具有两个或更多环的有机化合物,这类化合物在自然界中广泛存在,如某些色素、染料、药物和生物碱等。
稠环化合物的结构特点使其在物理、化学、生物学和医学等方面具有重要的应用价值。
红外光谱是研究化合物结构的重要手段之一,通过解析稠环化合物的红外光谱,可以深入了解其分子结构和化学键信息,为相关领域的研究提供有力支持。
二、稠环化合物的分类与结构特点稠环化合物根据环的数目和类型可以分为不同类别,如稠环芳烃、稠环脂肪烃和稠环杂环化合物等。
这些化合物通常具有稳定性较好、光学性能优异等特点。
稠环化合物的结构特点主要包括以下几个方面:1.环的数目和类型:稠环化合物中的环可以是六元环、七元环或更多元环,不同数目和类型的环会导致化合物的性质和功能有所差异。
2.取代基的类型和数目:稠环化合物中的取代基可以是氢、烷基、芳基等,这些取代基的类型和数目也会影响化合物的性质和功能。
3.化学键的性质:稠环化合物中的化学键可以是单键、双键或三键,不同性质的化学键会影响化合物的反应活性和稳定性。
三、红外光谱基本原理与特点红外光谱是一种基于分子振动和转动能级跃迁的光谱技术,当红外光照射到样品上时,若样品分子能够吸收特定波长的光,就会引起分子振动能级和转动能级的跃迁,从而产生红外吸收光谱。
红外光谱具有以下特点:1.特征性:每种化合物都有其独特的红外光谱,因此红外光谱可以用于化合物的定性和结构分析。
2.穿透性强:红外光具有较好的穿透能力和较低的能量,适用于各种类型的样品分析。
3.灵敏度高:红外光谱可以对微量样品进行分析,灵敏度较高。
4.应用范围广:红外光谱可以用于气体、液体、固体等多种样品的分析,应用范围广泛。
四、稠环化合物红外光谱解析方法解析稠环化合物的红外光谱需要采用适当的方法,以下是一些常用的解析方法:1.谱图检索比对法:将样品的红外光谱与已知的红外光谱数据库进行比对,从而确定化合物的结构和类别。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
H SO3H
H SO3H
有 排斥 作用
α-取代,动力学控制产物 α位活泼,但产物不稳定
β-取代,热力学控制 β位不活泼,但产物稳定
磺化反应是可逆反应,形成的α-萘磺酸 在高温下可转变为稳定的β-萘磺酸
应用:制备其它β-取代物的桥梁。
SO3Na NaOH 300℃
ONa + H
D:酰基化反应
酰基进入的位置与反应条件有关
3、性质
白色片状晶体,m.p. 80.2℃ 易升华
1)取代反应(比苯易,主要发生于α位)
A:卤代
Br2/CCl4
Cl2/Fe
Br Cl
+
Cl
5%
95%
B: 硝化:
HNO3 H2SO4
α位比β位活泼的原因:
NO2
Fe HCl
NH2
α-萘胺
生成α取代产物时形成σ络合物较稳定, 因此其活化能较低,反应速率快
Br CH3
(2)原取代基为第二类定位基,则异环α取代
SO3H 混酸
SO3H
NO2
NO2 混酸
NO2
+
NO2 NO2
NO2 NO2 HNO3-H2SO4
NO2
+
NO2
NO2
例外:
NO2
CH3 92% H2SO4
CH3
90~180℃
HO3S
6-甲基-2-萘磺酸
2)氧化反应(比苯易被氧化)
弱氧化→醌: 强氧化→环破裂
1、芳香性的判据——Hückel(4n+2)规则
含有4n+2个π电子的平面单环共轭体系具
有芳香性。 n=0,1,2,3,4 … H-NMR判断:
环内质子化学位移小,环外质子化学位移大
环辛四烯
H H
(1)
CH2
(3)
10-轮烯
H
H
(2)
1,6-亚甲基环癸五烯
有芳香性
δ= 0.5 ppm CH2
δ= 7.5 ppm (4)
F、萘亲电取代反应的定位规则
进入的基团可以发生在已有取代基的环上 (同环取代),也可以发生在另外一个环上 (异环取代)
(1)原取代基为第一类取代基,发生同环取代: 若原有基在α位,则新引入基进入另-α位, 若原有基在β位,则进入邻-α位:
即邻对位定位基
OMe
混酸
OMe
NO2 邻对位定位
CH3 Br2 CS2
C:磺化:
萘与浓硫酸进行磺化反应时,低温反应主要
生成α-萘磺酸,高温主要生成β-萘磺酸:
60℃
SO3H
+ H2SO4
SO3H
160℃
α位的活性高,反应速率快,动力学控制 β位的产物是稳定性的产物,热力学控制
原因:α位活性比β位大,反应速度较β位快,
低温时反应主要发生于α位。但-SO3H 的体积较大,在α位时,与8位C-H平行, 空间相互拥挤,因此是不稳定产物。
O
CrO3
CH3COOH O
O
+
V2O5 , K2SO4 O2 385-390℃
C O
C
O
邻苯二甲酸酐
用于合成染料、树脂、增塑剂等
3)还原反应: 萘的一个苯环容易被还原:
Na + 异戊 醇
132℃
(二)蒽、菲 C14H10
8
9
1
7
2
6
3
5
10
4蒽
四氢萘,萘满 沸点207℃,Tetralin
5 6
3
4
Байду номын сангаас
2
1
菲
7 8
10 9
致癌芳烃: 蒽、菲、芘的许多衍生物具有很强的致癌性:
3,4-苯并芘
1,2,5,6-二苯并蒽
1,2,3,4-二苯并菲
八、芳烃的来源:煤、石油
1、从煤焦油中分离 煤焦油(煤干馏的副产品)主要成份苯、
甲苯、二甲苯、萘等。 2、芳构化
烷烃、环烷烃在一定温度压力, 催化剂 作用下环化去氢转化为芳烃—铂重整。
3 、从石油裂解产品中分离
芳烃的鉴别:
1、
发烟 H2SO4 R
×
溶解
2、
R(含α氢) KMnO4 褪色
3、 苯及其同系物 萘 ……… 蒽 ………
HCHO H2SO4
土红色 蓝紫色 显色 蓝绿色
九、非苯芳烃和Hückel (4n+2) 规则 (休克尔)
前面提到的芳烃都具有苯环,结构上是 环状共轭三烯,那么是否具有环状共轭体系 的多烯都具有芳香性?
生成σ络合物的共振式如下:
H NO2
+
H NO2
H NO2
H NO2
+
+
+
H
+
NO2
H NO2
+
H NO2
+
7个共振式,其中4个保持完整的苯环结构
进攻β位生成的σ络合物的共振式为
+ NO2 H
+ NO2 H
+
NO2
H
NO2 H
+
NO2
H
+
NO2 H
+
6个共振式,但只有两个保持了苯环结构
萘的亲电取代反应一般发生在α位
CH3 H3C
1-甲基萘
α-
2-萘磺酸
β-
SO3H
OH
6-甲基-1-萘酚
2、萘结构
HH
0.142 0.136nm
H
H
0.139 0.140
H
H
HH
平面型
π 10 10
C-C键长不完全相等
α位电子云密度大
芳香性比苯差:
(π电子离域,萘有255.39KJ/mol的共轭能,较稳定有芳香性。 但小于2×150.72(两单独苯环),稳定性不如苯。)
其它环状共轭多烯
π
电 子
2
4
数 非环状 平面型
共轭
4
非环状 共轭
非芳性 非芳性 非芳性
[12]轮烯: π电子数不满足Hückel规则
[14]轮烯: π电子数满足Hückel规则
HH
环内质子的化学位移为δ=0 ppm,
HH
环外质子化学位移为δ=7.6 ppm
有芳香性
[16]轮烯
[18]轮烯
HH
H
H
H
H HH
H
H
HH H
H
H H
H H
18-轮烯
π电子数满足Hückel规则, 由于环较大,环内氢没有 拥挤,因此有芳香性
O
+ CH3-C-Cl
CS2 150℃
C6H5NO2 250℃
O C CH3
+
O C CH3
OH
O C CH3 3/1
可见: 酰基化是合成萘的β-取代物的又一条途径。
O
C CH3 Cl2,NaOH 60~70 ℃
COOH + CHCl3
E:氯甲基化:
+
HCHO
ZnCl2 HCl
CH2Cl
α-氯甲基萘
化学性质类似于单环芳烃:
硝化
硝化 ?
?
联苯的性质与苯相似,苯基是第一类定位 基,但由于邻位上的空阻,主要形成对位产物. 二元取代反应发生在哪个苯环上,取决于活性 大小。
(另外,存在对映异构的条件。立体化学中学习)
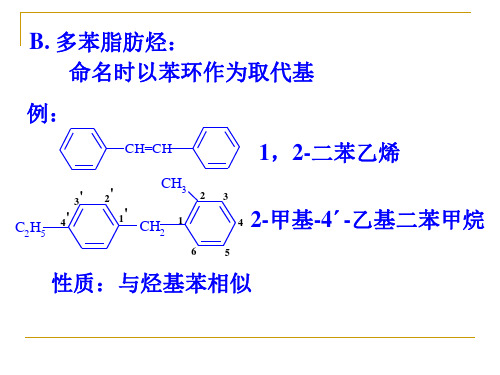
B. 多苯脂肪烃: 命名时以苯环作为取代基
例:
CH=CH
1,2-二苯乙烯
3' C2H5 4'
2'
CH3 2
1' CH2 1
6
3
4 2-甲基-4´-乙基二苯甲烷
5
性质:与烃基苯相似
C. 稠环芳烃 常见的
(一)萘(C10H8) (重点) 1、命名
8 7
1 2
1,4,5,8——α位
6
3 2,3,6,7——β位
5
4
萘
有一个取代基时,可用α、β命名,也可用阿 拉伯数字标明取代基位置。
环上有两个或两个以上取代基时,必须编号。 编号须从任一α位开始,编完一个环,再编另 一环,并考虑取代基的位次。
