不对称aldol 反应
不对称有机合成反应简述

不对称有机合成反应简述摘要:手性,是用来表达化合物构型的不对称性的术语,它是指化合物分子或者分子中某些基团的构型可以排列成互为镜像但是不能重叠的两种形式。
合成单一手性对映体的有效方法就是不对称合成。
这种合成往往要在催化剂作用下进行,因此称为“不对称催化反应”。
关键词:手性分子催化剂合成重要反应正文手性分子以其特殊的性能在有机合成的前沿地带经久不衰,在材料多样化的21世纪,手性分子的发展定会进入一个新的时代。
瑞典时间2001年10月10日11∶45分,瑞典皇家科学院宣布,将2001年度诺贝尔化学奖授予美国化学家诺尔斯(W. S. Knowles)、日本化学家野依良治(R. Noyori)和美国化学家夏普雷斯(K. B. Sharpless),以表彰他们在手性催化氢化反应和手性催化氧化反应研究方面所做出的卓越贡献。
自引入手性的概念以来,有机化学及其相关领域取得了迅猛的发展。
不对称合成作为有机化学的一个分支学科,在手性起源的研究和光学活性化合物的合成等方面的重要性日趋明显。
鉴于手性合成在现代合成业的“明星”地位,我将从以下几个方面简述它。
(一)实际应用一说不对称合成的实际应用,我们会立马想到手性药物。
当前,手性药物的研究与开发已成为世界新药发展的方向和热点领域。
据统计,世界上销售的药物总数为1850种,天然及半合成药物523种,其中手性药物为517种;合成药物1327种,其中手性药物528种。
但是,纯净的手性物质在大自然中的含量是极少的,工业合成的对映体,得到的是外消旋体,我们需要的仅仅是其中一种,一种只能浪费掉,别是另一种若有毒,比如说:从这可以看出,合成纯净单一的对映体已成为一种迫切的必要。
随着现代信息社会的发展,其合成技术日趋多样化以及高效化。
(二)手性合成技术上面已经说到,寻求优化合成方法是现代手性合成永恒不变的主题,那么,究竟有哪些技术呢?1.手性拆分是相对快捷合成手性化合物的方法外消旋体拆分法需要选择适当的溶剂,而找出一个合适的拆分剂是是十分困难的。
脯氨酰胺功能化介孔材料催化不对称aldol反应的反应条件优化

脯氨酰胺功能化介孔材料催化不对称aldol反应的反应条件优化摘要:本文制备了甲基修饰的脯氨酰胺功能化的介孔材料,研究结果表明:通过对反应条件的筛选,发现在水溶液中材料显示了对不对称aldol反应的最好的催化性能,催化剂可以循环使用5次,并且手性选择性基本保持不变。
关键词:介孔材料功能化脯氨酰胺不对称aldol反应自2000年,Barbas等人报道了L-proline催化的不对称aldol反应以来,不对称有机催化有了蓬勃的发展,已被人们认为是继过渡金属不对称催化和酶催化之后的第三种重要的不对称催化方法[1,2]。
相对于过渡金属催化剂,有机催化剂不需要使用价格高昂并且具有毒性的过渡金属,并且有机催化剂相对于过渡金属催化剂和酶催化剂不仅价格便宜,而且催化反应操作简单,因此,很多重要的不对称碳-碳键、碳-氮键形成反应的有机催化剂被开发出来。
基于文献中有报道L-脯氨酰胺是直接不对称aldol反应的高效催化剂[3],本文中,我们合成了含有L-脯氨酰胺功能团的介孔材料,另外有报道,甲基修饰可以提高脯氨酰胺功能化介孔材料的催化性能[4],我们制备了甲基修饰的脯氨酰胺功能化的介孔材料,并详细研究了反应条件(温度、溶剂、添加剂等)对催化性能的影响,并研究了催化剂的循环使用性能。
一、实验部分1.材料制备脯氨酰胺功能化的SBA-15型介孔材料参照文献制备[5]。
具体合成过程如下:28 mL HOAc-NaOAc 缓冲溶液中(pH=4.4,HOAc:0.52 mol/L,NaOAc :0.27 mol/L)加入1.0 g P123溶解,在25 oC 搅拌20 小时。
然后,向上述溶液中加入2.03 mL硅酸钠水溶液(20% SiO2,6% Na2O),10分钟后,将TEOS (6.8 mmol)与(2S,1’R,2’R)-N-t-butyloxycarbonylpyrrolidine-2-carboxylic acid [2’-(4-trimethoxysilylbenzylamide)-cyclohexyl]amide (PCA,1.7 mmol)与1.69g 乙醇超声混匀,加入到上述溶液中,然后在40oC 搅拌24 小时。
手性伯胺催化的不对称Aldol反应

Alo d l反 应被 认 为是现 代有 机合 成 中最有 效 的形成 碳碳键 的方法 之一 L,应 用 此反应 可 1 J 以合 成含 有两 个立 体 中心 的 B羟 基 羰基 化合 物 。自从 2 0 一 0 0年 L s 教授 发现 脯氨 酸 可 以催 化 i t
分 子 间 的不对 称 A dl lo 反应 以来 [,越 来 越 多 的科 学 家开 始致 力于 寻找 高效 的有 机催 化剂 。 2 】 鉴 于 此 ,我们 设计 合成 了一 系列 新型 的双 官 能 团控 制 的伯胺催 化 剂 , 化环 己酮 与对 硝基 苯 催
中 国 .成 都 2 1 00年 9月 全 国第 1 6届有 机 和精 细化 工 中 间体 学术 交流 会
手性伯胺催 化 的不对 称 A d l反应 lo
李慧 ,徐大震 ,刘英 俊 ,王永梅
南开大学元素有机国家重 点实 验室,3 0 7 ,天津 00 1 Emaly — i mw@nn ae u a : a k id . . c
【】 Ls R A. e r n . . ab ,l JA C e S c, 0 0 12 2 9 . 2 B. i, . L me d F B ra I ,= m. h m. o . 0 , 2 , 3 5 t a C s l 2
Die t y m ercAl o a t n t l z d b ia r c As m ti d l Re c i sCa ay e y Ch r l o P i a yAm i e t l ss rm r n sCa ay t
T eAl o e c in i e o n z da n f h s o ru t o sf r h o ma i n o c r o - a b nb n s n h d l a t r c g ie o eo t emo t wef l r o s s o o d t o i
离子对负载L-脯氨酸阴离子催化下的不对称Aldol反应

离子对负载L-脯氨酸阴离子催化下的不对称Aldol反应刘蝶丽;郭国长;赵晓伟;崔元臣【摘要】在水相中,通过阴阳离子结合使L-脯氨酸阴离子负载在基于Merrifield树脂的季铵根阳离子上,制备出功能性高分子离子液体.将该体系作为一种高效、可回收的催化剂用于催化醛与酮的不对称Aldol反应.结果表明:该催化体系在微量水中有很好的催化活性和立体选择性,相应的Aldol反应产物获得了6 : 94的dr值以及高达98%的ee值,且该催化体系有较好的重复使用性能.%L-Proline was loaded on the basis of quaternary ammonium cation based on Merrifield resin by ion pair in aqueous solution. The obtained heterogeneous catalyst was used to successfully catalyze direct asymmetric aldol reaction between aldehyde and ketone. The results show that the catalytic sys-tem has good catalytic activity and stereoselectivity in trace water,affording good enantioselectivity(up to 98%) and diastereoselectivity (up to 6 : 94),and the catalyst system has good reusability.【期刊名称】《化学研究》【年(卷),期】2018(029)002【总页数】6页(P146-151)【关键词】Merrifield树脂;季铵根阳离子;L-脯氨酸;离子液体;Aldol反应【作者】刘蝶丽;郭国长;赵晓伟;崔元臣【作者单位】河南大学化学化工学院,河南开封475000;河南大学纳米材料工程研究中心,河南开封475000;河南大学化学化工学院,河南开封475000;河南大学化学化工学院,河南开封475000;河南大学纳米材料工程研究中心,河南开封475000【正文语种】中文【中图分类】O621;O635直接不对称Aldol反应是形成C-C键的重要方法之一,它被广泛应用于有机合成、医药、农药和精细化工行业中. 自2000年,LIST等发现脯氨酸可作为一种高效催化剂催化酮和苯甲醛分子间的直接不对称Aldol反应以来,脯氨酸作为一种重要的手性小分子催化剂一直备受关注[1]. 虽然脯氨酸有机小分子催化剂具有催化活性高、反应操作简单、环保安全的优势,但在均相催化过程中,脯氨酸也存在一些缺陷,如稳定性差、使用量较大、分离和回收困难等不足[2-4]. 因此,近年来,L-脯氨酸的固载化和重复回收利用受到广泛关注. 负载型脯氨酸催化剂,克服了脯氨酸在均相催化过程中不能回收和重复使用的缺点. 聚合物、二氧化硅、离子液体等常被用作载体来负载脯氨酸及其衍生物[5-8].室温离子液体是熔点低于100 ℃、由阴阳离子构成的有机盐,具有易溶解、化学稳定性好、热稳定性高、无味、可重复使用、易功能化等特点,也称为低温熔融盐. 离子液体的阴阳离子结构可被设计和修饰,以达到所需的性能. 通过相对绿色方法如离子交换和酸碱中和反应,很多天然产物可被转化成离子液体[9-12]. 国内外有关离子液体的报道很多, 1997年,HOWARTH等首次合成了手性离子液体,合成后的手性离子液体作为Lewis酸来催化不对称Diels-Alder反应[13]. 2006 年, ZLOTIN小组报道了自负载离子液体,脯氨酸等催化中心可通过离子对作用负载到离子液体上, 同时达到回收离子液体和催化剂的目的[14]. 2010年王永梅合成了离子液体/脯氨酸催化剂,并系统地测试了其催化性能[15]. 由于手性离子液体同时具有离子液体和手性的特征,既可以作为手性溶剂,又可以作为手性诱导剂,从而引起了化学家的重视.本文拟用酸碱离子对对有机小分子催化剂脯氨酸进行负载,用聚合物阳离子负载L-脯氨酸阴离子,生成以L-脯氨酸为阴离子、基于Merrifield负载的季铵根为阳离子的功能高分子离子液体,将制备的催化剂用于催化醛、酮分子间的直接不对称Aldol反应,并探讨了溶剂、催化剂用量等不同条件对其催化性能的影响.1 实验部分1.1 试剂与仪器1)主要仪器傅立叶变换红外光谱仪(FI-IR):美国尼高力公司(AVATAR360型);凝胶渗色谱(GPC):美国Wyatt Technology公司(DAMN EOS);高效液相色谱仪(HPLC):美国安捷伦公司(Agilent 1100型); PE 2400-II. CHNS/O型元素分析仪.2)主要试剂与药品L-脯氨酸:吉尔生化(上海)有限公司;Merrifield树脂:日本吴羽株式会社(type#2051-2);三甲胺、三乙胺:阿拉丁试剂公司;对氟苯甲醛:AR 阿拉丁试剂公司;对溴苯甲醛、邻溴苯甲醛:AR Alfa Aesar试剂公司;对氰基苯甲醛、邻硝基苯甲醛、对氯苯甲醛:CP Alfa Aesar试剂公司.1.2 Merrifield树脂负载脯氨酸的合成取3.0 g Merrifield树脂,加入10 mL DMF,4 mL三乙胺/三甲胺,80 ℃反应24 h,降温,加入乙醇,静置后过滤,洗涤,真空干燥. 所得产物经元素分析表明三乙胺、三甲胺的负载量分别为0.62 mmol/g、0.83 mmol/g (以氮计). 然后将合成的季铵盐类化合物与脯氨酸在一定条件下发生反应,使脯氨酸以离子对的形式负载到高分子载体上.Scheme 1 脯氨酸负载催化剂的合成Scheme 1 Preparation of supportedproline catalyst2 结果与讨论2.1 季铵盐的红外表征图1为Merrifield树脂、负载的催化剂Ⅰ、Ⅱ的红外谱图,从图1中可以看出Merrifield树脂在670、1 262 cm-1有强的吸收峰,它们分别是苯环上氯甲基C-Cl键的伸缩振动吸收峰及氯甲基中—CH2键的摇摆振动吸收峰. 而负载催化剂Ⅰ、Ⅱ的红外谱带中在670、1 262 cm-1处,没有出现氯甲基中C-Cl键、—CH2的振动吸收峰,说明氯甲基中氯原子被取代.2.2 催化剂在不同溶剂中对Aldol反应的催化性能将所合成的季铵盐类化合物与L-脯氨酸形成的负载催化体系来催化不对称Aldol反应,探讨了溶剂、催化剂用量等条件对其催化性能的影响.图1 Merrifield树脂,a(Merrifield树脂与三乙胺合成的季铵盐)和b(Merrifield树脂与三甲胺合成的季铵盐)的红外表征Fig.1 FT-IR spectra of a (Merrifield-TEA),b (Merrifield-TMA) and Merrifield通过Aldol反应考察了不同催化体系及不同溶剂对反应的影响,结果见表1. 从表1可以看出,催化剂Ⅰ、Ⅱ在溶剂中的催化性能要优于无溶剂加入时的催化性能,且催化剂Ⅰ的催化性能要稍优于催化剂Ⅱ(Entry1,dr值20∶80,ee值90%;Entry2,dr值19∶81,ee值88). 以催化剂Ⅰ为代表,考察了不同溶剂对催化性能的影响. 从表1中可以看出催化剂Ⅰ在有机溶液中的ee值要比在水中的ee值高,但dr值相对较低,且在有机溶剂甲苯、石油醚中反应时,产物的ee值和dr值最高(Entry6,11). 但考虑到有机溶剂有一定毒性且会污染环境,选取绿色溶剂水作为后续研究的实验溶剂.表1 催化剂的筛选及不同溶剂对反应的影响Table 1 Screening of solvent for the organocatalytic asymmetric Aldol reaction of cyclohexanone and p-nitrobenzaldehydeEntryCat.Solventt/dYield/%dr(syn/anti)ee/%(anti)1L⁃ProlineH2O36812∶8 8882e[Choline][Pro]H2O1/697.9----1ⅠH2O36419∶81902ⅡH2O35520∶80883ⅠNeat35030∶70844ⅡNeat348 40∶60855ⅠDMSO46043∶57966Ⅰ正己烷46246∶54907Ⅰ甲苯42015∶85948ⅠDMF46246∶54909Ⅰ乙腈45029∶719810ⅠTHF44523∶779211Ⅰ异丙醇43025∶759212Ⅰ石油醚45922∶7894a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of cyclohexanone in the presence of 3% of amination resin and 12% of L-Proline and 500 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H); d I and II were respectively merrifield-tea/L-proline, merrifield-tma/L-proline; e. The catalyst synthesized see reference [10].表2探讨了水的用量对反应的影响. 结果表明,当体系中水的加入量从10 μL增加到300 μL时,产物的dr值和ee值没有明显变化(Entry1-5,dr值10∶90~6∶94,ee值96%~98%). 当水的用量增加至400 μL时,Aldol产物的ee 值和dr 值稍有降低(Entry6),继续增加水的用量产物的dr值和ee值明显的降低. (Entry6-10). 这可能是因为微量的水添加到催化体系中,通过氢键、离子键的作用促进了L-脯氨酸与离子液体功能化聚合物之间的作用,而大量的水加入不利于离子液体与脯氨酸间离子键的稳定,且大量水的加入会使脯氨酸溶解在水中而脱离反应底物,最终导致催化作用消失. 从产率、dr值和ee值三个方面考虑,接下来的实验中选取300 μL水为实验用量.表3考察了催化剂用量对反应的影响. 结果显示,当脯氨酸用量保持不变,若降低季铵盐的用量,发现产物的dr值和ee值均有所增加(Entry1-3,dr值10∶90~6∶94,ee值94%~96%). 当季铵盐用量保持不变,增加脯氨酸用量,产物的dr 值和ee值降低(Entry3-5,dr值12∶88~6∶94,ee值94%~98%). 从表3中可以看出季铵盐用量为6%、脯氨酸用量为12%为最佳催化剂用量.从表4可以得出,带有硝基和氰基等强吸电子基团的苯甲醛与环己酮反应时,相应的Aldol反应产物获得了较高的催化活性和立体选择性,得到了25%~70%的产率和20∶80~10∶90的dr 值,94%~95%的ee值(Entry1-3). 然而,当苯甲醛的取代基为弱吸电子基团如卤原子或给电子基团甲氧基时,反应活性较低,反应时间较长,相关Aldol产物的对映和非对映选择性较低(Entry4-7). 造成这种现象的原因可能是取代芳香醛中的吸电子基团增强了醛基中的碳原子的正电性,从而有利于作为亲核试剂的酮进攻醛中羰基上的碳原子,发生亲核加成反应. 相反,弱吸电子基或供电子基减弱了醛中羰基碳原子的正电性,从而不利于反应的进行. 此外,对位取代的芳香醛要优于邻位或间位取代的芳香醛,这是因为邻位或间位取代的芳香醛空间位阻大于对位取代的芳香醛,不利于亲核试剂的进攻.表2 水的用量对反应的影响Table 2 Amount of water for the asymmetric aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryH2Ot/dYield/%dr(syn/anti)ee/%(anti)110μL36410∶9098220μL35610∶9096350μL3216∶94984100μL3508∶92985300μL3686∶94966400μL32715∶85967500μL35619∶81908600μL32015∶85889800μL36560∶4020101000μL35055∶4520a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-Proline; bIsolated yield; c Determined by chiral HPLC analysis (Chiralpak AD-H).表3 催化剂用量对反应的影响Table 3 Amount of water for the asymmetric aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryMerrifield⁃TEA/%L⁃proline/%t/dYield/%dr(syn/anti)ee/%(anti)118123 5510∶90942121236010∶909636123686∶9496461833210∶909456253501 2∶8894a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 300 μL H2O;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).表4 催化剂的底物适用性Table 4 Asymmetric aldol reaction between cyclohexanone and various benzaldehydes catalyzed by catalyst 1 under the optimal conditionsaEntryRt/dYield/%dr(syn/anti)ee/%(anti)14⁃NO23686∶949623⁃NO245815∶859532,4⁃dinitro42520∶809444⁃CN57010∶909554⁃F56060∶406064⁃Cl55035∶658 074⁃Br52050∶506084⁃CH3O72920∶8078a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL sol vent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).为了优化反应条件,我们还探讨了环己酮用量对Aldol反应的影响,从表5可以看出,随着环己酮用量的减少,产物的dr值和ee值都明显的降低,可能是催化体系环境改变的原因.表5 环己酮用量对反应的影响Table 5 Effect of the amount of cyclohexanone on the aldol reaction between cyclohexanone and p-nitrobenzaldehydeaEntryTheamountofcyclohexanone(Equiv)Yield/%dr(syn/anti)ee/%(anti)1106 88∶9296286270∶3076346030∶7078425528∶7273a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).表6对催化剂的重复使用性进行了研究. 可以看出,催化剂可以重复使用5次,重复使用三次后dr值和ee值有所降低. 说明以非共价键形式制备的Merrifield树脂负载的L-脯氨酸催化剂具有一定的重复使用性能.表6 催化剂的回收重复使用性能Table 6 Reusability of catalyst in the reaction between cyclohexanone and p-nitrobenzaldehydeaEntryt/dYield/%dr(syn/anti)ee/%(syn)036810∶9096135510∶9094233614∶8692344022∶7880453046∶5460a Reaction was performed at 0.22 mmol scale of aldehyde, 10 equiv of ketone in the presence of 6% of amination resin and 12% of L-proline and 300 μL solvent;b Isolated yield;c Determined by chiral HPLC analysis (Chiralpak AD-H).3 结论本文制备了Merrifield树脂L-脯氨酸催化剂,并将其用于催化醛和酮的不对称Aldol反应. 结果表明,该催化剂催化下的反应产物获得了很好的对映选择性(ee 值90%~98%)和非对映选择性(dr值 10∶90~4∶96),且催化剂可以回收重复使用5次.参考文献:[1] LIST B, LERNER R A, BARBAS C F. Proline-catalyzed direct asymmetric aldol reactions [J]. Journal of the Ame-rican Chemical Society, 2000,122(10): 2395-2396.[2] TAN R, LI C, LUO J, et al. An effective heterogeneous L-proline catalyst for the direct asymmetric aldol reaction using graphene oxide as support [J]. Journal of Catalysis, 2013, 298: 138-147.[3] ZHANG X, ZHAO W, QU C, et al. Efficient asymmetric aldol reaction catalyzed by polyvinylidene chloride-supported ionic liquid/L-proline catalyst system [J]. Tetrahe-dron: Asymmetry, 2012, 23(6): 468-473. [4] LOU L L, ZHANG J, DU H, et al. Cinchona-derived pro-linamide inBrønsted acidic ionic liquids: A novel and recyclable catalytic system for asymmetric aldol reaction [J]. Catalysis Today, 2016, 264: 109-114.[5] GRUTTADAURIA M, GIACALONE F, MARCULESCU A M, et al. Novel prolinamide-supported polystyrene as highly stereoselective and recyclable organocatalyst for the Aldol reaction [J]. Advanced Synthesis & Catalysis, 2008, 350(9): 1397-1405.[6] GRUTTADAURIA M, SALVO A M P, GIACALONE F, et al. Enhanced activity and stereoselectivity of polystyrene-supported proline-based organic catalysts for direct asy-mmetric aldol reaction in water [J]. European Journal of Organic Chemistry, 2009, 2009(31): 5437-5444.[7] CALOGERO S, LANARI D, ORR M, et al. Supported L-proline on zirconium phosphates methyl and/or phenyl phosphonates as heterogeneous organocatalysts for direct asymmetric aldol addition [J]. Journal of Catalysis, 2011, 282(1): 112-119.[8] ZOU J, ZHAO W, LI R, et al. Synthesis of PVC-TEPA-supported proline derivative and its catalytic behavior in the direct asymmetric aldol reaction [J]. Journal of Applied Polymer Science, 2010, 118(2): 1020-1026.[9] XU D Z, LIU Y, SHI S, et al. Chiral quaternary alkyl-ammonium ionic liquid [Pro-dabco][BF4]: as a re-cyclable and highly efficient organocatalyst for asymmetric Michael addition reactions [J]. Tetrahedron: Asymmetry, 2010, 21(20): 2530-2534.[10] HU S, JIANG T, ZHANG Z, et al. Functional ionic liquid from biorenewable materials: synthesis and application as a catalyst in direct aldol reactions [J]. Tetrahedron Letters, 2007, 48(32): 5613-5617.[11] WANG W H, WANG X B, KODAMA K, et al. Novel chiral ammonium ionic liquids as efficient organocatalysts for asymmetric Michael addition of aldehydes to nitroolefins [J]. Tetrahedron, 2010, 66(27): 4970-4976. [12] 曹金, 周婵, 张龙, 等. 新型手性离子液体在不对称直接 Aldol 反应中的应用[C]. 中国化学会第十二届全国应用化学年会论文集, 2011.CAO J, ZHOU C, ZHANG L, et al. Novel chiral ionic liquids additive for asymmetric synselective direct Aldol reaction [C]. Proceedings of the Twelfth National Confe-rence on Applied Chemistry, Chinese Chemical Society, 2011.[13] HOWARTH J, HANLON K, FAYNE D, et al. Moisture stable dialkylimidazoliacim salts as heterogeneous and homogeneous lewis acid in the Diels-Alder reaction [J]. Tetrahedron Letters, 1999, 38(17): 3097-3100.[14] KUCHERENKO A S, STRUCHKOVA M I, ZLOTIN S G. The (S)-proline/polyelectrolyte system: an efficient, heterogeneous, reusable catalyst for direct asymmetric Aldol reactions [J]. European Journal of Organic Chemistry, 2006, 2006(8): 2000-2004.[15] ZHENG X, QIAN Y, WANG Y. Direct asymmetric aza Diels-Alder reaction catalyzed by chiral 2-pyrrolidinecarboxylic acid ionic liquid [J]. Catalysis Communications, 2010, 11(6): 567-570.。
联二萘酚衍生手性二胺催化的不对称Aldol反应

以手 性 胺 2 a~2 ( hr 1 和 手 性 磷 酸 3 j C a ) t a一3 i
的手 性胺 能有 效 催 化 醛 与 酮 之 间 的 Adl 应 ; lo 反 20 0 8年冯小 明等 发 展 了一 类 新 的手性 二 胺 催 化剂 , 化 Ad1 具 有 非 常好 的反 应 活 性 和 在催 lo 种
( hr2 为催化 剂 , C a ) t 考察芳基 甲基酮 (a f与三 1 —l) 氟 甲基 酮酸酯 的不对称 Adl lo反应 (ce e1 。 Shm )
1 实验 部分
1 1 仪 器与试 剂 .
立体选择性。在此基础 了, 我们 以联二萘酚为
原料合成 了一类性 能优 良的手 性二胺 催化剂 。 Adl l 反应尽 管取得 了极大 的成 功 , 其底 物 o 但 仅 限于 丙 酮 等脂 肪 酮 , 酮 如 苯 乙酮 作 为 Adl 芳 l o
受 到 广 泛 关 注 , 取 得 了 令 人 瞩 目 的进 展 。 并 20 0 7年程津 培等 发 现 具 有 一 级 一三 级胺然具有重要的意 义。我们设想手性二胺催化剂也许能催化苯乙酮
的不对 称 Adl 应 。 lo反
有机化合物中氟原子取代后其物理化学性质
Ab t a t s r c :A e iso n n ime i x e sp o u t n 8 % y ed wih 7 % e r y t e ie y te s re fe a t o rc e c s r d csi 0 il t 3 ewe e s n h sz d b h
As m m e rc Al o a t n y t i d lRe c i o
多相双功能催化剂上的不对称直接Aldol反应

硅酯 3嫁 接到 二 氧 化 硅 表 面后 , 吸收 峰消 失 .表 该 明 3中三 乙氧基 硅酯 与二 氧化硅 表面上 的羟基进行 缩 合 反应 生 成 了前 体 4 .另 外 ,4的 I R谱 在 29 7 2 c 处 出现 了 C H 弯 曲振 动 吸 收 峰 , 进 一 步 证 m — 这 实 了硅 酯 3已经 成 功 地 嫁 接 到二 氧 化 硅 表 面 . C
多相 双 功 能催 化 剂 上 的不 对 称直 接 Alo 反 应 dl
钟 琳 肖建 良1 , 李 灿 , , 2
( 中国 科 学 院 大 连 化 学 物 理 研 究 所 催 化 基 础 国家 重 点 实 验 室 ,辽 宁大 连 1 6 2 1 10 3
2利 物浦 大 学 化 学 系 ,利 物 浦 L 97 D, 国) 6 Z 英
0
NMR谱 在化 学位移 9 8处 的信 号 归 属 于与 硅 原 子 .
相 连 的碳 的共 振峰 _ . 基碳 和环状 链 上 的碳 的共 8 烷
r 。 H
、 N H
NH ( H 3i E) 2 S( t C O 3
P , y N2
Li H4 THF A1 .
N,
用红 外光 谱 (R) I 、固体 核 磁 ( P AsNMR) c c 、
热重分 析 和元 素 分 析对 前 体 4进 行 表 征 .固载 前 ,
载体 二氧 化 硅 ( 岛 海 洋 化 工 厂 , 9 / ) I 青 3 6m g 的 R 谱在 37 0c 5 m 处有 一个 很尖 锐 的吸 收 峰 , 属 于 归 二氧 化硅表 面上 的孤 立羟基 的 伸缩 振动 吸 收l ;当
不对称催化

新颖有机催化剂的合成及催化不对称直接Aldol反应研究张怀胜102200835摘要:以N-苄氧羰基-(S)-脯氨酸和5-(1-氨基烷基)四氮唑(烷基:甲基、乙基、2-苯基乙基)为原料,经两步反应合成了3个新颖的有机催化剂:(S)-5-脯氨酰胺基甲基四氮唑(3a),(S,S)-5-(1-脯氨酰胺基乙基)四氮唑(3b)和(S,S)-5-(1-脯氨酰胺基-2-苯基乙基)四氮唑(3c),并首次将其用于催化丙酮和含吸电子基芳香醛的不对称直接aldol反应.在室温条件下,催化剂3b表现出较好的催化活性,产物的ee值最高可达96%.关键词:有机催化剂;不对称催化;直接aldol反应;脯氨酰胺衍生物Studies on Synthesis of Novel Chiral Organocatalysts and Its Evaluations for Asymmetric Direct Aldol ReactionsAbstract: Three novel organocatalysts(S)-5-prolylaminomethyltetrazole(3a),(S,S)-5-(1-prolyl aminoethyl)tetrazole(3b)and(S,S)-5-(1-prolylamino-2-phenylethyl)tetrazole(3c)were readily prepared fromN-benzyloxycarbonyl-(S)-proline and corresponding 5-(1-aminoalkyl)tetrazol(alkyl: methyl,ethyl and2-phenylethyl)by the known reaction sequences in just two steps.Their catalytic performances were firstevaluated in the asymmetric direct aldol reactions of acetone with electron -deficient aromatic aldehydes.Atroom temperature,the catalyst 3b displayed the efficient reactivity and the enantiomeric excess(ee)value ofthe products was up to 96%.Keywords: organocatalyst;asymmetric catalysis;direct aldol reaction;prolinamide derivative 自List等[1]使用S-脯氨酸作为催化剂进行分子间直接aldol反应以来,越来越多的有机小分子被直接用作有机反应的催化剂[2].由于有机小分子催化剂不含金属离子,对环境友好,且在反应过程中不需要对反应底物进行修饰,符合原子经济性,因而引起了人们的极大关注,并成为现代有机合成化学的前沿领域之一[3].Aldol反应是有机合成中形成碳碳键的重要反应,可以用来合成β-羟基醛酮、α,β-不饱和羰基化合物及1,2-二醇等有机化合物.近年来对其研究较为活跃[4],尤其是在不对称直接aldol反应方面获得了令人瞩目的进展[5,6],许多关于脯氨酸[1,7]及其类似物[8~19]催化不对称直接aldol反应的研究被相继报道.Arvidsson等[16,17]用四氮唑替代S-脯氨酸中的羧基得到S-脯氨酸四氮唑,从而提高了催化剂的活性,扩展了反应的溶剂范围,但将其用于催化丙酮与取代芳香醛的不对称直接aldol反应时,对映选择性与脯氨酸催化相比并没有较大改善;Gong等[18,19]将S-脯氨酸通过酰胺键与一系列手性氨基醇相连,得到了末端带羟基的脯氨酰胺衍生物,并将其用于催化aldol反应,不仅打破了前人认为脯氨酰胺不能催化aldol反应的传统观念,而且在催化某些底物时得到了光学纯的产物,但是此类催化剂通常在低温反应条件下才表现出良好的对映选择性.在上述脯氨酸类似物的结构中,不仅脯氨酸的四氢吡咯环和仲氨的结构被保留下来,而且在多数情况下还体现出一个重要特征:催化剂中的酸性质子与底物受体原子之间形成一个或多个氢键.氢键的形成不仅活化了羰基,降低了反应的活化能,而且也使得aldol供体在进攻时具有面的选择性.Houk,Wu等[18,20,21]还通过理论计算研究了氢键在aldol反应的立体选择控制步骤中所起的重要作用.这些都为有机小分子催化剂的结构设计提供了依据.我们设计并合成了三个新颖的有机小分子催化剂3a~3c(Scheme 1),它们不仅保留了脯氨酸的吡咯环和仲氨的结构,而且在末端引入四氮唑结构以改善催化剂的溶解性和催化活性.室温条件下,首次将其用于催化丙酮与含吸电子基芳香醛的不对称直接aldol反应,取得了较好的催化效果,产率最高达75%,ee值最高达96%.1 实验部分1.1试剂与仪器对硝基苯甲醛、对溴苯甲醛(Lancaster公司);邻硝基苯甲醛、对氰基苯甲醛、对氯苯甲醛、邻氯苯甲醛(Acros公司);层析硅胶(青岛海洋化工厂);实验所用其它药品均为国产分析纯试剂.X-4系列数字显微熔点测定仪(北京第三光学仪器厂);WZZ-1S型数字式旋光仪(上海索光光电技术有限公司);Perkin-Elmer 240 C型元素分析仪,Mercury-300BB型核磁共振仪(美国Varian公司);Trace MS型气-质联用仪(美国Finnigan公司);AgilentTM 1100型高效液相色谱仪(Daicel Chiralpack AS-H色谱柱,流动相为正己烷-异丙醇).1.2催化剂3a~3c的合成N-苄氧羰基-(S)-脯氨酸参照文献[17]合成;5-氨基甲基四氮唑(1a),(S)-5-(1-氨基乙基)四氮唑(1b)和(S)-5-(1-氨基2-苯基乙基)四氮唑(1c)参照文献[22]合成.1.2.1(S,S)-5-[1-(N-苄氧羰基脯氨酰胺基)乙基]四氮唑(2b)向50 mL三颈圆底瓶中加入20 mL吡啶和化合物1b(1.13 g,10 mmol),冰浴冷却至0℃.氮气保护下,向体系内缓慢滴加N-苄氧羰基-(S)-脯氨酰氯[23](2.70 g,10 mmol),滴加完毕后于同一温度下反应1 h后升至室温,继续搅拌8 h.TLC检测至原料反应完毕,减压浓缩,粗品用乙醇重结晶,得到2.24 g白色固体2b.产率65%,m.p.200~202℃,15D[α]-81.8(c 1.0,C2H5OH);1HNMR(DMSO-d6,300 MHz)δ:1.43(dd,J=7.5,7.2 Hz,3H),1.78~1.90(m,3H),2.08~2.13(m,1H), 3.31~3.45(m,2H),4.18~4.24(m,1H),4.94~5.07(m,2H),5.20(q,J=7.8,4.5 Hz,1H),7.28~7.37 (m,5H),8.67(m,1H);13C NMR(DMSO-d6,75 MHz)δ:24.31*,28.65*,35.06,36.16,52.00*,64.55*, 71.07,132.30,132.65,132.80,132.97,133.44,133.60,142.14*,159.09*,163.42,176.96*(*Doublet due to existence of rotamers);MS m/z(%):344.2(M+,12),90.9(82),203.8(100).Anal.calcd forC16H20N6O3:C 55.80,H 5.85,N 24.40;found C 55.64,H5.98,N 24.57.1.2.2(S,S)-5-(1-脯氨酰胺基乙基)四氮唑(3b)将化合物2b(1.89 g,5.5 mmol)和0.10 g 5%钯碳加入到50 mL甲醇中,50℃催化氢化至反应结束(TLC检测),滤除钯碳,浓缩溶剂.产物用乙醇重结晶,得0.93g白色固体3b,产率80%,m.p. 238~240℃,15D[α]-116.7(c 0.15,H2O);1H NMR(D2O,300 MHz)δ:1.41(d,J=6.9 Hz,3H),1.86~1.90(m,3H),2.25~2.28(m,1H),3.19~3.27(m,2H),4.22(t,J=7.5 Hz,1H),5.13(q,J=6.9 Hz 1H);13C NMR(D2O,75 MHz)δ:19.25,23.89,29.69,42.60,46.60,59.94,168.76;MS m/z(%):210.9([M+1]+,1),68.0(5),70.0(100).Anal.calcd for C8H14N6O:C 45.40,H 6.71,N 39.97;found C 45.29,H 6.89, N 40.16.1.2.3(S)-5-脯氨酰胺基甲基四氮唑(3a)。
不对称羟醛缩合aldol反应
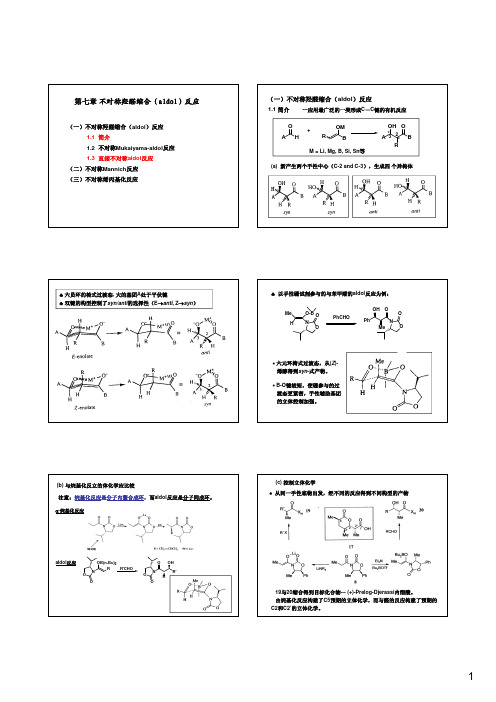
♣以手性硼试剂参与的与苯甲醛的aldol 反应为例:Me O-B NOHPhCHONOPhO Me OHO O ∙六元环椅式过渡态,从(Z )-(b)与烷基化反立的体化学应比较注意:烷基化反应是分子内螯合成环,而aldol 反应是分子间成环。
α-烷基化反应ON R OB(n-Bu)2OR'CHOONO OR'R OH aldol 反应∙从同一手性底物出发,经不同的反应得到不同构型的产物19与20缩合得到目标化合物---(+)-Prelog-Djerassi 内酯酸。
由烷基化反应构建了C5预期的立体化学,而与醛的反应构建了预期的C2和C2’的立体化学。
选择性。
Lewis 酸参与,环状中间体与醛反应,给出syn 构型产物。
Lewis 酸,形成开链(非环)结构,给出anti 构型产物。
醛羰基更易与Lewis 酸配位两类羟醛缩合试剂分别控制syn 和anti 选择性从4得到anti -aldol 产物,而从5得到syn -aldol 产物(2) Mukaiyama-aldol 反应R 1HO +R2R 3OSiMe 31)Lewis acid or R 1R 3OH R 2O Lewis base R 1R3OH R 2O+syn -anti -2)H 2O(a) 硅试剂的种类和特点:anti 构型(syn/anti:5:95)的产物,ee:99%产物的构型与烯醇双键的构型无关。
+RCHO PhOR O MeOH Zr cat.有机铜和锡催化剂(Evans )中心金属(铜或锡)和配体对产物立体化S-t-Bu OTMS MeOMe -78o C (S MeO O HO (2R)-anti-syn /anti (R Sn(OTf)2-11a (10 mol%)Sn(OTf)2-11b(10 mol%)-78o CMeOMeOO Me Cu(OTf)2-11c (10 mol%)NNO O MeMeRR 11b: R=Bn, 11c: R=t -Bu(S -78o C(2S)-anti-syn /anti (2S)-syn-syn /anti 发现了配体的加速作用,配体的加入极大地减小了水解反应PhPhO OH PhPh O OH +chiral cat.H 2O/C 2H 5OH(1:9)(a)手性有机金属催化剂催化直接aldol 反应的历程Trost试剂Up to 99%ee催化剂,一个Lewis酸的作一个Zn起碱的作用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Andrew D. Mesecar et al. J. Mol. Biol. (2009) 386, 1038–1053.
15
有机催化
有机小分子作为不对称催化剂,还具有许多特殊的优点。 直接不对称羟醛缩合反应具有操作简单和原子经济性的显著优点。
16
二肽磺酰胺11a 在产率和ee 值方面表现出最好的结果。
17
18
19
水 相 反 应
20
syn-1,2-Diol 结构特征——水溶性
21
寻求能够高效高选择性地催化不对称直 接aldol反应的催化体系正日渐成为有机化 学的一项新课题。
22
参考文献: [1] Yamaoka, M,; Nakazaki, A.; Kobayashi, S. Rate enhancement by water in a TiCl4-mediated stereoselective vinylogous Mukaiyama aldol reaction. Tetrahedron Lett. 51 (2010) 287–289. [2] Yamaoka, M.; Fukatsu, Y.; Nakazaki, A.; Kobayashi, S. Synthetic study of fomitellic acids:construction of the AB ring moiety. Tetrahedron Lett. 2009, 50,3849– 3852. [3] Mitsutaka Iwata, Ryo Yazaki, Yuta Suzuki, Naoya Kumagai, Masakatsu Shibasaki. Direct Catalytic Asymmetric Aldol Reactions of Thioamides: Toward a Stereocontrolled Synthesis of 1,3-Polyols. J. AM. CHEM. SOC. 9 VOL. 131, NO. 51, 2009 18245. [4] Scott D. Pegan, Kamolchanok Rukseree, Scott G. Franzblau and Andrew D. Mesecar. Structural Basis for Catalysis of a Tetrameric Class IIa Fructose 1,6Bisphosphate Aldolase from Mycobacterium tuberculosis. J. Mol. Biol. (2009) 386, 1038–1053. [5] S. S. V. Ramasastry, Klaus Albertshofer, Naoto Utsumi, and Carlos F. Barbas III. Water-Compatible Organocatalysts for Direct Asymmetric syn-Aldol Reactions of Dihydroxyacetone and Aldehydes. Org. Lett., Vol. 10, No. 8, 2008。1621-1624 [6] Evaggelia Tsandi, Christoforos G. Kokotos, Sofia Kousidou, Valentine Ragoussis, George Kokotos. Sulfonamides of homoproline and dipeptides as organocatalysts for Michael and aldol reactions Tetrahedron 65 (2009) 1444–1449. 23
谢谢!
24
Kobayashi et al. Tetrahedron Letters 51 (2010) 287–289.5在天然产物全合成中的 Nhomakorabea用6
Yamaoka, M.; Fukatsu, Y.; Nakazaki, A.; Kobayashi, S. Tetrahedron Lett. 2009, 50, 3849–3852
13
模拟Ⅱ类醛缩酶催化不对称直接Aldol反应
The class IIa fructose 1,6-bisphosphate aldolase (FBA) enzyme from M. tuberculosis (MtFBA) has been proposed as one such target since it is upregulated in latent TB.
11
生物催化
• 在生物体内广泛存在的醛缩酶是不对称直 接Aldol反应的高效催化剂。迄今为止已有 30余种醛缩酶被鉴别,根据催化机理的不 同,它们被分为两大类:I类醛缩酶,II类醛 缩酶。 • List等认为可以把L-脯氨酸看作是一类“微 型醛缩酶”(micro-aldolase)
12
模拟Ⅰ类醛缩酶催化不对称直接Aldol反应
Tol: 77 h, 77% yield Tol+5 mol% H2O: 55 h,76% yield Tol+10 mol% H2O: 40 h,74% yield Tol+20 mol% H2O: 26 h,69% yield
3
是否是此类反应的特征?
4
Although the specific role of water in the VMAR remains unclear, they tentatively propose the following two possibilities: (i)water might coordinate to TiCl4 and result in partial dissociation of TiCl4 aggregates, and (ii) both the proton and TiCl4 of a plausible hydrated TiCl4 might coordinate to the carbonyl oxygen, resulting in double activation.
7
配位催化
DMF, -20℃, 100h 62(14)% yield 87% ee X = 10 Calculated pKa value of hydrogen was 12.3. Experimentally determined pKa of 2-methoxyphenol is reported as 9.90 (calculated as 9.62), thus lithium salt of 2,2,5,7,8 pentamethylchromanol is much stronger base than lithium salt of 2-methoxyphenol
X=3 DMF, -60℃, 40h 91(trace) % yield
91% ee
x = 10 , 95% ee
8
底物范围
9
合成应用
10
• Future work will be dedicated to applying the present protocol to the asymmetric synthesis of natural products bearing a 1,3-polyol motif.
不对称aldol 反应
黄海 有机化学 200920102003
1
Aldol反应被认为是最有效的形成C—C键的反应之一。
• • • • •
手性辅基 金属配合物催化 生物催化 有机分子催化 参考文献
2
手性辅基举例
Vinylogous Mukaiyama aldol reaction 二氯甲烷:产率低;甲苯:反应极慢,无法反复生产。
