铜绿假单胞菌耐药性分析
抗菌药治疗下铜绿假单胞菌耐药变化分析

- 1] 汪 宁 , 国艾 滋 病 流 行 的 一 些 新 动 向 E ] 中 华 流 行 病 学 3 中 J.
杂 志 ,0 0 3 ( 1 : 2 51 0 . 2 1 ,1 1 ) 1 0 —2 9
但 此 种 二 联 检 测 试 剂 也 有 一 定 的局 限 性 , 测 结果 有 一 定 的假 检 阳 性 。原 因 是 由 于某 些 药 物 具 有 与 吗 啡 和 甲 基 安 非 他 明 相 同 或 相 似 的免 疫 化 学 结 构 , 一 定 的 浓 度 下 可 能 产 生 阳 性 结 果 , 在 如 服 用 雷 尼 替 丁 、 些 感 冒 药 、 喘 止 咳 复 方 制 剂 及 摄 入 含 有 某 平 罂 粟 壳 的 火 锅 等 都 有 可 能 引 起 假 阳性 结 果 _ 。本 次 检 测 结 果 5 ] 阳性 1 2例 , 检 只 有 1例 阳 性 , 阳 性 率 为 1 3 , 陈 永 复 假 .6 与 A 0 平 ] 道 的 1 3 基 本 相 符 。检 测 结 果 阳性 提 示 尿 液 中可 能 报 .1
同一 部 位 , 次 检 测 间 隔 3d以 上 。所 有 菌 株 均 采 用 法 国生 物 每
梅 里 埃 公 司 AT x rs n细 菌 鉴 定 系 统 鉴 定 到 种 。铜 绿 假 B E p ei o 单 胞 菌 AT C 7 5 , 购 自卫 生 部 临 检 中心 。 C 283均
奋 增 强 , 生 异 常 欣 快 感 , 期 或 大 量 服 用 后 容 易 产 生 耐 受 性 产 长 和依 赖 性 。 因此 在 征 兵 体 检 中 进 行 吗 啡 、 甲基 安 非 他 明 检测 非
E] 张桌然 , 语星. 床 微生 物学 和微生 物检验 [ . 1 倪 临 M] 3版 .
98例铜绿假单胞菌分离及耐药调查分析

98例铜绿假单胞菌分离及耐药调查分析摘要】目的:监测铜绿假单胞菌在我院临床的分布及耐药情况方法:收集2009年10月至2010年11月临床送检分离出铜绿假单胞菌98例(非重复株)。
采用KB纸片扩散法测定抗菌药物耐药率。
结果:铜绿假单胞菌的分布情况首先是ICU66例占67%、其次呼吸内科22例占22.%、脑外科7例占8%、消化内科1例占1%、神经内科1例占1%、普外科1例占1%。
抗生素的耐药情况是氨苄西林、头孢唑啉耐药率100%,复方新诺明91%、头孢噻肟是78%,环丙62%、哌拉西林59%氨苄西林/舒巴坦耐36%、头孢呋辛50%,就是碳青霉希酶的美罗培南、亚胺培南也有耐药。
我院的耐药情况与北京12家医院的耐药情况不同,但有几种抗生素接近如头孢他啶24%我院27%,亚胺培南他们32%我院30%,头孢哌酮/舒巴坦他们25%我院29%。
结论:铜绿假单胞菌耐药性较严重,加强抗生素药物使用及细菌耐药谱的监测,延缓细菌耐药株的产生与传播是医院各临床科室及感控科的重任。
【关键词】铜绿假单胞菌耐药率合理用药从上面表看出铜绿假单胞菌痰的分离最多,再者伤口感染较多,本菌为条件致病菌,是医院内感染的主要病原菌之一。
患代谢性疾病、血液病和恶性肿瘤的患者,以及术后或某些治疗后的患者易感染本菌。
经常引起术后伤口感染,也可引起褥疮、脓肿、化脓性中耳炎等。
本菌引起的感染病灶可导致血行散播,而发生菌血症和败血症。
讨论铜绿假单胞菌的耐药机制主要是β-内酰胺酶介导耐药。
铜绿假单胞菌具有可诱导ampC头孢菌素酶,所以哌拉西林和第三代头孢菌素在治疗由铜绿假单胞菌所致的感染中存在着危险性。
亚胺培南无论对诱导或去阻遏表达的铜绿假单胞菌还是有抗菌活性。
铜绿假单胞菌还产生质粒介导酶,主要以PSE-1和PSE-4多见。
最近,一些超广谱酶如PER-1,OXA-10,OXA-11在临床上出现,PER-1可被克拉维酸抑制,后二种酶则不被抑制。
需特别注意的是在铜绿假单胞菌中还发现了由可传递性质粒介导的碳青霉烯酶,可引起该菌对亚胺培南、美洛培南和除氨曲南以外的其他β-内酰胺类抗生素耐药。
耐亚胺培南铜绿假单胞菌的鉴定和药敏分析

鉴定步骤
样本采集与处理
从感染部位采集样本,进行适当处理,如匀浆、 离心等。
初步鉴定
通过观察菌落形态、革兰氏染色等初步判断是否 为铜绿假单胞菌。
细菌分离与培养
将处理后的样本接种于选择性培养基上,进行细 菌分离与培养。
生化鉴定与分子生物学鉴定
利用生化鉴定方法和分子生物学方法进行进一步 确认。
鉴定结果
80%
确定菌种
通过综合传统微生物学方法、生 化鉴定方法和分子生物学方法的 鉴定结果,确定菌种为铜绿假单 胞菌。
100%
明确耐药性
通过药敏试验等方法明确铜绿假 单胞菌对亚胺培南等药物的耐药 性。
80%
提供治疗建议
根据鉴定结果和药敏试验结果, 为临床医生提供合理的治疗建议 。
03
药敏分析方法
药敏试验原理
表示待检菌不能被常规剂量的 抗生素所抑制,MIC值远高于 参考范围。
04
耐亚胺培南铜绿假单胞菌的药敏特性
药物敏感性
敏感药物
耐亚胺培南铜绿假单胞菌对部分抗生素仍表现出敏感性,如氨基糖苷类、喹诺 酮类等。这些药物在体外试验中显示出较好的抗菌活性,可用于治疗该菌引起 的感染。
敏感程度差异
不同菌株对同一药物的敏感程度可能存在差异,这可能与菌株的遗传特性和药 物作用机制有关。因此,在治疗过程中需要根据药敏试验结果选用合适的抗生 素。
提高患者免疫力
加强营养支持、积极治疗原发 病等,提高患者抵抗力。
加强环境监测和消毒
定期对医院环境进行监测和消 毒,消除污染源。
06
总结与展望
研究成果总结
耐亚胺培南铜绿假单胞菌的鉴定方法
通过生化试验、分子生物学方法和药敏试验等多种手段,成功鉴定出耐亚胺培南铜绿假 单胞菌。
铜绿假单胞菌耐药性的形成机制及其对抗菌治疗的影响分析

铜绿假单胞菌耐药性的形成机制及其对抗菌治疗的影响分析铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的耐药性细菌,它具有多种耐药机制,严重影响了抗菌治疗的效果。
本文将深入探讨铜绿假单胞菌耐药性的形成机制,并分析该耐药性对抗菌治疗的影响。
一、铜绿假单胞菌耐药性的形成机制1. 药物外排泵系统:铜绿假单胞菌具有多种药物外排泵系统,如MexAB-OprM、MexCD-OprJ和MexEF-OprN等。
这些药物外排泵系统能有效地将抗生素从细胞内外排出,降低药物在细胞内的浓度,从而减少细胞所受到的药物压力。
2. 胞内酶的产生:铜绿假单胞菌能够产生β-内酰胺酶,这种酶能够有效地降解β-内酰胺类抗生素,如青霉素和头孢菌素等。
这种酶的产生使得抗生素在细胞内无法发挥其抗菌作用,导致细菌耐药。
3. 创建生物膜:铜绿假单胞菌具有生物膜形成的能力,生物膜提供了一种保护层,阻碍抗生素的进入,使得细菌在生物膜内相对于抗生素更加耐受。
此外,生物膜还能够促进细菌间的基因传递,进一步增加耐药性。
4. 固定多样的耐药基因:铜绿假单胞菌具有丰富的基因库,其中包括多种耐药基因。
这些耐药基因通过水平基因转移的方式在菌群内传递,使得菌群中的细菌获得了耐药性。
此外,铜绿假单胞菌还能够在适应抗生素选择压力的过程中产生新的耐药基因,进一步增加了其耐药性。
二、铜绿假单胞菌耐药性对抗菌治疗的影响1. 临床治疗效果下降:铜绿假单胞菌耐药性的形成导致了常用抗菌药物对其的治疗效果下降。
当患者感染耐药性铜绿假单胞菌时,抗菌药物可能无法有效杀灭菌株,从而延长感染时间,增加治疗难度和费用。
2. 增加治疗失败风险:铜绿假单胞菌耐药性的增加使得治疗失败的风险增加。
耐药性细菌在抗菌药物的压力下存活,可能发展出新的耐药基因,使其逐渐耐药多种抗菌药物。
这使得以往有效的抗菌治疗方案无法应用于与该菌株感染的患者,导致治疗失败。
3. 交叉感染的风险增加:铜绿假单胞菌耐药性的增加使得在医疗机构内交叉感染的风险增加。
铜绿假单胞茵的耐药性分析
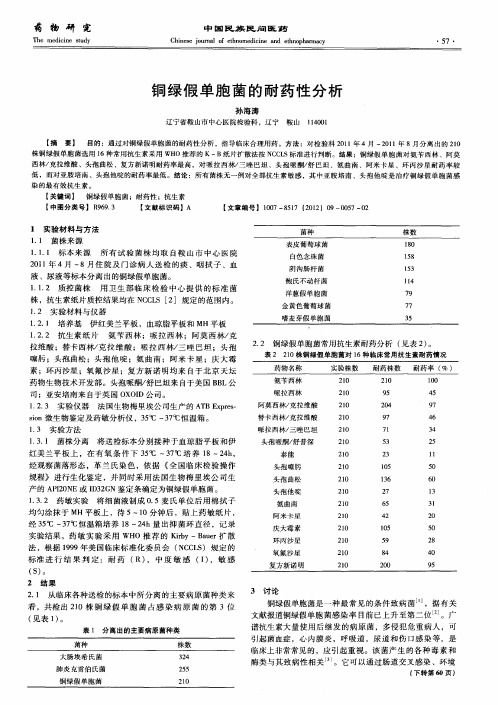
实验结 果。药敏 实 验采 用 WH O推 荐 的 Kry—B ur 散 i b ae 扩
法 ,根 据 19 美 国 临 床 标 准 化 委 员 会 ( C L ) 规 定 的 9 9年 N CS
标准 进 行 结 果 判 定 :耐 药 ( ,中 度 敏 感 ( ) R) I ,敏 感
( ) S 。
2 结果
2 1 从临床各种送检 的标 本中所分 离的主要 病原菌种类 来 .
3假 单 胞 菌 占感 染 病 原 菌 的第 3位 1
( 见表 I 。 )
表 1 分离 出的主要病原菌种类
菌种 大 肠 埃 希 氏 菌 肺 炎 克 雷 伯 氏 菌 铜 绿 假 单 胞 菌 株 数
药 物 研 究
Th me i i e su y e dcn td
中 国 民 族 民 间 医 药
C ieejun]o tn m dc e ad eho hr c hns ora feho e in n tnpamay i ・ 7・ 5
铜 绿 假 单 胞 茵 的 耐 药 性 分 析
…
"
1 3 1 菌株分离 . .
将 送检标本分别 接种于血琼脂 平板 和伊
红美兰平 板上 ,在 有 氧条 件 下 3 ℃ ~3 o 养 1 5 7C培 8—2 h 4, 经观察菌落形态 ,革兰 氏染 色 ,依据 《 国临床检 验操 作 全 规程》 进行生化鉴定 ,并 同 时采用 法 国生物梅 里埃 公 司生
产的 A I0 E或 I3 G P2 N D 2 N鉴 定条确定为铜绿假单胞菌 。 13 2 药敏实验 .. 将细菌液制 成 0 5麦 氏单 位后用 棉拭 子 . 均 匀涂抹于 MH平板上 ,待 5~1 钟后 ,贴上 药敏纸 片 , 0分
铜绿假单胞菌的耐药分析

续漏 出, 引起 慢 性 炎 症, 致 大 量 液 体 在腹 腔 内聚 导
集 , 由某 些 胰腺 基 础病 变 导 致 , 别 是 慢 性 胰 腺 多 特 炎, 但不包括 急性 胰腺 炎 时腹 腔炎 性 渗 出或 胰 腺癌
腹腔 转移所 至 的癌性 腹 水 。在 所 有 腹水 病 人 中, 胰 性腹 水所 占比例小于 5 临床较 为 罕见 , 内外 %u , J 国
3 讨
论
率 调查 中均 居 于首 要 位 置 , 由铜 绿 假 单 胞菌 引起 的 院 内感染 高达 3 % 以上 L 。本 次 分 析 得 出 的耐 药 0 3 j
情 况 是 : 丙 沙 星 的 敏 感 率 较 高 ( 2 6 ) 氨 基 糖 苷 环 9 。% , 类 的效 果 较 差 ( O 4 4 . %~5 . %) 头孢 类 抗 生 素 的 00 , 敏 感率 不是 很 高 ( 1 3 。有 报道铜 绿 假单 胞菌对 7 . %) 亚 胺 培 南 的 耐 药 率 已达 到 3 % , 至 4 % 以 上 L , 0 甚 0 4 』
胰性腹水是 指伴 随某些胰 腺 良性疾病 的胰液持
1 4 5 0 .2mmo L。腹 水淀 粉酶 4 9 7I L, 肪 酶 l / 7 . U/ 脂 1 6 7I L 5 . U/ 。腹 水 肿 瘤 标 记 物 C 1 54 8 A 2 5 .2U/ ml A1 95 7u mlC A、 F , 9 . / , E A P正 常。腹 部 B超 、 C C 、 T MRI 示 慢性 胰 腺 炎 、 胰 管 扩 张 、 提 主 中大 量 腹
增加 , 续 上述 方 法保 守 治 疗 1周 , 状 缓 解 不 明 继 症 显 , 至北 京 3 1医院行 E C 转 0 R P示 胰管 开 口狭 窄 , 体 尾部 有造 影剂外 漏 , 行胰 管 支架 置 入 术 。术后 1周
铜绿假单胞菌的抗生素耐药性及其机制分析

铜绿假单胞菌的抗生素耐药性及其机制分析铜绿假单胞菌(Pseudomonas aeruginosa)是一种常见的革兰氏阴性杆菌,具有广泛的分布和高度耐药性。
在医疗机构中,铜绿假单胞菌感染已成为严重的问题,对于治疗该菌引起的感染,抗生素耐药性的了解至关重要。
抗生素耐药性是指细菌对抗生素的抵抗能力,常见的耐药机制包括基因突变和外源性基因的水平传递。
铜绿假单胞菌对多种抗生素呈现耐药性,包括β-内酰胺类抗生素(如氨基苄青霉素、头孢菌素等)、氨基糖苷类抗生素、大环内酯类抗生素、喹诺酮类抗生素以及碳青霉烯类抗生素。
以下将对铜绿假单胞菌的抗生素耐药性及其机制进行分析。
首先,铜绿假单胞菌的内源性抗性机制是其耐药性的基础。
该菌种具有外膜结构以及多种封闭性的药物外排泵,这些结构可以拦截或排出抗生素,阻碍抗生素进入细胞或使其失效。
此外,铜绿假单胞菌具有自由基清除系统和外泌体的产生,这些机制有助于保护菌体免受抗生素的影响。
其次,铜绿假单胞菌的耐药性还可通过激活或抑制特定的耐药性相关基因来实现。
研究发现,菌体中的多个基因(如mexAB-oprM、mexXY-oprM、nfxB和ampR)在抗生素耐药性中起到关键的调控作用。
这些基因编码的蛋白质参与了药物外排泵系统或抗生素降解酶的表达,从而使菌体对抗生素的作用降低。
此外,外源性基因的水平传递也在铜绿假单胞菌的抗生素耐药性中发挥着重要作用。
许多耐药性基因以质粒或整合子的形式存在,它们可以通过转染、共同耐药岛(Resistance Island)或转座子的介导而传递给铜绿假单胞菌。
这种方式使菌体获得多样的抗生素耐药基因,从而增加了其对不同类别抗生素的耐药性。
在临床实践中,铜绿假单胞菌的抗生素耐药性对治疗选择带来了挑战。
然而,通过深入了解其耐药机制,可以为抗生素的合理使用提供指导。
当前,一些新型抗菌药物(如环丙沙星类)在对抗铜绿假单胞菌感染中显示出较好的效果,是一种潜在的治疗选择。
铜绿假单胞菌感染的耐药分析

3 讨 论
近年来 , 耐药菌感 染已成为我 国患者住 院时间延长 、 医疗 费用增加和导致 患者死 亡的重 要原 因。调 查显 示 , 医院 内金 黄 色葡萄球菌中 M R S A ( 耐 甲氧西林金黄 色葡萄球 菌) 的检 出 率高达 7 0 %[ 4 1 。耐 药菌 的增加 主要 归咎 于抗 菌药 的不 合理
难 J 。本组 3 0 0例患者 共分 离得 到 1 6 0株 病原 菌 , 阳性 率为
[ 4 ] Wa n g S H , S h e n g W H, C h a n g Y Y , e t a 1 . H e a h h e a r e —a s s o e i —
a t e d o u t b r e a k d u e t o p a n —d r u g es r i s t a n t Ae i n e t o b a e t e r b n ma a n n i i
精索静脉 曲张 ( V a r i c o c e l e , V C A) 是导致 男性 不育 的最常
眼科器械 , 剪F F 精索外筋膜 、 提睾肌 , 打 开精 索内筋膜后 , 术中 挤压 阴囊促使精索血管充血 , 更加清楚显示精索 血管 , 选择 曲
见原 因之 ・ , 正 常男性人群 的患病率为 1 5 %, 原发性男性不育 症患者 中约有 3 5 %伴有精索静 脉 曲张 , 而在 继发性 男性不 育
抗菌药
送检 、 早报告 、 早隔离 , 最大 限度地降低耐 药菌的感染率 ; 精 确抗生 素用 药 剂量 , 从 而避 免抗 生素过 量使用 、 降低不 良反 应, 加强 了临床抗感染治疗的主动性 和预见性 ; 切实遵 守无菌 技 术操 作规程 , 加强医院环境卫生管 理 , 达到预 防和控制耐药 菌的传播 的最终 目的。 总之 , 铜绿假单胞 菌感 染在临床上 比较多见 , 传统抗 生素 的耐药性 比较高 , 要 积极加强预 防与管理。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
铜绿假单胞菌耐药性分析
目的研究2011~2012年本医院患者分离出的铜绿假单胞菌(PAE)的耐药率。
方法采用VETEK2 Comact全自动微生物分析系统鉴定出274株铜绿假单胞菌,分别来自住院患者各类标本,按照CLSI各年度标准判断PAE对抗菌药物的耐药性。
结果在22种常用抗生素中,铜绿假单胞菌对半数以上的药物耐药率>40%。
铜绿假单胞菌对β-内酰胺类药物耐药率较高,对亚胺培南和美罗培南耐药性上升较快,对其他类抗生素都出现不同程度的耐药。
结论铜绿假单胞菌易出现多重耐药,2012年绿假单胞菌耐药率与2011年相比总体呈上升趋势,应加强铜绿假单胞菌的耐药性检测,依据药敏结果合理用药,才能有效防止多重耐药菌株的产生。
标签:铜绿假单胞菌;耐药率;耐药菌株
铜绿假单胞菌(Pseudomonas aeruginosa,PAE)为非发酵革兰氏阴性杆菌,在自然界分布广泛,为条件致病菌[1],可引起皮肤伤口、呼吸道、泌尿道菌血症等严重感染,是医院感染的主要病原菌之一。
因此,了解其感染的临床分布状况及其耐药情况,对有效治疗和预防该菌引起的院内感染非常重要。
现将本院2011年1月~2012年12月从临床标本中分离到的274株PAE的分布及耐药情况分析如下。
1 资料与方法
1.1 一般资料
2011年1月~2012年12月本院临床各科室送检的各种标本,包括痰液、伤口渗出液、脓液、尿液、血液、胸腔积液、腹水。
1.2 材料
VETEK2 Comact 全自动微生物分析系统及配套鉴定卡和药敏卡,购于法国梅里埃公司。
1.3 病原菌的分离、培养及鉴定
严格按照《全国临床检验操作规程》进行病原菌的培养及鉴定,严格按照仪器操作规程进行。
将可疑菌落进行革兰染色和生化反应鉴定为革兰氏阴性杆菌,氧化酶阳性。
用VETEK2 Comact自动细菌鉴定药敏仪配套的革兰氏阴性杆菌鉴定条挑取可疑纯菌落鉴定,确定为PAE。
1.4 药敏试验
应用梅里埃VETEK2及配套药敏鉴定卡自动分析22种抗生素最低抑菌浓度
(MIC),按各年度CLSI对PAE判断标准,判读结果为耐药、中介、敏感。
1.5 质控菌株
金黄色葡萄球菌(ATCC25923)、PAE(ATCC27853)、大肠埃希菌(ATCC25922),均购于原卫生部临床检验中心。
1.6 数据分析
采用Whonet 5.5分析软件,分析总结菌株来源标本分布情况,菌株科室分布情况,菌株对常用22种抗生素的耐药率、敏感率、中敏率。
2 结果
2.1 临床患者各类标本中PAE检出阳性情况
痰液标本检出221株,占80.7%;尿液分离出30株,占10.9%;分泌物分离出16株,占5.8%;胸腔积液、腹水分离出4株,占1.5%;血液中分离出3株,占1.1%。
共计274株。
2.2 PAE来源
重症监护室(ICU)101株(36.9%),其次是呼吸内科79株(28.8%),神经外科51株(18.6%),儿科26株(9.4%),泌尿外科14株(3.6%),耳鼻喉科3株(1.1%)。
2.3 PAE的耐药情况
在药敏试验中,本院PAE对大多数抗生素耐药。
2011年PAE对12种药物耐药率>40%,2012年对16种药物耐药率>40%。
对青霉素类和头孢类的耐药性最高,具体药敏试验结果见表1。
3 讨论
PAE是临床上常见的院内感染致病菌,近年来,由于广谱抗生素的广泛使用,各种侵入性治疗的不断增加,PAE的感染与耐药日益严重,给临床治疗带来严重困难。
PAE是上呼吸道的正常菌群,当机体免疫力下降时可引起呼吸道感染。
本院以痰标本中分离的PAE最为多见,占80.7%,提示PAE的感染以下呼吸道感染最为多见,与文献报道基本一致[2]。
临床科室间ICU室检测率最高,占36.9%,呼吸科次之,占28.8%。
ICU病区的患者病情危重,外伤严重,呼吸科患者多年老体弱,多伴有慢性病。
这些患者插管、呼吸机等侵入性治疗手段使用较多,抗菌药物应用时间较长,导致在医院环境中机会感染增加。
本研究药敏试验结果显示,2011年本院PAE对头孢哌酮/舒巴坦、哌拉西林
/他唑巴坦、美罗培南较为敏感(>70%),对12种抗生素都有不同程度的耐药(>40%)。
2012年本院PAE只对阿米卡星较敏感(>70%),对16种抗生素耐药率较高(>40%)。
特别是对氨苄西林、氨苄西林/舒巴坦、头孢唑啉、头孢呋辛钠、头孢曲松、头孢呋辛酯、头孢替坦、复方磺胺甲■唑和呋喃妥因等9种抗生素高度耐药,耐药率>90%。
对亚胺培南和美罗培南的敏感率分别由2011年的60.6%和73.1%降低为2012年的45.0%和52.1%,说明PAE耐药率高,且具有多重耐药的特征[3-4]。
其耐药机制主要有以下几点。
①细菌产生超广谱β-内酰胺酶(ESBLs):ESBLs能水解或灭活青霉素、头孢菌素类抗菌剂[5]。
②细菌的细胞壁或外膜的通透性改变:使抗生素不能或很少进入菌体内到达作用靶位[5]。
PAE 对β-内酰胺类抗生素耐药性的产生为细菌外膜非特异性孔道蛋白OprF缺陷而引起的,对亚胺培南的耐药性已证明是由于细菌外膜缺失一种蛋白——微孔蛋白D2[5],碳青霉烯类是一类抗菌活性极强的广谱高效抗生素,已成为治疗PAE引起严重感染的最常用药物,其中以亚胺培南使用最广范[6],但其耐药率逐年上升,目前本院亚胺培南耐药率已达48.5%,美罗培南耐药率已达43.8%,过度使用是导致其耐药率增高的主要诱因。
③氨基糖苷类钝化酶:PAE产生氨基糖苷类钝化酶是对氨基糖苷类抗生素耐药的原因之一。
氨基糖苷类钝化酶可分为乙酰转移酶(AAC)、磷酸转移酶(APH)、核苷转移酶(ANT)3类。
庆大霉素和妥布霉素作为一种广谱高效抗生素,应用比较广泛,导致了临床上较高的耐药率。
阿米卡星主要治疗对其他氨基糖苷类耐药的PAE株所致的感染,效果虽较好,但因其肾毒性和耳毒性等严重不良反应限制了其在临床上的广泛应用。
目前本院庆大霉素的耐药率为53.8%,妥布霉素为53.8%,阿米卡星耐药率相对较低,为27.2%。
④细菌靶位点的改变:喹诺酮类药物通过抑制DNA促旋酶或拓扑异构酶Ⅳ而抑制DNA合成,从而发挥抑菌和杀菌作用[7]。
然而细菌通过改变上述靶位点的结构来逃避抗菌药物的作用,从而产生了耐药性[8]。
左旋氧氟沙星和环丙沙星都是广谱抗菌药物,本院临床使用较为广泛,导致PAE对它们的耐药率也较高,目前本院环丙沙星耐药率为45.6%,左旋氧氟沙星耐药率为45.0%。
PAE 的耐药机制复杂,不但对不同抗菌药物有不同的耐药机制,而且对于同一种抗菌药物也可产生多种途径的耐药[9-11]。
综上所述,本院分离出的PAE株对多种抗生素都产生了较高的耐药性,且耐药率逐年上升。
为延缓PAE耐药菌株的发展,预防院内感染的发生,应加强对呼吸道感染患者的护理和预防控制,加强对医护人员手卫生、医疗器械和医疗环境的消毒隔离工作,加强抗菌药物的管理和控制,加强对PAE的耐药性监测,及时将药敏结果反馈给临床,以指导合理使用抗生素,防止多重耐药和泛耐药细菌在医院内的播散。
[参考文献]
[1] Wang M,Lamers RJ,Korthout HA,et al.Metabolomics in the context of systems biology:bridging traditional Chinese medicine and molecular pharmacology[J].Phytother Res,2005,19(3):173-182.
[2] 孙宝君.四年老年院内肺炎痰细菌培养耐药调查[J].中华医院感染学杂志,1998,8(3):181-182.
[3] Aloush V,Navon-Venezia S,Seigman-Igra Y,et al.Multidrug-resistant
Pseudomonas aeruginosa:risk factors and clinical impact[J].Antimicrob Agents Chemother,2006,50(1):43-48.
[4] 徐黔宁,王伟平,张仙森.铜绿假单胞菌感染分析及药敏分析.中华医院感染学杂志,2005,15(2):213 214
[5] 江明性,杨藻宸.药理学[M].4版.北京:人民卫生出版社,1997:277-279.
[6] 周乐翔,李智山,杨燕,等.铜绿假单胞菌医院感染与耐药性分析[J].中华医院感染学杂志,2008,18(12):1781-1783.
[7] Ball P.Quinolone generations:natural history or natural selection?[J].J Antimicrob Chemother,2000,46(Suppl T1):17-24.
[8] Hooper DC.Mechanisms of action of antimicrobials:focus on fluo-roquinolones[J].Clin Infect Dis,2001,32(Suppl1):S9-S15.
[9] 阮卫.铜绿假单胞菌耐药机制研究进展[J].国外医学·临床生化与检验学分册,2004,25(6):536.
[10] 李小靖,陈武嘉,钟燕玲.对亚胺培南耐药的铜绿假单胞菌药敏情况分析[J].中国医药科学,2012,2(14):106-107.
[11] 韦柳华.不同标本分离的耐碳青霉烯铜绿假单胞菌的耐药性分析[J].实用医学杂志,2013,29(1):117-119.。
