takara宝生物公司限制酶双酶切buffer表
宝生物双酶切使用表
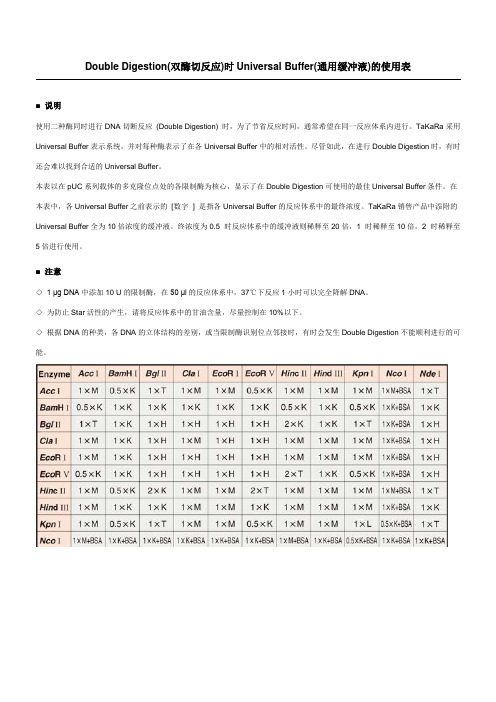
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■ 说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
双酶切体系梳理

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表■ 说明使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer 之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■ 注意◇1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
(精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏) (精选文档,可编辑word,整理文档不易,建议收藏)。
DNA限制性内切酶——双酶切反应时通用缓冲液及选用

DNA限制性内切酶——双酶切反应时通用缓冲液的选用
■当酶切位点确定后,最好购买同一家公司生产同一类型的内切酶(若酶切Buffer相同,这样有时候可以省去后期去需找酶切反应通用缓冲液)
■说明
使用两种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
双酶切体系
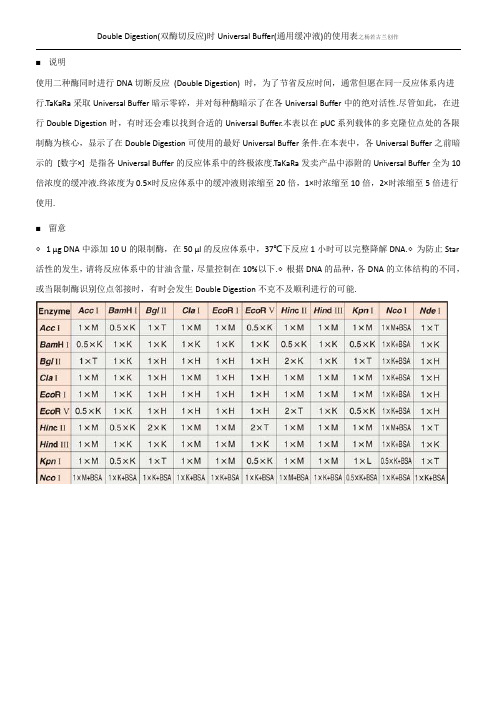
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表之杨若古兰创作
■说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常但愿在同一反应体系内进行.TaKaRa采取Universal Buffer暗示零碎,并对每种酶暗示了在各Universal Buffer中的绝对活性.尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer.本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最好Universal Buffer条件.在本表中,各Universal Buffer之前暗示的[数字×] 是指各Universal Buffer的反应体系中的终极浓度.TaKaRa发卖产品中添附的Universal Buffer全为10倍浓度的缓冲液.终浓度为0.5×时反应体系中的缓冲液则浓缩至20倍,1×时浓缩至10倍,2×时浓缩至5倍进行使用.
■留意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完整降解DNA.◇为防止Star 活性的发生,请将反应体系中的甘油含量,尽量控制在10%以下.◇根据DNA的品种,各DNA的立体结构的不同,或当限制酶识别位点邻接时,有时会发生Double Digestion不克不及顺利进行的可能.。
双酶切体系

双酶切体系(总2页)
--本页仅作为文档封面,使用时请直接删除即可--
--内页可以根据需求调整合适字体及大小--
Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表
■ 说明
使用二种酶同时进行DNA切断反应 (Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采用Universal Buffer表示系统,并对每种酶表示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前表示的 [数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
?
■ 注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇ 为防止Star活性的产生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇ 根据DNA的种类,各DNA的立体结构的差别,或当限制酶识别位点邻接时,有时会发生Double Digestion不能顺利进行的可能。
DNA限制性内切酶——酶切Buffer组分及其活性

DNA限制性内切酶——酶切Buffer组分及其活性TaKaRa公司,为了方便限制酶的统一使用,采用了通用缓冲液(Universal Buffer) 测定限制酶活性的体系(5种通用缓冲液中,用标注的),以此时的活性值作为100%。
并把在其它通用缓冲液中的相对活性表示如下表。
有( ) 标记的是易受Star活性影响的缓冲液,为了避免Star活性的影响,希望尽量使用或标注的缓冲液。
每种限制酶都有其自身的基本缓冲液(Basal Buffer),其中AccⅢ、BalⅠ、BcnⅠ、BglⅠ、Bpu1102Ⅰ、Cfr10Ⅰ、Eam1105Ⅰ、Eco52Ⅰ、NruⅠ、Psh BⅠ、Sna BⅠ、SspⅠ、TaqⅠ、VpaK11B Ⅰ(共14种)由于没有十分合适的通用缓冲液,只能使用基本缓冲液(Basal Buffer)。
各种限制酶的基本缓冲液组成不同,相互之间不能通用。
各种限制酶在基本缓冲液中的相对活性也被列于下表,供参考。
限制酶在各种缓冲液中的相对活性附带·活性测定用Buffer 推荐使用的Buffer*1+0.01%BSA→100%:Afl II, Aor13H I, Eco O65 I, Fok I, Hin1 I, Mun I, Nco I, Pvu I, Sse8387 I, Xba I *2 +0.01%BSA+0.01%Triton X-100→100%:Not I*3不加BSA按Universal Buffer分类的限制酶各Universal Buffer的组成■ 使用注意事项10×Buffer都为10倍浓度的缓冲液。
此外,10×T溶液中不含BSA,在使用时将BSA添加进去,使最终浓度为0.01%,有些限制酶(带有*1或*2标记)的反应体系中需加BSA或Triton X-100,添附的溶液是10倍浓度(0.1%) 的液体,使用时,请在反应体系中添加1/10量进行反应。
双酶切体系
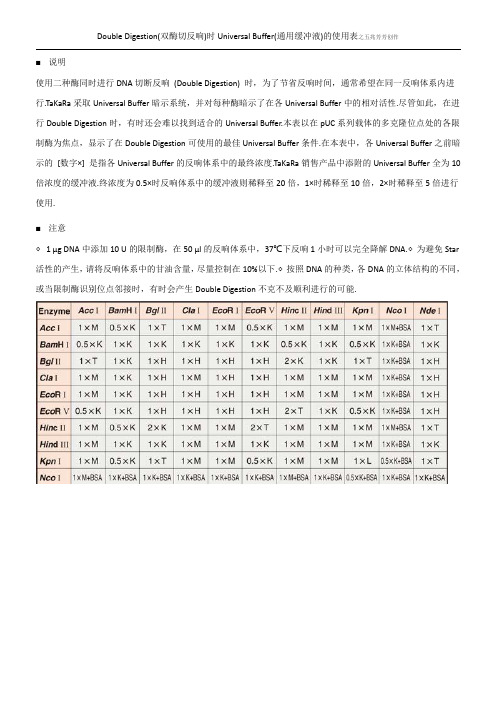
Double Digestion(双酶切反响)时Universal Buffer(通用缓冲液)的使用表之五兆芳芳创作
■说明
使用二种酶同时进行DNA切断反响(Double Digestion) 时,为了节省反响时间,通常希望在同一反响体系内进行.TaKaRa采取Universal Buffer暗示系统,并对每种酶暗示了在各Universal Buffer中的相对活性.尽管如此,在进行Double Digestion时,有时还会难以找到适合的Universal Buffer.本表以在pUC系列载体的多克隆位点处的各限制酶为焦点,显示了在Double Digestion可使用的最佳Universal Buffer条件.在本表中,各Universal Buffer之前暗示的[数字×] 是指各Universal Buffer的反响体系中的最终浓度.TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液.终浓度为0.5×时反响体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用.
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反响体系中,37℃下反响1小时可以完全降解DNA.◇为避免Star 活性的产生,请将反响体系中的甘油含量,尽量控制在10%以下.◇按照DNA的种类,各DNA的立体结构的不同,或当限制酶识别位点邻接时,有时会产生Double Digestion不克不及顺利进行的可能.。
双酶切体系

Double Digestion(双酶切反应)时Universal Buffer(通用缓冲液)的使用表之南宫帮珍创作
■说明
使用二种酶同时进行DNA切断反应(Double Digestion) 时,为了节省反应时间,通常希望在同一反应体系内进行。
TaKaRa采取Universal Buffer暗示系统,并对每种酶暗示了在各Universal Buffer中的相对活性。
尽管如此,在进行Double Digestion时,有时还会难以找到合适的Universal Buffer。
本表以在pUC系列载体的多克隆位点处的各限制酶为核心,显示了在Double Digestion可使用的最佳Universal Buffer条件。
在本表中,各Universal Buffer之前暗示的[数字×] 是指各Universal Buffer的反应体系中的最终浓度。
TaKaRa销售产品中添附的Universal Buffer全为10倍浓度的缓冲液。
终浓度为0.5×时反应体系中的缓冲液则稀释至20倍,1×时稀释至10倍,2×时稀释至5倍进行使用。
■注意
◇ 1 μg DNA中添加10 U的限制酶,在50 μl的反应体系中,37℃下反应1小时可以完全降解DNA。
◇为防止Star 活性的发生,请将反应体系中的甘油含量,尽量控制在10%以下。
◇根据DNA的种类,各DNA的立体结构的不同,或当限制酶识别位点邻接时,有时会发生Double Digestion不克不及顺利进行的可能。
