WHO乳腺肿瘤组织学分类-9月1日
最新WHO乳腺肿瘤分类的变化

WHO2012:乳头状病变的变化
• 增加了实性乳头状癌 • 对囊内乳头状癌的再认识,WHO2012中已更 名为“包被性乳头状癌” • 增加了对乳头状癌伴有不典型增生和导管 原位癌的描述(3mm标准 准: <3mm, 乳头状瘤 伴ADH;≥3mm, 乳头状瘤伴伴DCIS)
实性乳头状癌
• 好发于老年妇女(60-80岁) • 大部分病人有乳头溢液,溢血
• • • •
过于少见,形态、免疫表型和生物学行为都有待进一步探讨
化生性癌
低级别腺鳞癌 纤维瘤病样化生性癌(新增亚型) 鳞状细胞癌 梭形细胞癌 伴有间质分化的癌(名称的变化) 软骨分化、骨样分化、其他间质分化 • 肌上皮癌(归属的变化)
• • • • •
纤维瘤病样梭形细胞癌
Gobbi H et al, Cancer, 1999, 85:2170-82 • 首次提出纤维瘤病样梭形细胞癌的概念; • 30例纤维瘤病样梭形细胞癌术后8例局部复发(7 例肿块切除,1例局部扩大切除),但无淋巴结转 移和远处播散; • 有较好的生物学行为,更类似于纤维瘤病,而不 同于一般的化生性癌。建议采用纤维瘤病样化生 性肿瘤(Fibromatosis-like metaplastic tumors)
多形性癌(Polymorphous carcinoma)
定义:组织学特征与小涎腺 发生的“多形性低级别癌”相似。 流行病学:少见,新认识的类型,仅有3例报道。 临床特征:37--74岁。 大体:结节,大小1.5--4cm。 • 形态学:实性巢状,周围可见腺泡、筛状、小梁状及单行列兵样结 构。由单一形态细胞构成,圆形到卵圆形核,大量核分裂象。 • 免疫组化:三阴性(ER,PR,HER2)。 • 预后及预测:侵袭性生物学行为(高级别特征),预后较差(与涎 腺同形态肿瘤的低级别生物学行为不同)。
肿瘤分期

肾癌分期推荐采用2002年AJCC的TNM分期和分期组合(表-2、-3)[16](推荐分级B)。
2002年AJCC病理分期中评价N分期时,要求所检测淋巴结数目至少应包括8个被切除的淋巴结,如果淋巴结病理检查结果均为阴性或仅有1个阳性,被检测淋巴结数目<8个,则不能评价为N0或N1。
但如果病理确定淋巴结转移数目≥2个,N分期不受检测淋巴结数目的影响,确定为N2。
表-2 2002年AJCC肾癌的TNM分期肾脏的区域淋巴结包括:肾门淋巴结、腔静脉周围淋巴结、主动脉周围淋巴结和肾周的腹膜后淋巴结。
表-3 2002年AJCC肾癌分期组合霍奇金淋巴瘤分期I期:病变累及单个淋巴结区IE期:病变局限侵犯单个淋巴结外器官或部位II期:病变累及横膈同侧2个或以上的淋巴结区IIE期:病变局限侵犯单个淋巴结外器官或部位和它的区域淋巴结,伴或不伴横膈同侧的其它淋巴结区受累*注明受累的淋巴结区数目(如II3)III期:病变累及横膈两侧淋巴结区IIIE期:病变局限侵犯单个淋巴结外器官或部位,加横膈两侧淋巴结区受累IIIS期:病变累及脾脏,加以横膈两侧淋巴结区受累IIIE+S期:病变局限侵犯单个淋巴结外器官或部位和脾脏,加横膈两侧淋巴结区受累IV期:弥漫性(多灶性)侵犯1个或以上淋巴结外器官,伴或不伴相关淋巴结受累;或侵犯单个结外器官伴远处(非区域)淋巴结受累另外根据有无全身症状分为A、B。
A 无全身症状B 有以下一个以上症状:不能解释的发热>38℃;盗汗;体重减轻>10%非霍奇金淋巴瘤分期I期:病变累及单个淋巴结区IE期:病变局限侵犯单个淋巴结外器官或部位II期:病变累及横膈同侧2个或以上的淋巴结区IIE期:病变局限侵犯单个淋巴结外器官或部位和它的区域淋巴结,伴或不伴横膈同侧的其它淋巴结区受累*注明受累的淋巴结区数目(如II3)III期:病变累及横膈两侧淋巴结区IIIE期:病变局限侵犯单个淋巴结外器官或部位,加横膈两侧淋巴结区受累IIIS期:病变累及脾脏,加以横膈两侧淋巴结区受累IIIE+S期:病变局限侵犯单个淋巴结外器官或部位和脾脏,加横膈两侧淋巴结区受累IV期:弥漫性(多灶性)侵犯1个或以上淋巴结外器官,伴或不伴相关淋巴结受累;或侵犯单个结外器官伴远处(非区域)淋巴结受累另外根据有无全身症状分为A、B。
WHO乳腺癌组织学分类

混合型浸润性导管和小叶癌。肿瘤中可见两种明显不同的组织学形态, 左为导管癌,右为小叶癌。
1.2 浸润性导管癌: 多形性癌。
多形性和怪异的瘤巨细胞占瘤细胞50%以 上者
背景为腺癌或腺癌伴梭形细胞或鳞状分化 高度恶性
右图.免疫组化检测,癌组织表 达角蛋白(AE1/AE3和LP34), 证实为上皮性来源。
1.3 浸润性导管癌: 伴有破骨样 巨细胞的癌
浸润癌间质中有破骨巨细胞高-中分化的浸润 性导管癌 或其他组织学类型的癌
破骨巨细胞来源于组织细胞
CKP
1.4伴有绒癌特征的癌
① 有与绒癌类似的双向生长方式 ② 60%有β-HCG阳性的细胞 ③ 血清β-HCG可升高
鉴别
导管内癌伴有早期浸润: 以导管内癌为主的浸润性导管癌: 浸润性小叶癌 小管癌 髓样癌 浸润性筛状癌 放射状疤痕: 硬化性腺病:
小管小叶癌
多形性浸润性小叶癌
浸润性小叶癌粘液型
浸润性小叶癌小梁型
浸润性小叶癌硬化型
浸润性小叶癌伴神经内分泌分化型
浸润性小叶癌复合型 ,具有小叶和导管两型浸润性癌
混合型浸润型小叶癌
由经典型和一种或一种以上其他亚型小叶癌复合组成的病变
浸润性小叶癌印戒细胞型
鉴别
硬化性腺病 微腺型腺病 浸润性导管癌 小管癌 纯粹性(单纯性)粘液癌:没有小叶癌
21.导管内增生性病变
21.1普通导管增生 21.2平坦上皮不典型性 21.3不典型导管增生 21.4导管原位癌
22.微小浸润癌
23.导管内乳头状肿瘤 23.1中央型乳头状瘤 23.2外周型乳头状瘤 23.3不典型乳头状瘤 23.4导管内乳头状癌 23.5 囊内乳头状癌
1.浸润性导管癌(非特殊性)
WHO乳腺肿瘤组织学新分类的特点问题与对策

1 . 1 . 1 新 技术 、 新 成果 开始 用于辅 助 诊断 、 分 型及 预 测 新版 分类 最大 的特点是 新技 术 、新成 果开 始用 于辅助诊断 、 分 型 和 预测 , 如基 因、 染色体 、 分 子 标
癌 。新 版分类 对 D C I S亦推 荐进 行组 织学 分级 , 即分 为低、 中、 高 三个级 别 。 1 . 2 - 3 增加 预后 因素 及预测 因子 新 版 分类 在 每个 肿瘤 类 型 中均 增加 了预后 因素 及预测 因子 .其 中包 括 年龄 、 妊娠 、 肿瘤大小 、 炎细 胞 浸 润 、 淋 巴结状 况 、 组 织学 分 级 、 淋 巴管 和 血 管浸 润 、 倍体 、 分 子标 记 和 基 因表 达情 况等 , 使 临床 和病 理 的联 系 更加 紧密 。 1 . 2 - 4 强调 E R、 P R与 H e r 一 2 新 版 分 类 强 调 乳 腺 癌E R、 P R及 He r 一 2的表 达 与 临床 治疗 及 预 后 的意 义 。该 三项 指标 不仅 用 于指 导临 床对 内分 泌治疗 及
常发 生的遗 传变 异是 1 6号 染 色体长 臂缺 失 [ 。 E 一 钙
粘蛋 白( E — c a d h e r i n , E ~ c a d ) 基 因定 位 于 1 6 q 2 2 , 已 证实 1 6号 染 色 体 长 臂 缺 失 与 E — c a d表 达 缺 失 有 关I 5 ] 。免疫 组化 研究 也表 明小 叶原 位癌 绝 大多数 E — c a d阴性 而 C K 3 4 1 3 E 1 2阳性 .导 管原 位 癌 则 与之 相
1 6 q 。 1 7 p和 2 2 q缺失 [ 引 。 免疫 组化 检测 也有 助于 上述 三 种 病 变 鉴 别 :绝 大 多 数 正 常 乳 腺 组 织 和 U D H C K 3 4 1 3 E 1 2阳性 , 而 多数 A D H和 D C I S.  ̄ | I C K 3 通 性 导 管增 生 ( U D H) 、不 典 型 导管 增 生 ( A D H) 和导 管 原 位 癌 ( D C I S ) 三 者 的 鉴 别 中遗 传 学 特 点分 别 为 : 大约 7 %的 U D H显 示 一 定程 度 的 染 色 体 非 整倍 性 ,在 1 / 3的 U D H 中至 少 可证 实 一 个 位 点存在 L O H, U D H 中发 生 的 L O H位于 1 1 P 、 1 6 q和 1 7 p号染 色体 短 臂 上 , U D H基 因改 变 频率 明显 低 于 A D H E ] : 5 0 %的 A D H 具有 与 同侧乳 腺 浸 润性 癌 相 同 的L O H模 式 . L O H 经 常 发 生 的位 点 有 1 6 q , 1 7 p和
(整理)WHO乳腺肿瘤组织学分类-9月1日
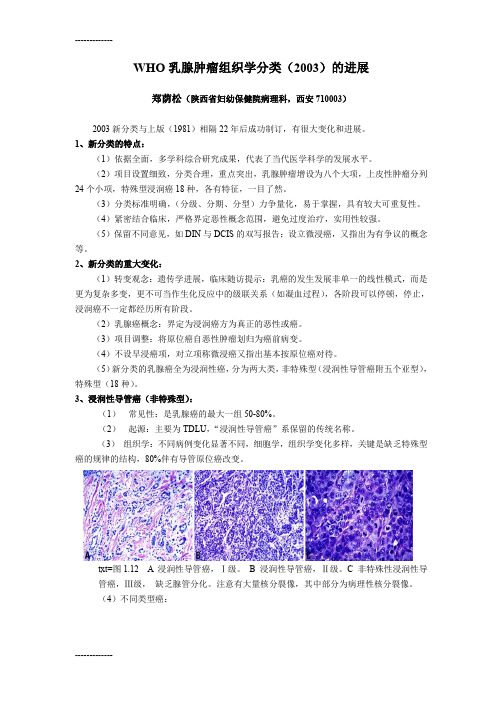
WHO乳腺肿瘤组织学分类(2003)的进展郑荫松(陕西省妇幼保健院病理科,西安710003)2003新分类与上版(1981)相隔22年后成功制订,有很大变化和进展。
1、新分类的特点:(1)依据全面,多学科综合研究成果,代表了当代医学科学的发展水平。
(2)项目设置细致,分类合理,重点突出,乳腺肿瘤增设为八个大项,上皮性肿瘤分列24个小项,特殊型浸润癌18种,各有特征,一目了然。
(3)分类标准明确,(分级、分期、分型)力争量化,易于掌握,具有较大可重复性。
(4)紧密结合临床,严格界定恶性概念范围,避免过度治疗,实用性较强。
(5)保留不同意见,如DIN与DCIS的双写报告;设立微浸癌,又指出为有争议的概念等。
2、新分类的重大变化:(1)转变观念:遗传学进展,临床随访提示:乳癌的发生发展非单一的线性模式,而是更为复杂多变,更不可当作生化反应中的级联关系(如凝血过程),各阶段可以停顿,停止,浸润癌不一定都经历所有阶段。
(2)乳腺癌概念:界定为浸润癌方为真正的恶性或癌。
(3)项目调整:将原位癌自恶性肿瘤划归为癌前病变。
(4)不设早浸癌项,对立项称微浸癌又指出基本按原位癌对待。
(5)新分类的乳腺癌全为浸润性癌,分为两大类,非特殊型(浸润性导管癌附五个亚型),特殊型(18种)。
3、浸润性导管癌(非特殊型):(1)常见性:是乳腺癌的最大一组50-80%。
(2)起源:主要为TDLU,“浸润性导管癌”系保留的传统名称。
(3)组织学:不同病例变化显著不同,细胞学,组织学变化多样,关键是缺乏特殊型癌的规律的结构,80%伴有导管原位癌改变。
txt=图1.12 A 浸润性导管癌,Ⅰ级。
B 浸润性导管癌,Ⅱ级。
C 非特殊性浸润性导管癌,Ⅲ级,缺乏腺管分化。
注意有大量核分裂像,其中部分为病理性核分裂像。
(4)不同类型癌:①混合型癌:非特殊型构象<50%,余为特殊型。
图1.13 混合型浸润性导管和小叶癌。
可见肿瘤中两种明显不同的组织生长方式,左为导管癌,右为小叶癌。
2012年版《WHO乳腺肿瘤分类》新变化与临床治疗的关系

或固有基因)与在同一肿瘤重复样本之间的分析
作者单位:300060天津医科大学肿瘤医院乳腺病理研究室 国家肿瘤临床医学研究中心乳腺癌防治教育部重点实验室天津 市“肿瘤防治”重点实验室 通信作者:牛昀,Email:yunniu2000@126.tom
相比,更多地揭示了至少5种命名为luminal
luminal
些质疑,尤其在国际会议和国际杂志上交流论文
时,遇到很尴尬的局面。至少国际同行认为接受 了这些不恰当治疗的病例,其疗效和随访数据与 国际上同类病例资料已无可比性。 4.1导管内癌 St.Gallen专家共识主要是针对早期浸润性 乳腺癌的临床治疗,NCCN指南则包含了浸润性 癌和原位癌临床处理原则。NCCN指南2013年1版 中对于导管内癌的主要治疗原则仍然是肿块切
的切片来评价,仅仅是明确的核分裂相才能被计数
(2003版:视野的选择应从肿瘤周边浸润区开始,
疾病的理解更深入,为治疗手段的改进提供了有 力证据和开辟了新的途径。乳腺病理学分类也在
随之不断地更新和增加内容,朝着更加适合临床 治疗需求、体现同病异治、异病同治新理念的方向 发展和完善。2012年新版《WHO乳腺肿瘤分
A、
B、HER-2过表达型、基底样以及正常乳腺
样型的乳腺癌分子亚型的存在。虽然使用不同的 内源性基因群和单样本预测因子可将乳腺癌分为
万方数据
・2。
主堡呈L膣痘苤盍(皇王题2垫!垒生!旦筮!鲞筮!塑堡!也』旦!!墅!望亟垦!塑!型业垦堂!i塑2:』!些垫!堡:!堕:!:盟垒!
几个固有亚型,但问题是也有资料显示,用不同的 方法可能会把同一病例归为不同的固有亚型。仅 仅基底样亚型不论使用何种分析方法仍可以被重 现性地证实,因此可说,目前最为稳定地能够被划 分开的是基底样和非基底样这两大固有亚型类 别_o。2012新版分类中提到微阵列检测PAM50的 出现和应用使乳腺癌分型缺乏标准化和缺乏再现 性的状况得到部分改善喁J。qRT.PCR技术可被用 于石蜡包埋存档样本,检测成套50个基因的表达 水平,将浸润性乳腺癌分类为luminal
乳腺癌病理学分类及预后标记物(研究荟萃)
⑤ 内分泌型管内癌
乳腺最小癌(1cm/0.5cm以下):乳腺微癌,乳腺隐匿癌
原位癌→最早浸润→微灶浸润→微小癌(主为管内癌成
分的浸润性. 浸润性癌
(1) 浸润性小叶癌
(2) 浸润性导管癌 infiltrating ductal carcinoma
①不典型髓样癌 atrypical medullary carcinoma
白细胞角蛋白(CK)
行业特选
15
* 非上皮标记
LCA
Vim VIII因子
actin
myosin,基底膜成份(laminin,IV型胶原等)
CD34、CD68
植物凝血素(lectin)
激素受体:ER、PR
行业特选
16
3.预后有关标记物 (1) bcl-2 NM23 VEGF EGF-R(表皮生长因子受体)
② 乙型小叶瘤 lopular neoplaisa, type B
(2) 管内癌 intraductal carcinoma
①实体型管内癌
②粉刺型管内癌
③筛状型管内癌
④小管型管内癌
⑤低乳头状管内癌
⑥混合型
行业特选
6
特殊类型导管原位癌:
① 透明细胞型管内癌
② 印戒细胞型管内癌
③ 梭形细胞型管内癌
④ 囊性分泌过多型管内癌
行业特选
17
(2) 表1 乳腺癌预后指标
编号 ZM-0104 ZM-0215 ZM-0065 ZM-0220 ZM-0208 ZM-0223 ZM-0079 ZM-0165 ZM-0213
抗体名称
表达情况
ER
强阳性
PR
强阳性
C-erbB-2
强阳性
WHO2019乳腺肿瘤分类
WHO2019乳腺肿瘤分类乳腺肿瘤是女性最常见的恶性肿瘤之一,也是全球女性死亡率最高的癌症。
根据世界卫生组织(WHO)于2019年发布的最新乳腺肿瘤分类标准,乳腺肿瘤可以分为多种类型,每一种都有其特定的病理特征、临床表现和治疗方法。
本文将介绍WHO2019乳腺肿瘤分类的主要内容。
首先,WHO2019乳腺肿瘤分类标准在乳腺肿瘤的诊断和治疗上有着重要的指导作用。
该分类标准将乳腺肿瘤分为非特指性肿瘤、良性肿瘤和恶性肿瘤三大类。
其中,非特指性肿瘤是指无法准确定义为良性或恶性的肿瘤,需要进一步的病理分析才能作出准确诊断。
而良性肿瘤则是指绝大多数无恶性潜能的肿瘤,一般不会对患者健康造成严重威胁。
恶性肿瘤则是指有恶性潜能的肿瘤,对患者健康造成危害,需要及时进行治疗。
根据WHO2019乳腺肿瘤分类标准,良性肿瘤又可以进一步分为乳腺纤维腺瘤、乳头状瘤、导管内增生症和乳腺导管扩张症等几种。
乳腺纤维腺瘤是乳腺最常见的良性肿瘤之一,多见于青年女性,通常具有明确的包膜,切除后有很低的复发率。
乳头状瘤则是一种少见的良性乳腺肿瘤,通常表现为乳头溢液、血性乳汁等症状。
导管内增生症是一种常见的乳腺病变,其中非典型导管内增生症有一定的恶性潜能,需要警惕。
乳腺导管扩张症又称为导管内乳头状瘤,主要表现为乳头溢液、乳头出血等症状。
相比之下,恶性肿瘤的分类更加复杂。
根据WHO2019乳腺肿瘤分类标准,恶性乳腺肿瘤可分为浸润性导管癌、乳头状癌、浸润性小叶癌、乳腺癌与转移性肿瘤等几种类型。
浸润性导管癌是最常见的乳腺癌类型,占据了乳腺癌患者的大部分比例,其特点是恶性细胞侵犯乳腺导管壁并侵蚀周围组织。
乳头状癌则是一种少见的乳腺癌类型,恶性细胞主要集中在肿瘤的乳头部分。
浸润性小叶癌是一种乳腺癌亚型,恶性细胞主要位于乳腺腺体的小叶部分。
乳腺癌与转移性肿瘤是指恶性细胞主要发生在乳腺癌原发灶以外的转移部位。
了解乳腺肿瘤的分类对于临床的诊断和治疗非常重要。
第五版 乳腺WHO 神经内分泌肿瘤篇
第五版乳腺WHO 神经内分泌篇神经内分泌肿瘤:总论1963年,Feyter和Hartmann首次在粘液性癌中描述了乳腺癌的神经内分泌分化,基于银染色阳性而判断这是一种形态类似于肠道类癌的浸润性癌。
1977年发表了第一例题目为“乳腺原发类癌”的系列报道。
且电子显微镜和改良银染色证实神经内分泌颗粒的存在,这些病例被称为嗜银性癌【98】。
随后,在1985年证实了嗜铬粒蛋白A(CgA)染色阳性【257】,这些为乳腺癌产生神经多肽提供了证据。
第三版(2003年卷《乳腺和女性生殖器官肿瘤的病理学和遗传学》中认为乳腺神经内分泌癌是一种独特的实体,并根据Sapino等人【1824】的标准定义。
乳腺神经内分泌肿瘤(NETs)被定义为上皮源性肿瘤,形态类似胃肠道和肺的NETs,在至少50%的侵袭性肿瘤细胞群中表达神经内分泌标记(特别是Syn及CgA)。
在2012年第四版乳腺WHO分类中,神经内分泌癌(NECs)被归类为具有“神经内分泌癌特征的癌”,其组织学形态与胃肠道和肺的NETs相似,且表达不同程度的神经内分泌标记。
在第四版WHO分类中,乳腺NETs主要分为两大类:(1)NETs,分化较好,包括低级别和中级别肿瘤。
(2)NECs,差分化/小细胞癌,基于描述,这些肿瘤包括小细胞癌NEC(SCNEC)而不包括大细胞NEC(LCNEC)。
这种分类也承认了第三类乳腺癌的存在,包括一系列有组织学及免疫组织化学特征的乳腺癌伴神经内分泌分化的乳腺癌子集,还包括非特殊型(no special type,NST)乳腺癌、实性乳头状癌以及粘液腺癌富于细胞型。
所以,在区分1级或2级乳腺癌伴神经内分泌分化与NETs标准不甚清楚。
在国际癌症研究机构(IARC)和WHO的一份专家共识声明中【1764】,建议采用“神经内分泌肿瘤(NEN)”一词,涵盖所有具有主要神经内分泌分化的肿瘤类别,包括分化好及分化差形态。
形态学以及神经内分泌分化标记物的表达被认为是关键特征。
乳腺癌的分类与分期
乳腺癌的分类与分期乳腺癌是一种常见的女性恶性肿瘤,也可发生于男性。
早期发现和准确分期对于乳腺癌的治疗和预后至关重要。
本文将对乳腺癌的分类及分期进行详细介绍。
一、乳腺癌的分类乳腺癌可按照不同标准进行分类,常见的分类方式有以下几种:1. 组织学分类根据乳腺癌的组织学类型,可将其分为浸润性导管癌(invasive ductal carcinoma, IDC)、非浸润性导管癌(non-invasive ductal carcinoma)、乳头状癌(papillary carcinoma)、黏液癌(mucinous carcinoma)等。
其中,浸润性导管癌是最常见的类型,占乳腺癌的大部分。
2. 分子分型根据乳腺癌的分子特征,以ER、PR和HER2为标志物,可将乳腺癌分为四种分子分型:激素受体阳性/HER2阴性、激素受体阳性/HER2阳性、激素受体阴性/HER2阳性和三阴乳腺癌。
不同分子分型对治疗和预后有着重要的指导意义。
3. TNM分期TNM分期是乳腺癌常用的分期系统,根据肿瘤大小(T)、淋巴结转移(N)、远处转移(M)等因素来确定乳腺癌的分期。
根据不同的分期,乳腺癌的治疗方案和预后也会有所差异。
二、乳腺癌的分期乳腺癌的分期是根据肿瘤的大小、淋巴结转移和远处转移等因素来确定的。
常用的乳腺癌分期系统有以下几种:1. 美国癌症学会分期系统(AJCC)该分期系统即TNM分期系统,根据乳腺癌的肿瘤大小、淋巴结转移和远处转移确定乳腺癌的分期。
分为0期、Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期。
0期:原位癌,即非浸润性癌,没有侵入基底膜,治愈率较高;Ⅰ期:肿瘤直径小于2厘米,未侵犯淋巴结;Ⅱ期:ⅡA期肿瘤直径小于2厘米,浸润少于3个淋巴结;ⅡB期肿瘤直径2-5厘米,或浸润3-9个淋巴结;ⅡC期肿瘤大于5厘米,或浸润10个以上淋巴结;Ⅲ期:ⅢA期肿瘤可见肿块状浸润,或淋巴结转移;ⅢB期肿瘤较大,浸润皮下组织或胸壁,或淋巴结转移;ⅢC期与ⅢB期类似,但淋巴结转移更明显;Ⅳ期:远处转移,即癌细胞扩散到其他器官。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
WHO乳腺肿瘤组织学分类(2003)的进展郑荫松(陕西省妇幼保健院病理科,西安710003)2003新分类与上版(1981)相隔22年后成功制订,有很大变化和进展。
1、新分类的特点:(1)依据全面,多学科综合研究成果,代表了当代医学科学的发展水平。
(2)项目设置细致,分类合理,重点突出,乳腺肿瘤增设为八个大项,上皮性肿瘤分列24个小项,特殊型浸润癌18种,各有特征,一目了然。
(3)分类标准明确,(分级、分期、分型)力争量化,易于掌握,具有较大可重复性。
(4)紧密结合临床,严格界定恶性概念范围,避免过度治疗,实用性较强。
(5)保留不同意见,如DIN与DCIS的双写报告;设立微浸癌,又指出为有争议的概念等。
2、新分类的重大变化:(1)转变观念:遗传学进展,临床随访提示:乳癌的发生发展非单一的线性模式,而是更为复杂多变,更不可当作生化反应中的级联关系(如凝血过程),各阶段可以停顿,停止,浸润癌不一定都经历所有阶段。
(2)乳腺癌概念:界定为浸润癌方为真正的恶性或癌。
(3)项目调整:将原位癌自恶性肿瘤划归为癌前病变。
(4)不设早浸癌项,对立项称微浸癌又指出基本按原位癌对待。
(5)新分类的乳腺癌全为浸润性癌,分为两大类,非特殊型(浸润性导管癌附五个亚型),特殊型(18种)。
3、浸润性导管癌(非特殊型):(1)常见性:是乳腺癌的最大一组50-80%。
(2)起源:主要为TDLU,“浸润性导管癌”系保留的传统名称。
(3)组织学:不同病例变化显著不同,细胞学,组织学变化多样,关键是缺乏特殊型癌的规律的结构,80%伴有导管原位癌改变。
txt=图1.12 A 浸润性导管癌,Ⅰ级。
B 浸润性导管癌,Ⅱ级。
C 非特殊性浸润性导管癌,Ⅲ级,缺乏腺管分化。
注意有大量核分裂像,其中部分为病理性核分裂像。
(4)不同类型癌:①混合型癌:非特殊型构象<50%,余为特殊型。
图1.13 混合型浸润性导管和小叶癌。
可见肿瘤中两种明显不同的组织生长方式,左为导管癌,右为小叶癌。
②多形性癌:怪异瘤巨细胞>50%,余为腺癌或腺癌伴梭形,鳞形分化,少见,高度恶性,易误认为肉瘤。
图1.14 浸润性导管癌:多形性癌。
A 缺乏明显结构的低分化癌细胞,容易误当作肉瘤。
B 免疫组化检测,瘤组织表达角蛋白(AE1/AE3和LP34),证实为上皮性来源。
③伴破骨巨细胞癌:已证明巨细胞为组织细胞(CD68阳性)。
图 1.16 A 浸润性导管癌伴有间质破骨样巨细胞和吞噬含铁血黄素的巨噬细胞。
B 低度恶性浸润性导管癌,间质中有明显的多核巨细胞。
④伴绒癌特征的癌:罕见,血清βHCG升高,60%非特殊型癌细胞中HCG(阳性),但组织学上呈绒癌特征者仅几例报道。
图1.17 伴有绒癌特征的癌。
A,B 带有模糊核的多核瘤细胞围绕呈簇的单核瘤细胞,伸展其不规则和延长的胞浆突起,与绒癌的双向生长方式类似。
B 在这种高度恶性的癌组织中,可见病理性核分裂像。
⑤伴黑色素瘤的癌:罕见,非特异型癌+恶黑,两种细胞可互相移行,应注意鉴别转移性恶黑或皮肤源性恶黑。
(5)免疫组化:70-80%ER阳性,15-30% erbB2阳性。
(6)遗传学:浸润学型导管癌与特殊型浸润癌遗传学改变显著不同,浸润型导管癌又表现为不同的遗传学特征,cDNA微排已证明可有不同特征。
(7)分级:规定统一应用Bloom和Richadson提出不断修改的patley &Scarff的半定量分级法(表1)表1乳腺癌组织学半定量分级法组织形态表现评分(分)腺腔形成占肿瘤的大部分(>75%) 1中等程度(10%—75%) 2少和无(<10%) 3核多形性小而规则一致的细胞 1中等大小及异型性细胞 2明显异型性细胞 3核分裂记数取决于显微镜视野(注)1~3组织学分级1级一高分化3~52级一中分化6~73级一低分化8~9注:3种不同显微镜视野核分裂记数测量举例视野直径(㎜)0.44 0.59 0.63视野面积(㎜2)0.152 0.274 0.312核分裂记数(每10HPF)1分0~5 0~9 0~112分6~10 10~19 12~223分≥11 ≥20 ≥23注意:①评判腺管和腺泡时,只有具有明确的中央空腔时,才被计数。
②评判核的多行性,是邻近乳腺组织正常上皮细胞状况作参考标准,核仁的大小及数量是有用的附加特征。
③核分裂计数,应排除细胞凋亡的核固缩和核深染,应以标准化固定视野区域或网格系统计数。
小结:浸润型导管癌新版诊断标准明确,解决了以往诊断的难题.不再使用不规范诊断名称,单纯癌、硬癌。
4、特殊型浸润性乳腺癌(1)原有特殊类型乳腺癌,改变不大者此处不再赘述。
(2)充实了浸润性小叶癌,近年发病率增高,分为实体型、腺泡型、多形型和混合型。
免疫组化(70-95%)ER阳性,增殖率偏低,多形型者erbB2可过表达,但低于IDC,E-Cadherin表达在小叶癌中有重要意义和作用。
图1.20 原位和浸润性小叶癌,位于视野左侧和下部的大细胞为浸润性瘤细胞。
图1.21 A 浸润性小叶癌。
B 在小叶癌细胞中,典型的缺乏E-Cadherin表达,而内陷的正常小叶则具有免疫反应。
C 大量的印戒细胞和胞浆内腔(靶环样分泌)。
图1.22 A 对比图B,经典性小叶癌细胞形态一致,呈单行排列。
B 浸润性多形性小叶癌具有多形性、非典型性细胞核。
(3)增列了神经内分泌型癌项分型:实体型、不典型癌、小细胞癌/燕麦细胞癌、大细胞神经内分泌癌四个亚型。
诊断标准:神经内泌阳性瘤细胞>50%.免疫组化:CK 7阳性、CK 20阴性、区别于肺小细胞癌转移(两项均阴性)。
E-Cadherin100%阳性,区别于小叶癌,GCDFP 15阳性,ER、PR过表达支持为乳腺原发癌。
图1.33 神经内分泌癌。
A 瘤细胞围绕管腔呈有极向排列,一些细胞显示类癌样嗜酸性颗粒。
B 免疫组织化学染色CgA呈阳性。
图1.34 乳腺神经内分泌癌。
腺泡状生长方式,可见梭形细胞呈圆形实性巢团分布,浸润致密的胶原性间质。
(4)新增六种特殊型浸润癌:①浸润性筛状癌:预后极佳,类似导管内筛状癌,80%伴筛状型导管原位癌。
图1.25 浸润性筛状癌。
左侧筛状型DCIS呈圆形结构,右侧不规则并成角的浸润性癌组织分布不规律。
②浸润性微乳头状癌:不多见,多伴早期淋巴结转移(>70%),60%瘤旁血管内瘤栓。
图1.38 浸润性微乳头状癌。
A 注意明显的血管浸润,瘤细胞簇中央空腔中偶见核固缩。
B 淋巴结转移。
C 外周细胞的细胞膜表达EMA。
③嗜酸性细胞癌:>70%嗜酸性细胞组成(抗线粒体阳性),应与大汗腺癌相区别。
图1.55 嗜酸细胞癌。
注意结节的边界清楚,细胞具有丰富的嗜酸性胞浆。
④腺泡细胞癌:类似腮腺泡细胞癌,瘤细胞酶类(抗淀粉酶、溶菌酶)表达阳性。
图1.59 腺泡细胞癌,细胞胞浆呈颗粒状。
图1.60 腺泡细胞癌。
注意缺乏核的非典型性。
图1.61 腺泡细胞癌,免疫组化染色瘤细胞呈溶菌酶阳性。
⑤富于糖原透明细胞癌:>90%含糖原的透明细胞组成,应用酶组织化学有助于鉴别诊断。
图1.62 富于糖元性癌。
A 瘤细胞有丰富的透明胞浆和相对一致的圆形核,呈实性生长,伴有分枝状血管。
B 注意在浸润癌附近的一个导管中,可见典型的导管上皮移行为透明细胞。
⑥皮脂腺样癌:极少见,非起源于皮肤皮脂腺的皮脂腺样癌,生物学行为不清。
瘤细胞表达全角蛋白,ER、PR可阳性。
小结:新老合计,现有18型特殊型浸润性乳腺癌,各有特征,分类细致而不显繁琐。
5、上皮增生性病变与癌前期病变的进展。
把原位癌从恶性肿瘤划出放入癌前病变范畴,把有关上皮增生性病变这个难题,分别独立列项:包括小叶性肿瘤、导管内增生性病变,导管内乳头状肿瘤及良性上皮增生。
涵盖了从正常上皮至良性增生—不典型增生—癌前病变谱系的变化特征,分类清晰,进展较大。
5.1小叶性肿瘤/瘤变定义:涵盖TDLU以细胞小且粘附松散为特征的所有异型性增生(异型小叶和小叶原位癌)。
性质:遗传学已证明其肿瘤性本质,是发生浸润癌的危险因素,但非必然前趋因子。
新分类只保留了小叶原位癌名称,生物学行为分级为2,性质已划归癌前病变。
形态学特征:小叶结构保存、病变局限TDLU内,75%有终末导管Paget病样侵犯。
分类:传统的(A型)为经典型、(B型)为多形型。
LIN三级分级法:尚待认证,病变严重者指出可诊断为LIN3级。
免疫组化:大多有ER、PR阳性,罕有erbB2表达,P53阴性,E-Cadherin通常为阴性。
随访:仅有少数妇女为非确定的癌前病变,只是发展为浸润癌的一个危险因素。
处理:避免临床过度治疗,当前提倡终生随访。
图1.74 早期小叶肿瘤。
A 末梢导管小叶单位中可见少量瘤细胞,快速观察切片时很容易遗漏。
B 用E-cadherin(棕色)和CK34BE12(紫色)进行双重免疫组化染色,显示小叶中有少量瘤细胞。
这些早期病变在观察HE染色切片时往往被遗漏。
图1.75 小叶肿瘤。
A 上皮层下可见增生的瘤细胞疏散排列(派杰样生长方式)。
B 典型瘤细胞E-cadherin染色呈阴性。
C CK34BE12免疫组化染色显示胞浆阳性。
图1.76 小叶肿瘤。
CK5/6免疫组化染色,阳性的上皮之间可见派杰样瘤细胞浸润,形态类似于网状纤维染色。
图1.77 小叶肿瘤。
A 腺泡中度膨大,充满瘤细胞,轮廓清楚。
B三叶草型,小叶肿瘤的典型形态。
瘤细胞使小叶膨大并外拉小叶内末梢导管,形成三叶草或项链形状。
5.2导管内增生性病变定义:指一组细胞学和组织学多样性增生,局限于TDLU,伴不同程度发展为浸润癌的风险性。
内容:①普通型导管增生;②平坦型上皮不典型性(新增成份);③不典型性导管增生;④导管原位癌分级:采用导管上皮内瘤变(DIN),同时认为应保持传统命名,规定两种命名分级同时应用,双写报告。
(表2)表2 导管内增生性病变的分级传统名称导管上皮内瘤名称普通型导管增生(UDH)普通型导管增生(UDH)平坦型上皮非典型性导管上皮内瘤1A(DIN1A)非典型性导管增生(ADH)导管上皮内瘤1B(DIN1B)导管原位癌(DCIS 1级)导管上皮内瘤1C(DIN1C)(DCIS 2级)导管上皮内瘤2 (DIN2 )(DCIS 3级)导管上皮内瘤3 (DIN3 )5.2.1普通性导管增生(UDH)定性:为良性,特征为二级腺腔,及中心细胞水流状排列。
(表3)表3普通型导管增生形态特点组织学特点细胞学特点不规则的开窗样生长多细胞型周边窗孔上皮细胞形态多样细胞搭桥样生长(伸长或扭曲) 细胞边界不清细胞排列水流样核形态多样细胞核分布不均或核重叠风险性:轻微升高(1.5—2.0倍),约占2.6%,间隔14.3年。
免疫组化:高分子量CK阳性,E-Cadherin阳性,ER稍高,CyclinD1增高,TP53阴性。
