实验五GUS染色检测基因瞬时表达
GUS报告基因范文

GUS报告基因范文GUS报告基因是一种用于筛选转基因植物的报告基因。
它在植物细胞内表达的酵素β-葡萄糖苷酶(β-Glucuronidase,GUS),能够将葡萄糖醛酸(X-Gluc)转化为蓝色产物。
通过观察和分析植物组织的GUS活性,可以判断是否发生了基因转化。
下面将详细介绍GUS报告基因的特点、应用以及实验方法。
1.GUS报告基因的特点(1)GUS基因来自于大肠杆菌,它很少在真核生物中表达,因此不会对植物正常生长发育产生影响。
(2)GUS基因编码的酵素活性能够方便、快速地用染色剂标记出来,实验结果直观可见。
(3)转GUS基因的步骤相对简单,转化率较高,且不需要使用昂贵的设备。
2.GUS报告基因的应用(1)植物转基因筛选:通过观察和分析转基因植物的GUS活性,可以确定哪些植株成功地转化了外源基因。
(2)基因调控研究:GUS报告基因可以用来研究目的基因的表达调控机制,例如在转基因植物中瞬时表达GUS基因,观察其在各种组织和发育阶段的表达情况,可以推测目的基因的启动子活性。
(3)信号传导途径研究:通过构建GUS基因的操纵,可以研究植物信号传导途径中特定基因的表达情况,进而了解信号传导途径的效率和调节机制。
3.实验方法以下是GUS报告基因实验的一般步骤:(1)构建GUS载体:将GUS基因与适合的植物表达载体进行连接,形成GUS转化载体。
(2)遗传转化:将GUS转化载体导入要进行转基因植物研究的植物细胞中,使用适当的生物技术方法(如冲击法、农杆菌介导法)实现遗传转化。
(3)植物筛选:选择经过转化的植株进行分析,通常可以通过PCR、Southern blot、Western blot等技术检测GUS基因的存在。
(4)组织切片染色:收集不同部位的植物组织,例如叶片、根、花等,制作切片。
使用X-Gluc作为底物加入切片中,观察蓝色染色产物的形成。
(5)定量分析:通过测定GUS活性,使用亲合素、含有底物的液体培养基等方法,可以 quantitatively 地测定GUS酶活性。
GUS基因瞬时表达检测小麦1Ay基因启动子功能

GUS基因瞬时表达检测小麦1Ay基因启动子功能马建华;王玉国;张瑾华;胡变芳;杨艳君【摘要】本试验以pAyGUS为转化质粒,该质粒为小麦高分子量麦谷蛋白亚基基因1Ay的启动子和β—葡糖苷酸酶(GUS)基因的重组质粒,利用基因枪法将该质粒导入小麦胚乳及胚中,检测其表达活性.通过X-gluc染色检测表明,GUS基因在该启动子的驱动下能在小麦种子中特异表达,可见小麦1Ay基因的启动子具有在小麦胚乳中特异表达的活性,这为小麦品种改良及转基因研究奠定了基础.【期刊名称】《山西农业大学学报(自然科学版)》【年(卷),期】2014(034)006【总页数】4页(P499-502)【关键词】小麦;1Ay基因;启动子;GUS基因;瞬时表达【作者】马建华;王玉国;张瑾华;胡变芳;杨艳君【作者单位】晋中学院生物科学与技术学院,山西晋中030600;山西农业大学农学院,山西太谷030801;晋中学院生物科学与技术学院,山西晋中030600;晋中学院生物科学与技术学院,山西晋中030600;晋中学院生物科学与技术学院,山西晋中030600【正文语种】中文【中图分类】S512.103.53;Q78小麦在世界上种植面积最大,是我国人民的主要粮食作物之一,其种植面积在我国位居第二[1]。
当前,优质小麦已经成为小麦育种研究者的主要目标之一。
研究显示,小麦加工品质受其高分子量麦谷蛋白亚基(HMW-GS)的数量、类型、结构和含量的影响[2]。
近年来许多改善小麦品质的高分子量麦谷蛋白亚基基因被克隆和转化,白建荣应用分子克隆技术获得了乌拉尔图小麦表达型和不表达型1Ay麦谷蛋白亚基基因[3]。
研究认为,通过转基因将表达型1Ay基因导入到栽培小麦品种中,将可能提高小麦的烘烤品质[4]。
而要实现这一目标,就必须获得高效且在种子中专一表达的启动子,驱动1Ay麦谷蛋白亚基基因在小麦种子中高效专一表达。
本试验以含标记基因GUS和胚乳特异性启动子1Aypromoter的质粒pAyGUS(6009bp)为转化质粒,对小麦胚乳及胚进行转化,以验证1Ay麦谷蛋白亚基基因的启动子的胚乳特异性启动功能,从而为小麦转基因及品质改良研究奠定基础。
实验五、GUS染色检测基因瞬时表达

问题解决能力
实验态度转变
在实验过程中遇到问题时,我学会了独立 思考和团队协作,积极寻找解决方案。
通过认真对待每一个细节,ቤተ መጻሕፍቲ ባይዱ培养了严谨 的实验态度和科学精神。
gus染色检测基因瞬时表达的未来发展方向
应用拓展
除了基础研究,gus染色检测基因瞬时表 达在医学诊断和治疗等领域也有广阔的应
用前景。
A 技术优化
01
02
03
研究基因功能
通过瞬时表达技术可以快 速检测特定基因的功能, 了解其在细胞中的作用。
药物筛选
利用瞬时表达技术筛选对 特定基因有调控作用的候 选药物。
基因治疗
瞬时表达技术可用于基因 治疗的研究,为疾病治疗 提供新思路。
02 实验原理
gus染色检测基因瞬时表达的生物学基础
基因瞬时表达
基因瞬时表达是指通过转录和翻译在 短时间内产生大量蛋白质的过程。在 植物和某些微生物中,瞬时表达常用 于研究基因的功能和表达调控。
学习gus染色检测基因瞬时表达的方法
准备实验材料
X-Gluc、缓冲液、DNA转染试 剂、细胞培养板等。
GUS染色
将转染后的细胞用X-Gluc染色 ,观察蓝色产物。
转染DNA
将目的DNA与转染试剂混合, 加入细胞培养板中,使DNA瞬 时表达。
结果分析
根据蓝色产物的多少判断GUS 基因的瞬时表达量。
掌握gus染色检测基因瞬时表达的应用
显色反应
在适宜的温度和pH条件下,GUS酶 催化底物水解,产生蓝色产物。
结果观察
通过观察蓝色产物的生成情况,判断 目的基因是否成功瞬时表达。
03 实验步骤
准备实验材料和试剂
准备所需的gus基因瞬时表 达载体。
gus基因检测

gus 基因PCR 反应程序: 94℃预变性5 min 94℃变性1 min58℃退火1 min 30个循环 72℃延伸2min 72℃延伸7 mingus 基因引物序列为:5’GCTATACGCCTTTGAAGCC 3’和5’TTGACTGCCTCTTCGCTGTA 3’GUS 染色母液:X-Gluc 由DMSO 溶解,贮存浓度为l0mg/mL,于-20°C 保存。
GUS 染液:500mg/L X-Gluc, 0.1mol/L K3Fe(CN)6,0.lmol/L K4Fe(CN)6,0.0lmol/L ,的配制方法:将7.800g NaH2PO4溶于水,定容至100ml●这是1ml的配方体系:终浓度药品分子量体积0.5M Na2EDTA 20ulTritonX-100 1ul1M 磷酸钠缓冲液(PH7.0) 100ul0.1M K3Fe(CN)6 5ul0.1M K4Fe(CN)6 5ul10mg/ml X-Gulc 200ul去离子水或无菌水669ul染液配方0.05M磷酸缓冲液 4.48ml 5mM铁氰化钾0.05ml, 5mM亚铁氰化钾0.05ml,Triton-100 0.01ml,水4.64ml,X-Gluc先溶于0.05ml DMF中,终浓度为0.5mg/ml37度染色过夜1.2染色步骤1)染色:加入适量配制好的GUS染液于24孔板的孔中,将待测样品浸到GUS染液中,将24孔板置于37℃保温箱中放置6h。
2)漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
3)脱色:加入100%乙醇浸泡直至完全脱色。
4)记录:在体视显微镜下拍照记录。
2.GUS报导基因的定量检测GUS能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
PScgpd1启动子融合GUS基因在酿酒酵母中的瞬时表达

关键 词 :甘 油代 谢 ; l启 动子 ; 葡糖 苷 酸酶 g
中 图分 类 号 : 9 9 9 Q 3 . 7ห้องสมุดไป่ตู้文献标 识 码 : A
Ana y i f Pr m 0 e 1 O h y Ge f Gl c r lM e a 0 i lss0 0 t r gp f t e Ke ne O y e 0 t b lc
wi . ,O 5 a d 1 O mo/ Na u p e n ,r s e t ey t 0 2 . n . lI h Cls p lme t e p c i l . v Th n y ciiy o r mo e e e z me a tvt fp o tr
2 S h o fBitc n 1g ,Ja g a je st ,W u i l 1 2 . c o lo o eh oo y in n n Unv r j y x 4 2 ,Chn ) 2 ja
Ab t a t A hu te ve t r YX2 一 e c n PSc pd1 GU S ha be n on t u t d nd r ns o m e s r c : s t l c o p 2 z o i — 1 g 一 d e c s r c e a t a f r d i t S“f r 7 f f , no f o e. P 以 b e e t o r to Th t a f r a s wa c t e i e u P y lc r po a i n. e r ns o m nt s ulur d n m di m
i n S c n ., c c , c , P. o Z tDi f r n m O i t e s n a f e e tos tc S r s
GUS染色液使用说明
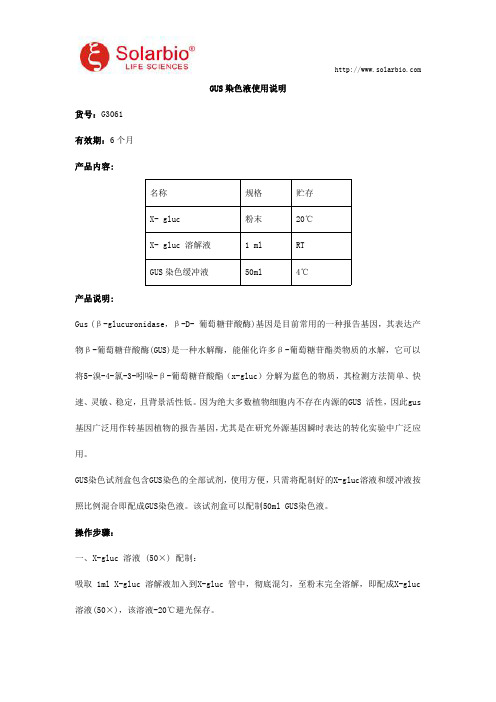
GUS染色液使用说明货号:G3061有效期:6个月产品内容:名称规格贮存X-gluc粉末20℃X-gluc溶解液1ml RTGUS染色缓冲液50ml4℃产品说明:Gus(β-glucuronidase,β-D-葡萄糖苷酸酶)基因是目前常用的一种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是一种水解酶,能催化许多β-葡萄糖苷酯类物质的水解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(x-gluc)分解为蓝色的物质,其检测方法简单、快速、灵敏、稳定,且背景活性低。
因为绝大多数植物细胞内不存在内源的GUS活性,因此gus 基因广泛用作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中广泛应用。
GUS染色试剂盒包含GUS染色的全部试剂,使用方便,只需将配制好的X-gluc溶液和缓冲液按照比例混合即配成GUS染色液。
该试剂盒可以配制50ml GUS染色液。
操作步骤:一、X-gluc溶液(50×)配制:吸取1ml X-gluc溶解液加入到X-gluc管中,彻底混匀,至粉末完全溶解,即配成X-gluc 溶液(50×),该溶液-20℃避光保存。
注:正常的X-gluc溶液颜色为无色,如果溶液变为红色或棕色,表明溶液失效。
二、GUS染色工作液配制:GUS染色工作液配制量1ml5ml10mlX-gluc溶液(50×)20μl100μl200μlGUS染色缓冲液1ml5ml10ml注:GUS染色工作液最好现用现配,短期贮存可以-20℃保存2-3天。
三、GUS染色步骤:1.预处理:将叶片、花瓣、根茎等组织剪成小片,放于1.5ml离心管中,加入预冷的90%丙酮完全覆盖材料,常温处理20-30分钟。
此步骤可以预固定组织并且可以去除部分叶绿素。
注:用于染色的植物材料的制备方法要因涉及的特定组织和器官的不同而异。
例如,拟南芥的根、花和叶片以及烟草幼苗的根就可以不作任何预处理而直接染色。
用基因枪将GUS基因导入玉米自交系的瞬时表达
,2#) 的方法 " $%)
基因枪轰击 枪击前将诱导 ( $ 的幼胚盾片向上一半转接在
没高渗
-=! H 甘露醇培养基上高渗处理 ! 直径 !=( *+$ 另一
半在原培养基上不动 ! 将诱导稳定的不同继代天数 的 II 型胚性愈伤组织同样处理 ! 用包裹 456 的金 弹进行轰击 ! 每皿轰击一次 ! 受体材料距阻挡网 )
( $ 的结果基本差不多 " 愈伤组织易变褐 !%&的百分
比小于 ’-8 ! 平均每块 %& 的斑点数小于 ,-! 而继代
( $ 的 %& 百分比最多为 2#8 ! 每块的斑点数不清 !
连成了一片 " 没高渗处理的更明显 !%& 的百分比最 多只有 ,)8! 平均每块 %& 的斑点数不到 ,9表 ,:"
./0 的 报 告 基 因 导 入 东 北 玉 米 自 交 系 幼 胚 和 已 稳
定的胚性愈伤组织 " 得到了较满意的结果 # 影响基因枪转化频率的因素是很多的 " 针对不 同靶组织材料主要是基因枪的理化因素 ’ 即基因枪 的 一 些 轰 击 参 数 -" 如 微 弹 的 速 度 $ 射 程 $ 真 空 度 和
$%&’()* +,,-&’./0 ’1- 2.(3.*’.& 4)%/*,()5%’.(/ (, 6(55-)&.%3 6()/ 7/8)-9 :./-* ./ ;()’1-%*’ 61./%
9/8: 9;<=> ?@/ 2A$BC> DEF:. 1A;$GA> AH IJ7 ,!"#"$ %&’("$)* +*, -.*$ /01 ’$ 23&’1"’#’3,4 5’$3678#"$3 !+&!""> KG;<I* <8*’)%&’L @MMIHCNA AMONPQR + 5 # 6IPR ISHAN ;<QTCJIH;Q< I<6 AMONPQ<;T TIJJ; QS TQMMANT;IJ TQN< ;<ONA6 J;<AR ;< :QNHGAIRH KG;<I UANA OQMOIN6A6 I<6 RAVANIJ SITHQNR ISSATH;<= HGA ;<RHI<H AWBNARR;Q< QS .CR =A<A UANA ;<VARH;=IHX A67 YGA NARCJH RGQUA6 HGA BNAHNAIHMA<H QS MIHAN;IJ> OQMOIN6MA<H 6;RHI<TA I<6 HGA BNARRCNA QS GAJ;CM ISSATHA6 HGA ;<RHI<H AWBNARR;Q< UGA< QHGAN BINIMAHANR UANA RAH7 =-> ?()9*L 3I;ZA[ 1INH;TJA OQMOIN6MA<H[ YNI<RSQNMIH;Q<[ YNI<R;A<H AWBNARR;Q<
农杆菌介导的马铃薯块茎GUS基因瞬时表达研究
农杆菌介导的马铃薯块茎GUS基因瞬时表达研究作者:舒锐等来源:《天津农业科学》2013年第11期摘要:采用根癌农杆菌介导的瞬时表达方法,以马铃薯块茎为主要的研究材料,分别采用浸染法和注射法将外源基因导入马铃薯块茎细胞中,然后进行GUS组织化学染色。
试验结果表明,导入马铃薯块茎细胞里的外源基因获得了表达;浸染法的表达区域更加均匀,优于注射法。
关键词:马铃薯;块茎;根癌农杆菌;瞬时表达;GUS中图分类号:S532 文献标识码:A DOI编码:10.3969/j.issn.1006-6500.2013.11.001马铃薯(Solanum tuberosum L.)俗称“土豆”,是茄科茄属多年生草本块茎植物,原产于安第斯山区和智利沿海山地,是仅次于水稻、玉米、小麦的世界第四大重要粮食作物,具有分布广泛、高产稳定、适应性强、营养丰富等特点,是一种兼具粮食、蔬菜、饲料以及工业原料等具有多种用途的经济作物[1]。
目前,农杆菌介导的瞬时表达方法已经在烟草、拟南芥、莴苣、番茄、草莓、梨等多种植物中得到应用。
利用此方法在叶片和果实中进行的研究比较常见,但是没有发现利用农杆菌介导法对马铃薯块茎进行瞬时表达的研究报道。
传统的稳定转化方法是目前研究马铃薯块茎最常用的方法,但是其具有试验周期长、耗资大、表达效率低下等缺点,因此,农杆菌介导的瞬时表达方法在马铃薯块茎上可以得到应用,将使得对马铃薯块茎特异启动子的研究变得更加方便快捷。
刘敏等[2]和孟楠等[3]采用注射法对草莓果实进行瞬时表达均获得成功,但是相对于草莓果实而言,马铃薯块茎结构更加致密,给试验带来了困难。
本研究分别采用浸染法和注射法侵染马铃薯块茎,以马铃薯叶片及烟草叶片为对照,通过GUS组织化学染色分析证明本研究的可行性。
1 材料和方法1.1 试验材料本研究采用鄂马铃薯(Solanum tuberosum L.)3号品种(E3)的叶片、块茎和烟草的叶片,作为转化受体材料。
GUS染色整理版培训讲学
1.GUS报告基因的定性检测GUS(β- 葡萄糖苷酸酶)能与显色底物X-gluc 反应,显现蓝色,因而可以通过组织化学染色定性研究GUS的表达水平和表达模式。
GUS 染色的稳定性好,组织定位精确,成为在植物中运用很广的报道基因。
gus基因是目前常用的一种报告基因,是β-D-葡萄糖苷酸酶(gus)基因,其表达产物β-葡萄糖苷酸酶(GUS)能催化裂解一系列的β-葡萄糖苷酸,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-Gluc)分解为蓝色的物质,也可以将4-甲基-伞形花酮-β-D-葡萄糖苷酯(4-MUG)分解为蓝色物质。
其检测方法简单、快速、灵敏、稳定,且背景活性低。
1.1 GUS染色底物的配制* 0.5M Na2HPO4配制方法:将17.907g Na2HPO4溶于水,定容至100ml。
0.5M NaH2PO4的配制方法:将7.800g NaH2PO4溶于水,定容至100ml。
实验步骤:1.将准备好的拟南芥植株放入小EP管中,加入染色液浸没试材,封好盖子;可用抽真空,5min,200mbr。
2.37℃培养箱中温育12h,或有蓝色出现,水中洗涤一次;3.将浸染过的试材转入70%(或95%乙醇)中脱色2-3次(除去叶绿素),每隔1小时更换一次脱色液,至阴性对照材料呈白色为止。
(漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
脱色:加入100%乙醇浸泡直至完全脱色。
)4.立体显微镜观察拍照。
2.GUS报导基因的定量检测GUS 能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
MU的激发波长为365nm,发射波长为456nm,其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋白在单位时间内产生的荧光物质的多少来定量的检测GUS含量。
Gus染色试剂配制及使用方法
Gus染⾊试剂配制及使⽤⽅法●产品简介:gus(β-glucuronidase,β-D- 葡萄糖苷酸酶)基因是⽬前常⽤的⼀种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是⼀种⽔解酶,能催化许多β-葡萄糖苷酯类物质的⽔解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(X-gluc.htm' target=_blank>x-gluc)分解为蓝⾊的物质,其检测⽅法简单、快速、灵敏、稳定,且背景活性低。
因为绝⼤多数植物细胞内不存在内源的GUS活性,因此gus基因⼴泛⽤作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中⼴泛应⽤。
该试剂盒包含GUS染⾊的全部试剂,使⽤⽅便,只需将染⾊液和缓冲液按照⽐例混合即配成GUS染⾊液。
该试剂盒可以配制50ml GUS染⾊液。
●贮存和效期:X-gluc染⾊液-20℃保存;GUS染⾊缓冲液4℃贮存。
⾃开封之⽇起有效期⼀年。
●使⽤说明:⼀. GUS染⾊液配制:X-gluc染⾊液为50×浓缩液,使⽤前⽤GUS染⾊缓冲液稀释50倍即配成GUS染⾊液。
如0.1 ml X-gluc染⾊液加⼊到5 ml GUS 染⾊缓冲液中,即配成5 ml GUS染⾊溶液。
该染⾊溶液最好现⽤现配,短期贮存可以-20℃保存2-3天。
⼆. GUS染⾊步骤:1.将准备好的材料浸泡在GUS染⾊液中,于25-37℃保温1⼩时⾄过夜。
2.叶⽚等绿⾊材料转⼊70%⼄醇中脱⾊2-3次,⾄阴性对照材料呈⽩⾊。
3.⾁眼或显微镜下观察,⽩⾊背景上的蓝⾊⼩点即为GUS表达位点。
注:⽤于染⾊的植物材料的制备⽅法要因涉及的特定组织和器官的不同⽽异。
例如,拟南芥的根、花和叶⽚以及烟草幼苗的根就可以不作任何预处理⽽直接染⾊。
但是像烟草和马铃薯这些植物的茎和叶就必须在染⾊前切成薄⽚(1-3mm)。
当操作⼤的组织和样品时,可以选⽤真空渗⼊法来帮助底物和酶渗⼊细胞。
GUS能与显⾊底物X-gluc 反应,显现蓝⾊,因⽽可以通过组织化学染⾊定性研究GUS的表达⽔平和表达模式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
瞬时表达与稳定表达
瞬时表达
W38侵染叶片
稳定表达
拟南芥1
NB侵染叶片 NB侵染下胚轴 NB注射叶片
拟南芥2 拟南芥3 拟南芥4 拟南芥5
实验报告
实验目的 实验原理(简略写) 实验方法 实验结果及分析(最重要) 同后果自负!
实验五
GUS染色检测基因瞬时表达 王欢欢 二零一二.九
报告基因
gus基因(β-葡萄糖苷酸酶基因)是目前转基因植物中应用最为广泛的报告基因。 β-葡萄糖苷酸酶是一个水解酶,以β-葡萄糖苷酸酯类物质为底物,其反应产物可以 用多种方法检测出来。 绝大多数植物没有葡萄糖苷酸酶的背景活性,因此gus作为报告基因广泛应用在植 物基因工程中。 标记基因为gus的常用商业载体:pBI121
gus基因转拟南芥的GUS检测结果
GUS染色
将拟南芥的幼苗或成年植株的组织浸泡于染色缓冲液中,置于真空 罐中0.5Mbar抽真空10 min,使染液充分渗入到组织的内部,然后置于 37 ℃浸泡过夜。移去染液,用0.1 mol/L的磷酸缓冲液(pH7.0)冲洗2-3次。 再用70%的乙醇脱色,更换乙醇2-3次,记录并拍照。
组织化学法检测
以5-溴-4-氯-3-吲哚-β-葡萄糖苷酸(XGluc)作为反应底物,将被检材料用含有 底物的缓冲液浸泡。若组织细胞被转入了 gus基因,并表达出Gus,适宜的条件下, 该酶就可将X-Gluc水解生成蓝色产物。这 是由其初始产物经氧化二聚作用形成的靛 蓝染料,它使具Gus活性的部位或位点呈现 蓝色,用肉眼或在显微镜下可看到,且在 一定程度下根据染色深浅可反映出Gus活性。 因此利用该方法可观察到外源基因在特定 器官、组织,甚至单个细胞内的表达情况。
