环氧乙烷灭菌工艺确认110830(30934866)
范例3环氧乙烷灭菌过程确认

范例3环氧乙烷灭菌过程确认环氧乙烷(EO)灭菌是一种常用的消毒方法,广泛应用于医疗器械、药品、食品等领域。
这种灭菌方式被广泛采用的原因是其具有较高的灭菌效果和良好的渗透力,可以灭杀各类微生物,包括细菌、真菌、孢子等。
环氧乙烷灭菌过程确认是确保环氧乙烷消毒过程能够达到灭菌效果的一系列验证步骤。
以下是一个环氧乙烷灭菌过程确认的范例:1.验证灭菌器的性能:-确定灭菌器的容量和规格,并检查其是否符合要求。
-检查灭菌器是否能够提供足够的湿度和温度,以保证灭菌效果。
-确保灭菌器的真空泵和加热系统正常运作。
2.定义灭菌参数:-确定灭菌温度、湿度和时间等参数,并记录下来。
-根据物料的特性,确定合适的灭菌参数。
3.准备灭菌器和物料:-清洁灭菌器,并确保没有残留的灭菌剂。
-将待灭菌的物料放入合适的容器中,并严密密封。
4.进行灭菌操作:-将物料放入灭菌器中,并确保物料能够充分暴露在灭菌剂中。
-关闭灭菌器门,并启动灭菌器。
-按照预设参数进行灭菌操作,包括升温、排气、注入灭菌剂和保持一定时间等步骤。
5.完成灭菌操作后,确认灭菌效果:-打开灭菌器门,取出被灭菌物料。
-进行微生物检测,包括菌落计数、生物指示剂等。
-根据结果判断灭菌效果是否符合要求。
6.记录和分析数据:-将灭菌操作和灭菌效果的数据记录下来,并进行分析。
-如果灭菌效果不符合要求,则需要进行调整,并重新进行灭菌过程确认。
7.编写灭菌过程确认报告:-根据完成的灭菌过程确认,编写报告,包括灭菌参数、检测结果、数据分析和结论等。
-将报告归档保存,以备查阅和审查。
在范例3中,我们详细说明了环氧乙烷灭菌过程确认的步骤和要点。
通过这一系列验证步骤,可以确保环氧乙烷灭菌过程的有效性和可靠性,从而保证被灭菌物料的质量和安全性。
一次性医疗器械质量管理——环氧乙烷灭菌器及灭菌确认

环氧乙烷—第1部分:医疗器械灭菌过程 开发、 确认和常规控制要求》 ISO11135-2-2008《医疗保健产品灭菌
环氧乙烷第2部分ISO11135-1应用指南》
4
GB4793.1-2007《测量、控制和实验室用电气设备的安全 要求 第1部分:通用要求》 GB4793.8-2008《测量、控制和实验室用电气设备的安全 要求 第2-042 部分:使用有毒气体处理医用材料及供实验 室用的压力灭菌器和灭菌器的专用要求》 GB/T16886.7-2001《医疗器械生物学评价 第7部分 环氧乙 烷灭菌残留量》 GB18281.2-2000《医疗保健产品灭菌 生物指示物 第2部分 环氧乙烷灭菌用生物指示物》 GB18282.1-2000《医疗保健产品灭菌 化学指示物 第1部分 通则》
这些标准是指导企业设计、制造灭菌器,使用 灭菌器的标准;是保证灭菌器质量、灭菌过程质量 的标准;也是医疗器械质量管理的依据。
3
YY0503-2005《环氧乙烷灭菌器》 EN1422-1997《环氧乙烷灭菌器》(+A1—2009) GB18279-2000《医疗器械
环氧乙烷灭菌确认和常规控制》 EN550《医疗保健产品
装的过程。 运行鉴定Operational Qualification(OQ):获得并出具书面证明,按操作程序进行
使用时,已安装设备能在预定范围内进行操作。 性能鉴定Performance Qualification(PQ):获得并出具书面证明的过程,已安
装设备按操作程序进行操作时,能持续按预定准则发挥性能并生产合格产品。 2)与辐照、湿热灭菌的标准统一; 3)ISO11139-2006医疗保健品灭菌 术语
(整理)环氧乙烷灭菌过程再确认验证资料
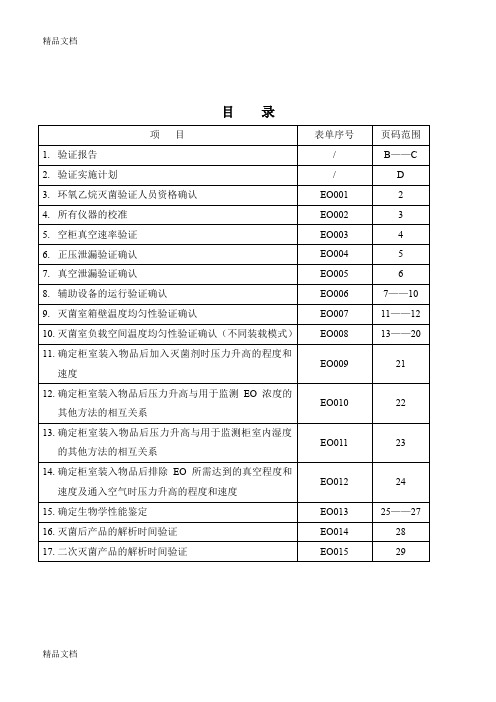
目录(续上表)环氧乙烷灭菌工艺验证实施计划环氧乙烷重新灭菌过程确认实施方案一、验证目的:1.环氧乙烷灭菌器年度灭菌工艺验证,确认目前的灭菌设备及灭菌工艺符合产品的要求。
2.对产品灭菌工艺进行周期验证确认,确认灭菌常规控制相关文件。
3.提高了环氧灭菌浓度后的半周期验证4.提高了环氧灭菌浓度后的环氧乙烷残留量验证二、验证小组人员组成:1.组长:2.组员:三、验证依据GB18279-2000 医疗器械环氧乙烷来菌确认与常规控制GB18282-2000 医疗保健产品灭菌化学指示物GB18281.1-2000 环氧乙烷灭菌用生物指示物GB/T19633-2005 最终灭菌医疗器械的包装四、验证产品名称:1.一次性使用xxxx2..一次性使用xxxx;3.一次性使用xxxx;4.一次性使用xxxx;5.一次性使用XXXX;五、验证过程(一)验证对象我公司现有10m3环氧乙烷灭菌器—台,灭菌器的使用状态良好,灭菌工艺也是多年来的成熟工艺。
为了完成这次的工艺验证计划,我们依据GB18279-2000《医疗器械环氧乙烷确认与常规控制》的要求,按以下验证方案进行验证。
(二)人员分工1.验证前准备、灭菌工艺的确定验证:2.灭菌器运行验证:;3.灭菌验证过程的操作:4.灭菌过程验证中物理性能、生物性能、试验鉴定:;5.验证过程中的审核:6.验证报告、作业文件的批准:7.重新验证方案及验证数据1.环氧乙烷灭菌验证人员资格确认2.所有仪器的校准3.空柜真空速率确认4.正压泄漏验证确认5.真空速率及泄漏验证确认6.辅助设备的运行验证确认8.灭菌室负载空间温度均匀性验证灭菌室负载温度均匀性试验确认表(装载模式一)灭菌室负载温度均匀性试验布点示意图(装载模式一)装载模式一图灭菌室负载温度均匀性试验确认表(装载模式二)灭菌室负载温度均匀性试验布点示意图(装载模式二)EO 008-4灭菌室负载温度均匀性试验确认表(装载模式三)灭菌室负载温度均匀性试验布点示意图(装载模式三)EO 008-6装载模式3图灭菌室负载温度均匀性试验确认表(装载模式四)灭菌室负载温度均匀性试验布点示意图(装载模式四)装载模式4图9.确定柜室装入物品后加入灭菌剂时压力升高的程度和速度12.确定柜室装入物品后排除EO所需达到的真空程度和速度及通入空气时压力升高的程度和速度(三次)13.确定生物学性能鉴定(生物指示物半周期)灭菌工艺确认EO 013-2生物指示物布点图验证布点14.灭菌后产品的解析时间验证15.二次灭菌产品的解析时间验证附图:装载模式一附图:装载模式二附图:装载模式三附图:装载模式四精品文档。
环氧乙烷灭菌确认工作指南

环氧乙烷灭菌确认工作指南
一、前言
为了保障灭菌效果和工作人员安全,这里提出该医疗机构环氧乙烷灭菌确认工作流程。
二、目的
规范医疗机构环氧乙烷灭菌工作流程,做到灭菌材料彻底灭菌,防止残余环氧乙烷泄漏对工作人员和就医人员造成影响。
三、确认工作流程
1. 灭菌结束后,立即打开通风管道排风,保证灭菌间通风通风达标。
2. 测量灭菌间内环境环氧乙烷残余含量,按要求应低于0.1。
3. 对灭菌物进行取样,使用生物检测试剂检测灭菌效果,结果应显示为缺乏生长。
4. 对取样灭菌物进行病原体鉴定,排除病原体污染。
5. 记录相关参数,签名确认灭菌合格。
灭菌不合格的重新灭菌、通风排风并复测。
6. 保管好相关记录作为采购、仓储管理的依据。
四、责任部门
消毒灭菌部负责具体操作并填写确认表;质量管理部负责定期监测和年审。
五、附录
1. 环氧乙烷灭菌确认表模板
以上就是一个环氧乙烷灭菌确认工作指南的初步内容框架,需要您进一步完善。
环氧乙烷灭菌工艺验证报告

环氧乙烷灭菌工艺验证报告环氧乙烷灭菌工艺验证报告1. 引言本报告旨在验证环氧乙烷(EO)灭菌工艺的有效性。
EO灭菌工艺是一种常用的灭菌方法,广泛应用于医疗器械、药品以及食品行业。
本次验证报告将介绍灭菌工艺验证的目的、方法和结果,以确保灭菌工艺符合标准和要求。
2. 目的灭菌工艺验证的目的是评估环氧乙烷灭菌工艺的有效性,确保能够达到对细菌、病毒和其他微生物的灭活要求。
3. 方法为验证环氧乙烷灭菌工艺的有效性,我们采取了以下方法:参考标准本次验证参考了国家相关标准,包括《医疗器械灭菌》(GB 18279)、《药品灭菌》(GB 17145)等相关标准。
定义验证项和指标根据参考标准,我们确定了以下验证项和指标: - 灭菌温度 - 灭菌湿度 - 灭菌时间 - 灭菌压力 - EO浓度采样和检测我们采取在灭菌过程中采样的方式,收集灭菌前后的样品,并通过培养基法、PCR法等方法检测样品中的菌落总数、大肠杆菌和金黄色葡萄球菌等指标。
数据分析收集到的数据将进行统计学分析,计算均值、标准差等参数,并与指标进行比较,以评估环氧乙烷灭菌工艺的有效性。
4. 结果与讨论根据验证的结果,我们得出以下结论:灭菌工艺参数符合标准要求通过对灭菌温度、湿度、时间、压力和EO浓度的验证,我们发现所有参数均符合国家相关标准的要求,确保了灭菌工艺的有效性。
样品中微生物指标达标经过采样和检测,我们发现灭菌后的样品中菌落总数、大肠杆菌和金黄色葡萄球菌等微生物指标均符合相关标准的要求,证明灭菌工艺能够有效杀灭细菌和病毒。
结果的稳定性和可重复性我们进行了多次验证实验,结果表明环氧乙烷灭菌工艺的灭菌效果稳定并具有可重复性,验证结果的一致性较高。
5. 结论通过本次环氧乙烷灭菌工艺的验证,我们得出以下结论:本次验证的环氧乙烷灭菌工艺符合国家相关标准和要求,能够有效灭活细菌、病毒和其他微生物。
灭菌工艺参数以及样品中的微生物指标均达标,结果稳定可靠。
环氧乙烷灭菌工艺在应用中具有较高的可行性和安全性。
环氧乙烷灭菌过程确认

- 暴露期间柜室内气体循环系统(若采用)正常运行的状态;
Page 32
过程确认参数应包含: • 暴露后清洗(如采用)
- 清洗压力的变化和真空速率 - 与惰性气体/空气/蒸汽相关的压力和速率。 - 重复的次数和重复时的任何变化。
Page 33
过程确认参数应包含: • 通风(如采用)
过程确认参数应包含: • 产品进入灭菌过程的最低温度和/或达到要求的最低温度的定义的条件 • 预处理,处理(若使用)
- 柜室/区内的时间、温度和湿度 - 灭菌装载的温度,湿度 - 装载从预处理转移到灭菌周期开始的最大所需时间 • 抽真空水平和速率(如果使用) - 真空持续时间 - 次数等
Page 29
物理性能确认(PPQ)
• 目的:通过建立一套合适的灭菌参数来保证产品的性能。
• 确认项目:灭菌参数确认(包括半时循环的参数)
• 实施步骤:替代品的准备、确认用仪器仪表的校正、温湿度传感器在替代 品中的设置
• 实施全时循环 温度、湿度、浓度、时间同常规灭菌参数或者上限
• 建议运行二次灭菌: 模拟再处理 测试二次灭菌样品残留 测试经过二次灭菌的样品的包装和产品功能
POQ
PQ
MPQ
PPQ
短周期
• 在生产用或试验灭菌柜内运行1个或多个短周期循环 • 证明BI存活技术的适宜性。 • 评估IPCD/EPCD/产品之间的抗性,实现期望的结果:
EPCD ≥ IPCD ≥ 产品生物负载 • 根据BI的阳性率来大概的估算D值,将8D的时间作为半周期的时间。
性能确认
Evaluation of Product ETO Residues 残留评估
Page 26
环氧乙烷灭菌过程确认和环氧乙烷灭菌工艺守则

环氧乙烷灭菌工艺守则一、操作前的准备1、确认环氧乙烷是否符合要求,并检查称重台称工作应正常。
2、检查设备、供水情况、水箱必须满水。
3、检查三相供电源,不可缺相。
二、操作中的注意事项1、灭菌工艺参数应事先设定,严格按灭菌操作规程进行。
2、炉门导轨及门封条每炉涂20#机械油润滑。
3、加药及出炉时,应注意通风,防止环氧乙烷中毒。
4、若发现人员中毒,其轻度症状为头晕或呕吐,应将中毒人员移至空气新鲜处即可,重度中毒者送医院治疗。
三、操作环境的清理1、应严格区分待灭菌产品和已灭菌产品,不得混放在一起。
2、操作环境不能堆放杂物,其余钢瓶应存放在通风阴暗的专用房间内。
3、操作场所应有醒目的严禁烟火警告牌,并备有灭火器材,做好防火防爆。
四、原材料质量要求1、灭菌药为纯环氧乙烷。
或混合环氧乙烷2、当更换其它厂家灭菌药时,应对灭菌效果用生物指示片予以验证。
五、安全技术操作要求1、现场不得有明火,配电设备及易产生火源的设备,应远离操作现场。
2、加药时,药量应准确。
3、加药时,打开钢瓶阀门时,要慢慢操作,确保进入灭菌柜的环氧乙烷全部气化。
4、勿使环氧乙烷出气口朝向人的面部,如不慎皮肤粘膜或眼睛沾上环氧乙烷液体,应立即用水冲洗15分钟,防止灼伤,并作好个人防护。
5、扑灭环氧乙烷小面积着火,可以用CO2、干粉、卤素灭火机,也可以用水扑灭。
六、操作人员的责任1、对灭菌产品的批号、规格、数量要准确,对灭菌质量负责。
2、做好灭菌记录,签全名字,对所填写的原始记录真实性、正确性负责。
3、对违章作业造成的设备事故负责。
4、有权拒绝执行更改灭菌条件的口头指令。
作业指导书--环氧乙烷灭菌确认及再确认程序指引

工作指引名称: 环氧乙烷灭菌确认及再确认程序指引1 适用范围适用于外发EO灭菌方案的制定,确认,验证程序.2 参考文件2.1 ISO11737-1 sterilization of medical devices-microbiological methods- part1:determination of a population of microorganisms on products2.2 ISO11138-1 Sterilization of health care products-Biological indicators2.3 ISO11138-2 sterilization of health care products-biological indicators-Part 2:Biological indicators for ethylene oxide sterilization2.4 ISO 11135 Medical devices – Validation and routine control of ethylene oxidesterilization3 定义3.1 IQ:设备安装验证3.2 OQ:设备运行验证3.3 PQ:设备性能验证.3.4 BI:生物指示剂.3.5 EO:环氧乙烷3.6 PCD:最具挑战性产品4 职责4.1 我司职责4.1.1 Providing inputs as required for preparation of the PQ and the final report;4.1.2 Review and approval of the PQ and the final report;4.1.3 Determination of product for sterilization;4.1.4 Product analysis to identify the location within the product at whichsterilization is most difficult to achieve and finally define the processchallenge device(PCD);4.1.5 Microbiological testing;4.1.6 Evaluate the performance of product is satisfied after sterilization;4.1.7 Controlling the manufacturing process, including meeting thespecifications products submitted to sterilization subcontractor, productdensity, orientation, dimensions;工作指引名称: 环氧乙烷灭菌确认及再确认程序指引4.1.8 Revision of specifications submitted to sterilization subcontractor;4.1.9 Change control of the product to include a review of product-relatedvariables that affect processing categories;4.1.10 Control of product labeled “sterilize” prior to sterilization4.1.11 Product release.4.2 sterilization subcontractor灭菌分包商职责:4.2.1 Installation of equipment;4.2.2 Equipment maintenance;4.2.3 Physical PQ;4.2.4 Routine sterilizer operation;4.2.5 Calibration;4.2.6 Process design;4.2.7 Equipment specification.4.2.8 Controlling the EO sterilization process;4.2.9 Change control of the EO sterilization process;4.2.10 Certification of sterilization;4.2.11 Developing processing categories5 灭菌确认程序5.1 BI及EO显示贴纸定义5.1.1 BI用于灭菌效果的监测,BI的生物体为:Bacillus atropheaus (ATCC#9372)5.1.2 EO显示贴纸用于标识产品是否过EO气体灭菌,贴纸灭菌前后应有明显不同.5.2 EO灭菌气体选择5.2.1 EO灭菌气体应在正规单位中购买,EO气体供应商应满足EO气体生产要求;5.2.2 每批EO气体均需要有规格说明及鉴定证书,满足EO灭菌要求;5.3 EO灭菌器要求,应有技术规格书及出厂合格证,满足EO灭菌要求;5.4 产品灭菌操作要求未灭菌与已灭菌产品应有严格区分,灭菌供应商应按相关程序及灭菌参数对产品进行灭菌安排.工作指引名称: 环氧乙烷灭菌确认及再确认程序指引5.5 EO灭菌确认计划制定,在确定制作灭菌方案时,需要制定灭菌确认的计划,内容包含:5.5.1 Product definition;5.5.2 Process definition;5.5.3 Validation5.6 EO灭菌产品5.6.1 做出灭菌方案中的EO灭菌产品列表;5.6.2 EO灭菌产品及PCD信息收集与数据分析;5.6.3 灭菌产品的数据收集与分析资料的评估整理,并通过部份周期暴露确立PCD的可适用性.5.7 产品与灭菌确认过程5.7.1 在引入新的或者更改的产品、包装或装载模式之前,应进行产品的定义;5.7.2 如果灭菌验证过程使用的是可销售产品,在完成验证后需抽样对产品进行无菌测试和产品功能性测试,在所有的测试合格和灭菌参数符合要求后方可放行;5.7.3 灭菌确认方法使用:灭菌过程致死率保守性确定方法—过速杀灭法(详见ISO11135-1 附录B)5.7.4 产品灭菌入柜装载模式5.7.4.1 根据sterilization subcontractor的EO灭菌柜尺寸规格及灭菌包装箱尺寸定义产品的最大装载模式;5.7.4.2 产品的最大装载模式,将用于产品的灭菌确认及再确认的装载.5.7.5 灭菌确认过程5.7.5.1 准备BI样品5.7.5.2 执行2个EO部分周期暴露过程fractional cycle expose,通过此过程用以证明EO灭菌有效,并确认最难灭菌产品及PCD;5.7.5.3 执行3个1/2灭菌周期过程half cycle expose,完成BI样品测试,每次BI测试结果应显示无菌;5.7.5.4 执行一次满周期的灭菌过程full cycle expose,完成BI样品测试及产品功能测试,BI测试应显示无菌,产品经灭菌后应不影响其功能,可满足要求.工作指引名称: 环氧乙烷灭菌确认及再确认程序指引5.8 确认过程及结论5.8.1 所执行的灭菌过程,其参数必须在规定的范围内;5.8.2 经过部分周期的过程验证确定产品或PCD将用于该灭菌方案BI代表样品;5.8.3 经过三个1/2周期的验证结果为合格,方能确定产品的满周期灭菌成立,方可用于产品的常规灭菌控制, 确定产品经满周期灭菌后,产品的无菌确保水平SAL达到10-6.5.9 灭菌确认5.9.1 设备安装验证IQ:设备必须进行设备安装确认,所有确认过程将进行记录,设备需要满足既定的技术规格要求;5.9.2 设备运行验证OQ:设备必须进行设备的运行确认,所有确认过程将进行记录,运行确认将证明设备的各项技术指标达到规定的要求;5.9.3 设备性能验证PQ:灭菌确认验证之前,需要装载满柜的产品进行性能验证测试,所有验证的过程参数按既定的过程参数表执行;5.9.4 产品完成最后满周期灭菌后,需要立即进行EO及ECH残留的测试,基于测试结果(要求≤10ug/g ),确定产品需要的通风时间;确定通风时间将用于往后的产品常规灭菌时的通风时间;5.10 灭菌确认及方案的批准EO灭菌确认的过程是基于ISO11135-1制定,完成灭菌确认后须制定灭菌方案,方案内容主要是按确认过程数据并包括5.10.1 要求5.10.2 产品讯息5.10.3 装箱方法5.10.4 PCD放置所有文件需要满足既定要求,经签批受控后生效;6 灭菌方案再确认6.1 在灭菌控制和监视过程中发生的失效表明灭菌过程无法达到要求的SAL,应确定失效的原因。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
a、灭菌因子与杀灭力的关系
温度
产品材质
形状结构
装载模式
杀灭力
湿度 装载密度
浓度
包装方式
包装材质
灭菌时间
环氧乙烷灭菌因子——温度
温度对环氧乙烷的灭菌效果有显著的影响,这是因为温度可促进化学反 应的进行,及提高环氧乙烷的浸透效果。相同条件下,温度越高,D值越小, 所需灭菌时间越短。温度每升高10℃,D值至少减小1/2,灭菌时间缩短一半。 下图为相同条件下D值随温度的变化图
—— ++++ ++ +-
常用工艺参数
❖ 温度:37℃-63℃ ❖ 湿度:30%RH-80%RH ❖ EO浓度:300—1000mg/L ❖ 时间:半周期的两倍 ❖ 装载体积:内胆容积的80% ❖ 抽真空深度:<-80Kpa
3Q确认要素
ISO 11135-1:2007 灭菌工艺确认要素
质量管理体系 灭菌剂特性 过程和设备特征 产品定义 过程定义 确认
环氧乙烷灭菌因子——湿度
湿度对环氧乙烷灭菌效果的影响并不明确。有一点可以确定,当相对湿度低于 30%RH时,明显影响环氧乙烷的灭菌效果,微生物比较难杀灭。因此,与干燥微 生物相比较,湿的微生物更容易被杀灭。当相对湿度超过30%RH时,环氧乙烷对 微生物的杀灭并不随相对湿度的升高而变的更容易杀灭,杀灭效果与湿度不成线性 关系。下表是环氧乙烷气体浓度与相对湿度对D值的影响(温度54.4℃)
环氧乙烷灭菌因子——时间
灭菌效果的评判,以灭菌后产品中微生物的存活概率来评价。同样条件下,灭菌时间越长, 产品中微生物存活的概率越小,灭菌效果就越好。下图是在一定条件下灭菌的枯草芽孢杆菌存活 概率与灭菌时间的关系(气体浓度 700mg/L,温度 50℃,湿度 50%RH)
灭菌动力学曲线——微生物的对数死亡规律
环氧乙烷灭菌过程确认
—— 田海涛
一、前言1
环氧乙烷灭菌过程确认
❖ 环氧乙烷气体 ❖ 环氧乙烷灭菌机理及特点 ❖ 环氧乙烷灭菌过程确认
一、前言2
产品无菌保证的系统性
原料控制 清洗
环境
包装工艺
灭菌
储存环境 包装材质
产品实现及寿命期
二、灭菌工艺核心标准及指南
1、GB 18279 — 2000 医疗器械 环氧乙烷灭菌 确认和常规控 制
c、高抗性的微生物选择
d、工艺参数和过程、产品参数的关系
过程、产品参数 对工艺参数的影响 与杀灭力的关系
产品材质 形状结构 包装方式 包装材质 装载方式 装载密度
材料的吸附性降低EO浓度 与环氧乙烷反应
复杂、封闭难于渗透,浓 度偏低。
热、湿度传导 气体渗透、析出
渗透、阻菌
浓度、温度一致性
品内温湿度、浓度
预处理/处理对品内温度的影响2
品内温度极差
14.0 12.0 10.0
8.0 6.0 4.0 2.0 0.0
初始
温度极差变化曲线
四小时-1 四小时-2 四小时-3 两小时-1 两小时-2 两完
加药完
灭菌完
处理无法有效改善品内温度一致性,需考虑柜 外预处理。
过程定义1
❖ 应规定产品的装载方式
环氧乙烷灭菌因子——浓度
作为影响环氧乙烷灭菌效果的重要因素,可通过提高其浓度来增强灭菌效果。通 常的灭菌操作中以450~800mg/L的浓度使用较多,最高浓度为1500mg/L,超过1500 mg/L,灭菌效果并不增加。在一定浓度范围内,温度、湿度等其它条件相同时,随 着浓度的增加,杀灭一定数量的微生物所需的时间越短,杀灭效果越好。
技术性指标
安装确认 IQ
执行
灭菌过程确认——DQ
GB/T 19974-2005中
5.3 杀灭微生物效果 5. 3. 1 杀微生物效果的研究应该: a) 说明灭菌因子对选择的具有代表性的微生物的杀灭力关系; b) 动力学曲线——已定义对特定抗性微生物的灭活力,并能有效预测微生
物暴露在特定处理情况下存活的概率。 c) 在已知对设定灭菌工艺中采用的灭菌因子具有高抗性的微生物灭活动力
2、ISO 11135—1:2007 Sterilization of health care products --- Ethylene oxide ---
Part 1: Requirements for development, validation and routine control of a sterilization process for medical devices
确认流程
验证
产品定义
过程定义
试运行确认
性能确认
安装鉴定/IQ
运行鉴定/OQ
物理性能确认 PPQ
微生物性能确认 MPQ
灭菌剂特性
确定: ❖ 灭菌剂的成分、储存条件和有效期; ❖ 应确定部分材质对环氧乙烷的影响; ❖ 应评估灭菌过程对环境的潜在影响。
过程和设备特征
❖ 过程
a) 预处理(若采用) b)排除空气 c) 处理(若采用) d) 加入EO e) 在作用时间内保 持规定的条件 f) 去除EO g) 清洗(若采用) h) 加入空气/惰性气体
学的基础上选择参考微生物 ; d) 确定影响灭菌因子杀灭力的工艺变量及与杀灭力相关的这些过程变量的
相互作用; e) 评价能够反作用于灭菌因子的运送和/或分布的要素;
注 :这 类 要 素 可 能 包 括例如环境、包装结构、几何形状、材料和生产 残余物、清洁和/或消毒 f) 评估能够反作用于依据物理和/或化学相互作用的灭菌因子的效果的要素;
3、GB/T 19974—2005 医疗保健产品灭菌 灭菌因子的特性及
医疗器械灭菌工艺的设定、确认 和常规控制的通用要求 4、YY / T 0287-2003 医疗器械质量管理体系用于法规的要求
(ISO 13485:2003,IDT)
灭菌过程确认环
基础设计 功能性指标
产品需要
DQ
性能确认 PQ 运行确认 OQ
i) 通风(若采用)
品内温度
预处理/处理对品内温度的影响1
45.0 40.0 35.0 30.0 25.0 20.0 15.0 10.0
初始
温度均值变化曲线
四小时-1 四小时-2 四小时-3 两小时-1 两小时-2 两小时-3
预热完 真空完 处理完 加药完 灭菌完
增加预处理时间明显能改善温度均值的提升。
过程定义2
❖ 应有文件和记录支持过程规范中规定的过程 参数和其公差的有效性。
周期确认 物理性能 鉴定
