空气的气液相平衡
空气的组成及其主要成份间的气液相平衡

(2) x-y 图 压力变化改变了气液浓度差
O2-N2 的 y-x 图 •O2-Ar 的 y-x 图(浓度差小)
5.3.2空气三元系气液平衡
O2-Ar-N2 的 T-x图 (1-2-3)
压力一定,三元混合物饱和液体 摩尔分数与温度关系
• 氧-氩-氮三元系的平衡图(p=133.3kPa)
三元平衡气液的比焓与二元相似,气体和液体混合物溶解热均
pyO2 pyN 2
N2 :79.1%
液体为理想溶液
pO2 pN 2
p x 0 O2 O2
p x 0 N2 N2
yO2
pO2 p
pO2 pO2 pN2
pO2
p x 0 O2 O2
p x 0 N2 N2
5.3.1空气的二元系气液平衡 (1)T-x-y 图
➢ 每个压力下有一个鱼形线 ➢ 气液的浓度差越大越易分离 ➢ 压力变化改变了气液浓度差 ➢ 平衡时气液相摩尔分数大小不同 ➢ 定压时,相变温度受膜填充密度(m2/m3)
容器结构 压力损失 膜制品的缺点 易漏气处
平膜
200~400 需要膜支撑物,设计
简单。 小
膜面易有针孔和膜面 受力不均。
膜与支撑物密封处。
空心纤维膜
20000~60000
不需要膜支撑物。
大 易混入断的纤维和不
完全空心纤维。 隔板树脂与空心纤维
例1: p=133.3kPa时,摩尔分数x1=15%、x2=5O%三元混合液 的饱和温度及比焓为多少?
解:根据压力和摩尔分数查图9-5得饱和温度为85K。 据表9-8得85K时液体比焓为
hO2 143 .1 k J / k g, hAr 120 .1 k J / k g, hN2 105 .7 k J / k g
化工原理8.2 相平衡关系8.2 吸收过程的相平衡关系

溶解度/[g(SO2)/1000g(H2O)]
250
200 150
0 oC 10 oC
100 50
20 oC 30 oC 40 oC
50 oC
0
20 40 60 80 100 120
pSO2/kPa
SO2在水中的溶解度
(1)总压、y一定,温度下降,在同一溶剂中,溶 质的溶解度x随之增加,有利于吸收。
101.3kPa
y
202.6kPa
x
20℃下SO2在水中的溶解度
(2)温度、y一定,总压增加,在同一溶剂中,溶 质的溶解度x随之增加,有利于吸收。
4
溶解度/[g(SO2)/1000g(H2O)]
溶解度/[g(O2)/1000g(H2O)]
0.10 0.08 0.06 0.04 0.02
0 oC
10 oC 20 oC 30 oC 40 oC 50 oC
p*=E·x
亨利系数,kPa
E值大,溶解度小,难溶气体 E值小,溶解度大,易溶气体 E影响因素:溶质、溶剂、T
T,E
p*=c/H
H 越大,溶解度越大 H :T,H
溶解度系数,kmol/(m3·kPa)
y*=m·x
m越大,溶解度越小; m:T,m;p,m
相平衡常数,无因次
Y*=mX
X:液相摩尔比 Y:气相摩尔比
在低浓度气体吸收计算中,通常采用基准不变的摩尔 比 Y( 或 X )表示组成
Y
气相中溶质A的摩尔数 气相中惰气B的摩尔数
y 1 y
X
液相中溶质A的摩尔数 液相中溶剂S的摩尔数
x 1 x
以摩尔比表示组成 的相平衡关系
气液相平衡关系

4.2气液相平衡关系本节教学要求1、重点掌握的内容:相平衡的影响因素及相平衡关系在吸收过程中的应用;2、熟悉的内容:溶解度、平衡状态、平衡分压、亨利定律。
4.2.1 相组成表示方法1.质量分率与摩尔分率质量分率:质量分率是指在混合物中某组分的质量占混合物总质量的分率。
对于混合物中的A 组分有mm w A A = (4-1) 式中 A w ——组分A 的质量分率;A m ——混合物中组分A 的质量,kg ;m ——混合物总质量,kg 。
1N B A =⋅⋅⋅++w w w (4-2)摩尔分率:摩尔分率是指在混合物中某组分的摩尔数n A 占混合物总摩尔数n 的分率。
对于混合物中的A 组分有 气相:nn y A A = (4-3) 液相:n n x A A =(4-4) 式中 A y 、A x ——分别为组分A 在气相和液相中的摩尔分率;A n ——液相或气相中组分A 的摩尔数,n ——液相或气相的总摩尔数。
1N B A =⋅⋅⋅++y y y (4-5) 1N B A =⋅⋅⋅++x x x (4-6) 质量分率与摩尔分率的关系为:NN B B A A A A x /M w /M w /M w /M w A ⋅⋅⋅++= (4-7) 式中 B A M M 、——分别为组分A 、B 的分子量。
2.摩尔比摩尔比是指混合物中某组分A 的摩尔数与惰性组分B (不参加传质的组分)的摩尔数之比,其定义式为BA A n n Y = (4-8)B A A n n X =(4-9) 式中 A Y 、A X ——分别为组分A 在气相和液相中的摩尔比;摩尔分率与摩尔比的关系为XX x +=1 (4-10) YY y +=1 (4-11) -x x X 1= (4-12) -yy Y 1= (4-13) 【例5-1】 在一常压、298K 的吸收塔内,用水吸收混合气中的SO 2。
已知混合气体中含SO 2的体积百分比为20%,其余组分可看作惰性气体,出塔气体中含SO 2体积百分比为2%,试分别用摩尔分率、摩尔比和摩尔浓度表示出塔气体中SO 2的组成。
2-1 空气分离的基本原理

弯管型
百叶窗型
多层隔 《煤炭气化板工塔艺型》
电动卷帘式干带过滤器---初步除尘
《煤炭气化工艺》
脉冲纸筒式过滤单元
《煤炭气化工艺》
(1)水分及CO2的脱除
脱除CO2、水蒸气一般用吸附法和冻结法。
吸附法是空气通过装有分子筛或硅胶的吸附器,二氧化碳和 水蒸气被吸附,达到清除的目的; 冻结法是在低温下,水分和二氧化碳以固态形式冻结,在切 换式换热器的通道内而被除去。经过一段时间后,自动将通 道切换,让干燥的返流气通过该通道,使前一段时间冻结的 二氧化碳和水蒸气在该气流中蒸发、升华而被带出装置。
➢ 这时,液相由于蒸发,使氮组分减少,同时由 于气相冷凝的氧也进入液相,因此液相的氧 浓度增加了,同样气相由于冷凝,使氧组分 减少,同时由于液相的氮进入气相,因此气 相的氮浓度增加了.多次的重复上述过程, 气相的氮浓度就不断增加,液相的氧浓度也 能不断的增加.这样经过多次的蒸发与冷凝 就能完成整个精馏过程,从而将空气中的氧 和氮分离开来.
《煤炭气化工艺》
双 级 精 馏 塔
《煤炭气化工艺》
筛板
注:下塔板数 与氮纯度有关, 当不产纯氮时 25块即可, 上塔板数取决 于氧的纯度, 当氧气纯度为 98.5%时,大 于50块,为 99.5%时,大 于76块。
《煤炭气化工艺》
板翅式换热器
《煤炭气化工艺》
《煤炭气化工艺》
板翅式换热器实物
36
空压机
预冷系统
纯化系统
增压机
氩系统
精馏系统
热交换器 制冷 膨胀机
低压氮气 高压氮气 压力氮气 高压氧气
低压氮压机 压力氮压机
开工氮压机
KDON58000/97500型空分装置简易流程
空气与水的气液平衡原理

空气与水的气液平衡原理空气与水的气液平衡原理是指当水与空气接触时,两者之间会发生物质的传递和平衡,从而形成水体和大气中溶解气体浓度的关系。
这种平衡是通过溶质的扩散、吸附和脱附等过程实现的。
本文将详细介绍空气与水的气液平衡原理。
首先,我们来了解一下气体溶解于液体中的基本原理。
气体分子在液体中溶解的过程可以分为三个主要步骤:气体分子通过扩散进入液体,然后逐渐与液体分子间相互作用,最后被液体吸附或反应生成新的物质。
这一过程受到温度、压力、液体性质等因素的影响。
在空气与水的气液平衡中,空气中的气体会溶解于水中。
气体溶解水的量可由亨利定律描述:在一定温度下,气体与溶液之间的溶解度(溶解质的浓度)与该溶质的分压成正比。
即溶解度与溶液中所含有的该气体分子的压力呈线性关系。
此外,温度也是空气与水的气液平衡中的重要因素。
一般情况下,温度升高会导致溶解度降低,即在相同的压力下,高温下水对气体的溶解度会较低。
这是因为温度增加会使液体分子的热运动加剧,分子之间的吸引力减弱,从而使气体分子与液体分子之间的作用力减小,溶解度降低。
除了温度和压力,溶解质本身的特性也会对气体在水中的溶解度产生影响。
溶解度与溶质的等值、溶质-溶剂分子之间的作用力、溶质分子的大小和形状以及液相中其他溶质的有无等因素相关。
在大气和水的气液平衡中,还存在气体在水体中的分布和传输过程。
大气中的气体通过扩散作用进入水体,形成溶解气体。
溶解气体在水体中可以通过对流、扩散和水体的混合转移。
此外,气体还可以通过化学反应与水体中的其他物质发生作用而在水体中转化。
总的来说,空气与水的气液平衡是通过气体分子在液体中的溶解和由溶质分子向气相的扩散、吸附、脱附等过程实现的。
这种平衡受到温度、压力、液相特性、溶质间相互作用等因素的影响。
了解和研究空气与水的气液平衡原理对于理解环境和大气污染、水体健康与污染以及气候变化等问题具有重要意义。
液体饱和蒸汽压的测定

液体饱和蒸汽压的测定【摘要】本实验根据克拉贝龙-克劳修斯方程,运用动态法研究环己烷的饱和蒸气压与温度的关系,并计算其摩尔汽化热。
在实验中了解了真空泵、气压计的使用方法及注意事项。
【关键词】饱和蒸气压 摩尔汽化热 动态法 克拉贝龙-克劳修斯方程 一、前言本实验研究的是单组分体系气-液相平衡:定温下把液体放在真空容器中,液体开始蒸发变成气体态,气态物质又可重新回到液体中。
达到平衡时,通过液体表面进出的分子数相等,定温下液体与其自身的蒸气达到平衡时的蒸气压就是液体的饱和蒸气压;蒸发1摩尔液体需要吸收的热量即为该温度下液体的摩尔汽化热∆H ;饱和蒸汽压与摩尔汽化热之间的关系可以用克拉贝龙-克劳修斯方程表示:d d v a p m l n p T H R T =∆2当液体与外界大气压相通,并且液体的饱和蒸气压与外界压强相等时,液体沸腾,此时的温度称为沸点.沸点是随着外压的改变而变化的。
若温度改变的区间不大,∆H 可视为为常数。
积分上式得:ln 'P A HRT =-∆或 lo g P A BT=-常数A A ='.2303,B H R =∆vap m 2303..log P 与1T 有线性关系。
作图可得一直线,斜率为-B 。
因此可得实验温度范围内液体的平均摩尔汽化热∆H 。
∆v a p mH R B =2303. 本实验采用的是在不同外部压力下测定液体沸点的动态法。
即测量多组不同气压下的沸点,并通过直线拟和计算出纯水的摩尔汽化热。
本实验操作较为复杂,应注意保证体系中不要混入空气,以免影响实验结果。
二、实验部分(一)仪器DTC-2AI控温仪南京南大万和科技有限公司WYB-I型真空稳压包南京南大万和科技有限公司U型压力计江苏省常州市东风仪表厂JJ-1型增力电动搅拌器江苏省金坛市环宇科学仪器厂1/10℃温度计福廷式压力计平衡管(二)药品环己烷液体(三)操作步骤1)装置概述平衡管由三个相连通的玻璃球构成,顶部与冷凝管相连。
第一节气液相平衡及亨利定律

求:在(1)乙炔水溶液浓度为 0.29×10−3 Kg / KgH2O (2)乙炔水溶液浓度为 0.15×10−3 Kg / KgH2O
时传质过程的方向及接触瞬间的推动力(用x,y表示)
解:亨利定律 查表 1)对浓度为 0.29
×P1730−235K°gC/时Kg乙H2炔O 水时溶液E
=
1.35
×105
对稀溶液一般c很小 ρ >> c(M S − M A ) ∴ H = ρ + c ( M S − M A ) = ρ
EM S
EM S
∴ P* = c = E M S c
Hρ
而对照 P* = Ex
∴ x = M Sc =
ρ
c
ρ
MS
(条件:c很小时)
3.
{ y* = mx y-* -与液相成平衡的气相中溶质摩尔分率 x--液相中溶质的摩尔分率
1mol溶液中所含溶质(A)为c Kmol,溶剂的摩尔数为: ρ − cM A
MS
溶质的摩尔分率 x =
c
c + ρ −cMA
= cMS
cMS
+ ρ −cMA
=
cMS
ρ +c(MS −MA)
MS
代入
P*
=
Ex
=
ρ
+
EM Sc
c(MS −
M
A)
而
p* = c H
∴1 H
=
p* c
=
ρ
EM S
+c(MS −MA)
=
nnA = yA nB yB
=
yA 1− yA
摩尔分率和摩尔比互换 4)摩尔浓度:
13 实验五 二元液体溶液的气—液平衡相图
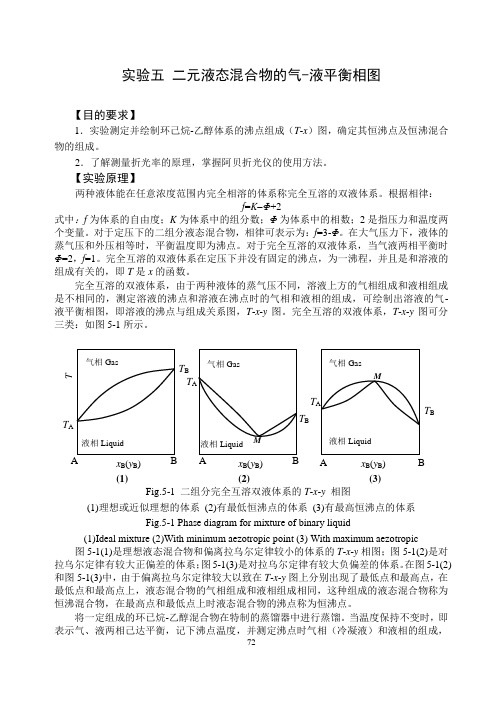
实验五 二元液态混合物的气-液平衡相图【目的要求】1.实验测定并绘制环己烷-乙醇体系的沸点组成(T -x )图,确定其恒沸点及恒沸混合物的组成。
2.了解测量折光率的原理,掌握阿贝折光仪的使用方法。
【实验原理】两种液体能在任意浓度范围内完全相溶的体系称完全互溶的双液体系。
根据相律:f =K Φ+2式中:f 为体系的自由度;K 为体系中的组分数;Φ为体系中的相数;2是指压力和温度两个变量。
对于定压下的二组分液态混合物,相律可表示为:f =3-Φ。
在大气压力下,液体的蒸气压和外压相等时,平衡温度即为沸点。
对于完全互溶的双液体系,当气液两相平衡时Φ=2,f =1。
完全互溶的双液体系在定压下并没有固定的沸点,为一沸程,并且是和溶液的组成有关的,即T 是x 的函数。
完全互溶的双液体系,由于两种液体的蒸气压不同,溶液上方的气相组成和液相组成是不相同的,测定溶液的沸点和溶液在沸点时的气相和液相的组成,可绘制出溶液的气-液平衡相图,即溶液的沸点与组成关系图,T -x -y 图。
完全互溶的双液体系,T -x -y 图可分三类:如图5-1所示。
图5-1(1)是理想液态混合物和偏离拉乌尔定律较小的体系的T -x -y 相图;图5-1(2)是对拉乌尔定律有较大正偏差的体系;图5-1(3)是对拉乌尔定律有较大负偏差的体系。
在图5-1(2)和图5-1(3)中,由于偏离拉乌尔定律较大以致在T -x -y 图上分别出现了最低点和最高点,在最低点和最高点上,液态混合物的气相组成和液相组成相同,这种组成的液态混合物称为恒沸混合物,在最高点和最低点上时液态混合物的沸点称为恒沸点。
将一定组成的环已烷-乙醇混合物在特制的蒸馏器中进行蒸馏。
当温度保持不变时,即表示气、液两相己达平衡,记下沸点温度,并测定沸点时气相(冷凝液)和液相的组成,Fig.5-1 二组分完全互溶双液体系的T -x -y 相图 (1)理想或近似理想的体系 (2)有最低恒沸点的体系 (3)有最高恒沸点的体系 Fig.5-1 Phase diagram for mixture of binary liquid(1)Ideal mixture (2)With minimum aezotropic point (3) With maximum aezotropic 液相Liquid 气相Gas T B x B (y B ) (3) M A B液相Liquid气相Gas T A T B x B (y B ) T (1) AB 液相Liquid 气相Gas T A T Bx B (y B ) (2) M A B T A图5-2 沸点仪示意图 1.温度计;2.接加热器;3.加液口;4.电热丝连接点;5.电热丝;6.分馏液;7.分馏液取样口 Fig.5-2 The sketch of ebulliometer 1.thermometer;2. connection pole;3. inlet orifice; 4. connection point of heater with wire;5.heater; 6. fractional liquid;7. sampling orifice 即可得到一组T -x -y 数据。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
空气的气液相平衡
(一)空气的组成
空气是一种均匀的多组分混合气体,它的主要成分是氧、氮和氩,此外还含有微量的氢及氖、氦、氪、氙等稀有气体。
根据地区条件的不同,空气中含有不定量的二氧化碳、水蒸气以及乙炔等碳氢化合物,空气的组成及各成分的沸点示于第8章表8-2中。
(二)空气的二元系气液平衡
1.气液平衡及氧、氩、氮饱和压力和温度的关系
在气液平衡条件下,各相的状态参数保持不变,它们的温度、压力都分别相等,这时的温度称饱和温度,压力称饱和蒸气压力。
纯物质在一定的压力下对应着唯一的饱和温度,或在一定的温度下对应有唯一的饱和压力。
图9-1示出氧、氩、氮纯物质在气液平衡时,饱和压力与温度之间的关系。
图9-1
由图知,氧、氩、氮在同一温度下具有不同的饱和蒸气压力,这是由于它们的分子结构和分子间的引力不同所致。
在同一温度
下饱和蒸气压的大小,表明了液体气化的难易程度。
饱和蒸气压大的物质容易由液体变为蒸气,反之,饱和蒸气压小的物质不易由液体变为蒸气。
在相同的温度下,氮的饱和蒸气压高于氧的饱和蒸气压,而在相同的压力下,氮的饱和温度低于氧。
氩则介于氧、氮之间。
2.氧-氮二元系的气液平衡压力、温度、比焓与成分的关系
氧-氮二元系气液平衡关系可用相平衡图表示。
相平衡图是按用实验方法求得的温度,压力,比焓及摩尔分数
之间的关系绘制。
常用的几种平衡图如下:图9-2
(1) 图
如图9-2所示,图中的每组曲线是在等压下作出的,纵座标表示温度,横座标表示氧的摩尔系数(x及y),对应于每一个压力都有一组气液相平衡曲线(称鱼形曲线,曲线中的压力数值单位是105Pa)。
以任一组曲线为例,上面的一条线称冷凝等压线,它表示在给定的压力下,与液相平衡的气相
组成与温度的关系,又称气相线;下面的一条线称沸腾等压线,它表示在给定压力下,与气相平衡的液相组成与温度的关系,又称液相线。
在气相线与液相线之间的区域称湿蒸气区。
曲线的两端点的纵座标分别表示纯氧和纯氮在该压力下的饱和温度。
由T-x-y 图我们可看出氧-氮二元溶液有以下特点:(1)气相中氧的摩尔分数为30~40%时,相平衡的气液的摩尔分数差最大,增加或减少气相中的含氧量时,气液摩尔分数差都减小,这表明当气相(或液相)中的含氧(或含氮)量愈少时愈难分离。
(2)压力越低,液相线与气相线的间距越大,即气液相间的摩尔分数差越大,这说明在低压下分离空气较在高压下分离容易。
(3)气液平衡时,液相中的氧摩尔分数大于气相中的氧摩尔
分数,气相中的氮摩尔分数大于液相中的氮摩尔分数。
(4)当压力一定时,溶液中低沸点组分的摩尔分数愈大,它的蒸发温度和冷凝温度愈低。
表9-5表示氧-氮气液平衡的温度T、压力p和摩尔分数y3、x3的关系。
表中为
液体中氮的摩尔分数;为气体中氮的摩尔分数;
表9-6为氩-氮气液平衡的温度T,压力p和摩尔分数y3、x3的关系。
表9-7为氧-氩气液平衡数据,表中为液体中氩的摩尔分数;为气体中氮的摩尔分数;
(2)图
图9-3所示为氧-氮二元系在不同压力下的图,它的横座标为溶液中氮的摩尔分数,用x表示,纵座标为与液体相平衡的气相中氮的摩尔分数,用y表示。
图中每一条曲线表
示图示压力下的关系。
在不同的压力下有不同的平衡曲线。
由此图可以看出在不同压力下氮的气相及液相中的浓度之间的关系。
此图可根据表9-5数据制作。
图9-4为氧-氩二元系在
p=133.3kPa下的图,可见气液平
衡时,差值比氧氮的浓度差值小得多,所以氧氩分离较难。
图9-3,图9-4
二元溶液的比焓,前面已有介绍,即气态的比焓不计溶解热、按纯组分的分数加和,但纯组分的比焓与溶液有相同温度和相同压力。
液态溶
液的比焓,对氧、氮、氩等组分的混合物不计溶解热,所以液态部分的等温线(在图上)也是直线。
由于压力对液体的比焓影响小,特别当压力较低时,所以液相区等温线适用各不同压力。
(三)空气的三元系气液平衡
1. 氧-氩-氮三元系气液平衡图
三元系的气液平衡关系,可根据实验数据表示在相平衡图上。
相平衡图一般有两种表示方法:三角形摩尔分数和直角座标摩尔分数表示法。
在三元系中分别以
代表氧、氩、氮气相及液相
摩尔分数。
图9-5为氧-氩-氮三元系的平衡图,该图是在定压下作出的,纵座标为气相中的氩摩尔分数,横座标为气相中氧摩尔分数,图中有和T的三组等值曲线。
在这个图
上按已知液相组成可求出与之平衡的气相
组成,反之按已知气相组成也可求得液相组成,并能确定平衡温度,由于三角形图使用不方便,不准确,故目前设计中多使用直角座标气液平衡图。
图9-5横座标是氧氮气液平衡关系,纵座标是氩氮气液平衡关系,斜边是氩氧平衡关系,压力为p=133.3kPa,按相同方法也可作得其他压力下的三元图。
图9-6是氧-氩-氮图在
p=133.3kPa压力时,横座标为液体中氧摩尔分数,纵座标为温度,表示三元混合物饱
和液体浓度与温度的关系。
图9-5 氧-氩-氮三元系平衡图 p=133.3kPa
图9-5 氧-氩-氮T-x1图 p=133.3kPa 直角座标图如图9-6所示。
图在左边为带有等氩摩尔分数线的氧的图,右边为
带有等氧摩尔分数线的氩的图。
通过该
图可由已知液相摩尔分数查得平衡气相摩
尔分数,或者根据气相摩尔分数查得平衡液相摩尔分数。
例如已知气相摩尔分数,,
压力为133.3kPa,则在图9-6横座标上找到
的读数,由此作垂线与氩的等摩尔分数
相交于一点,由此点作水平线,与纵
座标交于,即为平衡液相中的氧摩尔分数。
同样方法,在右图横座标上找到的
读数,由此作垂线,与氧的等摩尔分数线
交于一点,由此交点作水平线,与纵座标交于,即为平衡液相中的氩摩尔分数。
反之
如果已知液相中摩尔分数为,亦可由该平衡图查出与之平衡的气相摩尔分数。
三元平衡气液的比焓与二元相似,气体和液体混合物溶解热均忽略不计,液体比焓
----- 纯组分液体比焓,与溶液温度相同,
;
----- 液体摩尔分数。
气体混合物比焓为,
----- 与混和气体相同温度、压力的纯组分
气体比焓,;
----- 气体摩尔分数。
图9-6。
