2017年03月19日初中化学 酸碱中和图像题
九年级化学图像题 金属及酸碱盐反应试题(有答案和解析)

D、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀,一开始就会出现沉淀。而图象显示是过一段时间才出现沉淀。D错误。
常温下,向烧杯内的甲物质加入乙物质至过量,若x轴表示加入乙物质的质量,曲线从0点出发,逐渐增大,增大到一定程度时不再增大。
【详解】
A、向稀盐酸和硫酸钠混合液加氢氧化钡溶液,硫酸钠与氢氧化钡反应生成硫酸钡沉淀,且该沉淀不溶于盐酸,所以反应开始时就有沉淀产生,当硫酸钠反应完时,沉淀的量不再增加,与曲线相符,不符合题意;
A. 加水稀释氯化钠溶液
B. 在饱和KNO3溶液中加入KNO3固体
C. 向稀盐酸和氯化铜的混合溶液中加入氢氧化钠溶液
D. 硝酸铵溶于水时溶液的温度变化
【答案】C
C、铜和硝酸银反应生成硝酸铜和银。反应方程式为:Cu+2AgNO3=Cu(NO3)2+2Ag。根据方程式可知,每消耗340份质量的硝酸银,就会生成188份质量的银,溶质的质量逐渐减少,溶液的质量也会逐渐减少。C正确;
D、氢氧化钠溶液加入水,溶液的碱性逐渐减弱,无限的趋近于7。D正确。
故选B。
11.下列图像能正确反映对应变化关系的是
D. 向一定浓度的NaOH溶液中加水稀释
【答案】B
【解析】
【分析】
【详解】
A、向一定质量的硫酸铜和稀硫酸的混合溶液中,逐滴加入氢氧化钠溶液。氢氧化钠先和稀硫酸反应生成硫酸钠和水,然后和硫酸铜反应生成氢氧化铜沉淀和硫酸钠。A正确;
中考化学压轴题之pH的变化图像(中考题型整理,突破提升)附详细答案

一、中考初中化学pH的变化图像1.硫酸和氢氧化钠溶液发生中和反应时,溶液pH的变化如图所示。
下列说法正确的是()A.图中a点所示溶液呈酸性B.图中c点所示的溶液中,含有Na2SO4和NaOHC.b.点表示酸和碱恰好反应完D.该实验是将氢氧化钠溶液逐滴滴入到硫酸溶液中【答案】C【解析】【分析】【详解】A、a点溶液pH>7,溶液为碱性,A选项错误;B、c点溶液pH<7,为酸性溶液,所以溶液中应有H2SO4,B选项错误;C、b点溶液pH=7,说明硫酸和氢氧化钠恰好完全反应,C选项正确;D、溶液由碱性→中性→酸性,因此是硫酸滴入氢氧化钠溶液中,D选项错误;故选C。
2.下列图像能正确反应其对应关系的是()A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入过量的硝酸钾B.向一定量氢氧化钙溶液中加入过量的碳酸钠溶液C.向一定量稀盐酸中滴加过量的氢氧化钠溶液D.等质量的镁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸中【答案】B【解析】【分析】【详解】A.某温度下,向一定量接近饱和的硝酸钾溶液中不断加入过量的硝酸钾晶体,当达到饱和后固体就不会溶解,所以质量分数不会一直增大,选项错误;B. 向一定量氢氧化钙溶液中加入过量的碳酸钠溶液,碳酸钠和氢氧化钙反应生成碳酸钙沉淀和水,完全反应后,沉淀不再增加,选项正确;C.向稀盐酸中滴加过量的氢氧化钠溶液,随着反应溶液的pH值会增大,当氢氧化钠过量后溶液的pH值就会大于7,选项错误;D.等质量的镁和锌同时分别放入两份溶质质量分数相同的足量稀盐酸中,镁的活动性大于锌,所以镁先反应完,但是镁的相对原子质量小于锌的相对原子质量,所以镁反应完后产生的氢气质量多,选项错误。
故选B。
3.下列图象能正确反映其对应操作中各量变化关系的是()A.给氯酸钾和二氧化锰的混合物加热B.向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体C.向pH=l的酸溶液中不断加水D.向一定质量的过氧化氢溶液中加入二氧化锰固体【答案】C【解析】【分析】【详解】A、给氯酸钾和二氧化锰的混合物加热,二氧化锰作催化剂,二氧化锰作催化剂,反应前后质量不变,故选项图象不能正确反映其对应操作中各量变化关系,不符合题意;B、向一定温度下的饱和氢氧化钙溶液中不断加入氧化钙固体,氧化钙与水反应生成氢氧化钙,水的质量不断减少,有氢氧化钙析出,溶质的质量不断减少,故选项图象不能正确反映其对应操作中各量变化关系,不符合题意;C、向pH=l的酸溶液中不断加水,酸性逐渐变弱,pH逐渐增大,但溶液始终显酸性,故选项图象能正确反映其对应操作中各量变化关系,符合题意;D、过氧化氢在二氧化锰的催化作用下生成水和氧气,完全反应后溶液的质量为0,故选项图象不能正确反映其对应操作中各量变化关系,不符合题意。
九年级化学全册第7单元常见的酸和碱两例中和反应图像题释疑解析素材鲁教版(new)
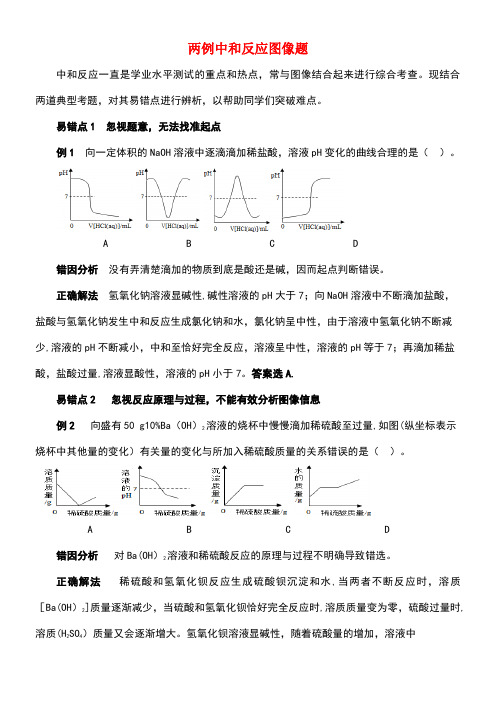
两例中和反应图像题中和反应一直是学业水平测试的重点和热点,常与图像结合起来进行综合考查。
现结合两道典型考题,对其易错点进行辨析,以帮助同学们突破难点。
易错点1 忽视题意,无法找准起点例1 向一定体积的NaOH溶液中逐滴滴加稀盐酸,溶液pH变化的曲线合理的是()。
A B C D错因分析没有弄清楚滴加的物质到底是酸还是碱,因而起点判断错误。
正确解法氢氧化钠溶液显碱性,碱性溶液的pH大于7;向NaOH溶液中不断滴加盐酸,盐酸与氢氧化钠发生中和反应生成氯化钠和水,氯化钠呈中性,由于溶液中氢氧化钠不断减少,溶液的pH不断减小,中和至恰好完全反应,溶液呈中性,溶液的pH等于7;再滴加稀盐酸,盐酸过量,溶液显酸性,溶液的pH小于7。
答案选A.易错点2 忽视反应原理与过程,不能有效分析图像信息例2向盛有50 g10%Ba(OH)2溶液的烧杯中慢慢滴加稀硫酸至过量,如图(纵坐标表示烧杯中其他量的变化)有关量的变化与所加入稀硫酸质量的关系错误的是()。
A B C D错因分析对Ba(OH)2溶液和稀硫酸反应的原理与过程不明确导致错选。
正确解法稀硫酸和氢氧化钡反应生成硫酸钡沉淀和水,当两者不断反应时,溶质[Ba(OH)2]质量逐渐减少,当硫酸和氢氧化钡恰好完全反应时,溶质质量变为零,硫酸过量时,溶质(H2SO4)质量又会逐渐增大。
氢氧化钡溶液显碱性,随着硫酸量的增加,溶液中的OH—不断减少,pH变小,直至恰好反应,pH=7,再加入稀硫酸后,酸性不断增强,pH小于7。
随着反应的进行,沉淀量不断增大,直至恰好反应,沉淀量不再改变.不断滴加稀硫酸至过量,水的质量不断增加,不会出现不变的情况。
答案选D。
尊敬的读者:本文由我和我的同事在百忙中收集整编出来,本文档在发布之前我们对内容进行仔细校对,但是难免会有不尽如人意之处,如有疏漏之处请指正,希望本文能为您解开疑惑,引发思考。
文中部分文字受到网友的关怀和支持,在此表示感谢!在往后的日子希望与大家共同进步,成长。
中考化学压轴题之pH的变化图像(中考题型整理,突破提升)

一、中考初中化学pH的变化图像1.某校化学小组在利用硫酸和氢氧化钾两溶液探究酸碱中和反应时,利用数字化传感器测得烧杯中溶液pH的变化图像如图所示。
下列说法正确的是A.图中c点所示溶液呈碱性B.图中a点所示溶液中,含有的溶质是K2SO4和H2SO4C.该实验是将氢氧化钾溶液逐滴滴入到盛有硫酸溶液的烧杯中D.由c点到d点的变化过程中没有发生化学反应【答案】D【解析】【分析】【详解】A、根据图示,c点所示溶液pH﹤7,呈酸性,选项A不正确;B、从图中溶液的pH由大逐渐变小可知,该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,图中a点所示溶液pH﹥7,呈碱性,溶液中氢氧化钾没有全部被反应,溶液中含有的溶质应该是K2SO4和KOH,选项B不正确;C、根据图中溶液的pH变化情况,溶液的pH起点大于7,且随着试剂的加入pH由大逐渐变小,可见该实验是将硫酸溶液逐滴滴入到盛有氢氧化钾溶液的烧杯中,选项C不正确;D、图中b点溶液的pH=7,此时硫酸和氢氧化钾恰好完全反应,继续加入稀硫酸,稀硫酸不和溶液中的其他物质反应,因此溶液的酸性逐渐增强,pH继续减小。
根据分析,虽然由c点到d点的变化过程中溶液pH继续减小,但变化中没有生成新物质,没有发生化学反应,选项D正确。
故选D。
2.下列实验所示的图像中,其纵坐标随横坐标变化关系合理的是A.硝酸铵溶于水B.等量CaCO3与足量盐酸C.稀释一定量浓硫酸D.向盐酸中滴加NaOH【答案】C【解析】【分析】【详解】A、硝酸铵溶于水,吸收大量的热,溶液温度降低,不符合题意;B、反应物的接触面积越大,反应越剧烈,所以粉末状的碳酸钙反应最剧烈,反应时间最短,不符合题意;C、将浓硫酸加水稀释成稀硫酸,溶质质量不变,符合题意;D、向稀盐酸中不断滴加氢氧化钠溶液,溶液的pH值从小于7逐渐增大,最终大于7,不符合题意。
故选C。
3.下列根据实验操作所绘制的图象中,正确的是()况A.A B.B C.C D.D【答案】D【解析】【分析】【详解】A、用胃舒平主要成分Al(OH)3治胃酸过多,胃液pH不断变大,氢氧化铝不溶于水,胃液的pH不能增大到7,更不能超过7,故A错误。
(化学)初中化学图像题 pH的变化图像解题技巧及练习题含解析

(化学)初中化学图像题 pH的变化图像解题技巧及练习题含解析一、化学图像题 pH的变化图像(稀释或中和)1.把盐酸溶液逐滴滴入到氢氧化钠溶液中直至过量,这个过程中溶液pH的变化曲线为()A.B.C.D.【来源】上海市静安区实验中学沪教版五四制九年级下册5.4碱的性质3【答案】C【解析】【详解】把盐酸溶液逐滴滴入到氢氧化钠溶液中直至过量,开始表现为氢氧化钠溶液的碱性,pH值大于7;把盐酸溶液逐滴滴入,与氢氧化钠溶液反应,中和至中性,pH值等于7;再滴入盐酸,盐酸过量,溶液呈酸性,则pH值小于7。
故选C。
2.下列图像能正确反映其对应变化关系的是()①常温下向HCl和MgCl2的混合溶液中滴加NaOH溶液②一定温度下,向接近饱和的KNO3溶液中加入KNO3固体③向一定量的锌粉中加入足量的CuSO4溶液④用等质量、等质量分数的过氧化氢溶液制氧气,a使用催化剂,b未使用催化剂A .①②③B .①②④C .①③④D .①②③④【来源】【万唯】2019年云南省初中学业水平考试化学试题成果检测卷(一)《逆袭卷》【答案】C【解析】【详解】常温下向HCl 和MgCl 2的混合溶液中滴加NaOH 溶液,开始时溶液的pH<7,NaOH 先与HCl 反应,pH 逐渐增大,当HCl 完全反应后(pH=7),氢氧化钠再与MgCl 2反应生成氢氧化镁沉淀和氯化钠,该反应过程中溶液的pH 不变,当MgCl 2反应完全后,继续滴加NaOH ,溶液pH 增大,接近氢氧化钠溶液的pH ,①正确;一定温度下,向接近饱和的KNO 3溶液中加入KNO 3固体,溶液的溶质质量分数不从零开始,②错误;向一定量的锌粉中加入足量的CuSO 4 溶液,发生的反应为44=Zn + CuSO ZnSO + Cu ,每65份质量的Zn 可置换出64份质量的Cu ,固体的质量逐渐减小,当Zn 反应完全后固体质量不再变化,③正确;催化剂在化学反应中可以加快反应速率,但不会改变生成物的质量,④正确; ①③④正确,故选C 。
中考化学 pH的变化图像 综合题及答案

一、中考初中化学pH的变化图像1.下列图象能正确反映其对应操作中各量变化关系的是 ()A.将饱和石灰水敞口放置在空气中一段时间B.稀释等质量的30%的H2SO4溶液和10%的H2SO4溶液C.等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量D.向一定量的CuSO4溶液中加入足量的铁粉【答案】D【解析】【分析】【详解】A、饱和石灰水中的氢氧化钙会吸收空气中的二氧化碳生成碳酸钙沉淀和水,所以溶液的质量减少,图象不能正确反映其对应操作中各量变化关系,不符合题意;B、硫酸加水稀释仍显酸性,pH小于7,不会等于7,且10%的稀硫酸的pH要比30%的稀硫酸的pH大,图象不能正确反映其对应操作中各量变化关系,不符合题意;C、根据化学方程式Zn + H2SO4= ZnSO4+ H2↑,Fe + H2SO4= FeSO4+ H2↑可知,每65份质量的锌能生成2份质量的氢气,每56份质量的铁能生成2份质量的氢气,等质量的锌、铁与足量的稀硫酸反应,产生氢气的质量铁大于锌,图象不能正确反映其对应操作中各量变化关系,不符合题意;D、由化学方程式Fe+CuSO4=Cu+FeSO4可知,每56份铁参与反应时,置换出64份质量的铜,所以溶液的质量减小,直至硫酸铜完全反应时不再改变,图象能正确反映其对应操作中各量变化关系,符合题意。
故选D。
2.下列图象分别与选项中的操作项对应,其中不合理的是()A.往一定量的NaOH溶液中滴加稀盐酸至过量B.某温度下,将KNO3固体不断地加入水中C.向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液D.持续不断地加热一定质量的碳酸氢钠固体【答案】D【解析】【详解】A、向一定量的NaOH溶液滴加盐酸中至过量,碱性逐渐变弱,酸性逐渐增强,pH值的变化是从大于7逐渐的减小到小于7,故选项图象与选项中的操作项对应合理;B、某温度下,将KNO3固体不断地加入水中,所得溶液的溶质的质量分数由0不断增大,当达到饱和时溶质质量分数不再增大,故选项图象与选项中的操作项对应合理;C、向一定量CuSO4溶液和稀硫酸的混合溶液中滴加NaOH溶液,先与硫酸反应,开始时不会生成沉淀,硫酸消耗完后再与硫酸铜反应会生成氢氧化铜沉淀,故沉淀的质量先是零,再不断上升,最后形成一条水平直线,故选项图象与选项中的操作项对应合理;D、持续不断地加热一定质量的碳酸氢钠固体,碳酸氢钠受热分解生成了碳酸钠、水和二氧化碳,剩余固体的质量不为0,故选项图象与选项中的操作项对应不合理。
初中化学图像题 金属及酸碱盐反应解题技巧分析及练习题(含答案)及解析

初中化学图像题 金属及酸碱盐反应解题技巧分析及练习题(含答案)及解析一、化学图像题 金属及酸碱盐反应的图像 1.下列图像不能正确反映其对应关系的是A .常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)B .加热一定质量的高锰酸钾C .向氯化镁和盐酸的混合溶液中,滴加氢氧化钡溶液D .分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸【答案】A 【解析】 【详解】A 、常温下向一定质量的稀盐酸中逐渐加入镁条,镁与稀盐酸反应生成氯化镁和氢气,随着镁条质量的增加,生成氢气的质量逐渐增加,待稀盐酸完全反应后,不再变化,因此,气体的质量不会一直增加,符合题意;B 、加热一定质量的高锰酸钾,高锰酸钾加热分解为锰酸钾、二氧化锰和氧气,固体质量逐渐减少,固体中锰元素的质量不变,故固体中锰元素的质量分数不断增加,待高锰酸钾完全反应后,不再变化,不符合题意;C 、向氯化镁和盐酸的混合溶液中,滴加氢氧化钡溶液,氢氧化钡先和盐酸反应生成氯化钡和水,因此一开始无沉淀产生,待盐酸完全反应后,再和氯化镁反应生成氢氧化镁沉淀和氯化钡,沉淀质量不断增加,待氯化镁完全反应后,沉淀质量不再变化,不符合题意;D 、分别向等质量的锌粉和铁粉中,加入足量等质量分数的稀盐酸,锌和稀盐酸反应:22Zn+2HCl=ZnCl +H ↑,铁和稀盐酸反应:22Fe+2HCl=FeCl +H ↑,锌比铁活泼,锌反应速率快,反应时间短,锌的相对分子质量大于铁,故铁最后产生氢气的质量多,不符合题意。
故选A 。
2.向硝酸银和硝酸铜的混合溶液中加入一定量的锌粉(锌先与金属活动性较弱的金属的盐溶液反应),反应中溶液的质量与加入锌粉质量的关系如图所示,以下分析正确的是()A .a 点时溶液中溶质有2种B .c 点前溶液为有色溶液C .向b 点溶液滴入稀盐酸有白色沉淀生成D .c 、d 点固体种类相同 【答案】B 【解析】 【分析】根据题给信息,锌先与金属活动性较弱的金属的盐溶液反应,即锌先与硝酸银溶液反应,生成硝酸锌和银,根据化学方程式()332=Zn + 2AgNO Zn NO +2Ag ,每65份质量的锌置换出216份质量的银,因此反应后溶液质量减少,且幅度较大,待硝酸银反应完后锌再与硝酸铜溶液反应,生成硝酸锌和铜,根据化学方程式()()3322Zn + Cu NO = Zn NO +Cu ,每65份质量的锌置换出64份质量的铜,因此反应后溶液质量增加,但增加的幅度较小。
全国中考化学pH的变化图像的综合中考真题汇总及答案

一、中考初中化学pH的变化图像1.下列图像能正确反映其对应关系的是()A.向等质量、等浓度的稀硫酸中分别加入过量的Zn和FeB.向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸C.用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气D.向盛有稀硫酸的烧杯中不断加水稀释【答案】B【解析】【分析】【详解】A、酸质量相等,金属过量,最终产生氢气质量相等,产生相同质量的氢气时,消耗的锌的质量应大于铁的质量,与图像不符;B、向含有少量NaOH的Na2CO3溶液中逐滴加入稀盐酸,稀盐酸会先和氢氧化钠反应生成氯化钠和水,再和碳酸钠反应生成二氧化碳氯化钠和水,与图像相符,故选B;C、催化剂只能改变反应速率,不能改变生成物的多少,用等质量、等浓度的过氧化氢溶液在有、无催化剂条件下制取氧气,生成氧气质量应该相等,与图像不符;D、加水稀释只会使稀硫酸酸性减弱,不可能pH大于7,变为碱性,与图像不符。
【点睛】该题是一道图像题,图像题的难点在于图像信息和文字信息的转化,然后和实际反应情况对应是否相符。
2.下列图像能正确反映对应变化关系的是A.两份等质量的氯酸钾在有、无 MnO2的情况下加热产生氧气B.加水稀释盐酸C.向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液D.将足量粉末状的铁和镁分别与等质量、等质量分数的稀盐酸反应【答案】C【解析】【分析】【详解】A、两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气,催化剂只能影响反应速率,产生氧气的质量相等,故选项图象不能正确反映对应变化关系;B、向浓盐酸中不断加水稀释,溶液始终显酸性,pH不可能大于7,故选项图象不能正确反映对应变化关系;C、向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液,碳酸钠先与稀盐酸反应生成氯化钠、水和二氧化碳气体,开始不生成沉淀。
稀盐酸消耗完,碳酸钠再与氯化钙反应生成碳酸钙沉淀,沉淀的质量不断上升,完全反应后不变,故选项图象能正确反映对应变化关系;D、将足量粉末状的铁和镁分别与等质量、等质量分数的稀盐酸反应,由质量守恒定律,生成氢气中氢元素来源于稀盐酸,稀盐酸中溶质的质量相等,则最终生成氢气的质量应相等,故选项图象不能正确反映对应变化关系。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2017年03月19日酸碱中和图像初中化学组卷
一.填空题(共8小题)
1.已知甲、乙分别是盐酸溶液和氢氧化钠溶液中的一种.下图表示:向盛有10mL 稀的甲溶液(其中滴有少量紫色石蕊试剂)中,加入乙溶液时,溶液pH的变化曲线.请分析曲线回答问题:
(1)甲是溶液;滴有少量紫色石蕊试剂甲溶液呈色.
(2)当加入乙溶液的体积为mL时,甲、乙溶液恰好完全反应.
(3)当溶液的pH=1.4时,溶液中的溶质是(指示剂除外).
2.数字化装备正逐步进入校园.利用数字传感器可以测得酸与碱反应过程中溶液pH变化的图象.如图是盐酸与氢氧化钠溶液反应过程中的pH变化的图象.(1)反应的化学方程式为;
(2)当溶液呈中性时,所消耗氢氧化钠溶液的体积是mL;
(3)图中b点所示溶液中,含有的溶质是.
3.在用氢氧化钠溶液与硫酸溶液进行中和反应的实验时,反应过程中溶液的酸碱度变化如图所示
(1)该反应的化学方程式为.
(2)该实验操作是将滴加到另一种溶液中.
(3)当加入溶液的质量为a克时,所得溶液中的溶质是(填化学式).
(4)当加入溶液的质量为b克时,向所得溶液中滴加酚酞溶液,溶液呈色.
4.某校化学性质在利用硫酸和氢氧化钠溶液探究酸碱中和反应时.利用数字化传感器测得烧杯中溶液pH的变化图象,如图所示.下列说法正确的是.A.由a点到b点的pH变化过程证明酸和碱发生了中和反应
B.图中c点所示溶液呈碱性
C.该实验是将氢氧化钠溶液逐滴滴入到盛有硫酸的烧杯中
D.图中b点所示溶液中,含有的溶质是.
5.下列图象能正确反映溶液酸碱度随加入物质质量变化趋势的是()
A、往稀硫酸中加入过量氢氧化钠溶液
B、往水中加入稀硫酸
C、往氢氧化钠溶液中加入过量稀硫酸
D、.
6.实验小组探究盐酸和氢氧化钠反应过程中溶液pH的变化规律,得到如图所示曲线.根据如图回答下列问题:
(1)该实验是将滴加到另一种物质中.
A.盐酸B.氢氧化钠
(2)在A点时,溶液中的溶质有.
(3)B点表不的意义是.
(4)该反应的化学方程式是.
7.某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式.
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么?
【假设猜想】针对疑问,大家纷纷提出猜想.甲组同学的猜想如下,请你补上猜想四.
猜想一:只有Na2SO4
猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4、H2SO4和NaOH
猜想四:
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是,
理由是.
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用了老师提供的pH试纸、Na2CO3溶液、BaC12溶液,进行如下三个方案的探究.
实验方
案
测溶液的pH 滴加Na 2CO 3溶液 滴加BaCl 2溶液
实验操
作
实验现
象
试纸变色,对比比色卡,pH <7 产生白色沉淀 实验结
论 溶液中有H 2SO 4 溶液中有H 2SO 4 溶液中有H 2SO 4
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予了肯定.同时指出(2)中存在两处明显错误,请大家反思.同学们经过反思发现了如下两处错误:
①实验操作中的错误是 ;
②实验方案中也有一个是错误的,错误的原因是 .
8.某化学兴趣小组的同学往氢氧化钠溶液中滴加稀盐酸时,没有看到明显现象.
【提出问题】氢氧化钠与盐酸是否发生了化学反应?
【查阅资料】酸与碱发生中和反应会放出热量.
【实验设计】甲、乙、丙三位同学分别设计了如下实验方案,请你帮他们完成实验报告.
同
学
实验操作 现象 结论
甲
溶液由红色变成 氢氧化钠与盐
酸发生了化学
反应,反应的
化学方程式为
乙
U 型玻璃管中 边的红墨水液面
下降(所加稀盐酸
的体积忽略不计) 氢氧化钠与盐
酸发生了化学反应
丙 用 测定氢氧化钠溶液的pH ,向其中滴加足量稀盐酸,再测定溶液的pH 最后溶液的pH (填“≥7”、“≤7”、“不变” 氢氧化钠与盐
酸发生了化学
反应
【评价反思】你认为实验设计方案不合理的同学是 ,理由是 .
【拓展延伸】另有一位同学向自己配制的氢氧化钠溶液中滴加酚酞试液时,溶液变红色,可是红色即刻消失了,出现此意外情况的原因是 (填以下序号).
A .所用的酚酞试液是变质的
B .所用的氢氧化钠溶液浓度太大
C .氢氧化钠溶液吸收了空气中二氧化碳.
二.实验探究题(共3小题)
9.如图1所示是氢氧化钠溶液与盐酸反应的实验研究.
(1)未滴加盐酸时,烧杯中溶液呈 色.
(2)随着盐酸不断滴入,烧杯中溶液的pH 逐渐 (填“增大”、“减小”或“不变”),该反应的化学方程式是 .
(3)随着盐酸不断滴入,烧杯中溶液温度变化如坐标图2所示.某时刻测得溶液的温度是32℃,请判断b点时溶液的酸碱性并说明理由.
(4)当溶液的温度为38℃时,可证明溶液不含氢氧化钠的实验方法是(填选项).
A.品尝烧杯中溶液的味道
B.用手沾取烧杯中溶液并体验是否有滑腻感
C.往烧杯中再滴加少量氢氧化钠溶液并观察溶液颜色.
10.小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度.于是他对所得溶液的酸碱性进行探究.【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈性,还可能呈性.
【实验验证】
实验操作实验现象结论
用试管取该溶液1﹣2mL,滴入1﹣2滴无色酚酞溶液,振荡无色酚酞溶液变溶液呈碱性无色酚酞溶液不
变色
溶液呈
【分析与思考】(1)若溶液呈碱性,则溶液中使其呈碱性的离子是(填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入稀盐酸,溶液由色刚刚变为色时,则为中性.
(2)若无色酚酞溶液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:(要选用两种不同类别物质)
方案一:取样,加入,若观察到,则所取溶液呈酸性;若无明显现象,则呈中性.化学方程式.
方案二:取样,加入,若观察到,则所取溶液呈酸性,该反应的化学方程式为;若无明显现象,则呈中性.
11.小红同学进行酸碱中和反应的实验(如图所示).她向氢氧化钠溶液中滴加一定量稀盐酸后,想起氢氧化钠溶液中事先没有滴加指示剂,为了确定盐酸与氢氧化钠的反应程度,她从烧杯中取了少量溶液于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到试管中溶液颜色没有变化.于是她对烧杯中的溶液进
行了以下探究:
(1)小红认为此时烧杯中的溶液可能有以下三种情况:
①盐酸与氢氧化钠恰好完全反应;②氢氧化钠有剩余;③盐酸过量.
小明同学却断定不可能“氢氧化钠有剩余”,他的理由是:;
(2)他们共同设计了一个实验方案,欲对上述其他两种可能情况进行验证.请根据相关内容填写如表:
试验方法可能观察到
的现象
结论
将少量锌粒放入试管中,然后从烧杯中取适量溶液至试管中.如果则盐酸过量
如果则盐酸与氢氧化钠恰
好完全反应
(3)经过讨论,他们认为利用下列几种物质代替锌粒,也可以达到验证目的.你认为其中不正确的是(填序号).
A.生锈的铁钉B.碳酸钠粉末C.硫酸钠粉末D.氢氧化铜
(4)如图曲线能够表示小红所做试验中溶液pH变化趋势的是(填序号).
2017年03月19日无敌的寂寞的初中化学组卷
参考答案
一.填空题(共8小题)
1.氢氧化钠;蓝;9;NaCl,HCl;2.NaOH+HCl=NaCl+H2O;10;NaOH和NaCl;3.2NaOH+H2SO4=Na2SO4+2H2O;氢氧化钠溶液;H2SO4和Na2SO4;红;4.A;硫酸钠;5.向稀硫酸中加入过量氢氧化钠溶液;6.A;氯化钠和氢氧化钠;氢氧化钠溶液和稀盐酸恰好完全反应;NaOH+HCl=NaCl+H2O;7.H2SO4+2NaOH=Na2SO4+2H2O;有Na2SO4和NaOH;猜想三;H2SO4和NaOH在溶液中不能共存;NaOH;有气泡产生;pH试纸浸入溶液中;Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在;8.无色;HCl+NaOH=NaCl+H2O;左;pH试纸;≤7;乙;氢氧化钠固体溶于水也会放出热量.;B;
二.实验探究题(共3小题)
9.红;减小;NaOH+HCl=NaCl+H2O;酸性,因为是溶液的温度由高到降低;C;10.中;酸;红;中性或酸性;OH﹣;红;无;碳酸钠溶液;有气泡冒出;Na2CO3+2HCl ═2NaCl+H2O+CO2↑;锌粒;有气泡产生;Zn+2HCl=ZnCl2+H2↑;11.观察到试管中溶液颜色没有变化,说明溶液一定不显碱性,所以不可能是氢氧化钠有剩余;有气泡冒出;没有气体生成;C;C;。
