氧化还原反应的特征与实质课件
合集下载
氧化还原反应ppt课件

根据下列反应判断有关物质还原性强弱的顺序 A
H2SO3 + I2 + H2O === 2HI + H2SO4
2FeCl3 + 2HI === 2FeCl2 + 2HCl + I2 A.H2SO3 > I- > Fe2+ B.I- > Fe2+ > H2SO3 C.Fe2+ > I- > H2SO3 D.Fe2+ > H2SO3 >I-
电子的得失、共用电子对的偏移
氧化反应 还原反应 二者关系
元素化合价
电子的转移
升高
失电子(偏离)
降低
得电子(偏向)
二者是同时进行的
1.下列变化过程中,元素失去电子的是( D )
A.MnO2 → Mn2+
B.CuO → CuCl2
C.Ag+ → Ag2O
D.Sn2+ → Sn4+
2.下列说法正确的是( D ) A.有得、失氧的反应才是氧化还原反应 B.氧化还原反应中,氧化反应与还原反应是先后进行的 C.有电子得失的反应才是氧化还原反应 D.凡是有化合价升降的反应,都是氧化还原反应
高温
C + H2O ===== H2 + CO
CuO + H2 ==== Cu + H2O
物质 CuO
C H2O
C CuO H2
氧化(还原)反应 还原 氧化 还原 氧化 还原 氧化
化合价变化 降低 升高 降低 升高 降低 升高
化合价升高 —— 氧化反应
化合价降低 —— 还原反应
化合价升高,发生氧化反应
Zn + 2HCl ==== ZnCl2 + H2↑
化合价
得失电子
氧化还原反应ppt课件

请找出下列反应的氧化剂、氧化产物、还原剂、还原产物
Fe2O3 + 3CO
高温
=
2Fe + 3CO2
2KMnO4 Δ= K2MnO4+MnO2+O2 ↑
SO2 + 2H2S = 3S↓+2H2O
1.3 氧化还原反应
第二课时
4、氧化还原反应的本质
点燃
2Na + Cl2 = 2NaCl 化合价发生改变的原因:电子得失
部分非金属单质
含有高价态元素的
氧
化合物
化 某些金属活动性较
剂 弱的元素对应的高
价态离子
过氧化物
O2、Cl2等 浓硫酸、HNO3、KMnO4、MnO2、
KClO3、K2Cr2O7等
Fe3+、Ag+、Pb4+、Cu2+等
Na2O2、H2O2等
4、氧化性 还原性
还原剂具有还原性(降低其他物质元素的化合价)
化合价升高,失电子,被氧化
化合价降低,得电子,被还原
氧化剂:所含元素的化合价降低, 即得到电子(或电子对偏向)的反应物。
还原剂:所含元素的化合价升高, 即ห้องสมุดไป่ตู้去电子(或电子对偏离)的反应物。
记忆口诀
升失氧,降得还,要说剂,恰相反 还原剂: 化合价升高,失去电子,发生氧化反应,被氧化,生成氧化产物 氧化剂: 化合价降低,得到电子,发生还原反应,被还原,生成还原产物
2.单线桥法(不同元素,失电子物质指向得电子物质)
2×3e-
0 +3
0 +3
①必须箭头(失电子物质元素)指向箭尾(得电子物质对应元素) ②单线桥上不须注明“得到”或“失去”,仅注明电子转移数目
B (大本 P27 第 4 题)下列反应中,电子转移的方向和数目正确的是( )
氧化还原反应ppt课件

今天你收获了什么?
基本类型
是否为氧化还原反应
分解反应
否
分解反应
是
复分解反应
否
复分解反应
否
置换反应
是
X
是
化合反应
是
化合反应
否
总结:基本反应与氧化还原反应的关系
化合反应
氧化还原反应
置换反应
复分解反应
分解反应
非 氧 化 还 原 反 应
判断下列说法是否正确:
1.有单质参加的化合反应一定是氧化还原反应 √ 2.有单质生成的分解反应一定是氧化还原反应 √ 3.有单质参加或生成的反应一定是氧化还原反应 ×
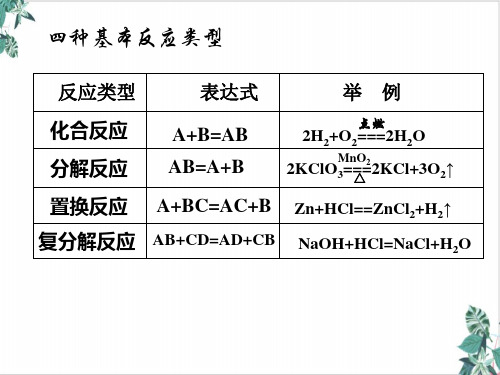
任务三、氧化还原反应与四种基本反应类型的关系
化学反应(反应条件未标)
CaCO3==CaO+CO2↑ 2H2O=2H2↑+O2↑ AgNO3+NaCl==AgCl↓+NaNO3
BaCl2 + Na2SO4 = 2NaCl + BaSO4 ↓
Fe+CuSO4=FeSO4+Cu Fe2O3+3CO==2Fe+3CO2 2Na+ Cl2=2NaCl H2O+ CaO == Ca(OH)2
,那么氧化还原反应中元素的化合价为什么会发生变化呢,它的本质 原因是什么?
熟读教材P21-22,思考并小组讨论
以
和
构进行分析。
为例,利用原子结
微观探析
失去电子、化合价升高,
氧化反应
00
+1 -1
得到电子、化合
价降低,还原反应
Na
+11
+17
Cl
Na+ +11 Na+ Cl-
氧化还原反应ppt课件

化合价降低,得电子,被还原
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
化合价升高,失电子,被氧化
三、四个基本反应类型与氧化还原反应的关系
1、化合反应:
A + B = AB
2、分解反应:
3、置换反应:
4、复分解反应:
AB = A + B
A + BC = B + AC
思考:有单质参加或生成的反应一定是置换反应吗?
AB + CD = AD + CB
C
B D
自我检测
5、下列哪个反应表示二氧化硫被还原( )A、SO2+2H2O+Cl2 = H2SO4+2HCl B、SO2+2H2S = 2H2O+3S↓C、SO2+2NaOH = Na2SO3+H2O D、SO2+Na2CO3 = Na2SO3+CO2↑
B
自我检测
氧化还原反应 第一课时
一、从不同角度认识氧化还原反应
1、从得氧失氧的角度认识氧化还原反应
得到氧原子,发生氧化反应
失去氧原子,发生还原反应
H2 + CuO = Cu + H2O
化合价升高
化合价降低
氧化反应
还原反应
0 +1
失去电子
发生氧化反应
元素化合价降低
得到电子
发生还原反应
口诀:
升、失、氧
降、得、还
二、关于氧化还原反应的几个重要概念
1、氧化剂:
2、还原剂:
反应物中元素化合价降低的物质
(被还原的物质)
(主要从升失氧、降得还入手分析)
氧化性:
(氧化剂具有氧化性)
物质得到电子的性质
√
氧化还原反应课件

△
2Na2S+Na2SO3+6HCl===6NaCl+3S↓+3H2O
-2 +4 0
3Cl2 + 6NaOH == 5NaCl + NaClO3 +3H2O
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
电解
还原剂 氧化剂 还原产物 氧化产物
点燃
3)2Fe +3Cl2 == 2FeCl3
还原剂 氧化剂 既是还原产物又是氧化产物
练习1:
水(H2O)在很多化学反应中起极其重要 的作用。请研究下列有水参与的氧化还原反应: 2Na + 2H2 O === 2NaOH + H2↑ 3NO2 + H2O === 2HNO3 + NO 2H2O === 2H2↑+ O2↑ 2F2 + 2H2O === 4HF + O2 水只做氧化剂的是 ,水只做还原剂的是 ,水既做氧化剂又还原剂的是 ,水既不是氧化剂又不是还原剂的是 。
Cu
Cl
Mn
Cu
N
练习2
R、X、Y和Z是四种元素,其常见化合价 均为+2价,且X2+与单质R不反应; X2 + +Z=X+Z2 +; Y+Z2 + =Y2 + +Z。这四种离子被还原为0价时表现的氧化性大小符合() A. R2 + >X 2+ >Z 2+ >Y2+ B. X 2+ > R 2+ > Y 2+ >Z 2+ C. Y 2+ >Z 2+ > R 2+ >X 2+ D. Z 2+ > X 2+ > R 2+ >Y 2+
2Na2S+Na2SO3+6HCl===6NaCl+3S↓+3H2O
-2 +4 0
3Cl2 + 6NaOH == 5NaCl + NaClO3 +3H2O
2)2NaCl + 2H2O == H2↑ + Cl2↑ + 2NaOH
电解
还原剂 氧化剂 还原产物 氧化产物
点燃
3)2Fe +3Cl2 == 2FeCl3
还原剂 氧化剂 既是还原产物又是氧化产物
练习1:
水(H2O)在很多化学反应中起极其重要 的作用。请研究下列有水参与的氧化还原反应: 2Na + 2H2 O === 2NaOH + H2↑ 3NO2 + H2O === 2HNO3 + NO 2H2O === 2H2↑+ O2↑ 2F2 + 2H2O === 4HF + O2 水只做氧化剂的是 ,水只做还原剂的是 ,水既做氧化剂又还原剂的是 ,水既不是氧化剂又不是还原剂的是 。
Cu
Cl
Mn
Cu
N
练习2
R、X、Y和Z是四种元素,其常见化合价 均为+2价,且X2+与单质R不反应; X2 + +Z=X+Z2 +; Y+Z2 + =Y2 + +Z。这四种离子被还原为0价时表现的氧化性大小符合() A. R2 + >X 2+ >Z 2+ >Y2+ B. X 2+ > R 2+ > Y 2+ >Z 2+ C. Y 2+ >Z 2+ > R 2+ >X 2+ D. Z 2+ > X 2+ > R 2+ >Y 2+
人教版化学必修一氧化还原反应ppt33张课件
单质还原性逐渐减弱:K>Ca>Na>Mg>Al>Zn>Fe…
2.元素处于最低价态时,只能做还原剂:Cl-、S2-、I- 元素处于最高价态时,只能做氧化剂:KMnO4、 FeCl3、H2SO4、HNO3
阳离子氧化性逐渐增强: K+<Ca2+<Na+<Mg2+<Al3+<Zn2+<Fe 2+…
3.归中规律 同种元素不同价态间发生氧坏反应时,高价+ 低价 中间价态,即“只靠拢,不交叉。”
例:在KClO3+6HCl(浓)===KCl+3Cl2+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为 。
3、这是从电子得失的角度看(也是氧化还原反应的实质):
因此,有电子转移(得失或电子对偏移)的反应都是氧化还原反应。
Fe + 2HCl = FeCl2 + H2 ↑
2e-
CH4 + 2O2 = CO2 + 2H2O
8e-
-4 0 +4 -2
0 +1 +2 0
有单质参加的
有单质生成的
三、氧还反应中电子转移的表示方法
1.双线桥法:
(1)标出反应中化合价发生变化的元素的化合价,判断其升降。
(2)画线条,箭头由反应物指向生成物中同种元素。
(3)在桥上标明电子“得”“失”电子,同时用a×b e-形式表示得、失电子数。 a—得、失电子的原子总数 b—每个原子得失电子数(a,b为1时可省略)
如: 2Fe+3Cl2 =2FeCl3 Fe+S= FeS 则氧化性:Cl2 > S
氧化还原反应ppt课件

思考与讨论: (1)请根据初中学过的氧化反应和还原反应的知识,分析以下反应,完成下表。
2CuO+C 2Cu+CO2↑ Fe2O3+3CO 2Fe+3CO2↑
物质 得氧物质 失氧物质
反应物 C、CO CuO、Fe2O3
发生的反应(氧化反应或还原反应) 氧化反应 还原反应
思考:你判断氧化反应和还原反应的依据是什么?
另一条线始于反应物中的升价元素,止于产物中同种元素。
注得失---正确标出反应前后“得到”或“失去”电子总数
课堂探究 氧化还原反应电子转移的表示方法
双线桥法的注意事项: (1)箭头、箭尾必须对应化合价变化的同种元素的原子; (2)必须注明“得到”或“失去”; (3)电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子 个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略; (4)被还原的物质和被氧化的物质得失电子数守恒。
注意:两个可能:化合反应和分解反应可能是氧化还原反应。
两个一定:置换反应一定是氧化还原反应,复分解反应一定是非氧化还原反应。
课堂探究 氧化还原反应与四大基本反应的关系
思考与讨论:观察下列反应,它们是氧化还原反应吗?属于四大基本反应类型吗?
有单质参加或生成的化学反应一定是氧化还原反应吗?
4HCl(浓)+MnO2 MnCl2+Cl2↑+2H2O
人教版(2019)必修第一册
第一章 物质及其变化
第三节 氧化还原反应
第一课时 氧化还原反应
素养目标
宏观辨识与微观探析:
从宏观上理解化合价变化是氧化还原反应的表观现象,从微观上明确在氧化还原 反应中物质发生化合价变化的本质原因是电子的转移(得失和共用电子对偏移)。
氧化还原反应(最新版)PPT

知识铺垫
新知预习
自主测试
一、从不同角度分析氧化还原反应1.从得氧、失氧的角度认识氧化还原反应反应:2CuO+C 2Cu+CO2↑(1)CuO失氧,发生了还原反应,该物质是氧化剂。(2)C得氧,发生了氧化反应,该物质是还原剂。结论:从得氧、失氧的角度看,一种物质得到氧被氧化,另一种物质失去氧被还原的反应叫做氧化还原反应。
探究一
探究二
素养脉络
随堂检测
D项,HgS中汞元素由+2价降到0价,转移2e-,O2中氧元素由0价降到-2价,转移2×2e-,且均为得电子,而HgS中硫元素化合价由-2价升高到+4价,失6e-,正确的表示方法为
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
1.古诗词是古人为我们留下的宝贵精神财富,下列诗句不涉及氧化还原反应的是( )A.野火烧不尽,春风吹又生B.春蚕到死丝方尽,蜡炬成灰泪始干C.粉身碎骨浑不怕,要留清白在人间D.爆竹声中一岁除,春风送暖入屠苏答案C解析A 、B两项中均涉及物质燃烧,D项中有火药爆炸,都属于氧化还原反应;C项中反应为CaCO3 CaO+CO2↑,无元素化合价升降,属于非氧化还原反应。
探究一
探究二
素养脉络
随堂检测
探究一
探究二
素养脉络
随堂检测
深化拓展1.双线桥法和单线桥法的书写步骤(1)双线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
(2)单线桥法的书写步骤:
探究一
探究二
素养脉络
随堂检测
2.用双线桥法表示电子转移的方向和数目时的注意事项(1)箭头必须由反应物指向生成物,且两端对准同种元素。(2)在“线桥”上标明电子“得到”或“失去”,且得到与失去的电子总数必须相等,电子对的偏移也按得失处理。(3)电子转移数以a×be-形式表示,a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。(4)箭头方向不代表电子转移的方向,仅表示电子转移前后粒子的变化。3.用单线桥法表示电子转移的方向和数目时的注意事项(1)单线桥必须画在反应物中。(2)箭头指向得电子原子,箭尾指向失电子原子。(3)“线桥”上只标电子转移的数目,不标“得”“失”字样。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
0 Ⅰ2
+
O2
化合价降低,氧被化还还原反原应的特(征与还实质原反应)
第二章 化学物质及其变化
第三节 氧化还原反应
第二课时
氧化还原反应的特征 与实质
氧化还原反应的特征与实质
教师:程瑞生
思考: 下列反应是不是氧化还原反应 化合价降低
F氧0 e化+ 还C+2u原SO反4 应= 的F+2e特SO证4 :+
0
0
+1 -1
H2 + Cl2 === 2 H Cl
化合价升降的原因:共用电子对的偏移
氧化还原反应的特征与实质
4、氧化还原反应的实质: 电子的转移
电子的得失
得e 化合价降低 失e 化合价升高
共用电子对的偏移
偏向:化合价降低 偏离:化合价升高
氧化还原反应的特征与实质
小结:从微观角度(电子转移)认识氧化还原反应:
转移
氧化还原反应的特征与实质
是氧化还原反 应的表观特征, 可作为氧化还 原反应的判断 依据。
此课件下载可自行编辑修改,供参考! 感谢您的支持,我们努力做得更好!
氧化还原反应的特征与实质
氧化反应:被氧化元素化合价升高,失去电子(或电子对偏离) 还原反应:被还原反应化合价降低,得到电子(或电子对偏向)
氧化还原反应的特征与实质
练 习:
下列叙述正确的是( BD )
A、在氧化还原反应中,失去电子的物质,所含元素化合价 降低 B、凡是有元素化合价升降的化学反应都是氧化还原反应 C、在氧化还原反应中一定所有的元素化合价都发生变化 D、氧化还原反应的本质是电子的转移(得失或偏移)
氧化还原反应的特征与实质
一、氧化还原反应
局限于得
从得氧失氧角度分析:
氧失氧的
一种物质得到氧被氧化,同时另一种物质反失应去氧被还
原的反应是氧化还原反应。
从化合价升降角度分析: 有元素化合价升降的反应是氧化还原反应。
从电子转移角度分析:
有电子转移(得失或偏移) 的反应是氧化还原反应。
氧化还原反应
的本质是电子
【课前练习】
下列反应属于氧化还原反应的是( D )
A.ⅠBr + H2O = HBr + HⅠO
B.NH4HCO3 = NH3↑+ CO2↑+ H2O
C.Na2O2 + 2HCl = H2O2 + 2NaCl 化合价升高,被氧化(氧化反应)
0 D.O3
+
-1 2NaⅠ
+
H2O=△=
-2 2NaOH
+
化合价升高,发生氧化反应
失电子
0
0
+1 -1
2
Na
+
Cl2
= 2NaCl
得电子
化合价降低,发生还原反应
升、失、氧;
化合价升高,发生氧化反应
共用电子对偏离
H0 2+ C0 l2 = 2+H1 C-l1
共用电子对偏向
化合价降低,发生还原反应
降、得、还
氧化还原反应: 有化合价改变的反应 本质上是:电子转移(电子得失或偏移)
来?
氧化还原反应的特征与实质
3、从电子得失角度分析:
离子化合物NaCl 的形成过程
Na 失去e- Cl
失去e-后
得到e-后
Na+ [ Cl ]-
00
+1-1
2Na+Cl2==2Na Cl
Na+ Cl -
化合价升降的原因:
氧化还原反应的特征与实质
电子的得失
共价化合物HCl 的形成过程
H
Cl
H Cl
0
Cu
各元1,素化每的合个化价合反价应升有中高变,化都吗有?找元出素变的化化的合化价合价? 发生变化 化合价降低
2升M,0高每g,个+必反2有+H应1元C中素l,=的有化M元+2合g素价C的降l2化低+合。H0价2↑
化合价升高 氧化还原反应的特பைடு நூலகம்与实质
化合价的升降是什么 原因引起的?如何在 上述两反应中表达出
