叶绿体的分离与荧光观察
叶绿体的分离与荧光观察.ppt

表面张力作用, 从而使细胞发生融合,
进而细胞质沟通,形成一个双核或多核 细胞
实验用品
1.器材:离心机,移液枪,水涡锅,载玻 片,盖玻片,血细胞计数板,刻度试管, 刻度吸管,电炉,冷冻离心管,显微镜, 烧杯, 吸管
2.试剂:Alsever溶液,GKN溶液,0.85% 生理盐水,50%PEG ,蒸馏水
红细胞膨胀 到一定程度时,细胞膜破裂, 即红细胞发生溶血.由于溶质透人速度不 同,溶血时间也不同。
实验用品
试剂:0.17 mol/L氯化钠,0.17 mol/L 氯化铵,0.17 mol/L硝酸钠,0.12 mol/ L硫酸 钠,0.12 mol/L草酸钠,0.12mol /L醋酸钠, 0.32 mol/L葡萄糖,0.32 mol/L甘油,0.32 mol/L乙醇,0.32mol /L丙醇。 仪器:显微镜,载玻片,盖 玻片,吸管,小烧杯,试管,试管架
50%PEG混合液: 称取少许PEG(Mw 6000)放人刻度离心管内,在沸水浴中加 热, 使其溶化,待冷却至50℃时,加入 预热至50℃ 的等体积的GKN液,混匀。 注意使用前配制。
实验方法
1.取新鲜的鸡血与Alsever溶液以1:4的 比例混匀,可在冰箱内存放一周(4℃)
2.取1ml贮存鸡血加入4ml0.85%生理盐水, 充分混匀800r/min,3min弃上清,重复离 心两次。
悬浮介质:通常用缓冲的蔗糖溶液,它 比较接近细胞质的分散相,在一定程度 上能够保持细胞器的结构和酶的活性。
詹纳斯活染:詹纳斯绿B是对线粒体专一 的、毒性很小的、活性染料,由于其碱 性,解离后
带正电,由电性吸引堆积在线粒体膜上。
线粒体的细胞色素氧化酶使该染料保持 在氧化状态呈现蓝绿色从而使线粒体显 色,而细胞质中的染料被还原成无色。
实验二叶绿体的分离与荧光观察

叶绿体荧光产生的机制
荧光产生
叶绿体在接受光能后,将能量转化为活跃的化学能,这个过程会产生荧光。荧光是一种光发射现象,发生在叶绿 素和其他色素分子吸收光能后。
荧光类型
根据荧光产生的机制,可以将荧光分为自发性荧光和诱导荧光。自发性荧光是指色素分子自发地吸收光能后产生 的荧光;诱导荧光是指通过外部刺激使色素分子吸收光能后产生的荧光。
叶绿体的分离
01
02
03
04
制备匀浆
将新鲜叶片洗净后剪碎,加入 适量的磷酸缓冲液,用匀浆器
充分研磨的转速和时间进行离心分离,
使叶绿体沉淀到底部。
吸取上清液
将上清液吸出,留下叶绿体沉 淀。
重悬浮
将叶绿体沉淀重新悬浮在适量 的溶液中,以便进行后续的荧
光观察。
实验二叶绿体的分 离与荧光观察
目录
• 实验目的 • 实验原理 • 实验步骤 • 结果分析 • 实验结论
01
CATALOGUE
实验目的
掌握叶绿体的分离技术
叶绿体的分离
通过离心、密度梯度离心等技术,从植物组织中分离出叶绿 体。
叶绿体纯化
通过过滤、洗涤等步骤,去除杂质,获得纯度较高的叶绿体 。
了解叶绿体荧光的基本原理
叶绿体分离的原理与方法
原理
叶绿体分离主要依据其密度和大小差异进行。常用的分离方法有差速离心法和密度梯度离心法。差速 离心法是通过逐渐增加离心速度,使不同大小和密度的细胞器分批分离;密度梯度离心法则是在介质 中形成密度梯度,使不同密度的细胞器在梯度中停留并形成不同的区带。
方法
叶绿体分离通常包括细胞破碎、差速离心或密度梯度离心、洗涤和重悬浮等步骤。根据实验需求,可 以选择适当的方法分离纯化叶绿体。
实验三 叶绿体的分离与荧光观察

实验三叶绿体的分离与荧光观察一、实验目的1.了解差速离心法分离细胞成分的一般原理和方法。
2.掌握从植物叶组织中分离叶绿体的方法。
3.熟悉荧光显微镜的使用方法,并观察叶绿体的自发荧光和次生荧光。
4.熟悉利用叶绿体得率来测量叶绿素含量。
二、实验原理叶绿体是是植物细胞中由双层膜围成,含有叶绿素能进行光合作用的能量转换细胞器。
由于具有这一重要功能,所以它一直是植物学、细胞生物学和遗传学等的重要研究对象。
植物细胞被细胞壁所包围,因此实验中必须破碎细胞壁的同时保持叶绿体的完整。
叶绿体是植物细胞中较大的一种细胞器。
将组织匀浆后悬浮在等渗介质中进行差速离心,是分离叶绿体等细胞器的常用方法。
差速离心就是根据一个颗粒在离心场中的沉降速率取决于颗粒的大小、形状和密度,及离心力以及悬浮介质的粘度等因素进行的。
在一给定的离心场中,同一时间内,密度和大小不同的颗粒其沉降速率不同。
依次增加离心力和离心时间,就能够使非均一悬浮液中的颗粒按其大小、密度先后分批沉降在离心管底部,分批收集即可获得各种亚细胞组分。
叶绿体的分离应在等渗溶液(0.35 mol/L氯化钠或0.4 mol/L蔗糖溶液)中进行,以免渗透压的改变使叶绿体受到损坏。
先将匀浆液在1 000 rpm的条件下离心2 min(以去除其中的组织残渣和一些未被破碎的完整细胞),然后在 3 000 rpm的条件下离心5 min,即可获得沉淀的叶绿体(混有部分细胞核)。
分离过程最好在0~4℃的条件下进行;如果在室温下,要迅速分离和观察。
有些生物体内的物质受激光照射后可直接发出荧光,称为自发荧光(或直接荧光),有的生物材料本身不发荧光,但它吸收荧光染料后同样也能发出荧光,这种荧光为次生荧光(或间接荧光)。
叶绿体含有的叶绿素发出火红色荧光属于自发荧光,叶绿体吸附吖啶橙后可发桔红色荧光属于次生荧光。
三、实验仪器、材料和试剂1.设备与器材。
叶绿体的分离及荧光观察
什么是荧光 ?
物质中的电子吸收光的能量由低能状态转变为高能状态,再回到低能状态(基态)时释放出的光。
三、荧光显微镜的成像原理
01
保持固有的荧光特性
02
荧光波长>激发波长
03
荧光强度极小于激发光的强度
04
有不同程度的衰减
05
荧光强度取决于激发光强度、被检物浓度、荧光效率
四、荧光的性质
五、荧光显微术应用
常用的细胞破碎方法
方法
技术
原理
效果
成本
举例
机 械 法
匀浆法
细胞被搅拌器劈碎或受剪切力而破碎
适中
适中
动植物组织或细胞
研磨法
细胞被研磨物磨碎
适中
便宜
植物组织
超声波法
用超声波的空穴作用使细胞破碎
剧烈
昂贵
细胞悬浮液小规模处理
珠磨破碎法
细胞被玻璃珠或铁珠捣碎
剧烈
便宜
细胞悬浮液和植物细胞大规模处理
化 学 法
渗透冲击
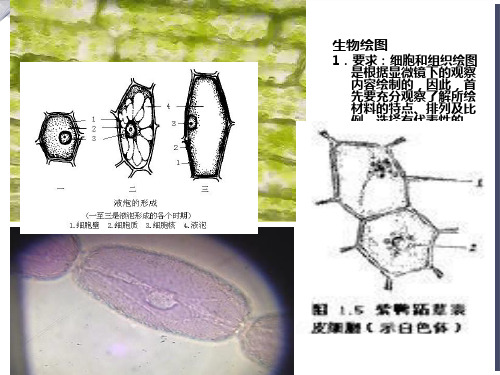
生物绘图 1.要求:细胞和组织绘图是根据显微镜下的观察内容绘制的,因此,首先要充分观察了解所绘材料的特点、排列及比例。选择有代表性的、典型的部位进行绘图。客观真实地反映材料的自然状态。即生物绘图要求具备高度的科学性和真实感,形态正确、比例适当、清晰美观。 2、用线条和圆点来完成全图。如,用线条描绘细胞壁与膜。用“点”表示明暗和颜色的深浅,给予立体感 3、不要只孤独的绘制一个细胞,要表现出显微镜下还有其他细胞的存在,
介质梯度应预先形成 ,离心前将样品小心铺放在密度梯度溶液表面、底部或中间,离心后形成区带。
介质梯度不需预先制备,离心时把密度均一的介质液和样品混合后装入离心管,通过离心自形成梯度,让颗粒在梯度中进行再分配。
叶绿体的分离与荧光观察.ppt

实验原理
脂质体常用类脂如磷脂酰胆碱、磷脂酰 丝氨酸、磷脂酰乙醇胺、胆固醇等制备。 其中最常用的是磷脂酰胆碱和胆固醇的 混合物。利用磷脂的双亲分子特性,加 入水相后形成囊状或液晶态,用超声波 处理,磷脂类双亲媒性分子被打碎为分 子或分子团,并自动重新排布成类似生 物膜的双分子层囊泡。
实验用品
器材 超声波清洗机、光学显微镜、旋涡混合
凝集素(lectin)是一类含糖的(少数除 外)并能与糖专一结合的蛋白质,它能 具有凝集细胞和刺激细胞分裂的作用, 凝集素使细胞凝集是由于他与细胞表面 的糖分子连接,在细胞间形成“桥”的 结果,加入与凝集素互补的糖可以抑制 细胞的凝集。
实验用品
1、材料:土豆块茎 2、器材和仪器:显微镜,粗天平,载玻
0.85%生理盐水:0.85g氯化钠溶于 100mL重蒸水中。
ALsver液: 葡萄糖 2.05g , 枸橼酸钠 0.8g , NaCl 0.42 加蒸馏水至100ml
GKN液: NaCl 8g ,KCl 0.4g , N0.a629HgP, O葡4萄·2H糖2O2g1,苯.77酚g ,红 N0.a0H1g2P溶O于4·H2O 1000ml蒸馏水中
3.弃上清再加4mlGKN溶液离心,加GKN 液,制成细胞悬液。
4.取上述细胞悬液1ml与刻度试管中,用 血细胞计数板计数,用GKN液将其调整 为5×106个/ml
5.取上述细胞悬液1ml于另一刻度试管中, 放入37℃水浴中,浴热20min,PEG液也 浴热20min
6、20min后,将0.5ml 50%PEG液逐滴沿 管壁加入到1ml细胞悬液中,边加入边摇 匀,然后再放入37℃水浴中保温20min。
2、记录荧光显微镜下观察的叶绿体自发 荧光和次生荧光现象,分析结果 。
叶绿体的分离与荧光观察

04 实验操作流程
实验材料准备
01
02
03
新鲜植物叶片
选择健康、无病虫害的植 物叶片,如菠菜、豌豆等。
实验试剂
包括分离液、荧光染色剂、 缓冲液等。
实验仪器
包括离心机、显微镜、染 色皿、吸管等。
叶绿体的分离
将新鲜叶片洗净,剪成小段, 放入离心管中。
加入适量的分离液,轻轻摇晃 ,使叶片充分浸泡在分离液中
荧光显微镜的工作原理和使用方法
工作原理
荧光显微镜利用特定波长的光激发细 胞内荧光染料或荧光探针发出可见光 ,通过光学系统放大并显示在屏幕上 。
使用方法
使用荧光显微镜时,需要先对样本进 行染色或标记,然后将其置于显微镜 下观察。观察时需要调整光源和滤光 片,以获得最佳的荧光效果。
荧光观察技术在叶绿体研究中的应用
叶绿体形态观察
荧光染料或荧光探针可以标记叶 绿体,通过荧光显微镜观察叶绿
体的形态、数量和分布情况。
叶绿体功能研究
荧光染料或荧光探针可以结合叶绿 体中的色素或蛋白质,通过观察荧 光信号的变化来研究叶绿体的功能 和代谢过程。
叶绿体动力学研究
利用荧光探针标记叶绿体,可以观 察叶绿体的运动和分布情况,了解 其在细胞内的动力学特征。
荧光观察
在荧光显微镜下观察叶绿体,发现叶绿体发出强烈的绿色荧光,表 明叶绿体含有丰富的叶绿素。
细胞壁与细胞质的分离
通过实验操作,成功将细胞壁与细胞质分离,便于后续实验的进行。
结果分析
1 2
叶绿体分离效果
实验结果表明,采用离心和密度梯度离心法能够 获得较为纯净的叶绿体,分离效果较好。
荧光观察的意义
荧光观察能够直观地展示叶绿体的存在和状态, 对于研究叶绿体的功能和结构具有重要意义。
高中生物实验 叶绿体的分离和荧光观察 实验报告

实验十一叶绿体的分离和荧光观察一.实验目的了解细胞匀浆和差速离心分级分离细胞组分的原理。
了解提取叶绿体的基本原理及其过程,通过光学显微镜的观察了解体外分离的叶绿体的一般形态,增加对叶绿体的感性认识。
掌握吖啶橙染色叶绿体的方法。
掌握显微数码拍照的方法。
二.实验内容提取叶绿体,吖啶橙染色,观察染色结果。
显微数码拍照。
三.实验原理将组织匀浆后悬浮在等渗介质中进行差速离心,是分离细胞器的常用方法。
在一定的离心场中,同一时间内,密度和大小不同的颗粒其沉降速度不同。
依次增加离心力和离心时间,就能够使非均一悬浮液中的颗粒按其大小、密度先后分批沉降在离心管底部。
叶绿体的分离应在等渗溶液(0.35mol/LNacl或0.4mol/L 蔗糖溶液)中进行。
离心后可得沉淀的叶绿体。
四.实验方法与步骤1.取嫩叶3g,洗净去柄去叶脉,剪碎放入研钵中。
2.加4ml0.35mol/LNacl,研磨匀浆,尼龙布过滤于离心管中1ml。
3.1000rpm离心2分钟弃去沉淀。
4.3000rpm离心15分钟,弃去上清液,将沉淀用少量0.35mNacl悬浮。
5.提取叶绿体观察:①普通光镜②荧光光镜③加吖啶橙。
6.撕取叶表皮观察:①普通光镜②荧光光镜③加吖啶橙。
a.在普通光镜下,可看到叶绿体为绿色椒榄形,在高倍镜下看到叶绿体内部含有较深的绿色的绿色小颗粒即基粒。
b.在荧光显微镜下,叶绿体发出火红色荧光。
c.加入吖啶橙染后,叶绿体可发也桔红色荧光。
而其中混有的细胞核发出绿色荧光菠菜叶手切片观察。
d.在普通光镜下可以看到三种细胞:表皮细胞:为边缘吐锯齿表的鳞片状细胞。
保卫细胞:为构成气孔的成对存在的肾形细胞。
叶肉细胞:为排成栅状的长形和椭圆形细胞。
5.显微数码拍照。
五.实验结果。
高中生物 实验四:叶绿体的分离与荧光观察

6.沉淀用0.35mol/L氯化钠溶液悬浮。 7.取叶绿体悬液1滴置于载玻片上,加盖玻片后用普通光 学显微镜观察。使用荧光显微镜观时,将叶绿体悬液滴在 无荧光的载玻片上,再滴加1滴0.01%吖啶橙荧光染料, 盖上无荧光的盖玻片后即可观察。
8.观察叶绿体的形态结构、测量1~5个叶绿体的长轴和短
【ห้องสมุดไป่ตู้验原理】
某些物质在一定短波长的光(如紫外光)的照射下吸收光 能进入激发态,从激发态回到基态时,就能在极短的时间 内放射出比照射光波长更长的光(如可见光),这种光就
称为荧光。若停止供能,荧光现象立即停止。有些生物体
内的物质受激发光照射后,可直接发出荧光(称为自发荧 光),如叶绿素的火红色荧光。有的生物材料本身不发荧 光,但它吸收荧光染料后同样也能发出荧光(称为间接荧 光),如叶绿体吸附吖啶橙后可发橘红色荧光本实验利用 荧光显微镜对发荧光的叶绿体进行观察。
实验四:叶绿体的分离与荧光 观察
【实验目的】
了解叶绿体分离的一般原理和方法,并熟悉应用 荧光显微镜方法观察叶绿体荧光现象。
【实验原理】
叶绿体是植物细胞中较大的一种细胞器,能发生 特有的能量转换。利用低速离心机可以分离叶绿 体,其分离在等渗溶液(0.35mol/L氯化钠或 0.4mol/L蔗糖溶液)中进行,目的是为了防止渗 透压的改变引起叶绿体的损伤。将匀浆液在 1000r/min离心,去除其中的组织残渣和一些未 被破碎的完整细胞,然后,3000r/min离心,可 获得沉淀的叶绿体(混有部分细胞核)。在室温 下进行分离要迅速。
【仪器、材料与试剂】
仪器:普通离心机,组织捣碎机,天平,荧光显微镜,显微 镜,载玻片,盖玻片,镊子,接种针,目镜测微尺,物镜测 微尺,恒温箱,培养皿,滤纸,试管,试管架,移液管,滴 管,烧杯,无荧光载片,盖玻片,离心管。 材料:菠菜叶片
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二叶绿体的分离与荧光观察
一、实验目的
了解叶绿体分离的一般原理和方法,并熟悉应用荧光显微镜方法观察叶绿体荧光现象。
二、实验原理
1、叶绿体的分离应在等渗溶液L氯化钠或L蔗糖溶液)中进行,以免渗透压
的改变使叶绿体受到损伤。
利用差速离心法将匀浆液离心,从而使叶绿体得到分离。
分离过程最好在0~5℃的条件下进行;如果在室温下,要迅速分离和观察。
2、有些生物体内的物质受激发光照射后直接发出荧光,称为自发荧光(或直
接荧光),如叶绿素的火红色荧光和木质素的黄色荧光等。
有的生物材料本身不发荧光,但它吸收荧光染料后同样也能发出荧光,这种荧光称为次生荧光(或间接荧光),如叶绿体吸附吖啶橙后可发桔红色荧光。
本实验利用荧光显微镜对叶绿体的荧光进行观察。
三、实验步骤
1.选取新鲜的嫩白菜叶片,洗净擦干后去除叶梗和粗脉,撕成小碎块,称
3g放于玻璃研钵中,加入LNaCl溶液,匀浆3~ 5min。
2.匀浆液用2层尼龙布过滤于50ml烧杯中。
3.将滤液平分到2个离心管中,天平配平,1000r/min下离心2min。
弃去沉
淀。
4.将上清液在3000r/min下离心5min。
弃去上清,沉淀即为叶绿体。
5.将沉淀用LNaCl溶液悬浮,做两张临时装片:①取一滴叶绿体悬液滴于
载片上,加盖片观察;②取一滴叶绿体悬液滴于载片上,再滴加1-2滴%吖啶橙荧光染料,加盖片观察:
①在普通光镜下观察;
②在荧光显微镜下观察:先用明视野(白炽光灯下)和用低倍镜头观察,
找到适当的标本后,再转高倍镜头,并将白炽光灯转换成以汞灯激发光
作光源,用暗视野观察。
6.撕取白菜叶片下表皮一小片置于滴有清水的载片上,盖上盖玻片,在普通
光镜下观察气孔的形状,保卫细胞里面的叶绿体;随后转置荧光显微镜下观察。
四、结果与分析
参考文献
《细胞生物学实验》李玲李雪峰着湖南科学技术出版社百度文库《叶绿体的分离与荧光观察》。
