手性药物的拆分高效液相色谱HPLC
液相色谱法分离手性药物

第一讲手性分离色谱手性药物常用的色谱分离方法有:高效液相色谱、气相色谱、毛细管电泳、超临界流体色谱。
手性药物给人类曾经带来过空前的灾难——反应停事件。
概念手性:指一种化合物分子由于其三维空间结构的原因所显示出的相互不能重合,但互为镜像关系,它形象的比喻为人的左右手,这叫手性。
对映体: 由于手性中心连接的四个基团在空间三维排列的不同,对偏振光产生的旋转方向不同,从而产生不能重叠的互为镜像的光学异构体,称对映体。
旋光性:手性药物对映体之间对偏振光的偏转程度相同,但偏转方向相反,即旋光性。
右旋体:能使偏振光按顺时针方向旋转的对映体称为右旋体以d-或(+)-表示。
左旋体:按逆时针方向旋转者称为左旋体以l-或(-)-表示。
外消旋体:等量的左旋体和右旋体构成外消旋体,没有旋光性,以(dl)或(±)表示。
内消旋体:分子中含有手性碳原子,但作为分子整体来说是非手性的。
内消旋化合物是纯净物。
外消旋体与内消旋体的共同之处是:二者均无旋光性。
外消旋体:是混合物,可拆分出一对对映体。
内消旋体:是化合物,不能拆分。
手性药物:是指由具有药理活性的手性化合物组成的药物。
手性药物的表示方法1.dl-或(±)-表示能使偏振光的偏振面按顺时针方向旋转的对映体称为右旋体(dextrotatory),在药名前用d-或(+)-表示;反之,称为左旋体(levorotatory),在药名前加l-或(-)-表示。
外消旋体(racemate)则是由等量的左旋体和右旋体构成,没有旋光性,在其药名前用dl-或(±)-表示。
2. D/L标记法(相对构型)1951年前,人们还无法确定化合物的绝对构型。
费歇尔(Fischer)人为地选定(D)-甘油醛为标准物,以标准参照物来确定药物的立体化学构型,相对构型。
由于D/L构型表示法它只适用与甘油醛结构类似的化合物,对多个手性碳的化合物使用不方便。
与表示旋光方向的d和l容易混淆,目前多限于糖和氨基酸的立体化学命名。
手性药物的分离在色谱法中的应用

手性药物的分离在色谱法中的应用
手性药物是指具有手性结构的药物分子,即能够存在两种非重叠的立体异构体,分别为左旋体和右旋体。
左旋体和右旋体的生物学活性、药理学效应以及代谢动力学等方面可能存在显著差异。
对手性药物的分离具有重要的意义。
色谱法是一种常用的分离手性药物的方法,可通过多种不同的基质和条件实现手性药物的分离。
色谱法是通过样品在固定或移动相上的分配和传递行为实现分离的方法。
常见的色谱法包括高效液相色谱法(HPLC)、气相色谱法(GC)和超高效液相色谱法(UPLC)等。
高效液相色谱法(HPLC)是一种广泛应用于药物分析的方法。
在手性药物的分离中,HPLC常用的手性担子包括α-酮基-β-环糊精、β-环糊精、碘化环糊精等。
这些手性担子能够与手性药物形成包合物,从而实现手性药物的选择性分离。
还可以通过改变流动相的组成、pH值和温度等条件来调节手性药物与手性担子之间的相互作用,进一步优化分离效果。
HPLC分离后的手性药物可以通过光学旋光仪进行旋光度测定,以确定药物的手性纯度和相对含量。
手性药物的拆分

*
COOH
COOH
COOH
酶
H2N CH3
H
+H
CH3
NHCOCH3
消旋丙氨酸
NH2
消旋乙酰丙氨酸
NHCOCH3
L-丙氨酸(溶于乙醇)D-乙酰丙氨酸 (不溶于乙醇)
三.色谱法
1. 高效液相色谱法(HPLC)
HPLC法包括直接法和间接法 直接法的分离原理:手性药物对映体之 一与手性固定相或手性流动相之间发生 分子间的三点作用,同时另一对映异构体 则发生两点作用,形成暂时的非对映异构 体的结合物质,前者较后者稳定,通过洗 脱使两对映异构体分离
优先结晶法是一种高效、简单而又快捷 的拆分方法,晶种的加入造成2个对映异 构体具有不同的结晶速率是该动态过程 控制的关键。 利用循环优先结晶方法进行拆分的实例: 抗高血压药物L-甲基多巴的拆分[5],见 图(三)。
HO HO H3C COOH NH2
图(三)L-甲基多巴
1.3 逆向结晶法
在外消旋体的饱和溶液中加入可溶性某 一种构型的异构体(如R-异构体),添 加的(R)-异构体就会吸附到外消旋溶 液中的同种构型异构体结晶的表面,从 而抑制了这种构造体结晶的继续生长, 而溶液中的(S)-异构体结晶速度就会 加快,从而形成结晶析出。
奥沙西泮新戊酸酯
2.气相色谱法(GC)
在气相色谱仪中选择适当的吸附剂作固 定相(通常是手性固定相),使之选择性地 吸附外消旋体中的一种异构体,可以快速 分离手性化合物。 手性化合物的直接气相色谱分离,其关键 问题是必须找到一个合适的手性固定相, 如高聚物固定相、均三氮苯型固定相、 菊酰胺型固定相、光学活性金属络合物 固定相等。
手性药物的拆分
手性药物的拆分——高效液相色谱(HPLC)
其它类型的旋光性聚合物CSPs还包含旋光性聚酰 胺、聚氨酯类、含有轴手性联萘基的旋光性聚合物、 (+)-聚-N-二苯甲基马来酰亚胺等。
2.手性拆分实例
2.1 高效液相色谱手性固定相法分离酸性化合物对 映体
手性柱 涂敷型CDMPC(20 nm, 300 mm×4.0 mm) Pirkl(S,S)WhelkO1(12mm,250mm×4.0mm )
1.4 多模式环糊精固定相
环糊精衍生化固定相既可以用于反相分离又可以用于正相分 离,因而称为多模式手性固定相。手性识别作用既有包容络 合,又有π-π电荷转移,氢键和立体排斥相互作用等多种作 用,应用范围广泛。
制备过程有四个步骤:
(1)硅胶上键合N-(2-氨乙基-3-氨丙基)基团 (2)用对甲苯磺酰氯专一性的磺化环糊精的羟基 ( 3)2-氨乙基-3-氨丙基键合硅胶与甲苯磺酰氯-β-环糊精反应;通
淀粉手性固定相的制备方法与纤维素手性固定相相似,首先 用淀粉与相应的有机化合物,如苯甲酰氯,苯基异氰酸酯等 反应,得到淀粉衍生物,再将这种衍生物涂敷在氨丙基键合 硅胶上,便可以得到淀粉类手性固定相。
1.3 环糊精手性固定相
OH
HO O OHOHO
OHO OH O
HO
OH
OOH
O
OH
O
HO
OH
+
SiO2
O O Si O
CH2CH2CH2NHCOCH2CH2CONHCH2CH2NH
3.碳氧键连接 醚基键合相与环糊精反应,:
O
SiO2
O
HO
O Si
+ (CH2)3oCH2CHCH2
O
SiO2
O O Si O
手性药物的分离在色谱法中的应用

手性药物的分离在色谱法中的应用手性药物是指具有手性结构的药物。
它们可以分为左旋和右旋两种类型,两者化学性质相同,但左右旋异构体对生物系统的影响却截然不同,这种现象被称为手性诱导失活效应。
因此,在制药过程中需要对手性药物进行分离,以确保药效和安全性。
色谱法是分离手性化合物的主要方法之一,其基本原理是利用不同化合物的物理、化学性质差异,通过分离柱将混合物中的目标物分离出来。
以下是一些色谱法在手性药物分离中的应用。
手性高效液相色谱法(HPLC)手性HPLC是目前最常用于手性药物分离的方法之一,它是利用手性固定相在悬浊液中对手性化合物进行分离。
具有手性结构的固定相与目标分子相互作用,从而实现分离。
手性HPLC可以分别采用手性固定相或手性混合物来进行分离。
此外,在手性HPLC中,主要可以采用簇列技术或化学反应转化手性方法来提高分离效率和选择性。
毛细管电泳(CE)毛细管电泳是一种基于电化学原理的分离技术,它利用电场将样品中的分子分离。
在毛细管电泳中,可以采用手性高分辨涂层来进行手性药物的分离。
在此基础上,还可以采用手性化合物作为毛细管填充剂,进一步提高分离效率和分离度。
气相色谱法(GC)气相色谱法是一种利用气体作为流动相的色谱法。
在处理手性药物时,通常需要使用手性柱和手性混合物。
与HPLC不同,该方法的分离依赖于分子间的“挤压”力。
因此,手性柱具有不同的式样,以保证灵敏度和选择性。
超临界流体色谱法(SFC)SFC是一种介于HPLC和GC之间的色谱法。
它使用超临界流体作为移动相,可以在温度和压力条件下实现高效率的手性药物分离。
通常使用手性柱和手性对映异构体混合物进行分离。
此外,还可以应用具有特定分子功能的催化剂来提高分离效率。
总之,手性药物分离是一项非常复杂的任务,需要使用不同的色谱技术和方法来实现。
无论是HPLC、CE、GC还是SFC,它们都有各自的优缺点和适用范围,因此在选择分离方法时需要综合考虑样品特性,实验设备和分离效率与成本等因素。
分子印迹手性拆分详解

例:反相 HPLC 法, 直接进样生物样品来评价新型限进 CSP—poly-CD-RAM, 结果显示, 样品中的蛋白质先被洗脱, 对检测无干扰,同时将其直接注入人血 浆和牛奶中其中进行HPLC分析可以得到的几种手性药物和农药均能够在 poly- CD-RAM 上实现手性拆分。
五、高效液相色谱手性流动相添加剂法分离手性药物 1、定义:在流动相中添加手性选择剂, 制造手性环境使外消旋 体分离,即手性流动相添加剂(chiral mobile phase additive, CMPA)法。对映体和手性选择剂相互作用形成瞬态非对映体复合 物,两复合物稳定性及其在固定相和流动相之间分配行为的不同 使其在非手性色谱柱从而实现分离的目的。 2、优缺点;CMPA 法拆分对映体不需要柱前衍生化,常规色谱 柱即可分离,成本相对较低且更加灵活,针对不同样品可使用不 同手性添加剂,但是某些手性流动相添加剂不稳定,干扰检测结 果。 3、例:以 β- 环糊精作为手性流动相添加剂,研究佐匹克隆对映体在反相高效
以拆分手性药物酮洛芬为例:采用 4-乙烯基吡啶为功能单体,以二甲 基丙烯酸乙二醇酯为交联剂,引
发剂偶氮二异丁腈(AIBN).在模板
分子(S)-酮洛芬的存在下,制备出 (S)-酮洛芬的分子印迹聚合(MIPs), 并用匀浆法装柱 (250mm×4mm,i.d.).
然后使用V(乙酸)∶V(乙腈)=
1∶9 的溶液洗脱,至无模板分子, 用HPLC进行分析. 色谱条件:流动相为乙腈(含有一定 量乙酸);UV检测,波长258 nm;流
速0.2 mL/min;进样体积10μL;操作
温度19~36℃ 。
(R)-和(S)-酮洛芬在印迹柱上的分离谱图
(S)-酮洛芬在印迹柱上的谱图
空白柱没有拆分能力,而制得的分子印迹聚 合物对酮洛芬的外消旋混合物显示出良好 的手性拆分能力,(S)-酮洛芬的容量因子为
浅谈高效液相色谱(HPLC)在目前手性药物分析领域中的应用
体进行分离。铜和锌等都是常用的配位金属。氨基酸及衍生物、 多巴胺、氧氟沙星等均可用此类方法分离[4]。由于目前为止还未 发现任何一种试剂可以作为通用型试剂,所以在选择手性试剂时 可能会经过多次尝试,选择分离效果最好的手性添加剂。
2.3 手性衍生化试剂法(CDR) 当满足以下条件时可以使用手性衍生化试剂法:①手性化 合物对映体中有氨基、羟基或羧基等基团,其容易发生衍生作 用;②反应产物具有稳定的化学性质,手性试剂具有稳定的手 性性质,以及较高的光学纯度,不易发生变化,不会在色谱条 件下发生消旋化反应[5]。根据手性化合物对映体中有氨基、羟 基或羧基等基团以及分离效率之间的差别,将反应产物进行分 离。胺类试剂、酰化试剂氯甲酸酯类等均是目前常用的衍生化 试剂。因为该类方法是使用普通色谱柱,因此成本较低,分离 的灵敏度较高。
过去常使用酶消化法、分布结晶法等非色谱方法对手性药 物进行拆分,拆分过程耗时、烦琐,具有较大的不可控性,近 年来随着色谱技术的不断发展,在对手性药物进行拆分方面有 了较为广泛的应用[2]。 目前在手性药物进行拆分时较为常用的 方法有气象色谱、毛细管电泳和毛细管色谱以及高效液相色谱 法等,其中高效液相色谱法(HPLC)以其反应速度快、效率 高、准确性强等特点被广泛应用。
究进展[J].药物分析杂志,2015,35(7):1127-1133. [2] 刘丽敏.高效液相色谱在中草药和抗生素类药物分析中的应用
[D].成都:西南大学,2008. [3] 潘永玉.手性药物的对映体分离方法与药物动力学研究[D].沈阳:
沈阳药科大学,2007. [4] 康自华,阳小成,陈婷.高效液相色谱法在药物分析中的应用[J].广
高效液相色谱(HPLC)是一种在近年来被广泛应用的色 谱分析方法,其与传统色谱法相比,具有效率高、灵敏性高和 分析分离速度快等优点。高效液相色谱法原理上可对所有的 热稳定性差、沸点高和相对分子质量大的有机物进行分离和分 析,其不仅可用于对手性药物的定量分析,而且可用于制备分 离,在手性药物分析领域具有较为广泛的应用。
手性药物拆分技术及分析
手性药物拆分技术及分析在药物研究和开发中,手性药物是一个非常重要的领域。
手性药物指的是分子结构中含有手性中心(手性碳原子)的化合物,左旋和右旋两种异构体具有不同的生物活性和体内代谢途径。
因此,正确地分析和分离手性药物对于药物研究和有效性的评估至关重要。
手性药物分析技术主要包括色谱法、光学活性法和核磁共振(NMR)法。
色谱法是一种常用的手性药物分析方法。
它基于手性药物的两种对映异构体在手性固定相上的不同吸附能力进行分离。
常见的色谱法包括高效液相色谱法(HPLC)和毛细管电泳法。
HPLC通常使用手性固定相柱,通过选择性地吸附左旋或右旋手性分子,实现对手性药物的分离。
毛细管电泳是一种高效的手性药物分析方法,基于对映异构体在电场中的迁移速率不同,通过毛细管中背景电解质的浓度和pH值调节来分离手性药物。
光学活性法是一种基于光学活性性质来分析和测定手性药物的方法。
光学活性手性药物由于具有旋光性,可以引起光的偏振方向发生旋转。
常用的光学活性法包括旋光仪法和圆二色光谱法。
旋光仪法是通过测定手性分子对光的旋转角度来判断手性药物的对映异构体的含量和比例。
圆二色光谱法则是测量手性分子对不同波长光的吸收性质,通过对波长的差异来判断手性药物的对映异构体。
核磁共振(NMR)是一种基于核磁共振现象来分析手性药物的方法。
NMR技术通过检测手性碳原子或核自旋的信号来确定手性药物的结构和对映异构体的比例。
通过对样品进行核磁共振实验后,通过解释谱图的峰位和峰形等信息,可以得到手性药物的分析结果。
此外,还有一些其他的手性药物分析方法,如质谱法、X射线衍射法和环光谱法等。
这些方法在手性药物分析中各有优劣,适用于不同类别和性质的手性药物。
总之,手性药物分析技术对于药物研究和评估的重要性不可忽视。
科学家们通过不断研究和发展新的手性分析技术,为新药开发和治疗提供了更可靠和准确的手性药物分析方法。
高效液相色谱法在手性药物拆分中的应用(2021年整理)
高效液相色谱法在手性药物拆分中的应用(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(高效液相色谱法在手性药物拆分中的应用(word版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为高效液相色谱法在手性药物拆分中的应用(word版可编辑修改)的全部内容。
高效液相色谱法在手性药物拆分中的应用摘要:外消旋化合物的手性分离是获得单一对映体的方法之一.随着人们对纯光学药物的需求日益增加,各种手性分离技术得以快速发展。
近几十年来,在这些手性分离技术中,高效液相色谱法( HPLC )被公认为是一种强大、快速、高效的分离技术,它已成功应用于对映体药物的分离分析和制备中。
HPLC用于对手性药物分离的研究已取得很大进展,并且研发了大量可应用于手性小分子和聚合物分离的手性固定相,大大提高HPLC的手性识别能力。
本文以HPLC的手性药物分离为焦点,介绍了近几年高效液相色谱法手性固定相的新发展和应用。
关键词:高效液相色谱法手性药物手性拆分Application of High Performance Liquid Chromatography in Chiral Separation of PharmaceuticalsAbstract:Resolution of racemic compounds is one of the potential ways of obtaining both enantiomers。
The increasing demand for enantiopure drugs has led to the development of a variety of stereoselective separation technologies。
如何应用高效液相色谱法进行手性药物对映异构体拆分
如何应用高效液相色谱法进行手性药物对映异构体拆分对于市场上越来越多对目标物准确定性的要求,而手性产物是其中较为重要的一部分,因此对于手性目标物的检测就显得尤为重要。
一、什么是手性导构和对映异构体?当药物分子中碳原子上连接有4个不相同的基团时,该碳原子被称为不对称碳或手性碳(中心),会导致药物分子存在异构体,如果两个异构体之间的关系如同一个物体的立体结构在照镜子,这个立体结构和它在镜子中的像互为对映异构体(对映体)。
图1是手性对映异构体的图示。
图1 手性对映异构体图示对映体具有相同的物理性质(如熔点,沸点,溶解度,折射率,酸性,密度等),热力学性质(如自由能,焓、熵等)和化学性质。
除非在手性环境(如手性试剂,手性溶剂)中才表现出差异。
对映体对偏振光的作用不同,它们的比旋光度数值相同,但方向相反。
对映体的生物活性不相同,化学反应中表现出等速率。
等量的左旋体与右旋体的混合物构成外消旋体。
从对映体中分离出单纯一个光学异构体的方法称手性拆分。
最普通的手性拆分方法是消旋旋体与光学活性相反的离子(称拆分剂)作用生成非对映体。
手性药物对映体拆分的方法主要有非色谱法和色谱法。
非色谱法(主要包括结晶法、微生物消化法等)耗时长,过程繁琐不能制备高纯度对映体,色谱法是基于把对映体的混合物转换成非对映异构体,然后利用它们在化学或物理性质上的差异进行分离。
主要包括气相色谱(GC)、超临界流体色谱(SFC)、毛细管电泳(CE)和毛细管电色谱(CEC)等。
表1罗列了色谱手性拆分的发展史。
其中高效液相色谱(HPLC)因其独特的优势成为手性分析领域最常用的一种技术。
表1 色谱手性拆分发展史二、HPLC手性拆分方法手性药物拆分法通常分为直接法和间接法两大类。
间接法和直接法的共同特点是均以现代技术为基础并引人不对称中心或光活性分子;不同的是间接法是将其引入分子溶质内,而直接法则是引人分子间。
引人手性环境使对映异构体间呈现物理特征的差异是手性进行光学异构体拆分的基础。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
OH
O
+
O
H
OH
OH
n
NCO
OCONH
H
NHOCO
O
O OCONH
n
? 3.纤维素-三(3,5-二甲基苯基氨基甲酸酯)(CDMPC)
? 商品名为手性OD柱,具有极高的光学拆分能力,是广泛使用的 手性固定相之一。以微晶纤维素与3,5-二甲基苯基异氰酸酯反 应,将生成的纤维素-三(3,5-二甲基苯基氨基甲酸酯)以 15%的量涂敷在氨丙基硅胶上,制得CDMPC-CSP:
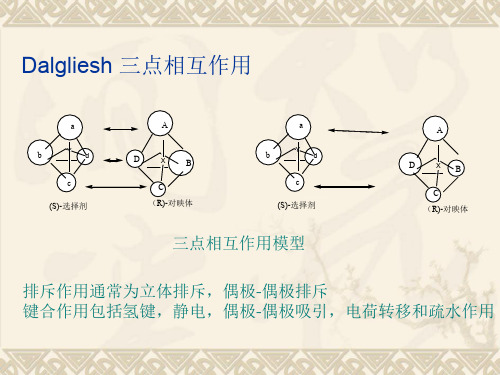
Dalgliesh 三点相互作用
a
b
Y d
c (S)-选择剂
A
D
X
B
C (R)-对映体
a
b
Y d
c (S)-选择剂
三点相互作用模型
A
D
XB
C (R)-对映体
排斥作用通常为立体排斥,偶极-偶极排斥 键合作用包括氢键,静电,偶极-偶极吸引,电荷转移和疏水作用
根据固定相的不同,与对映体之间存在以下几 种作用
OH
H OH
O O
OH n
H3C
+
H3C
NCO
CH 3
OCONH O
CH 3
O
H
OCONH
H3C
NHOCO
n CH3
CH 3
CH 3
1.2 淀粉类手性固定相
? 最基本的有如下 4种。
OCOR
OCONH
R O
O
H
OCONH
NHOCO
n
R
R
直链淀粉
OCOR
O
OH
H
OCOR
n
O
OCOR
O
H
OCOR
直链淀粉
1.3 环糊精手性固定相
OH
HO O OHOHO
OHO OH O
HO
OH
O OH
O
OH O
HO
OH
O OH
O OH
O
OHO OH O OH
HO
?-CD环状构型(俯视图)
环糊精包封药物的立体结构
环糊精分子中每个葡萄糖单元含有5个手性碳原子,如β-CD含有 35个手性碳原子,同时与各种有机分子形成包容配合物,分子 整体上具有光学活性和立体识别能力,是一种理想的手性选择剂
(1)
(OH)2
H3C
SO2Cl
(OTs) 2
(2)
SiO2 O
n(NHR)
H2NR
SiO2 O
β-CD固定相改性过程
n(OTs)
1.5 刷型手性固定相
? 刷型手性固定相( CSP)是通过链烃基将手性有机 小分子链接到硅胶载体上制得,又叫 Pirkle型手性固 定相。
? 刷型手性固定相的合成主要有两种途径,即含端羧 基或异氰酸酯基的手性基团的化合物与氨基键合硅 胶进行缩合反应,分别形成含酰胺型或脲型结构的 手性固定相:
过N-(2-氨乙基-3-氨丙基)键合硅胶上的氨基与环糊精上的甲苯磺 酰基之间发生反应,把环糊精链接到硅胶上 ? (4)环糊精上未反应的甲苯磺酰基与各种改性剂进一步反应,得到 改性的环糊精键合固定相
SiO2
OH
(CH3O)3Si(CH2)3NH(CH2)2NH2 SiO2
O Si(CH2)3NH(CH2)2NH2
O O Si(CH2)nNH2+R*COOH
O O O Si(CH2)nNH2+R*HNCO O
O O Si(CH2)nNHCOR*
O O O Si(CH2)nNHCONHR O
连接到硅胶表面的手性有机物在手性中心附近至少含有一种下列 的功能团: (1)酸性或碱性的芳香基团,在手性识别过程中能发生电荷转移
1.R=H ,直链淀粉 -三(苯基氨基甲酸酯) 2.R=3 ,5-(CH3)2,直链淀粉 -三(3,5,-二甲基苯基氨基甲酸酯) 3.R=C 6H5,直链淀粉 -三(苯基甲酸酯) 4.R=3 ,5-(CH3)C6H5NH,直链淀粉 ——三(3,5-二甲基苯基氨基甲酸酯)
? 淀粉手性固定相的制备方法与纤维素手性固定相相似,首先 用淀粉与相应的有机化合物,如苯甲酰氯,苯基异氰酸酯等 反应,得到淀粉衍生物,再将这种衍生物涂敷在氨丙基键合 硅胶上,便可以得到淀粉类手性固定相。
1.1纤维素衍生物手性固定相
? 1.纤维素-三(苯甲酸酯)( CTB)固定相 ? 由微晶纤维素和苯甲酰氯反应:
OH
O
+
O
H
OH
OH
n
COCl
OCO
H
OCO
O
O OCO
n
将得到的纤维素-(三苯甲酸酯)涂敷在氨丙基硅烷化硅胶上, 便得到CTB固定相
? 2.纤维素-三(苯基氨基甲酸酯)( CTPC)
? 由微晶纤维素与异氰酸苯酯反应,将得到的纤维 素-三(苯基氨基甲酸酯)涂敷在氨基键合的硅胶 上,便得到 CTPC手性固定相 :
CD及衍生化CD化学键合手性固定相键合方式:
? 1.胺键连接 氨丙基硅胶键合相与环糊精反应:
SiO2
O O Si
+ CH2CH2CH2NH2
HO
O
SiO2
O O Si O
CH2CH2CH2NH
? 2.酰胺键连接 羧基化的氨丙基硅胶键合相与乙二胺 环糊精反应:
SiO2
O O Si O
HNH2CH2CNH2
这种键合方式不含氮键,固定相的稳定性好。
1.4 多模式环糊精固定相
? 环糊精衍生化固定相既可以用于反相分离又可以用于正相分 离,因而称为多模式手性固定相。手性识别作用既有包容络 合,又有π-π电荷转移,氢键和立体排斥相互作用等多种作 用,应用范围广泛。
? 制备过程有四个步骤:
? (1)硅胶上键合N-(2-氨乙基-3-氨丙基)基团 ? (2)用对甲苯磺酰氯专一性的磺化环糊精的羟基 ? ( 3)2-氨乙基-3-氨丙基键合硅胶与甲苯磺酰氯-β-环糊精反应;通
相互作用; (2)能形成氢键的原子或基团; (3)能发生偶极-偶极叠合相互作用的极性键或基团; (4)能提供立体排斥,范德华相互作用构型控制的非极性基团。
? 交互作用原理是对“刷型”手性固定相设计有重要指导意义 的原则,即如果一个固定性的化合物A的对映体之一能对另 一化合物B的对映体进行拆分的话,那么反之亦然。
? (1)过渡金属离子的手性配位作用 ? (2)π-π电荷转印相互作用 ? (3)包结络合作用 ? (4)氢键相互作用 ? (5)立体契合作用
1 手性固定相
? 第一类包括低聚糖,多糖及其衍生物,聚丙烯酰胺, 聚丙烯酸酯等
? a,纯有机聚合物 ? b,聚合物涂覆在无机载体上 ? c,接枝聚合物
? 第二类是把光学活性分子通过离子键或共价键连接 到硅胶载体表面,应用的光学活性物质有氨基酸衍 生物,冠醚,金鸡纳生物碱,糖类,胺类,酒石酸 衍生物,环糊精和联二萘酚等
CH2CH2CH2NHCOCH2CH2COOH
+
SiO2
O O Si O
CH2CH2CH2NHCOCH2CH2CONHCH2CH2NH
? 3.碳氧键连接 醚基键合相与环糊精反应,:
O
SiO2
O
HO
O Si
(CH2)3oCH 2CHCH 2
+
O
SiO 2
O O Si O
CH 2CH2CH2OCH 2CHOHCH 2O
