第五章-精细有机化工工艺
第五章 精细有机化工工艺

项目 磺化剂 沸点,℃ 磺化速度 磺化转化率 磺化热效应 磺化物粘度 副反应 产生废酸量 反应器容积
H2SO4 290~317
慢 达到平衡,不完全
需加热 低 少 大 大
ClSO3H 151~150
较快 较完全
一般 一般 少 较少 大
SO3•H2SO4
较快 较完全
一般 一般 少 较少 一般
SO3 46 瞬间完成 定量转化 放热量大,需冷却 十分粘稠 多,有时很高 无 很小
十二烷基苯磺酸钠是合成洗涤剂工业中产量最大, 用途最广的阴 离子表面活性剂
反应原理
C12H25
SO3
空气
C12H25
SO3H
该反应属于气液非均相反应, 化学反应速度很快, 几乎在瞬间完成, 且 放出大量的热, 因此, 工业上用干燥的空气将三氧化硫稀释至浓度为47%。
➢ 磺化反应器
➢磺化工艺
§ 5.3 硝化
• 硝酸(HNO3) • 混合酸: (HNO3-H2SO4-H2O) • 硝酸与乙酸酐混合物(HNO3-(CH3CO)2O) • 有机硝酸酯(C2H5CO-ONO2) • 含氮氧化物(N2O5)
4.硝化反应的特点
• 反应不可逆 • 反应速度快, 无需高温 • 放热量大, 需要及时移除反应热 • 多数为非均相反应, 需要加强传质
九八酸(98%) 九二酸(92~93%)
20~25% 三氧化硫(SO3) 60~65%
发烟硫酸(SO3•H2SO4)
氯磺酸(ClSO3H)
其它: 氨基磺酸(NH2SO3H)、亚硫酸盐(Na2SO3)
二、磺化反应的基本原理
➢ 磺化反应是亲电取代反应。一般认为是按二步反应进行的。
➢ 三氧化硫和HSO3+阳离子被认为是真正的磺化剂:
《精细有机合成及工艺》思考题
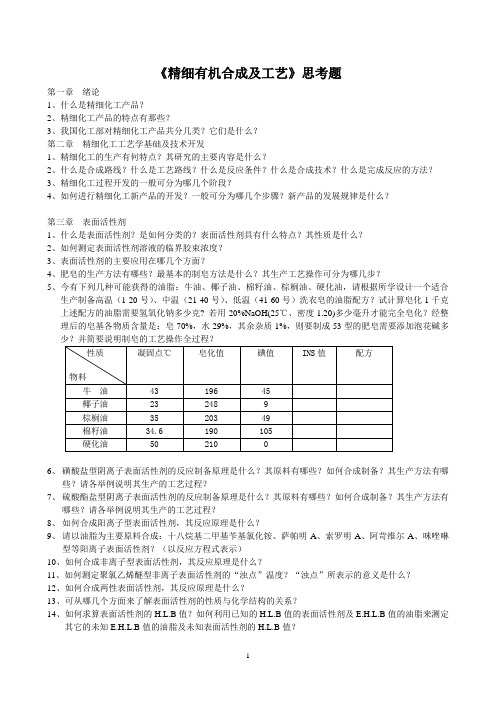
《精细有机合成及工艺》思考题第一章绪论1、什么是精细化工产品?2、精细化工产品的特点有那些?3、我国化工部对精细化工产品共分几类?它们是什么?第二章精细化工工艺学基础及技术开发1、精细化工的生产有何特点?其研究的主要内容是什么?2、什么是合成路线?什么是工艺路线?什么是反应条件?什么是合成技术?什么是完成反应的方法?3、精细化工过程开发的一般可分为哪几个阶段?4、如何进行精细化工新产品的开发?一般可分为哪几个步骤?新产品的发展规律是什么?第三章表面活性剂1、什么是表面活性剂?是如何分类的?表面活性剂具有什么特点?其性质是什么?2、如何测定表面活性剂溶液的临界胶束浓度?3、表面活性剂的主要应用在哪几个方面?4、肥皂的生产方法有哪些?最基本的制皂方法是什么?其生产工艺操作可分为哪几步?5、今有下列几种可能获得的油脂:牛油、椰子油、棉籽油、棕榈油、硬化油,请根据所学设计一个适合生产制备高温(1-20号)、中温(21-40号)、低温(41-60号)洗衣皂的油脂配方?试计算皂化1千克上述配方的油脂需要氢氧化钠多少克? 若用20%NaOH(25℃、密度1.20)多少毫升才能完全皂化?经整理后的皂基各物质含量是:皂70%,水29%,其余杂质1%,则要制成53型的肥皂需要添加泡花碱多6、磺酸盐型阴离子表面活性剂的反应制备原理是什么?其原料有哪些?如何合成制备?其生产方法有哪些?请各举例说明其生产的工艺过程?7、硫酸酯盐型阴离子表面活性剂的反应制备原理是什么?其原料有哪些?如何合成制备?其生产方法有哪些?请各举例说明其生产的工艺过程?8、如何合成阳离子型表面活性剂,其反应原理是什么?9、请以油脂为主要原料合成:十八烷基二甲基苄基氯化铵、萨帕明A、索罗明A、阿苛维尔A、咪唑啉型等阳离子表面活性剂?(以反应方程式表示)10、如何合成非离子型表面活性剂,其反应原理是什么?11、如何测定聚氯乙烯醚型非离子表面活性剂的“浊点”温度?“浊点”所表示的意义是什么?12、如何合成两性表面活性剂,其反应原理是什么?13、可从哪几个方面来了解表面活性剂的性质与化学结构的关系?14、如何求算表面活性剂的H.L.B值?如何利用已知的H.L.B值的表面活性剂及E.H.L.B值的油脂来测定其它的未知E.H.L.B值的油脂及未知表面活性剂的H.L.B值?15、7%的Tween—60(14.9)和Arace—60(2.1)来乳化31.1%的矿物油(E.H.L.B值10.5)及17.5%的硬化油(10)试求出乳化剂的使用比例。
精细有机合成化学及工艺学

羰基可与亲核试剂发生缩合反应,生成醇、醚或酯类化合物;也可与亲电试剂发生加成反 应,生成烯烃或卤代烃类化合物。
羰基的α-卤代与α-氨基化
在羰基α位引入卤素或氨基,可生成α-卤代酮或α-氨基酮类化合物。常用的卤化剂有卤素、 N-卤代酰胺等,氨基化试剂有氨、胺类化合物等。
氨基官能团转化与合成策略
其他领域
此外,精细有机合成还在染料、香料、 涂料、食品添加剂等领域有着广泛的 应用。
02
基本原理与方法
有机合成反应类型及机理
亲电取代反应
亲电试剂进攻有机分子中的电 子云密度较大的部位,发生取 代反应。
消除反应
有机化合物在特定条件下失去 小分子,形成不饱和键。
亲核取代反应
涉及亲核试剂对有机化合物中 的离去基团进行攻击,形成新 的化学键。
大环化合物合成技术
01
线性合成策略
通过逐步增长碳链的方法合成大环化合物,如酰胺化、酯化等缩合反应
构建大环。
02
模板合成法
利用模板效应控制分子内成环反应,实现大环化合物的合成,如分子内
Diels-Alder反应、分子内Michael加成等。
03
片段连接法
将预先制备好的片段通过高效连接反应组合成大环化合物,如Suzuki偶
初始阶段
早期的有机合成主要依赖于天然产物的提取和分离,合成方法相对 简单。
发展阶段
随着有机化学理论的不断发展和合成方法的不断创新,精细有机合 成逐渐成为一个独立的学科领域。
成熟阶段
现代精细有机合成已经发展成为一个高度成熟的领域,合成方法和技 术不断更新和完善,能够合成出各种复杂结构和功能的有机化合物。
未来研究方向和挑战
复杂天然产物的全合成
精细化工 第五章 硝化反应

1
5.1 5.2 5.3 5.4 5.5 5.6 5.7 5.8 5.9
概述 硝化反应历程 混酸硝化 硫酸介质中的硝化 有机溶剂-混酸硝化 在乙酐或乙酸中的硝化 稀硝酸硝化 臵换硝化 亚硝化
2
5.1
概述
一、定义
向有机物分子的碳原子上引入硝基生成C-NO2键的反 应称硝化反应。 Ar-H + HO-NO2 →Ar-NO2 + H2O 硝化反应是最普遍,最早的有机反应之一1834年 在脂肪族碳原子上的硝化反应,因难于控制,工业 上很少应用。芳族硝化反应像磺化反应一样是非常 重要的一类化学过程,其应用十分广泛。
21
例如:在采用多锅串联法对甲苯进行混酸 硝化时在第一硝化锅中,酸相中的硝酸浓 度较大,硫酸浓度也较高,反应受传质控 制。
而在第二锅中,由于酸度降低和硝酸含量 减少,反应速率将转变为受动力学控制, 即受化学反应速度控制。
22
二、混酸的硝化能力 对于每个具体硝化过程用的混酸都要求具有适当的 硝化能力。 硝化能力太强,虽然反应快,但容易产生多硝化副 反应; 硝化能力太弱,反应缓慢,甚至硝化不完全。 工业上通常利用硫酸脱水值(D.V.S)和废酸计算浓 度(F.N.A)来表示混酸的硝化能力。 混酸的硝化能力,只适用于混酸硝化,不适用于在 浓硫酸介质中的硝化。
时所用的硝酸约过量10~65%。
5、臵换硝化
11
5.2
硝化反应历程
一、硝化剂的活性质点
已经证实,多数硝化剂参加硝化反应的活性质点 为硝基阳离子。
HNO3 2H2 SO4 NO2 H3O 2HSO4
精细化工工艺学—第五章食品添加剂

• 中和、脱色、过滤 • 干燥
2020/5/14
苯甲酸钠生产流程
2020/5/14
5.1.2 山梨酸及盐
• 化学结构式(2,4-己二烯酸):
CH3CH=CHCH=COOH
• 生产方法(丁烯醛和丙二酸法):
2020/5/14
生产工艺流程
2020/5/14
5.1.3 其它防腐剂
2020/5/14
2020/5/14
谷氨酸生产方法
• 谷氨酸发酵的原料处理及培养基:
– 淀粉和糊精先水解成葡萄糖;
• 经发酵将葡萄糖转变成谷氨酸:
2C6H12O6+2NH3+3O2→C5H9O4N+2CO2+6H2O
– 氮源:
• 硫酸铵、氯化铵、氨水、尿素、液氮等
• 谷氨酸的提取、脱色 • 浓缩和结晶
• 面粉处理剂:
– 漂白、增加弹性Байду номын сангаас蓬松、发泡等。
• 品质改良剂:减少肉类加工过程原汁的 流失,防止鱼类冷藏过程蛋白质的变性 ,主要以磷酸盐为主。(P179 表5-3)
2020/5/14
课堂作业
• 什么是食品添加剂?其作用有哪些? • 对食品添加剂有哪些基本要求? • 举例说明食品的腐烂变质与防腐机理。 • 常用的调味剂有哪几类? • 天然色素和合成色素各有何特点? • 说明苯甲酸钠生产工艺中物料(如甲苯、空气
• 对羟基苯甲酸酯;(P144图5-2)
• 丙酸及其盐(P145 图5-3) CH2=CH2+CO+H2→ CH3CH2 CHO→ → CH3CH 2COOH
2020/5/14
影响因素
• PH值; • 食品污染程度; • 防腐剂在食品中的分散状态; • 加热; • 多种防腐剂共用
精细有机合成化学及工艺学

精细有机合成化学及工艺学1. 精细有机合成化学有机合成化学是化学的一个分支领域,主要是研究有机物的合成方法、合成反应机理、合成原料等。
而精细有机合成化学则是有机合成化学的一个重要分支,它研究的是更加复杂的有机分子的合成方法以及高效的制备技术。
1.1 精细有机合成化学的概念精细有机合成化学指的是合成更加复杂的有机化合物的方法,例如生物活性分子、药物分子、天然产物等。
它不仅需要充分了解化学反应的机理,还需要考虑反应的条件、催化剂的选择以及中间体的稳定性等因素,从而使得反应具有高效、高收率、高纯度等特点。
1.2 精细有机合成化学的原则在精细有机合成化学中,以下原则是非常重要的:•合成路线的选择。
在合成复杂有机分子的过程中,由于反应底物的复杂性和特殊性,合成路线的选择是非常重要的。
需要进行多次的尝试和改进,找到最优的合成路线。
•反应条件的优化。
精细有机合成化学涉及到多个反应步骤,需要对反应条件进行优化,例如温度、压力、溶剂的选择等,以保证反应的效率和产率。
•保护基团的选择。
在有机化合物合成中,由于末端基团的敏感性,需要采用保护基团以防止它们在反应过程中受到损伤或者分解。
•催化剂的选择和使用。
精细有机合成化学中催化剂的选择和使用非常重要,可以大大提高反应的效率和速率,以及降低反应的温度和压力等。
2. 精细有机合成工艺学精细有机合成工艺学是精细有机合成化学的实践应用,主要研究有机化合物的制备工艺,包括生产过程的设计、合成路线的开发、分离和纯化技术等,以实现工业化大规模生产。
2.1 精细有机合成工艺学的应用领域精细有机合成工艺学广泛应用于生产中,包括制药、农药、色素、涂料、环保材料等领域。
•制药领域。
精细有机合成工艺学在药物合成中亦有突出作用。
现代药物的设计和化学合成往往需要使用多步、多中间体和多催化剂等工艺,因此精细有机合成工艺学在药物生产中显得格外重要。
•农药领域。
在农药的研发和生产中,精细有机合成工艺学也扮演了重要角色。
化工工艺学-第五章思考题答案
化⼯⼯艺学-第五章思考题答案第五章课后习题1.⾼分⼦材料的熔融指数如何测定?其数均分⼦量、重均分⼦量、粘均分⼦量如何定义?答:熔融指数:测定将聚⼄烯树脂放⼊标准的塑性计中加热到190℃熔融后,在承受2160g 的负荷下,l0min内通过2.09mm孔径⽽挤压出来的树脂重量克数数均分⼦量:聚合物是由化学组成相同⽽聚合度不等的同系混合物组成,数均分⼦量是按分⼦数⽬统计的平均分⼦数,符号为MN(Molecular Number)。
重均分⼦量:Weight-average Molecular Weight,合成的⾼分⼦以及多数的天然⾼分⼦都是具有不同分⼦量的同系物的混合物,因此分⼦量不是均⼀的。
重均分⼦量就是按分⼦重量统计的平均分⼦量。
粘均分⼦量:聚合物是由化学组成相同⽽聚合度不等的同系混合物组成,粘均分⼦量是按分⼦粘度统计的平均分⼦数2.⾼压法低密度聚⼄烯的合成反应器类型、温度、压⼒条件如何?单程转化率⼤约是多少?⽣产过程主要分哪⼏个阶段?答:反应器类型:聚合反应器压⼒:压⼒在122~303MPa或更⾼温度:聚合反应温度在130~350℃单程转化率:⼤约是为15~30%⽣产过程主要分3⼏个阶段:聚合阶段:压⼒为3.0~3.3MPa的新鲜⼄烯,压缩⾄25MPa,再⼆次压缩⾄反应压⼒(200~300MPa),冷却后进⼊聚合反应器。
引发剂由⾼压泵送⼊⼄烯进料⼝或直接注⼊聚合反应器分离过程:反应物料冷却后进⼊⾼压分离器,减压⾄25MPa,未反应的⼄烯分离出来返回⼆次压缩机再⽤,聚⼄烯则进⼊低压分离器,减压到0.1MPa以下,使残存的⼄烯进⼀步分离出来⼲燥过程:聚⼄烯树脂在低压分离器中与抗氧化剂等添加剂混合后挤出切粒,得到粒状聚⼄烯,然后被⽔送往脱⽔振动筛,脱去⽔分后进⼊离⼼⼲燥器,脱除表⾯附着的⽔分,再经振动筛分除不合格的粒料,成品由⽓流输送⾄计量设备计量,成为⼀次成品3.线性低密度聚⼄烯的分⼦结构有哪些特点?答:线型低密度聚⼄烯是⼄烯与α-烯烃的共聚物,分⼦呈线性结构,密度0.91-0.94,与LDPE类似4.淤浆法环式反应器聚⼄烯流程的反应温度、压⼒、介质有何特点?反应温度和压⼒是否有联系?答:温度:55~75℃压⼒:1.5~3MPa 介质:⽤较轻的异丁烷作介质温度越⾼,所需的压⼒,⽐较⼤5.中压溶液法聚⼄烯流程的反应温度、压⼒、介质有何特点?反应温度和压⼒是否有联系?为什么需要⼀个全混反应器串联⼀个管式反应器答:反应温度、压⼒:较⾼温度(200℃)和较⾼压⼒(10MPa)下聚合介质:在烃类溶剂(异联系:反应在不同的温度下,需要不同的反应压⼒,中压法⼄烯在较⾼温度(200℃)和较⾼压⼒(10MPa)下聚合低压法⼄烯在较低温度(<100℃)和较低压⼒(2MPa)下聚合,低压冷却法反应压⼒和温度与低压法类似,原因:聚⼄烯溶液由第⼀级反应器后进⼊管式反应器进⼀步聚合,达到聚合物浓度约为10%。
精细有机化工单元反应及工艺学基础PPT课件
制定应急预案并进行演练,提高应对 突发事件的快速反应和处置能力,减 少事故损失。
环境保护措施
废气、废水、废渣处理
节能减排技术
对生产过程中产生的废气、废水、废渣进 行妥善处理,确保达标排放,减少对环境 的污染。
采用先进的节能减排技术,降低生产过程 中的能源消耗和污染物排放量。
环境监测与报告
精细有机化工单元反应及工艺学基 础ppt课件
目录
• 引言 • 精细有机化工单元反应 • 精细有机化工工艺学基础 • 精细有机化工工艺流程设计 • 精细有机化工生产安全与环保 • 案例分析
01 引言
课程背景
精细有机化工是化学工业的重要组成部分,涉及医药、农药、染料、香料 等众多领域,对国民经济和社会发展具有重要意义。
随着科技的进步和市场需求的变化,精细有机化工行业对人才的需求日益 增加,对从业人员的专业素质和技能水平要求也越来越高。
为了满足行业对高素质人才的需求,提高从业人员的专业素质和技能水平, 本课程应运而生。
课程目标
掌握精细有机化工单元反应的 基本原理、工艺流程及操作要
点。
熟悉常见精细有机化合物的合 成方法、生产工艺及质量控制
工艺流程设计原则
安全可靠
确保工艺流程在生产过程中的 安全性和可靠性,采取必要的 安全措施和设备,降低事故风
险。
经济合理
在满足产品需求的前提下,优 化工艺流程,降低生产成本, 提高经济效益。
技术先进
采用先进的生产技术和设备, 提高生产效率和产品质量,同 时考虑技术的可行性和稳定性 。
环保节能
减少工艺流程对环境的污染和 能源的消耗,采用环保节能技 术和设备,实现可持续发展。
工艺流程图绘制
精细有机合成单元反应 与合成设计 第五章
OH 6 CONH Ar + 6 NaCl + Na2HPO3 + NaH2PO3
石河子大学化学化工学院
5.1.3 用羧酸酐的N-酰化
R`NH2 + (RCO)2O R`NHCOR + RCOOH
反应时没有水生成,因此是不可逆的。酸酐的酰 化活性较羧酸为强,除了用于酰化脂肪族或芳香族伯 胺外,还能用于较难酰化的胺。如仲胺、以及芳环上 含有吸电子基团的芳胺类。最常用的酸酐是乙酐。
石河子大学化学化工学院
5.1.7 酰基的水解
RNHCOR` + H2O RNH2 + R`COOH
酰基的水解稳定性: PhCO- > CH3CO- > HCO-
石河子大学化学化工学院
5.2 C-酰化反应
C-酰化是在芳环上引入酰基,制备芳
酮或芳醛的反应过程,它是以酰卤或酸酐
为酰化剂,对芳环进行亲电取代的反应, 属于F-C反应中的重要一类。
石河子大学化学化工学院
5.2.2.3 催化剂 路易斯酸,AlBr3催化活性较好。但最常用的强
催化剂是无水三氯化铝。它的优点是价廉易得,催
基时,反应活性增加,反之,有吸电子基团时,
反应活性下降。
石河子大学化学化工学院
酰化反应活性大小: 羧酸 < 酸酐 < 酰氯
芳香族酰氯的反应活性较脂肪族酰氯为低。
石河子大学化学化工学院
5.1.2 用羧酸的酰化
R`NH2 + RCOOH R`NHCOR + H2O
由于羧酸的酰化能力较弱,一般只适用于碱性 较强的胺类进行酰化。为了平衡向右移,通常取过
石河子大学化学化工学院
5.2.1 C-酰化反应历程
精细化工工艺学(5香料)
5.2.2.2植物性天然香料的产品类型 5.2.2.2植物性天然香料的产品类型
依据提取方法不同,天然香料可以分为七类产品: 依据提取方法不同,天然香料可以分为七类产品: 1、浸膏(concrete ) 浸膏( 浸膏 植物的花、茎、叶、根等用烃类溶剂萃取,减压蒸去溶剂, 得到含有植物腊的半固体。 浸膏的主要成分:香精油、腊质、色素。 主要用途:不直接用于调香,需要加工成净油。
3
(3)单离香料 ) 使用物理或化学的方法从天然香料中分离出来的单体香料 化合物。 化合物。 例如,在薄荷油中含有 左右的薄荷醇, 例如,在薄荷油中含有70~80%左右的薄荷醇,用重结 左右的薄荷醇 晶的方法从薄荷油中分离出来的薄荷醇就是单离香料,俗称薄 晶的方法从薄荷油中分离出来的薄荷醇就是单离香料, 荷脑。 荷脑。 由于从天然精油分离出来的单离香料, 由于从天然精油分离出来的单离香料,绝大多数用有机合成 的方法可合成出来,因此,单离香料与合成香料, 的方法可合成出来,因此,单离香料与合成香料,除来源不同 外,并无结构上的本质区别。 并无结构上的本质区别。
6
5.2
天然香料
5.2.1动物性天然香料 5.2.1动物性天然香料
动物的分泌物或排泄物。动物性天然香料 有十几种,能够形成商品和经常应用的只有 麝香、灵猫香、海狸香、 麝香、灵猫香、海狸香、龙涎香 4种被视为香料中的珍品 通常与酒精配成酊剂使用
7
麝香( (1) 麝香(Musk) )
雄麝鹿生殖腺的分泌物 麝鹿主要栖息于中国的云南、青海、新疆及东北各省, 印度北部,中亚高原,蒙古及西伯利亚南部等地;10岁的麝 鹿,每只可采50克麝香。 麝鹿香囊中的麝香凉干后呈暗棕色的颗粒,粒状麝香具有 强烈的臭味,用酒精稀释具有特殊的芳香
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
项目 磺化剂 沸点,℃ 磺化速度 磺化转化率 磺化热效应 磺化物粘度 副反应 产生废酸量 反应器容积
H2SO4 290~317
慢 达到平衡,不完全
需加热 低 少 大 大
ClSO3H 151~150
较快 较完全
一般 一般 少 较少 大
SO3•H2SO4
较快 较完全
一般 一般 少 较少 一般
SO3 46 瞬间完成 定量转化 放热量大,需冷却 十分粘稠 多,有时很高 无 很小
-NHCO-、-NH2OH、-N2+X-、-N=N-、-NHNH2、 -CN • 含硫基团:-SO3H、-SO2Cl、-SO2NH2、-SO2NHR
• 含氧基团:-OH、-OR、-OAc、-COH、-COR、 -COOH、-COOR、-COCl、-CONH2
• 烷基、酰基
2) 精细有机合成的主要单元反应
磺化反应是亲电 取代反应
三、磺化反应的影响因素
1、被磺化物的结构和性质 (2)空间效应的影响---P211
表
R 一磺化异构产物的比例(25℃,89.1%H2SO4)
R
CH3
C2H5 CH(CH3)8
0.39
0.057
0
2、磺化剂的种类、浓度和用量
不同磺化剂对反应的影响-p211
HO3S
SO3H
SO3H SO3H
SO3H
SO3H
3、 磺化值
磺化速率与硫酸中所含水浓度的平方成反比例,当硫酸浓度降 低一定值,磺化反应停止,此时剩余的酸称为废酸(w),习惯上把 这种废酸折算成三氧化硫的质量分数表示,称为“”值—p212。
80 w =
98
不同物质磺化是不同的,如苯单磺化废酸浓度78.4% (=64) 单磺化的硫酸浓度(a)一定要大于废酸浓度(w)——a>w 根据磺化值,选定磺化剂
CH3
NO2
二甲苯麝香
NO3
CH3
O2N
COCH3
(CH3)3C
CH3
NO2
葵子麝香
医药:硝化甘油、
硝酸异山梨酯、 新戊四硝酸酯。
NO3
CH3
O2N
NO2
OCH3 C(CH3)3
酮麝香
3、硝化剂
硝化试剂:在硝化反应中能提供硝基(-NO2)的化学物质
硝化剂主要是硝酸。由于被硝化物性质和活泼性的不同,硝 化剂常常不是单独的硝酸,而是各种质子酸,有机酸,酸酐及 各种Lewis酸的混合物。
<80℃
95%H2SO4
>160 ℃
SO3H
五、十二烷基苯磺酸钠的合成
十二烷基苯磺酸钠是合成洗涤剂工业中产量最大,用途最广的阴 离子表面活性剂
反应原理
C12H25
SO3
空气
C12H25
SO3H
该反应属于气液非均相反应,化学反应速度很快,几乎在瞬间完成, 且放出大量的热,因此,工业上用干燥的空气将三氧化硫稀释至浓度 为4-7%。
ONa + NaCl + H2O
NO2
ONa NO2 + NaCl + H2O
NO2
Cl
Cl
Cl2
混酸硝化
水解
FeCl
3
OH
还原
NO2
OH
OH
乙酰化
NO2
NH2
NHCOCH3
• 扑热息痛(对乙酰氨基酚)
• 满足产品性能要求
NO 2
O3N
CH3 NO3
OCHH3
O3N
NO3
CH3
O2N
NO2
(CH3)3C
a 1100% 80 100 80
H2SO4[(H2SO4 ) 100%]
a 1100% 80 81.6 98
H2SO4[(H2SO4 ) 98%]
a 1 98% 80 80 98
98%酸只能磺化小于 80的反应!! ---表5-4
3、 磺化反应的工艺条件
胶束
SO3H
碱性水解
OH
OH OH HO3S
磺化
SO3H
溴化 HO3S
OH
Br 水解 H+
SO3H
OH Br
O2N
δ
+
Cl
+
..
H2N
磺化
O2N
δ
+
Cl
+
..
H2N
SO3H
芳氨基化
OCH3
O2N
芳氨基化
OCH3
O2N
NH
OCH3
H+,水解
NH SO3H
OCH3
3、磺化试剂
浓硫酸(浓H2SO4)
九八酸(98%) 九二酸(92~93%)
要产生高浓 度NO2+,减
少水量
浓硝酸、发烟硝酸主要以分子状态存在,仅有少部分硝酸经分子 间质子的转移而离解成NO2+,硝化能力不强。(3%)
硝酸主要使用活性较高的酚、酚醚、芳胺及稠环芳烃的硝化。 硝化反应速度不断下降,氧化反应显著增强。(硝酸浓度减小)
② 混酸(H2SO4-HNO3-H2O)
• 硝酸(HNO3) • 混合酸:(HNO3-H2SO4-H2O) • 硝酸与乙酸酐混合物(HNO3-(CH3CO)2O) • 有机硝酸酯(C2H5CO-ONO2) • 含氮氧化物(N2O5)
4、硝化反应的特点
• 反应不可逆 • 反应速度快,无需高温 • 放热量大,需要及时移除反应热 • 多数为非均相反应,需要加强传质
二、硝化反应基本原理
H2SO4
+ HNO3 50oC, 98%
NO2 + H2O
芳环上的硝化反应是典型的亲电取代反应
一般认为硝化剂是以NO2+(硝酰正离子)形式参与反应的。
+ NO2+
NO2+ 慢
NO2 H NO2 -H+
①硝 酸
HNO3 + HNO3
H2NO+3 + NO3-
H2NO+3
H2O + NO2+
产物与磺化剂的种类、浓度和反应温度有关。
+ H2SO4
SO3H
SO3H
SO3H
HO3S
SO3H
SO3H
SO3H
+
SO3H
SO3H
多磺化产物的制备往往需要进行多步磺化。
SO3•H2SO4 50~90℃
H2SO4 60℃
SO3H
SO3•H2SO4 35~55℃
SO3H
SO3H
SO3H
SO3•H2SO4 150~250℃
SO3H
磺化
水解(碱熔)
氯化
Cl 气固相接触催化水解
C-烷化 硝化
高压液相碱性水解
CH(CH3)2 氧化
CH3 H3C C O OH
OH
脱羧 COOH
酸解 水解
NO2
还原
NH2 重氮化
N2+Cl-
氧化 CH3
合成工艺路线的选择依据
• 路线短 • 总收率最高 • 易于工业化生产 • 成本低,经济效益高 • 原料易得
SO3H SO3H
烷基苯磺化产物是邻位和对位取代物的混合物。
CH 3
+ H2SO4
反应温度不同 产物比例不同
0℃ 25℃ 100℃
CH 3
SO3H +
邻甲基苯磺酸 43% 32% 13%
CH 3
SO3H
对甲基苯磺酸 53% 62% 79%
萘的磺化时磺酸基进入的位置和反应温度有关。
SO3H
100%H2SO4
——《精细化工产品分类暂行规定》,1986年3月6日
2、精细化工的特点
• 多品种,小批量 • 大量采用复配技术 • 投资小、附加价值高、利润大 • 技术密集度高、产品更新换代快
3、精细有机合成的单元反应
主体结构 精细化学品
取代基
1) 精细化学品的主要取代基
• 卤素:-Cl、-Br、-I、-F • 含氮基团:-NO2、-NO、-NH2、-NHR、-NR1R2
80℃ + 浓 H2SO4
H2SO4, SO3 30~50℃
SO3H
SO3H
+
H2O
反应可逆,生成的水
使 H2SO4 变稀,磺化速度
变慢,水解速度加快,故
常用发烟硫酸进行磺化,
以减少可逆反应的发生。
若在较高温度下反应,则苯磺酸可进一步生成苯二磺酸,且 主要生成间位产物。
SO3H
H2S2O7
70℃
O
+ SO O
H SO3
SO3 + HOSO3H
SO3 SO3H
+ HSO4
SO3H
+ H2O
180 ℃
+ H2SO4
三、磺化反应的影响因素
1、被磺化物的结构和性质 被磺化物活泼顺序为:萘>甲苯>苯>蒽醌>>饱和烃类
(1)取代基的影响
当芳环上存在吸电子基:-NO2、-SO3H、-COOH时,磺化变难 当存在供电子基-Cl、-CH3、-OH、-NH2时,磺化反应变易。
反应温度和反应时间
影响反应速度: 影响磺酸进入的位置。
添加剂
改变定位--汞、钯、铊和铑等在蒽醌磺化中的-位定位作用。 抑制副反应--磺化反应中加入无水硫酸钠。
搅拌 避免磺化剂浓度局部过高使反应混合均匀。 避免发生局部过热现象而导致副反应发生,并有利于热量导出。
四.典型磺化反应
苯与浓硫酸在加热下或与发烟硫酸作用,生成苯磺酸。
