理学第四讲热力学第一定律
热力学第一定律原理分析

热力学第一定律原理分析热力学是研究物质能量转化和守恒的学科,其中最基本的定律被称为热力学第一定律。
热力学第一定律表明能量在物理系统中是守恒的,它是整个热力学理论体系的基础。
本文将对热力学第一定律原理进行分析,探讨其相关概念、表述以及应用。
一、热力学第一定律的基本概念热力学第一定律,也称为能量守恒定律,指的是能量在物理系统中的守恒原理。
按照能量守恒原理,一个系统的内能变化等于从系统中传入的热量减去对外做功的量。
这可用一个简单的数学公式来表示:ΔU = Q - W其中,ΔU表示系统内能的变化,Q表示系统所吸收或放出的热量,W表示系统所做的对外功。
这个公式反映了能量不会自发地消失或产生,只能通过热量传递和对外做功的方式转移。
二、热力学第一定律的表述热力学第一定律可以用不同的形式表述,其中最常见的有以下几种形式:1. 热力学第一定律的简单表述:能量不会自发地产生或消失,只能从一个物体传递到另一个物体或转化为其他形式。
2. 热力学第一定律的数学表述:在一个热力学循环中,系统的内能变化等于循环过程中吸热与放热之间的差值,再减去对外做功的量。
3. 热力学第一定律的微观表述:能量守恒的原理可以通过分子级别的能量转移来解释,即分子间的热运动导致能量传递。
三、热力学第一定律的应用热力学第一定律是研究热力学问题的基础和出发点,它在各个领域都有重要应用,以下是其中的一些常见应用:1. 热力学循环中的工作原理:热力学第一定律揭示了热力学循环中能量的转移与转化,例如内燃机、蒸汽机等均基于这一原理进行工作。
2. 热力学过程中的能量分析:热力学第一定律可以用于分析热传导、热辐射等能量转移过程中的能量转化效率和能源利用率。
3. 热力学平衡条件的确定:热力学第一定律可以用于确定物质在不同温度下的平衡条件,从而对不同系统的热平衡进行分析。
4. 热力学系统的性质研究:热力学第一定律可以帮助研究者了解系统内部的能量分布和转移状况,从而更好地分析系统的性质和行为。
热力学第一定律ppt

热力学第一定律ppt引言热力学第一定律是热力学中的基本定律之一。
它表明了能量的守恒原理,也被称为能量守恒定律。
热力学第一定律对于理解能量转化和能量守恒的过程至关重要,应用广泛。
热力学第一定律的表述热力学第一定律可以用如下方式表述:在孤立系统中,能量的增量等于对外界做功和系统热量的和。
这个表述可以用以下数学公式表示:ΔE = Q - W其中,ΔE表示能量的增量,Q表示系统吸收的热量,W表示系统对外做功。
能量转化示意图为了更好地理解热力学第一定律,我们可以通过一个能量转化示意图来说明。
能量转化示意图能量转化示意图在这个示意图中,输入的能量被系统吸收,一部分能量被转化为系统内能的增加(热量),一部分能量被系统用于对外做功。
根据热力学第一定律,系统吸收的热量和对外做的功加起来等于能量的增量。
热力学第一定律的应用热力学第一定律在工程和科学研究中有着广泛的应用。
以下是一些具体的应用:热力学循环分析热力学第一定律用于分析各种热力学循环,如卡诺循环和热力学循环。
通过应用热力学第一定律,我们可以确定循环中的能量转化效率、功率输出等参数。
能量守恒分析热力学第一定律可以应用于能量守恒的分析,例如分析能源系统中的能量损失和能量转化过程。
通过分析系统的能量转化过程,我们可以找出能量损失的原因,并采取措施来提高能源利用效率。
温度变化分析热力学第一定律可以用来分析物质的温度变化。
根据热力学第一定律,物质的内能增加会导致温度升高,而内能减少则会导致温度降低。
因此,可以通过热力学第一定律来研究物质的显热效应和隐热效应。
结论热力学第一定律是热力学中的基本定律之一,它表明了能量的守恒原理。
通过应用热力学第一定律,我们可以分析能量的转化过程,研究能源系统的能量损失和能量转化效率,并进一步提高能源利用效率。
热力学第一定律在工程和科学研究中有着广泛的应用,对于理解能量转化和能量守恒的过程起到了重要的作用。
《热力学第一定律》 讲义

《热力学第一定律》讲义一、热力学第一定律的引入在探索自然界的能量转化和守恒规律的过程中,热力学第一定律应运而生。
它是热力学的基础,对于理解各种热现象和能量转换过程具有至关重要的意义。
想象一下,我们生活中的各种能量形式,比如热能让我们感到温暖,机械能让机器运转,电能点亮灯光。
那么,这些不同形式的能量之间是如何相互转换的?又是否存在某种不变的规律呢?这就是热力学第一定律要回答的问题。
二、热力学第一定律的表述热力学第一定律可以表述为:能量既不会凭空产生,也不会凭空消失,它只会从一种形式转化为另一种形式,或者从一个物体转移到另一个物体,而在转化和转移的过程中,能量的总量保持不变。
这看似简单的一句话,却蕴含着深刻的物理内涵。
它意味着我们的宇宙是一个封闭的能量系统,能量的流动和变化有着严格的规律可循。
为了更直观地理解这一定律,我们可以举几个例子。
比如,当我们燃烧煤炭来加热水时,煤炭中的化学能通过燃烧转化为热能,然后热能传递给水,使水的温度升高。
在这个过程中,总能量始终保持不变,只是能量的形式从化学能变成了热能。
又比如,汽车发动机通过燃烧汽油将化学能转化为机械能,从而驱动汽车前进。
虽然能量的形式发生了变化,但能量的总量并没有增加或减少。
三、热力学第一定律的数学表达式热力学第一定律可以用数学表达式来精确描述。
通常,我们用ΔU = Q + W 来表示。
其中,ΔU 表示系统内能的变化,Q 表示系统吸收或放出的热量,W 表示系统对外界做功或外界对系统做功。
当 Q 为正值时,表示系统吸收热量;当 Q 为负值时,表示系统放出热量。
当 W 为正值时,表示系统对外界做功;当 W 为负值时,表示外界对系统做功。
这个表达式清晰地展示了内能、热量和功之间的关系。
比如说,一个绝热容器中的气体被压缩,外界对气体做功,由于是绝热过程,没有热量交换(Q = 0),根据表达式,气体的内能增加(ΔU > 0)。
再比如,一个热的物体与一个冷的物体接触,热的物体向冷的物体传递热量(Q < 0),如果没有做功过程(W = 0),那么热物体的内能减少,冷物体的内能增加,但两者内能的总和不变。
热力学第一定律的内容及公式

热力学第一定律的内容及公式热力学第一定律是物理学家在研究热力学时发现的一个基本定律,又称一阶热力学,它主要是指热力学里的“能量守恒定律”,也就是所谓的“热力学第一定律”。
热力学里有两个重要概念,一个是“热量”,一个是“动能”,它们都是热量的形式,而热力学第一定律宣称:“系统在每一次进行的任何物理或化学变化中,热量的总量是保持不变的”,也就是说:“热量守恒定律”,或“热力学第一定律”。
其公式如下:ΔU = Q - W (热量守恒定律)其中,ΔU:系统内部能量的变化量,U”代表“内能”;Q:进入系统的热量量,Q”代表“热量”;W:系统外的动摩擦的功,“W”代表功。
热力学第一定律的推导是基于“能量守恒原理”,也就是基于“能量守恒定律”,即“能量在发生物理和化学变化的过程中是守恒的”,其具体原理可以这样理解:在任何物理或化学变化的过程中,能量只会由一种形式转化为另一种形式,而不会消失或增多,因此可以将它作为守恒量。
这就是“能量守恒定律”所说的“能量不会消失,而只能由一种形式转化为另一种形式”。
热力学第一定律的实际应用非常广泛,它不仅被广泛应用于电力,热动力学,机械学,天然气等,而且它也是热动力机制的基础,比如火的燃烧,爆炸,发动机的工作,热能的转化等等,都离不开热力学第一定律的应用。
热力学第一定律的推导实际上是由能量守恒定律的原理推出来的,其中,Q一般表示进入系统的热量,W表示系统外的动摩擦功,ΔU表示系统内部能量的变化量,因此,Q-W=ΔU,也就是说,热量守恒定律是指热量的总量在发生变化的过程中是保持不变的。
热力学第一定律也有其局限性,它不适用于非平衡态的物理过程,也不适用于外部力的作用下的重力运动,而是适用于系统在收敛过程中的热运动,这也是其它热力学定律如热力学第二定律等作用于平衡态中才能发挥最好作用的原因。
总之,热力学第一定律是由能量守恒定律推导出来的,其公式为Q-W=ΔU,它简单而实用,极大地推动了某些物理过程的进程,发挥了极其重要的作用,并且它也有自己的局限性,不适用于非平衡态的物理过程以及外部力的作用下的重力运动。
[理学]第四讲:热力学第一定律
![[理学]第四讲:热力学第一定律](https://img.taocdn.com/s3/m/c6f599ee5ff7ba0d4a7302768e9951e79b896936.png)
于p(环)。
2021/12/28
23
第二十三页,共116页。
3.恒容过程 :系统状态发生变化时,系统的体积始终不变。
4.绝热过程(adiabatic process,adia.):系统状态变化时与环境无热交换。
5.循环过程(cyclic process):当系统由始态经历一系列具体途径后又
回到原来状态的过程。
循环过程的特点: 系统所有状态函数变化量均为零
但变化过程中,系统与环境交换的功与热却往往不为零。
2021/12/28
24
第二十四页,共116页。
例 1:等 T 过程:理气的等温膨胀过程
(298K, 5Pθ, 1dm3 ) 298K (298K, Pθ, 5dm3 )
2. 力平衡(mechanical equilibrium):(无刚性壁时)系统内
各部分的压力相等,即处于力平衡。
3. 相平衡(phase equilibrium):当系统不止一相时,达平衡后各
相的组成和数量不随时间而改变,即处于相平衡。
4. 化学平衡(chemical equilibrium):有化学反应时,达
2021/12/28
3
第三页,共116页。
§4-1 热力学概论
一. 概论 1. 热力学是物理学的一个分支 共有三条基本定律。第一定律能量转化过程
中的数量守恒;第二定律能量转化过程中进
行的方向和限度;第三定律低温下物质运动
状态,并为各种物质的热力学函数的计算提
供科学方法。 4 第四页,共116页。
2. 热力学应用于研究化学——化学热力学 把热力学中的基本原理用来研究化学现象
热学学 第四章 热力学第一定律.
植物,通过氧化把化学能转化为热和机械能。
16
亥姆霍兹 德国 物理学家(1821~1894) 《力之守恒》 化学、力学、电磁学、热学
17
• 2 内能
内能:在热学参考系下,所有分子的无规则运动的能量之和。
热学参考系:使系统宏观静止的参考系
用的能量,在过程中保持为常数,因此可以省略。
• 内能具体包含哪些能量---普遍
分子的动能(包括平动、转动、振动)
+分子内部的振动势能
+分子间的势能
18
---原子核内的能量,不能被运用,省略。 ---系统整体运动的能量,不是内能,排除。 (系统的整体平动、转动的动能) ---对于理想气体,分子间势能在任何过程中始终保持为常数, 可以省略。 • 例子:单原子分子理想气体的内能。 每个分子的动能之和。---热学坐标系。 • 例子:刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。 • 例子:非刚性双(多)原子分子理想气体的内能。 每个分子的平动动能之和,每个分子的转动动能之和。每个分 子的振动动能之和,每个分子的振动势能之和。 • 例子:前面的例子都为非理想气体时。 都要包含分子间的势能之和。
系统和外界在非功过程交换的能量,称为热量
注意:1)热量过程量。
2)系统和外界必须有温度差,才能交换热量。
3)系统和外界交换能量的方式只有两种:功,热量。
§4.3 热力学第一定律
本质:能量转化和守恒定律在热学系统的表现。
1 历史
14
焦耳(1818-1889),英国。 热功当量
w电=I 2Rt=JQ w重力=JQ Q cmT
热力学第一定律ppt课件

3.2 热机及其效率
➢ 3.2.1热机
;.
➢ 1.1历史渊源与科学背景
人类使用热能为自己服务有着悠久的历史,火的发明和利用是人类支配自然力的伟大开
端,是人类文明进步的里程碑。中国古代就对火热的本性进行了探讨,殷商时期形成的“五行
说”——金、木、水、火、土,就把火热看成是构成宇宙万物的五种元素之一。
北宋时刘昼更明确指出“金性苞水,木性藏火,故炼金则水出,钻木而生火。”古希腊米利
都学派的那拉克西曼德(Anaximander,约公元前611—547) 把火看成是与土、水、气并列的
一种原素,它们都是由某种原始物质形成的世界四大主要元素。恩培多克勒(Empedocles,约
公元前500—430)更明确提出四元素学说,认为万物都是水、火、土、气四元素在不同数量
上不同比例的配合,与我国的五行说十分相似。但是人类对热的本质的认识却是很晚的事情。
18世纪中期,苏格兰科学家布莱克等人提出了热质说。这种理论认为,热是由一种特殊的没有
重量的流体物质,即热质(热素)所组成,并用以较圆满地解释了诸如由热传导从而导致热平
衡、相变潜热和量热学等热现象,因而这种学说为当时一些著名科学家所接受,成为十八世纪
热力学占统治地位的理论。
十九世纪以来热之唯动说渐渐地为更多的人们所注意。特别是英国化学家和物理学家克 鲁克斯(M.Crookes,1832—1919),所做的风车叶轮旋转实验,证明了热的本质就是分子无规 则动的结论。热动说较好地解释了热质说无法解释的现象,如摩擦生热等。使人们对热的本
质的认识大大地进了一步。戴维以冰块摩擦生热融化为例而写成的名为《论热、光及光的 复合》的论文,为热功相当提供了有相当说服力的实例,激励着更多的人去探讨这一问题。
物理化学:热力学第一定律PPT课件

要的热量为Q,则就定义
1 n
δQ p dT
为该物质在该温度
下的摩尔定压热容,以 C p , m 表示,
Cp,m
1 δQp n dT
对恒压过程
δ Q p d H p n d H m ,p
代入有
C p ,m
1H n Tp
H m Tp
—— C p , m 定义式
单位: Jm o l1K 1
(2) 应用——计算单纯pVT 过程H
第二章 热力学第一定律
热力学是自然科学中建立最早的学科之一
1. 第一定律:能量守恒,解决过程的能量衡算 问题(功、热、热力学能等)
2. 第二定律:过程进行的方向判据 3. 第三定律:解决物质熵的计算
热力学基本定律是生产经验和科学实验的总结,它们不 能用其它理论方法加以证明,但其正确性毋庸置疑。 需要指出: (1)经典热力学研究含有大量质点的宏观系统:其原理、 结论不能用于描述单个的微观粒子; (2)经典热力学只考虑平衡问题:只考虑系统由始态到末 态的净结果,并依此解决诸如过程能量衡算、过程的方向、 限度的判断等热力学问题,至于由始态到末态的过程是如何 发生与进行的、沿什么途径、变化的快慢等等一些问题,经 典热力学往往不予考虑。
W p a m b V 2 V 1p V 2 V 1 p 1 V 1 p 2 V 2 由热力学第一定律可得: Q p UW =U 2 p2V 2 U 1 p1 V 1
定义 : HdefU pV
H为焓,为状态函数,广延量,单位 J Qp H δQp dH
即恒压热与过程的焓能变在量值上相等
注:H 的计算的基本公式: H= U+ (pV) 恒压过程 H = Q
§2.1 基本概念和术语
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
行的方向和限度;第三定律低温下物质运动
状态,并为各种物质的热力学函数的计算提
供科学方法。 3
2. 热力学应用于研究化学——化学热力学
把热力学中的基本原理用来研究化学现象 及与化学有关的物理现象——化学热力学。
化学变化中的能量的转变,反应的热效应
——热力学第一定律的应用。 化学变化的方向和限度——热力学第二定
(2)绝热箱中的所有水为系统;
(3)以绝热箱中的所有水和电热丝为系统;
(4)以绝热箱中的水、电热丝及外接电源为系统。
2020/4/30
14
4.2.2
•定义:描述(决定)系统状态的物理量。 •分类: ——微观性质:分子的极性、偶极矩等(热力学不考虑)。
——宏观性质:温度T、压力p、体积V、密度、粘度 、表面
2. 封闭系统(closed system):与环境之间只可能有能量交换而
无物质交换。(物化多用)
3. 敞开(开放)系统(open system):与环境之间既有能量
交换,又有物质交换。
能量交换 物质交换
隔离系统
封闭系统
敞开系统
2020/4/30
10
2020/4/30
11
2020/4/30
可能有物质或能量交换)的有限部分物质。
•说明:
——系统与环境之间可以有实际的界面,也可以没有实际的界 面。
例:一钢瓶氧气:
——研究其中全部气体:有界面(内壁)。 ——研究其中部分气体:只有想象的界面。 ——按系统与环境之间是否有能量交换与物质交换,可把系统分
2020/4/30
9
1. 隔离(孤立)系统(isolated system) :与环境之间既
12
体系
环境
界面
a CH3OH CH3OH(g) g-l 界面 (l) +空气+冰浴 (真实)
b
CH3OH (g + l)
空气+冰浴
空气+甲醇气 界面(虚构)
2020/4/30
13
2.在一个绝热容器中盛有水,水中浸有电热丝,通电加热,如将 下列不同对象看作是系统,则分别为何种系统: (1)以液态水为系统;
张力 、热力学能(也称内能)U等。
——(宏观)性质的分类(根据是否与系统内物质的量成正
比(有加和性):
•广度性质(广延量,容量性质)(extensive properties):具 有加和性的性质。例:V,n,U,H,A,G
•强度性质(intensive properties)。不具加和关系的性质。例:T,
3.掌握状态函数的特点和方法,并能熟练地解决有关
的热力学问题。
4.掌握热力学第一定律的数学表达式及其在不同条件下
的特定表达式。
5.掌握热容的概念,明确不同状态下CP与CV的关系;能 熟练地计算理想气体在定温、定压、定容和绝热过程 中的Q、W、U和H。
6.明确用fHmθ、cHmθ计算fHmθ的方法,以及rHm与温 度的关系。能应用盖斯定律、基尔霍夫方程以及热力学 基本数据计算包括相变和化学变化在内的各种过程的 rHm。
2020/4/30
5
热力学研究方法的特点和局限性
1. 热力学方法的特点 研究大量粒子的宏观体系的宏观性质
之 间 的关系及变化规律,
不考虑微观粒子的微观结构
不涉及反应的速度和机理
2020/4/30
6
2. 优点和局限性
安 1)热力学只研究体系的始终态 根据始终态的性质而得到可靠的
结果;不考虑变化中的细节;不考虑 物质内部的结构因素
律的应用。
2020/4/30
4
3. 典型事例,说明化学热力学的应用 a. 熔炉炼铁:Fe3O4 + 4CO → 3Fe + 4CO2
b. 人造金刚石: C(石墨)→C(金刚石) 由热力学知道 P>15000P° 时,才有可能; 今天已实现了这个转变(60000P°,1000℃, 催化剂)
二. 热力学研究方法的特点和局限性
仅202与0/4/3系0 统的始态、末态有关,与变化的具体历程无16
状态函数的特征
状态一定,其值一定; 殊途同归,变化为等; 周而复始,变化为零; 相互联系,相互制约
单值函数,连续可微分 具有全微分性 。
2020/4/30
17
Z= Z(x,y)
Z
Z
dZ
( X
)Y
dX
( Y
)X
dY
V(T,P)dV
( V T
)P dT
(
V P
)
T
dP
P(T,V) P
P
dP
( T
பைடு நூலகம்
)V
dT
( V
)T
dV
2020/4/30
18
4.2.4 热力学平衡态(equilibrium
state)
•定义:若将系统与其环境之间的一切联
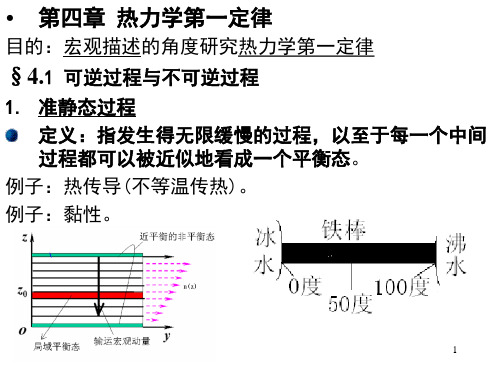
系隔绝,其状态仍不随时间而变化,则 称该系统处于热力学的平衡状态,简称 平衡态。 例:金属棒两端分别与0ºC及100ºC的两恒温热源接触:
2020/4/30
1
§4.1 序言
•物理化学(理论化学)的研究内容:
——结构化学(量子化学); ——化学热力学; ——化学动力学。
•热力学(thermodynamics):研究能量相互转换过程中应遵循规律
的科学;应用于化学即为化学热力学。
——特点:
(1)研究对象的宏观性质,只适用于有极大量粒子的系统,不适
2) 不考虑时间因素 3)不考虑粒子的个别行为
2020/4/30
7
学习要点:
吃透基本概念;特别注意条件。
最重要的基本概念:
状态函数;可逆过程
2020/4/30
8
§4.2 热力学基本概念及术语
4.2.1 系统与环境 •定义:
——系统(体系,物系,system,sys.):研究的对象; ——环境(surroundings,surr.) 系统之外,与系统密切相关(即
用于个别或少数粒子。
(2)没有时间概念,不考虑发生的原因以及所经过的历程。这些
都是热力学的优点,但同时也带来了它的局限性(不能解决速度 和机理问题)。
——基础理论:第一、二、(三)定律。
——应用:化学平衡、相平衡、电化学(大部分)、表面与胶体
化学20。20/4/30
2
§4-1 热力学概论
一. 概论 1. 热力学是物理学的一个分支 共有三条基本定律。第一定律能量转化过程
p,。
•注意:某些广度性质的比值往往是强度性质。例:Vm=V/n;
2020/4/30
15
4.2.3 状态与状态函数
•定义:
——状态:系统所有宏观性质的综和体现。 ——状态函数:系统所有宏观性质皆为状态函数。 •状态函数的特点:
——定态有定值(与其历史和达到该状态的历程无关); ——其微分是全微分;如dp、dV、dT等; ——系统由始态1变化到末态2所引起状态函数的变化值
