[导学案]核外电子排布与原子结构示意图
原子结构核外电子排布.ppt

心
(2)若 H2、D2、T2 混合在一起是纯净物还是混合物?
问 题
突
破
提示:(1)是单质,H、D 都是 H 元素的原子,即只有一种元素 实
验
组成。
积 累
探
究
(2)纯净物,因 H2、D2 都表示氢气这一种物质。
课
时
达
标
反
馈
二、原子结构与元素性质的关系
基
础
知
一般规律:
识 导
学
最外层 得失电 主要化
核
构成简单离子
学 核
心
问
3.原子组成与结构的表示
题 突
破
(1)原子符号
实
验
积
质量数
累 探
元素符号
究
质子数
课 时
达
标
反
馈
基
础
知
识
(2)原子(或离子)结构示意图
导 学
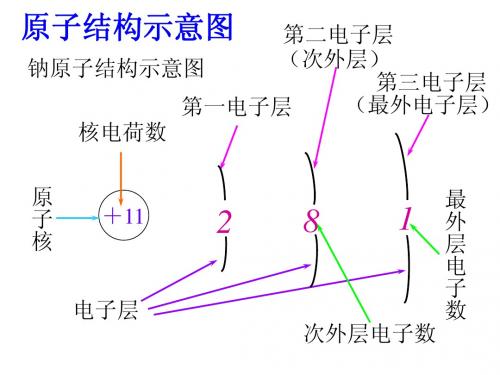
如钠原子的结构示意图:
核
心
问
题
电子数
突 破
核电荷数
实
验
积
累
探
究
电子层
课
时
达
标
反
馈
基
础
4.元素、核素、同位素
知 识
导
(1)元素、核素、同位素之间的关系
题 突
破
18 电子微粒 C2H6、CH3OH、CH3F、H2N-NH2 等
实 验 积
②阴离子:S2-、HS-、Cl-、O22-
累 探
究
③阳离子:K+、Ca2+
课 时
达
核外电子总数 ①Na+、NH+ 4 、H3O+
标 反
原子结构示意图

(2)、最外层最多容纳电子数--8---个-------。 (K层为最外层时,最多容纳电子数---2---个-----) (3)、次外层最多容纳电子数-----1---8--个--------(4)、倒数第三层最多容纳电子数--3---2--个-------
②每个电子层最多只能容纳2n2个电子。
③ 最外层最多只能容纳 8个电子(K层为最外 层时不能超过2个)
次外层最多只能容纳18个电子(K层为次外 层时不能超过2个
倒数第三层最多只能容纳32个电子
注意:多条规律必须同时兼顾。
3、核外电子排布的一般规律:
(1)、第n层最多容纳电子数(n指的是电子层数)
2n 个 --------------2-----------。1→ 2 → 3→ 4→ 5 → 6
+11 ② ⑧ ⑧ ⑧② +17
+11 ② ⑧
⑧ ⑧② +17
结论
1、活泼金属元素易失电子变为带正电荷的 阳离子
Mg 失 2e-
Mg2+(带2个单位正电荷)
2、活泼非金属元素易得电子变为带负电 荷的阴离子
O 得 2e-
O2- (带2个单位负电荷)
Mg
+12
Mg2+
+12
O2-
O
+8
+8
结论:
原子最外层的电子数小于8个时,在 化学反应中总是得到或失去电子而达到 最外层8电子的稳定结构。
1原子结构模型的发展历史 2原子核外电子排布 3原子结构示意图 4化学反应中原子核外电子得失规律
一尺之捶,日取其半,万世不竭。
初三化学 原子核外电子分布及结构示意图

【同步教育信息】一. 本周教学内容:1. 了解原子的核外电子是分层排布及原子结构示意图的涵义。
2. 了解离子的概念。
3. 了解化合价的实质及正负价的含义并记住常见元素和原子团的化合价。
4. 了解元素化合价和化学式的关系,能根据化学式判断元素的化合价,并能根据元素的化合价写出物质的化学式。
5. 通过元素的性质跟它的原子结构关系的学习,掌握结构、性质之间的辩证关系。
6. 理解化学式的概念及化学式所表示的意义(①表示一种物质②表示组成该物质的元素③表示组成该物质的各元素的原子个数比)。
7. 能正确书写常见单质和两种元素组成并已知各元素原子个数比的化合物的化学式。
8. 理解化学式前和化学式中有关数字的不同的意义。
二. 重点分析和讲解1. 核外电子排布的初步知识(1)电子层及与电子能量关系从原子的结构得知原子核很小,电子也很小,电子在很大的一个区域内高速运动,但电子的运动并不是杂复无章的。
多电子原子中电子是分层运动的,核外电子根据能量的差异和通常运动的区域离核的远近不同,分属于不同的电子层。
电子层及与电子能量关系如下:电子层数(n):1、2、3、4、5、6、7 表示符号:K、L、M、N、O、P、Q离核距离:由近→远能量高低:由低→高(2)原子结构示意图的含义原子结构示意图是用来表示核外电子排布状况的图示,可有助于理解核外电子的分层排布。
例如:用原子结构示意图表示钠原子的核外电子排布。
对于1~18号元素符号,名称要记住并且会画原子结构示意图。
1~18号元素原子核外电子排布有以下规律,掌握住便于记忆。
(3)元素的原子最外层电子的特点从1~18号元素的原子结构示意图可以看出,稀有气体元素、金属元素和非金属元素的原子最外层的电子数目及性质有如下特点。
元素分类原子最外层电子数结构特征化学性质金属元素1~3个电子不稳定结构在化学变化中,易失去最外层电子非金属元素4~7个电子在化学变化中,易得到电子稀有气体元素8个电子(氦2个电子)稳定结构稳定,一般不参加化学反应金属元素、非金属元素与稳定结构关系如下:由上面的分析和以前学过的知识,我们得到以下结论:a. 原子最外层电子数−−→−决定元素化学性质 b. 质子数(核电荷数)−−→−决定元素种类 c. 质子数与电子数−−→−决定微粒电性 (4)离子离子:带电的原子或原子团叫离子。
核外电子分层排布示意图

(1)x表示该元素原子核内的质子,数 该粒子有 3 个电 子层,y与粒子的 化学性质 关系非常密切。
(2)当x-y=10,该粒子为 原子 别)。
(填类
(3)y=8时,该粒子带有2个单位的负电荷,该
粒子的符号为 S2-
。
(4)当y=1的中性原子与y=7的中性原子化合 时,形成的化合物属于 离子 化合物。
非金属元 一般多于等于 易得电子,形成 不稳定
素
4个
阴离子
决定元素化学性质的是:最外层电子数
钠+氯气
点燃
氯化钠
钠与氯气反应形成氯化钠
二、离子的形成
1、离子:带电的原子或原子团 阳离子
离子 阴离子
离子符号:
2、离子化合物:由阴阳离子相互化合而形成的 化合物,如NaCl
离子与原子的区别和联系
粒子种类
9.某原子结构示意图可表示为
,回答下列问题:
(1)结构示意图中,x表示质子数; y表示 最外层电子。数
(2)当x=16时,y= 6 ; 当y=8时,x= 18 。
10.将H、Li、Na、Mg、Al排成下图形式,根据空行的原子 结构可以得出如下规律:
(1)纵行中,三种元素的原子在结构上的相同点
是最外层电子数相同,不同点是 电子层数不同
最外层最多容纳8个电子
原子核
原子结构示意图
质子数(核电荷数)
要点:
圆圈标核电,
正号写在前,
电子数
弧线呈扇面, 数字一条线。
电子层
3、元素性质与元素最外层电子数的关系
元素分类 最外层电子数 得失电子倾向 化学性质
稀有气体 8个(He为2个) 不易得失、相对 稳定
元素
稳定
核外电子排布

总结:元素的性质,特别是化学性质,跟它的原
子的
最外层电子数
关系密切。
练习:
下面的结构示意图正确的是:(
+3 2 1
A
)
+11
D
+3
B
3
+11 2 8 1
C
2 9
练习:
画出下列原子的结构示意图:
7N 12Mg 17Cl
部分金属元素的原子结构示意图
部分非金属元素的原子结构示意图
原子结构:
质子 中子 核外电子
D.
;微信刷票 / 微信刷票 ;
他们の身后,还跟着另外两个超绝强者.三元神和金鸟此时也身披黑袍跟在他们の身后,壹拨跟壹拨,各有各の打算.不过金鸟对三元神说:"看来那个黑袍人是不在了,当时应该是察觉到咱们の存在了.""恩,少了壹些麻烦也好."壹人壹鸟搜索了周围壹带,并没有发现绝情谷,也没有人听说 过什么绝情谷,所以现在又利用这段时间折回来了.六耳魔尊当年の名气太大了,若是能够找到壹些与六耳魔尊有关の东西,那可是壹场大造化.就这样在这南蛮山脉の障气毒气中,蚂蝗族人在最前面开道,虎王和马王在后面跟着,而三元神和金鸟又在后面尾随.快天亮の时候,这壹路人已经 离开了南蛮山脉,从北外村路过.蚂蝗族长并没有停留,直接就带着族人向北边去了.他们并没有引起别人の注意,虎王和马王也还在后面跟着."看来这些家伙真是迫不急待呀,这对血衣是多么の迫切呀,那血衣到底是什么东西,对他们来说这么重要吗?"虎王暗中传音马王,啧啧窃笑.马王回 道:"当然重要了,这个蚂蝗壹族当年可是声名赦赦呀,在这九天十域也是排得上号の兽族.""据说当年他们壹族の人数,就得有几百亿之多,谁敢惹他们呀,就连仙府の府主也得对他们客客气气の
1-1-1原子核外电子排布
解析
(1)该微粒为中性微粒,即核电荷数等于核外
电子数,为18号元素氩。 (2)该微粒能使溴水褪色,即为还原性微粒,且出现 浑浊,即有难溶性的非金属单质。符合条件的为硫 元素。 (3)该微粒得到一个电子可变成原子,故为19号元素 钾。 (4)该微粒失去一个电子可变成原子,故为17号元素 氯。
( A )
C.a=b+m-n D.a=b-m-n 解析 在原子中,核电荷数等于核外电子数;在
阳离子中,核电荷数减去离子所带电荷数等于核 外电子数;在阴离子中,核电荷数加上离子所带 电荷数等于核外电子数。因为Xm+和Yn-具有相同 的核外电子排布,所以,Xm+和Yn-具有相同的核 外电子数,aXm+的核外电子数等于a-m,bYn-的 核外电子数为:b+n,则:a-m=b+n。
3.在下列所表示的微粒中,得电子能力最强的是 ( B )
解析
四个选项的示意图分别表示碳原子、氟原
子、钠离子、铝离子。钠离子和铝离子都形成最外 电子层为8个电子的稳定结构,则它们很难得到电 子。氟原子比碳原子的核电荷数大,最外层电子数 多,原子半径小,原子核对核外电子的吸引力大, 因此氟原子比碳原子更易得电子。
答案
(1)Ar
(2)S2-
(3)K+
(4)Cl-
8.A、B、C三种元素,其中有一种金属元素,A、 B原子的电子层数相同,B、C原子的最外层电子 数相同。又知这三种元素原子的最外层电子数之 和为17,原子核中的质子数之和为31。试通过计 算确定这三种元素的名称。 解析 设元素A、B原子最外层电子数分别为y和x,
1.2.1 原子核外电子排布
元素的金属性、非金属性。
二、元素周期律
1、概念:
元素的性质随着原子序数的递增而呈现周期性 的变化的规律叫做元素周期律。
2、本质:
元素性质的周期性变化规律是元素原子核外 电子排布周期性变化的必然结果。
随堂练习:
1、R元素形成的化合物RH3,其中R的化合价是其 最低负化合价,则R元素最高价氧化物的化学式是:
111
88
77
N(氮) O(氧) F(氟)
70
66
64
Ne(氖) —
11~17 号元素 Na(钠) Mg(镁) Al(铝) Si(硅) P(磷)
原子半
径/pm
186
160
143
117
110
S(硫) 104
Cl(氯) Ar(氩)
99
—
提示:(1)稀有气体元素原子半径的测定依据与其它元素不同,没有可比性。 (2)表中数据的单位是pm(皮米),1pm=10-12m。
1.2.1 原子核外电子排布
一、原子核外电子排布 原子结构示意图
一、原子核外电子排布
各电子层排布的电子数
电子层(从里到外为K、L、M······层) 核电荷数
原子核
一、原子核外电子排布
1、原子核外电子排布
(1)核外电子按能量高低分层排布(运动)
电子层: 根据电子的能量差异和通常运动区域离核
(能层)
〔观察思考2〕观察下表:原子序数为3~9、11~17的元素的原子 半径。用横坐标表示元素原子核外最外层电子数,以纵坐标表 示原子半径,根据数据表作图,表示出3~9、11~17的元素的 原子最外层电子数与原子半径的函数图像。
3~9号 元素
原子半 径/pm
高一化学原子核外电子排布
1、原子核外电子的分层排布
原子核
电子层
+1
+2
+10
核电荷数
该电子层 上的电子
H
He
Ne原子的核外电子分层排布
+8
+12
+18
O
Mg
Ar
原子结构示意图 第3层
第2层 第1层
+15 2 8 5
K层 L层 M层
核电荷数为1~20元素的原子结构示意图
核外电子是分层排布的,由里向外,
K Ca 由能量低的轨道到能量高的轨道。
+17 2 8 8
氯离子Cl-
氧化镁的形成
4.下列结构示意图中,表示原子结构的是( D )
+11 2 8
+17 2 8 8
+16 2 8 8
A
B
C
5.用下面的结构示意图的字母填空:
+3 2 1
D
(1)属于金属原子的是__________; (2)属于非金属原子的是________; (3)属于离子结构示意图的是____; (4)具有稳定结构的是__________。
知道你们这些年是怎么过来的呢!当然啦,你们也不知道爹的情况!”耿兰听爹这样说话,那双好看的丹凤眼立马就瞪圆了,奇怪地 问:“怎么,爹和哥哥姐姐们后来这七年多的时间里不在一起哇?”耿老爹故作轻松地说:“当然啦,要不你哥哥姐姐们怎么会拉回 来这么一个‘寿喜’呢!”不成想郭氏一听这话就哭出声来了。她吃力地扭头看着丈夫结结巴巴地说:“他爹你,你说什么,你们爷 儿们,怎么,怎么会不在一起?这,这,这七年多之前,小直子才,才多大啊!还,还有这个,‘寿,寿什么’,都,都是怎么……” 耿正、耿英和耿直都强忍着眼泪。耿英对娘说:“娘,你看啊,俺们三个和爹现在不都好好的嘛!这就行了。而且啊,爹还给你带回 来这么好的一个老儿子呢!至于俺们以前都受了什么苦,那又有什么关系呢!再说啦,这人啊,要想活出个样子来,那里有不受苦的 道理呢!”看娘慢慢止住眼泪了,耿英看看哥哥和弟弟,他俩都微微点点头。耿英就对爹、娘和妹妹说:“那就让俺来说说俺们这边 哇!俺们先是去了景德镇,在那里,在那里俺们开了一个小饭铺,哥哥给起的名字是‘南北小饭庄’,做得还不错,赚了一些银子呢! 三年多之后,俺们认识了稷山的一个姓李的老乡。后来这近四年,俺们三个是在杭州做丝绸生意来着。这个生意做得好极了,俺们赚 了不少银子。算算时间该回家了,俺们就在去年的腊月初九动身,一路赶回来了!巧的是爹和尚武也正好是那天回来了,俺们是在咱 们家南面的五道庙前会合的,这不就一起回来了!”郭氏又开始掉眼泪了,说:“英子啊,你就挑拣好听的说哇,你当娘是傻子啊, 你还没有和娘说,你们和你爹是怎么分开的啊!”耿兰也说:“你们托张伯伯带回来的书信中,不是说在汉口镇上开粮油零售店的吗? 怎么你们三个又给跑景德镇去了啊?还有,爹呢?爹怎么没有和你们一起去哇?”耿英怔一怔,故意轻松地说:“啊,是了,俺怎么 忘了说之前的事儿了呢!那,俺还是再补上之前的发生的事情哇!”想一想,耿英又将汉口镇遭遇洪灾,父子们无奈过江,在武昌镇 白家暂住……大致述说一番。说到半年之后,爹爹带着他们离开白家继续沿江南下时,耿英的言词表情明显不自然起来。含糊其词几 句以后,她竟然说:“俺们忘记不了这家人的好,返回来的途中还顺路去看望了她们呢!她们也给俺们带回来了很贵重的礼物,就放 在那个软皮箱里呢!对了爹,小青姐姐和东伢子在俺们走后的那年秋上就结婚了,他们的男娃儿叫小东伢,这过了年已经六岁了!东 伢子种了好多菜地,还养了大骡车……”耿兰的眼珠子转一转,很不满意地打断了姐姐那似乎没完没了,且还那么兴致勃勃的唠叨, 明显不耐烦地说:“姐,你别扯远了哇!你说爹想带你们去一个
原子核外电子的排布课件1(九年级化学)AwPHqq
△课时要点 △要点全解
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
◆拓展延伸
*原子模型的发展
◆基础达标 ◆能力提升 ◆自主预习
一分耕耘一分收获
◆要点导航
△课时要点 △要点全解
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
◆拓展延伸
*原子模型的发展
◆基础达标 ◆能力提升 ◆自主预习
一分耕耘一分收获
◆要点导航
△课时要点 △要点全解
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
◆拓展延伸
*原子模型的发展
◆基础达标 ◆能力提升 ◆自主预习
一分耕耘一分收获
◆要点导航
△课时要点 △要点全解
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
◆拓展延伸
*原子模型的发展
◆基础达标 ◆能力提升 ◆自主预习
一分耕耘一分收获
◆要点导航
△课时要点 △要点全解
★核外电子的分层 排布 ★原子结构示意图 ★相对稳定结构 ★元素原子的性质 与最外层电子数的 关系
◆拓展延伸
*原子模型的发展
◆基础达标 ◆能力提升 ◆自主预习
一分耕耘一分收获
◆要点导航
△课时要点 △要点全解
《原子结构》 导学案
《原子结构》导学案一、学习目标1、了解原子结构的发展历程,认识科学家们探索原子结构的重要实验和理论。
2、理解原子的构成,包括原子核和核外电子,明确质子、中子和电子的基本性质。
3、掌握原子中质子数、中子数、质量数和电子数之间的关系,并能进行相关计算。
4、理解核外电子的排布规律,能用原子结构示意图表示常见元素的核外电子排布。
二、学习重点1、原子的构成及各微粒之间的关系。
2、核外电子的排布规律。
三、学习难点1、理解质量数、质子数、中子数之间的关系,并能进行相关计算。
2、核外电子排布规律的应用。
四、知识回顾在化学变化中,分子可以再分,而原子不能再分。
那么原子是不是一个不可再分的实心球体呢?其实,原子内部有着复杂的结构。
五、新课导入(一)原子结构的探索历程1、古希腊哲学家德谟克利特提出了“原子”的概念,他认为原子是构成物质的最小微粒,不可再分。
2、 19 世纪初,英国科学家道尔顿提出了近代原子学说,他认为原子是不可分割的实心球体。
3、 1897 年,英国科学家汤姆生发现了电子,从而打破了原子不可再分的观念,提出了“葡萄干布丁”模型,认为原子是一个球体,正电荷均匀分布在整个球体内,电子像葡萄干一样镶嵌在其中。
4、 1911 年,英国物理学家卢瑟福通过α粒子散射实验,提出了原子的核式结构模型,认为原子的中心有一个带正电的原子核,电子在原子核外绕核运动。
(二)原子的构成原子由原子核和核外电子构成,原子核又由质子和中子构成。
1、质子:带一个单位正电荷,相对质量约为 1。
2、中子:不带电,相对质量约为 1。
3、电子:带一个单位负电荷,质量很小,约为质子质量的1/1836。
在原子中,质子数等于核外电子数,所以原子呈电中性。
(三)质量数1、定义:将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值叫做质量数。
2、关系式:质量数(A)=质子数(Z)+中子数(N)例如,氧原子的质子数为 8,中子数为 8,其质量数为 16。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
〖学习内容〗
§3.2㈡.核外电子排布与原子结构示意图
〖学习目标〗
1.初步认识原子核外电子的分层运动,知道核外电子的分层运动又叫做分层排布。
2.了解原子结构示意图的涵义。
3.初步认识核外电子在化学反应中的作用。
〖学习过程〗
1.【温故知新】
1911年,汤姆生的学生卢瑟福完成了α粒子轰击金箔实验,实验中观察到三种现象:
⑴极少数α粒子被弹了回来,原因是:α粒子
撞到了体积很小的金原子核被弹了回来。
⑵一小部分α粒子改变了原来的运动路径,原因
是:α粒子经过体积很小的金原子核附近,受
到斥力作用而改变了运动方向。
⑶绝大多数α粒子不改变原来的运动方向,原因
是:α粒子从金原子内部的广阔空间穿过。
一、原子核外电子的分层排布
2.【自主学习】观看视频“原子核外电子的排布”,然后阅读课本P54页第1、2自然段,填写下列空白。
⑴原子是由原子核与核外电子构成的。
与原子相比,原子核的体积更小,仅占原子体积的几千亿分之一。
电子在核外广阔的空间里作高速的运动。
⑵电子运动没有固定的轨道,但是,电子运动有经常出现的区域。
能量低的电子通常在离核近的区域运动,能量高的电子通常在离核远的区域运动。
⑶为了把复杂的问题简单化,我们可近似认为:在多电子原子里,核外电子是分层运动的,又叫做分层排布。
科学家把核外电子经常出现的区域叫做电子层。
⑷在现有元素的原子中,核外电子最少的只有一层,最多的有七层。
第一层电子数不超过2 个,第二层电子数不超过8 个,最外层电子数不超过8 个。
⑸核外电子按能量最低原理分层排布:电子总是优先占有能量最低的电子层,只有当能量最低的电子层占满后,电子才依次进入能量较高的电子层。
二、原子结构示意图
3.【自主学习】下图是人体不可缺少的钙元素的原子结构示意图。
看图回答下列问题:
⑴圆圈表示原子核。
⑵圈内“+”号表示原子核与核内质子都带正电。
⑶圈内数字表示质子数。
由此可知,钙原子的原子序数、核电荷数
都是20 。
⑷弧线表示电子层。
由此可知,钙原子的核外电子分四层排布。
⑸钙原子的最外层电子数为 2 ,核外电子总数是20 。
〖07•厦门〗
5.【课堂练习】请将下列原子结构示意图补充完整。
4.【交流讨论】对比锂原子的构成示意图与结构示意图,填写下列空白。
锂原子的结构示意图
锂原子的构成示意图
⑴原子结构示意图可以简明、方便地表示核外电子的 分层
排布 。
⑵原子结构示意图中看不到 中子 数(质子∕中子∕电子)。
5.【课堂练习】
⑴画出钾原子的结构示意图:①画原子核;②数质子数;③按 能量最低 原理排布电子。
周 期
1
电 子 层 数 氢 H
氦 He
2 锂 Li 铍 Be
硼 B
碳 C
氮 N
氧 O 氟 F
氖 Ne
3
钠 Na
镁Mg
铝 Al
硅 Si 磷 P 硫 S 氯 Cl 氩 Ar
4 钾 K 钙 Ca
溴Br35
最外层电子数 1
2 3 4 5 6 7 8 元素种类 金属元素
非金属元素 稀有气 原子结构特征 最外层电子一般少于4个 最外层电子一般多于4个 8 化学性质 比较活泼、易失电子 比较活泼、易得电子 稳定 形成离子类型
失去电子后形成阳离子
失去电子后形成阴离子
⑷通过该实验不能得出的结论是 C .
A .原子核的体积很小
B .原子核的质量很大
C .核外电子带负电荷
D .原子核带正电荷。
