有机化学第10章羧酸及其衍生物
有机化学——10羧酸衍生物和脂类

=
R C OH + N2 + H2O
3.霍夫曼降解反应
=
O R C NH2 + Br2
NaOH
R NH2 + NaBr + Na2CO3 + H2O
反应使碳链减少一个碳原子
=
O
O
五、碳酸衍生物
(一)脲(尿素)——碳酸的二元酰胺
1. 弱碱性 不能使石蕊试纸变色, 只能与强酸成盐
= = =
O R C NHOH +
=
R'COOH
O
R C O R'
=
+ H NH OH
O R C NHOH +
= =
R'OH
O
R C NH2 + H NH OH
O R C NHOH + NH3 异羟肟酸
3R C NHOH + FeCl3
=
异羟肟酸铁 (红~紫色)
可用做羧酸及其衍生物的定性检验
=
O
O (R C NHO)3Fe + 3HCl
(四)酯缩合反应
具有α-H的酯在碱的作用下与另一分子酯发生 反应称酯缩合反应或克莱森(Claisen)缩合反应
CH3 O O O O ① C2H5ONa C OC2H5 + H CH2 C O C2H5 CH3 C CH2 C OC2H5 + C2H5OH ②H
=
=
=
(五)还原反应
卤、酸酐和酯还原成伯醇
乙酰乙酸乙酯 β 丁酮酸乙酯
羧酸衍生物比羧酸容易还原。氢化铝锂可将酰
=
O R C O R C
汪小兰有机化学第四版10-17章答案

第十章:羧酸及其衍生物10.1 用系统命名法命名(如有俗名请注出)或写出结构式a.(CH 3)2CHCOOHb.OHCOOHc.CH 3CH=CHCOOHd.CH 3CHCH 2COOHe.CH 3CH 2CH 2COClf.(CH 3CH 2CH 2CO)2Og.CH 3 CH 2COOC 2H 5h.CH 3CH 2CH 2OCOCH 3i.CONH 2j.HOOCC=CCOOHk.邻苯二甲酸二甲酯l.甲酸异丙酯m.N-甲基丙酰胺s.苯甲酰基n---r.略t.乙酰基答案:a. 2-甲基丙酸 2-Methylpropanoic acid (异丁酸 Isobutanoic acid )b. 邻羟基苯甲酸(水杨酸)o -Hydroxybenzoic acidc. 2-丁烯酸 2-Butenoic acid d 3-溴丁酸 3-Bromobutanoic acid e. 丁酰氯 Butanoyl Chloride f. 丁酸酐 Butanoic anhydride g. 丙酸乙酯 Ethyl propanoate h. 乙酸丙酯 Propyl acetate i. 苯甲酰胺 Benzamide j. 顺丁烯二酸 Maleic acids.COt.H 3CCO k.COOCH 3COOCH 3l.HCOOCH(CH 3)2m.CH 3CH 2CONHCH 310.2 将下列化合物按酸性增强的顺序排列:a. CH 3CH 2CHBrCO 2Hb. CH 3CHBrCH 2CO 2Hc. CH 3CH 2CH 2CO 2Hd. CH 3CH 2CH 2CH 2OHe. C 6H 5OHf. H 2CO 3g. Br 3CCO 2Hh. H 2O 答案:酸性排序 g > a > b > c > f > e > h > d 10.3 写出下列反应的主要产物a.22724b.(CH 3)2CHOH +COClH 3Cc.HOCH 2CH 2COOH LiAlH 4d.NCCH 2CH 2CN+H 2ONaOHH+e.CH 2COOH CH 2COOH2f.CH 3COCl+CH 3g.(CH 3CO)2O+OHh.CH 3CH 2COOC 2H 5NaOC 2H 5i.CH 3COOC 2H 5+CH 3CH 2CH 2OHH +j.CH 3CH(COOH)2k.COOH+HCll.2+HOCH 2CH 2OH m.COOHLiAlH 4COOH n.HCOOH+OH o.CH 2CH 2COOC 2H 5CH 2CH 2COOC 2H 5p.NCONH 2OHq.CH 2(COOC 2H 5)2+H 2NCONH 2答案:a.22724COOH COOH+COOHCOOHb.(CH 3)2CHOH +COOCH(CH 3)2H 3CCOClH 3Cc.HOCH 2CH 2COOH LiAlH 4HOCH 2CH 2CH 2OHd.NCCH 2CH 2CN+H 2ONaOH-OOCCH 2CH 2COO -H+HOOCCH 2CH 2COOHe.CH 2COOHCH 2COOH2Of.CH 3COCl+CH 3CH 3COCH 3+CH 3COCH 3g.(CH 3CO)2O+OHOCOCH 3h.CH 3CH 2COOC 2H 5NaOC 2H 5CH 3CH 2COCHCOOC 2H 53i.CH 3COOC 2H 5+CH 3CH 2CH 2OHH+CH 3COOCH 2CH 2CH 3+C 2H 5OHj.CH 3CH(COOH)2CH 3CH 2COOHk.COOH+HClClCOOH+ CO 2l.2+HOCH 2CH 2OH 2CH 2OOCm.COOHLiAlH 4CH 2OHCOOH n.HCOOH+OH HCOO o.CH 2CH 2COOC 2H 5CH 2CH 2COOC 2H 5OCOOC 2H 5p.NCONH 2OH -NCOO +NH 3q.CH 2(COOC 2H 5)2+H 2NCONH 2HN NH O OO10.4 用简单化学方法鉴别下列各组化合物:a.COOH COOH 与与CH 2COOHCH 2COOHb.COOHOCH 3OH COOCH 3与c.(CH 3)2CHCH=CHCOOH与COOHd.COOHCH 3OHCOCH 3OHOHCH=CH 2与答案:a. KmnO 4b. FeCl 3c. Br 2 or KmnO 4d. ①FeCl 3 ②2,4-二硝基苯肼或I 2 / NaOH10.5 完成下列转化:a.OCOOHOHb.CH 3CH 2CH 2BrCH 3CH 2CH 2COOH c.(CH 3)2CHOH 3)2C COOHd.CH 3CH 3OOOO OOe.(CH 3)2C=CH 2(CH 3)3CCOOHf.COOHBrg.HC CH CH 3COOC 2H 5h.OOi.CH 3CH 2COOH CH 3CH 2CH 2CH 2COOH j.CH 3COOH CH 2(COOC 2H 5)2k.O O OCH 2COONH 4CH 2CONH 2l.CO 2CH 3OHCOOH OOCCH 3m.CH 3CH 2COOH CH 3CH 2COOn.CH 3CH(COOC 2H 5)2CH 3CH 2COOH答案:a.OCN OH+COOH OHb.CH 3CH 2CH 2Br CN-CH 3CH 2CH 2CN+CH 3CH 2CH 2COOH c.(CH 3)2CHOH 32(CH 3)2C O (CH 3)2C CN+3)2C COOHOH d.CH 3CH 3KMnO 4COOHCOOH COOHCOOHOOOO OOe.(CH 3)2C=CH 2HBr(CH 3)3CBrMg 2(CH 3)3CMgBrCO 2+ 23)3CCOOHf.33CH 3KMnO 4COOHBr 2COOHBr g.HC CH2H Hg ,CH 3CHOKMnO 4CH 3COOH CH 3COOC 2H 5HCN21)22h.OHNO 3HOOC(CH 2)4COOHOi.CH 3CH 2COOHLiAlH 4CH 3CH 2CH 2OHHBrCH 3CH 2CH 2Br2CH 3CH 2CH 2MgBrO +CH 3CH 2CH 2CH 2CH 2OH4CH 3CH 2CH 2CH 2COOH或CH 3COCH 2COOC 2H 5EtONa322CH 3CO CH CH 2CH 2CH 3COOC 2H 5浓-CH 3(CH 2)3COOHj.CH 3COOH 2PCH 2COOH Cl-CH 2COOH CNCH 2(COOC 2H 5)2k.O O O3CH 2COONH 42CONH 2l.CO 2CH 3OHH +H 2O COOH OH3m.CH 3CH 2COOHSOCl 2CH 3CH 2COClCH 2COOn.CH 3CH(COOC 2H 5)2-+CH 3CH 2COOH+10.6 怎样将己醇、己酸和对甲苯酚的混合物分离得到各种纯的组分? 答案:己醇A已酸B 对甲苯酚C已酸钠已酸B 已醇对甲苯酚NaOH已醇AHClC10.7 写出分子式为C 5H 6O 4的不饱和二元羧酸的各种异构体。
有机化学--羧酸及其衍生物

POCl3
HCl↑
O R C OH
SOCl2
O R C Cl
SO2↑
低、高沸点 ↑ HCl 的酰氯制备 都适合
② 酸酐的生成
羧酸在脱水剂如五氧化二磷的存在下,加热。两分子羧 酸失去一分子水而形成酸酐。
R-C OH R-C OH O R-C O R-C + H2O
P2O5
△
(产率较低)
O
分子量较大的羧酸在乙酐(作脱水剂)存在下,失水生 成酸酐。反应平衡中发生了酸和酸酐的交换。 O O CH3-C 2R-C-OH + O CH3-C O
任何使酸根负离子稳定的因素都将增加其酸性,羧酸根负离 子愈稳定,愈容易生成,酸性就愈强。
(1)电子效应的影响
诱导效应:X—COOH
-I使酸性增强, +I使酸性减弱
X= F Cl Br I CHO 3.53 NO2 1.68
+N(CH ) 3 3
pKa 2.66 2.86 2.90 3.18
1.83
O CH3CH2 C
丙酰基
O C
苯甲酰基
CH3 CH3 CH3CH-CHCH2COOH CH3CH-CHCH21 COOH 4 3 2 CH2CH3 CH
5 6 3
CH3-C =CH-COOH CH3 3-甲基-2-丁烯酸
γ β α
4
3
2
1
3,4-二甲基戊酸 CH2-COOH CH2-COOH 丁二酸
羧酸铵盐 腈的水解为其逆反应:
酰胺
腈
O C OH + HNH-
O C NHN-苯基苯甲酰胺
+ H2 O
扑热息痛
3、羧基的还原 (LiAlH4)
大学有机化学羧酸及其衍生物习题答案
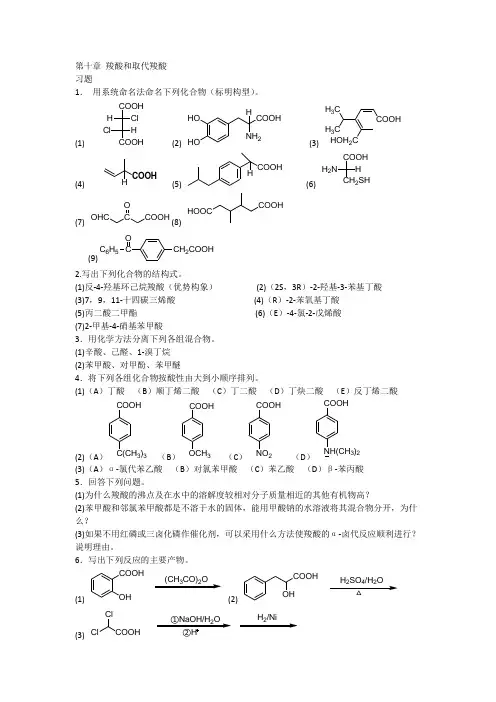
第十章羧酸和取代羧酸习题1.用系统命名法命名下列化合物(标明构型)。
(1){EMBED ChemDraw.Document.6.0 \* MERGEFORMAT |COOHCOOHClHHCl(2)(3)(4) (5) (6)(7) (8) (9)2.写出下列化合物的结构式。
(1)反-4-羟基环己烷羧酸(优势构象)(2)(2S,3R)-2-羟基-3-苯基丁酸(3)7,9,11-十四碳三烯酸(4)(R)-2-苯氧基丁酸(5)丙二酸二甲酯(6)(E)-4-氯-2-戊烯酸(7)2-甲基-4-硝基苯甲酸3.用化学方法分离下列各组混合物。
(1)辛酸、己醛、1-溴丁烷(2)苯甲酸、对甲酚、苯甲醚4.将下列各组化合物按酸性由大到小顺序排列。
(1)(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸(2)(A)(B)(C)(D)(3)(A)α-氯代苯乙酸(B)对氯苯甲酸(C)苯乙酸(D)β-苯丙酸5.回答下列问题。
(1)为什么羧酸的沸点及在水中的溶解度较相对分子质量相近的其他有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?(3)如果不用红磷或三卤化磷作催化剂,可以采用什么方法使羧酸的α-卤代反应顺利进行?说明理由。
6.写出下列反应的主要产物。
(1) (2)(3)(4)(5) (6)(7) (8)(9) (10)7.下列化合物在加热条件下发生什么反应?写出主要产物。
(1)3-苯基-2-羟基丙酸(2)邻羟基苯乙酸(3)2-环戊酮羧酸(4)顺-β(邻羟基苯)丙烯酸(5)丁二酸(6)庚二酸8.用化学方法区别下列各组化合物。
(1)乙醇,乙醛,乙酸(2)水杨酸,2-羟基环己烷羧酸,乙酰水杨酸(3)甲酸,草酸,丙二酸(4)对甲基苯甲酸,对甲氧基苯乙酮,2-乙烯基-1,4-苯二酚9.指出下列反应式中存在的问题。
(1)(2)(3)(4)10.按由快到慢的次序排列下列醇或酸在酸催化下酯化时的速度。
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
羧酸及衍生物

H HOOC
H
chrysanthemic acid (pyrethrin)
二、物理性质(physical properities)
沸 点:
CH3CH2CH2OH CH 3CO OH
2OH
HCOO H
+ H2O
COOH 230℃ COOH
丁二 酸 酐 二 丁 CO 酸 酐 O
KMnO4 H2SO4
O
COOH COOH
P2O5
O
O + H2OFra bibliotek⑷ 酰卤 (acyl halide)的生成:
O R C O OH + Cl S Cl 亚硫酰氯 氯化亚砜 O
R
C
Cl + HCl + SO2
卤化试剂:PCl3, PCl5, SOCl2, PBr3
COOH
A-CH2-COOH
加热 ,碱
CH
ACH3 + CO2
在结构上,两个吸电子基连在同一个碳上的 化合物,热力学上是不稳定的,受热易脱羧。
HOOCCH2COOH
CH3COOH + CO2
当-碳上连有吸电子基团时,羧酸受热易发生脱 羧反应。
O O CH3 C C O H
-CO2
O CH3 C H
合成题:
COOH CH2Br
解:
COOH 1).LiAlH4 2).H3O+
HBr CH2Br
CH2OH
4. 脱羧反应(decarboxylation)
—羧酸失去羧基的反应,即脱去一分子CO2。
第十章 羧酸及其衍生物
+ H OC2H5
18
H
+
O CH3C
18
OC2H5 + H2O
酰氧断裂
12
O CH3C OH
:OH
+H
+
OH CH3C OH 加成
-H2O
HOC2H5
OH CH3 C OH HOC2H5
OH CH3 C OC2H5
: : : : : : : :
质子迁 移
-H+
O CH3 C OC2H5
1
I 羧酸
一,结构 烃基与羧基相连的物质叫羧酸:一元羧酸通式为 RCOOH;羧基( COOH)就是羧酸的官能团 RCOOH;羧基(-COOH)就是羧酸的官能团. 就是羧酸的官能团.
O
ห้องสมุดไป่ตู้
中碳为SP 杂化, OH 中碳为SP2 杂化,氧原子与羰基双键间存 在着P― 共扼.由于共扼, P―л 在着P―л共扼.由于共扼,使羧基中的羰基失去了典 型的羰基的性质(如不与NH OH作用 作用) 型的羰基的性质(如不与NH2OH作用);―OH 氧原 子上的电子云向羰基偏移,这有利于―OH氢的离解 氢的离解. 子上的电子云向羰基偏移,这有利于―OH氢的离解.
14
Br2 / P
(2)芳香环的取代反应 (2)芳香环的取代反应
COOH Br2 FeBr3
COOH
Br
5. 二元羧酸的受热反应
乙 二 酸 HOOCCOOH 丙 二 酸 HOOCCH 2COOH 丁二酸 CH 2 COOH CH 2 COOH 戊 二 酸 CH 2 CH 2COOH CH 2COOH
CH 3 COOH + C 2H 5 OH : 1 1 1 : 10
羧酸及其衍生物
羧酸及其衍生物羧酸及其衍生物Ⅰ 目的要求羧酸是含有羧基(―COOH)的含氧有机化合物,我们平常所说的有机酸就是指的这类化合物。
所谓羧酸衍生物,包括的化合物种类很多,诸如羧酸盐类、酰卤类、酯类(包括内酯、交酯、聚酯等)、酸酐类、酰胺类(包括酰亚胺、内酰胺)等都是羧酸衍生物,有人甚至把腈类也包括在羧酸衍生物的范围之内。
其实,比较常见的而又比较重要的是酰卤、酸酐、酯和酰胺这四类化合物。
羧酸盐与一般无机酸盐在键价类型上没大区别,不作专门介绍。
至于腈类,将放在含氮化合物中加以介绍。
这四类化合物都是羧酸分子中,因酰基转移而产生的衍生物,所以又叫羧酸的酰基衍生物。
羧酸及其衍生物RCOL(L:-OH、-X、-OOCR′、-OR′、-NH2)在许多重要天然产物的构成以及在生物代谢过程中均占有重要地位。
本章将以饱和一元脂肪酸为重点,讨论羧酸及其衍生物的结构和性质。
鉴于乙酰乙酸乙酯和丙二酸二乙酯在有机合成上的重要地位,本章作概括介绍。
希望学生在此基础上,探讨设计合成路线的一般方法。
本章学习的具体要求1、掌握羧酸的结构与性质之间的关系。
2、掌握羧酸衍生物的主要化学性质。
3、了解羧酸衍生物的亲核取代反应机理。
4、掌握羧酸与羧酸衍生物之间相互转变条件。
5、了解卤代酸、羟基酸的特性。
6、掌握乙酰乙酸乙酯和丙二酸二乙酯的制法、性质和在有机合成上的应用。
这也是本章的重点之一。
Ⅱ 学习提要(一)羧酸一、概述羧酸往往有俗名,希望学生有所了解,尽可能记忆一些,脂肪酸的系统命名原则和醛相β α同。
γCH3-CH-CH2-COOH2 14 3 OH 芳香酸命名是把芳环视作取代基。
76羧酸的沸点比分子量相近的其它有机物高,这是由于羧酸能以氢键缔合。
同时,即使在气态时,羧酸也是双分子缔合的,所以羧酸的沸点比分子量相近的醇还要高。
二、羧酸结构和化学性质亲核取代O 还原R-C-C-O-H α-H反应H 脱羧酸性1、酸性?E O O O +?R-C H + R-C R-C E EO-H O OO O NaOH/Na2CO3/ NaHCO3H2O + R-C E R-C EH+ O-Na O-H应用:①鉴别:与酚不同,与非酸性物质不同。
大学有机化学下学期复习题
N-亚硝基化物 油层 丙醇 水相
①HCl ②NaOH
乙醚提取蒸馏
41
(4)
酰化N-甲基苯胺
乙酰氯
水相(NaOH中和)
HCl
油相
乙醚提取
洗涤蒸馏
42
9.完成下列转换
Cl Cl
(1)
NH2 NO2
CH3
NH2 NO2
(2)
NO2
CH3
43
Cl
Cl
(1)
NH2 NO2
Cl
(CH3CO)2O
Cl
Cl HNO3
10%NaOH 水溶液
水层
辛酸盐
加盐酸 调PH至酸性
辛酸
己醛 有机层 和1-溴丁烷 饱和亚硫酸氢钠
有机层 1-溴丁烷
水层
白色固体
水层
白色固体
加盐酸 调PH至酸性
己醛
6
4、将下列化合物按指定性质的活泼程度从小到大排列成序
(1)将下列化合物按醇解反应速率快慢排序: A. 苯甲酰氯 B.丙烯酰氯 C. 乙酰氯
CH3
KMnO4 H+ COOH
CN
CONH2 1) SOCl2 2 ) NH3
CN P2O5
CN HNO3 H2SO4 NO2
Fe HCl
CN
NH2
CN NaNO2 HCl CN CuCN
48
(5)
Cl
CH2CH3
Cl
NH2
(6)
NHCH3 CH3
49
Cl
CH2CH3
Cl
NH2
(5)
KMnO4
36
6. 在一组分子量相近的伯、仲和叔胺中,为何通 常伯胺的沸点最高?
羧酸及其衍生物
乙酰氯,加热后才出现白色沉淀者为氯,无上述现象发生者为乙酸酐 (4)首先在三者中分别
加入容易,不能产生黄色碘仿沉淀者为乙酸;然后把能发生碘仿反应的两者再加入托伦试剂 实 验,能够发生银镜反映者为乙醛,无此现象者为乙醇
答:由强到弱的排列顺序如下 (1) 草酸>丙二酸>氯乙酸>乙酸>苯酚 (2)F3CCOOH> C6H5COOH> CH3COOH >C6H5OH> C2H5OH
(3) CH3CCl2COOH >CH3CHClCOOH >CH2ClCH2COOH >CH3CH2COOH >H2O >C2H5OH 10.4 用化学方法区别下列各组化合物。 (1) 甲酸,乙酸,乙二酸;(2)乙酸丁酯,丁酸乙酯,甲基丙烯甲酯 (2) 乙酰胺,乙酰氯,滤乙烷;(4)乙醇,乙醛,乙酸
Cl C6H6,AlCl3 (C6H5)3COH
(3) 乙 烯、丙 烯
3甲 基 丁酸
CH2
CH2
O2,Ag 250 ℃
CH3CH CH2 HBr
CH2
CH2OCH3 NhomakorabeaCH2CH2
Mg CH3CHCH3 无水 乙 醚 CH3CHMgBr
O
CH3 CH3CHCH2CH2OMgBr
H3+
Br O,H2O
CH3
C6H6,AlCl3
COCH2CH2COOH
C2H5NH2 (过量) C2H5NHCOCH2CH2COONH3C2H5
10.7 写出丙酸乙酯与下列试剂作用的产物
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
. 6H O 2
Ⅱ羧酸衍生物
羧酸分子中的羧基被不同基团取代的产物—羧酸的衍生物。 一、命名
酰氯和酰胺的命名相同,以它所含酰基命名
O O C CH 3 C Cl Cl CH3 C NH2 C NH2 O O
O H C N
CH3
O C H 3 C N H C H 2C H 3
CH3
N,N‘—二甲基甲酰胺(DMF)
O H2 R
'
+
-H R
+
O R C OR
'
H
(4)酰胺的形成
先得到铵盐,将铵盐加热,首先失去一分子水,生成酰胺,继续加热失水成腈。
O R C OH O O ONH
4
+
NH3
R
C
-H 2 O
R
C
NH2
-H 2 O
R
C
N
正好是腈水解的逆反应。 芳香、二元羧酸同样具有上述反应,可生成单酰氯、单酯也可生成二酰氯二酯。
2-丁烯酸
二元羧酸、 选取含有两个羧基的最长碳链,叫某二酸。
COOH H 3 CH 2 C H C HOOCCH COOH
2 CH 2 CH 2 CH 2 COOH
乙基丙二酸
HOOCCH=CHCOOH
已二酸
丁烯二酸 芳香酸:把芳环作为取代基
COOH COOH CH=CH-COOH HOOCH
2C
邻苯二甲酸
三、化学性质 1、酸性 RCOOH可看作 HOH中的H被酰基
R O C
取代的产物。
由于羰基的π 键与羟基氧原子上未共用电子对形成P-π 共轭体系,—OH氧上电子密度因向羰基转移而有所降低,使得—OH中氢氧间电 子密度降低,键强度减弱,以致—OH中的氢以质子形成离解,所以酸性比弱酸 和水强得多。但与强酸相比,羧酸只属于弱酸。
COOH COOH CO OH H 2C COOH Δ HCOOH + CO 2
Δ C H 3CO O H + CO 2
丙二酸的脱羧反应是所有含有β—羧基或羰基的化合物共有反应如:
COOH R HC COOH , R O C C H 2C O O H
烷基丙二酸,β-酮酸
丁二酸及加热至熔点以上,则分子内失水形成环状酸酐(内酐)
O R C O R C O 3 R C O H + P C l3 3R O H + P C l5 R O H + SO C l2 R O C O C O C Cl + H 3P O 3 C l + P O C l3 + H C l C l + SO2 + HC l
如产物是低沸点酰氯,如乙酰氯,可用3法合成,用蒸馏法与亚磷酸分离;如产
第九章 羧酸及其衍生物
C OH
分子中含有羧基 的物质是羧酸,羧基由羰基和羟基组 O 成,但羟基氧原子上的未共用电子对与羰基的π 键能形成P-π 共轭 体系,从而使羟基氧电子密度降低,而羰基碳上电子密度增高。 因此,羧酸中羰基对亲核试剂的活性降低,不能与HCN,H2N-OH 等 进行加成。
O R C OH
O H 2C H 2C H 2C H 2C COOH H 2C COOH Δ B a (O H ) 2 + C O 2 + H 2O
八个碳以上的二元羧酸加热得到的是分子间失水而形成的酸酐; 由此说明,有可能形成环状化合物的条件下,总是比较容易形成五、六元环。 四、羧酸的结构对酸性的影响 与羧酸直接或间接相连的原子或基团,对羧酸的酸性有不同的影响,甲酸在 所有饱和一元羧酸中酸性最强。
O R C O H
如 CH3COOH的α-H 被氯取代,由于氯原子较强的吸电子诱导效应,使得羧基 中的电子密度发生转移,其结果是氢氧间电子密度降低,羧基中的氢更易以质子 的形式电离,所以一氯乙酸比乙酸酸性更强。
α—卤代酸的酸性随卤原子的增加而增加,Cl3CCOOH的酸性几乎与无机酸相当。 诱导效应随距离的增长而迅速减弱,如卤素取代在β 位,则酸性小得多。 卤素的电负性不同,对酸性的影响也不同;F>Cl> Br> I ,所以不同乙酸的酸 性以氟代乙酸为最强. —COOH也为吸电子基,所以对于二元酸,当羧基相距较近时,一个羧基能
O C O H + C l2 日光 C lC H 2 O C OH 日 光 ,C l 2 C l2 C H O C 日 光 ,C l 2 C l3 C OH O C OH
CH3
(2).芳环的取代:—COOH属于间位定位基
COOH B r2 F eB r 3 , Δ Br COOH
5、二元羧酸的受热反应 由于不同位置羧基之间的相互影响不同,有不同的反应。脂肪族二元羧酸的 受热反应产物不同
O
C
R
)、卤素、烷氧基、氨基
置换分别形成酸酐、酰卤、酯或酰氨等羧酸衍生物。 (1).酸酐的形成
R O C O R C O H R C O O H P2O 5 R O C O + H 2O
(2).酰卤的生成: 卤化剂为PX3,PX5,COCl2
(2).酰卤的生成: 卤化剂为PX3,PX5,COCl2
二元羧酸分两步电离,第二步比第一步要难,分别形成酸式盐和中性盐:
COOH NaOH COOH COONa COOH NaOH COONa COONa
草酸氢钠
草酸钠
由于二元羧酸有两个羧基,所以相同碳数的二元羧酸酸性比一元羧酸酸性强些。
2. 羧基中羟基的取代反应
O
羧酸中的—OH可作为一个基团被酸根(
β-苯基丙烯酸(肉桂酸)
α-荼乙酸
环烷羧酸:把环烃看成取代基
二、物理性质 状态 C10以下为液态 气味 C10 以上为蜡状固态
COOH
环已基甲酸
脂肪二元羧酸、芳香酸为结晶固体。 C1~C3具有强烈的酸味和刺激性。 C4-C9具有腐败恶臭、动物汗液和奶油发酸变坏。 的气味是由于含有游离正丁酸的缘故。 水溶性 C10以上挥发性小、无气味。 低级脂肪酸易溶于水,随分子量的增高,水溶 性降低,羧基为亲水基团,与水可形成氢键, 烃基为憎水基,越大越不易溶于水。
物是高沸点酰氯,可用2法合成,可先蒸去 POCl3 ,留下酰氯,如苯甲酰氯 (b.p197℃) ;亚硫酰氯法副产物是气体,两种情况都适用。
(3)酯的生成 在强酸的催化下,羧酸可与醇形成酯,有机酸与醇的酯化是可逆的:
O R C O
' H + R OH
浓 H 2S O 4 R Δ
O C O R
'
+ H 2O
5 (C O O H ) 2 + 2 K M n O + 3 H 2 S O 4 4 K 2SO 4 + 2 M n SO 4 + 1 0 C O 2 + 8 H 2O
草酸可与许多金属生成可溶性的络离子
Fe 2 (C 2 O 4 ) 3
+
3K 2C 2O 4
+
6H 2O
2 K 3 [Fe(C
2O 4)3]
O [O ] H C OH HO C OH O C O 2 + H 2O
2、苯甲酸
苯甲酸和苄醇以酯的形式存在于安息香胶及其它一些树脂中,所以称安息香 酸,无色结晶、微溶于水,可升华。
3、乙二酸 俗名:草酸,常以盐的形式存在于许多植物的细胞壁中,易溶于水,不溶于 有机溶剂。草酸为饱和二元羧酸中酸性最强的,除具有一般羧酸的性质外,还有 还原性,能还原高锰酸钾。
酸酐根据酸的来源命名
O O CH 3 CH 3 C O C C H 3C H 2 O O C O CH3 C O O O
乙酸酐(乙酐)
乙丙酐
邻苯二甲酸酐(苯酐)
酯的命名和酸酐相似,按照形成它的酸和醇叫某酸某酯。
O C H 3C O C H 2C H 3 O C H 3C O C H 2C H 2 C H 2C H 3 O O CH 3 (C H 3 ) 2 C H C H 2 C O C H 2
O O OH R C OH
甲酸与其他饱和酸在结构上的区别在于:H
C
造成酸性差别在于H、R—的电子效应不同,由此可以得出结论:由于烷基的 供电子效应,使得除甲酸外的其他脂肪酸的O—H间电子密度有所增加,从而H 以H+ 形式电离的程度降低。
所以C2以上的饱和一元羧酸的酸性都比甲酸弱。
不同的烷基给电子性的差别不大,因此在饱和一元羧酸中,除甲酸酸性最强 外,其他同系物的电离常数都属同一数量级。
羧酸能以氢键缔合,且两分子羧酸间可形成两个氢键,具有较大的键能,即使在 气态也以双分子缔合,故其沸点高于等分子量的醇。
熔点: 一元、二元羧酸的熔点不是随分子量增加而递增,而是呈锯齿形地变化, 即含偶数碳原子的比相邻奇数碳原子的羧酸熔点高。
熔点与分子的排列有关
在偶碳链中,链端甲基与羧基分别在链的两端,对称性较高,晶格排列 紧密;在奇碳链中,链端甲基与羧基都在链的同一边,对称性低,晶格排列不及 前者紧密。
3
2 RCOONa
+ CO 2 +
H 2O
羧酸的碱金属盐都溶于水,不溶于水的羧酸转变为其碱金属盐后即可溶解, 此性质可用于羧酸与其他不溶于水的中性有机物的分离。 如分离:
COOH CH 3 CH 2 OCH
2 CH 3
有机层 乙醚 乙醚 Na2CO3溶液
苯甲酸
分离
水层 苯甲酸钠
酯化
苯甲酸
由于羧酸的酸性强于酚,所以用NaHCO3可分离羧酸和酚。
+
CH3
C
18
O
C H 2CH 3 +
H 2O
这说明酯化反应中的水是羧酸的烃基和醇的氢形成的,即羧酸发生了酰—氧键 的断裂。 历程: 酸的催化作用是增加羧基碳的亲电性
