有机化学第十章羧酸及其衍生物共23页
大学无机化学 第十章 羧酸及其衍生物
(⒉) 核磁共振(NMR) O R-C -O-H
O R-CH2-C -OH δ=10~13 ppm δ=2~2.7 ppm
920 3200~2500 1400 1725 1320 1200
3200~2500㎝-1为O-H的伸缩振动; 1725cm-1为 C=O伸缩振动; 1400cm-1 1320cm-1 为CH3弯曲振动
甲基为给电子基
不同卤素取代羧酸酸性:
Cl3C-COOH>Cl2CH-COOH>ClCH2-COOH>CH3-COOH
FCH2COOH > ClCH2COOH > BrCH2COOH
>ICH3COOH > CH3COOH Cl Cl
CH3CH2CHCOOH > CH3CHCH2COOH Cl
> CH2CH2CH2COOH > CH3CH2CH2COOH
日常用的肥皂,是高级脂肪酸的钠盐; 食用的油以及许多工业用的油都是属于羧酸的甘油酯。 羧酸也一类非常重要的工业原料,例如化合成纤维 (尼龙、的确良)的重要原料之一就是羧酸。
1.2 羧酸的分类 脂肪酸: CH3COOH 乙酸
芳香酸: C6H5COOH
饱和酸: CH3CH2COOH
苯甲酸
丙酸 丙烯酸 乙酸
O R C OH
P2O5
O O R C O C R + H2O
羧酸之间脱水反应:
同种酸、不同酸和二元酸分子内均可发生脱水反应。
乙酸酐
戊二酸酐
很多二元酸可以直接加热,分子内失水而形成五元或六元 环状的酸酐。
O C OH C OH O
△
邻苯二甲酸酐
O C + H 2O C O O
马来酸酐
分子量较大的羧酸在醋酸酐(作脱水剂)存在下,失水生
有机化学——10羧酸衍生物和脂类

=
R C OH + N2 + H2O
3.霍夫曼降解反应
=
O R C NH2 + Br2
NaOH
R NH2 + NaBr + Na2CO3 + H2O
反应使碳链减少一个碳原子
=
O
O
五、碳酸衍生物
(一)脲(尿素)——碳酸的二元酰胺
1. 弱碱性 不能使石蕊试纸变色, 只能与强酸成盐
= = =
O R C NHOH +
=
R'COOH
O
R C O R'
=
+ H NH OH
O R C NHOH +
= =
R'OH
O
R C NH2 + H NH OH
O R C NHOH + NH3 异羟肟酸
3R C NHOH + FeCl3
=
异羟肟酸铁 (红~紫色)
可用做羧酸及其衍生物的定性检验
=
O
O (R C NHO)3Fe + 3HCl
(四)酯缩合反应
具有α-H的酯在碱的作用下与另一分子酯发生 反应称酯缩合反应或克莱森(Claisen)缩合反应
CH3 O O O O ① C2H5ONa C OC2H5 + H CH2 C O C2H5 CH3 C CH2 C OC2H5 + C2H5OH ②H
=
=
=
(五)还原反应
卤、酸酐和酯还原成伯醇
乙酰乙酸乙酯 β 丁酮酸乙酯
羧酸衍生物比羧酸容易还原。氢化铝锂可将酰
=
O R C O R C
第十章羧酸及其衍生物和取代酸详解演示文稿

第十七页,共53页。
4、 羧酸的受热分解-脱羧反应
羧酸分子脱去CO2的反应叫脱羧反应,根据羧酸结构不同可以得 到不同产物
(1) 一元羧酸
R – COONa NaOH-CaO
共熔
R - H + Na2CO3
羧酸的α位上有强吸电子基团时,容易脱羧
CCl3 – COOH
△
CHCl3 + CO2↑
R'
浓H2SO4
R
O C
O
△
R' + H2O
CH2COOH 浓H2SO4
OH
CH2
CO O
H3O+
CH2COOH OH
第十六页,共53页。
3、 还原
用LiAlH4可以将羧酸还原为醇,该还原剂不影响化合物中的
不饱和键.
O R C OH
LiAlH4
R CH2 OH 伯伯醇醇
H2C CH CH2 COOH LiAlH4 H2C CH CH2 CH2 OH
⑴ 酰氯、酰胺:将相应的“酸”改为酰氯、酰胺即可。例如:
第二十七页,共53页。
⑵ 酸酐
由相应的酸来命名
两分子酸相同:
O CH3 C
O CH3 C
O
乙酸酐
O CH3 CH2 C
O CH3 CH2 C
O
丙酸酐
O C
O
C O
苯甲酸酐
两分子酸不同:
O CH3 C
O
CH3 CH2 C O
乙(酸)丙(酸)酐
第二十八页,共53页。
3、苯甲酸 安息香酸,苯甲酸钠作为防腐剂. 4、乙二酸 草酸,酸性最强的二元酸.具有很强的配位能力.在定量分析中
有机化学-羧酸及其衍生物

O CH3OC
O
H+
COCH3 + 2HOCH2CH2OH -2CH3OH
酯交换
O
O
O HOCH2CH2 OC
O
CH3OC
COCH3
COCH2CH2OH
HOCH2CH2OH
酯交换
O
O
C
C OCH2CH2O n n=80100
( 涤纶 )
16
4、酰胺的反应
酰胺的反应活性更小,需在酸或碱催化下长时间
加热回流才能水解
O
或 其它试剂
R CH
醛
水解反应 醇解反应 胺解反应
还原反应
11
1、酰氯的取代反应
H—OH O
R—C—Cl + H—OR'
H—NH2
O
R—C—OH O
HCl 水解
R—C—OR' + HCl 醇解
O
R—C—NH2 NH4Cl 氨解
(酰氯活性大是个优良的酰基化试剂)
O CH3CCl + CH3CH2CH2OH
RCH2
O CX
O
O
RCH2 C O C R
O RCH2 C OR'CH C
H
有弱酸性
可加成至 饱和
L
可被亲核 试剂取代
L: 离去基团 (Leaving group)
9
一、羧酸衍生物的取代反应
这类反应是羧酸衍生物与羧酸、以及羧酸衍生物 之间的相互转化。
O RCL
HOH
R C OH
RCOOH
OO
O
RC O C R HOR'
R C OR' RCOOH
第十章羧酸第十一章羧酸衍生物
二 羧基中氢的反应
1 酸碱反应 强无机酸 > 羧酸 > 碳酸 > 酚
p Ka
4~5 6.35 10
RCOOH + NaHCO 3 羧酸可以和碳酸氢钠反应
RCOO -Na+ + CO 2 + H2O
ArONa + CO 2 + H2O
ArOH + NaHCO 3 酚不能和碳酸氢钠反应
2 羧酸盐的若干性质
诱导吸电子作用中、
共轭给电子作用小。
诱导吸电子作用小、 共轭给电子作用大。
pka 2.98
pka 4.08
pka 4.57
苯甲酸的pka 4.20
第四节 羧酸的制备 一 氧化法
醇、醛、芳烃、炔、烯、酮(卤仿反应)的氧化
二 羧酸衍生物的水解反应(参见十三章)
O
OO
O
O
R-C-X R-C-O-C-R' R-C-OR' R-C-NH 2
HCOOH pka 3.37
C 6H5-COOH 4.20
CH 3COOH 4.73
(2)空间效应: 利于H+离解的空间结构 酸性强,不利于H+离解的空 间结构酸性弱.
O
OH H O
(3)分子内的氢键也能 使羧酸的酸性增强。
4 芳香羧酸的情况分析
取代基具有吸电子共轭效应时,酸性强弱顺序为: 邻>对>间
*1. 羧酸盐是固体 *2. 羧酸盐的溶解度
钠、钾、銨 盐可溶于水,重金属盐不溶于水。 *3. 羧酸根具有碱性和亲核性
羧酸盐能与活泼卤代烷反应(见下页)
三 羧酸α-H的反应 —— 赫尔 -乌尔哈 -泽林斯基反应
第十章 羧酸及其衍生物

+ H OC2H5
18
H
+
O CH3C
18
OC2H5 + H2O
酰氧断裂
12
O CH3C OH
:OH
+H
+
OH CH3C OH 加成
-H2O
HOC2H5
OH CH3 C OH HOC2H5
OH CH3 C OC2H5
: : : : : : : :
质子迁 移
-H+
O CH3 C OC2H5
1
I 羧酸
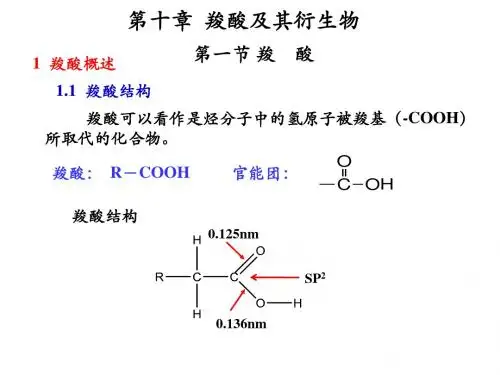
一,结构 烃基与羧基相连的物质叫羧酸:一元羧酸通式为 RCOOH;羧基( COOH)就是羧酸的官能团 RCOOH;羧基(-COOH)就是羧酸的官能团. 就是羧酸的官能团.
O
ห้องสมุดไป่ตู้
中碳为SP 杂化, OH 中碳为SP2 杂化,氧原子与羰基双键间存 在着P― 共扼.由于共扼, P―л 在着P―л共扼.由于共扼,使羧基中的羰基失去了典 型的羰基的性质(如不与NH OH作用 作用) 型的羰基的性质(如不与NH2OH作用);―OH 氧原 子上的电子云向羰基偏移,这有利于―OH氢的离解 氢的离解. 子上的电子云向羰基偏移,这有利于―OH氢的离解.
14
Br2 / P
(2)芳香环的取代反应 (2)芳香环的取代反应
COOH Br2 FeBr3
COOH
Br
5. 二元羧酸的受热反应
乙 二 酸 HOOCCOOH 丙 二 酸 HOOCCH 2COOH 丁二酸 CH 2 COOH CH 2 COOH 戊 二 酸 CH 2 CH 2COOH CH 2COOH
CH 3 COOH + C 2H 5 OH : 1 1 1 : 10
有机化学第十章羧酸
Organic Chemistry
10.2 羧酸的物理性质
Physical Properties of Carboxylic Acids
Xiamen University
Physical Constants of Some Carboxylic Acids
Structure HCOOH OrganicCCHh3eCmOisOtrHy
自然界中的羧酸
OH
COOH
Organic Chemistry
HO
OH
胆酸 (Cholic acid)
H
H
CC
CH3(CH2)7
(CH2)7COOH
油酸 ( Oleic acid )
H C
Xiamen UCniHve3r(sCitHy 2)4
HH
C
C
CH2
H C
(CH2)7COOH
亚油酸 ( Linoleic acid )
Xiamen University
O
RC
R
O
羧酸根的共振结构
O C
O
O Organic Chemistry HC O 1.27A
Xiamen University
1.20A O HC OH 1.34A
Organic Chemistry
10.4 羧酸的制备 Preparation of Carboxylic acids
CH3CH2COOH
FCH2COOH
BrCH2COOH
HOCH2COOH
CH2=CHCOOH
XiamenCU6Hni5vCerOsiOtyH HOOCCOOH
m.p. ( ) 8.4 16.6 -22 35.2 50 80 13
10 羧酸及羧酸衍生物
δ+
C
3
δ' +
C
2
C
1
O
ClCH2CH2COO
CH3CH2COO
上页 下页 返回 退出
3) 取代基诱导效应对酸性的影响
② 对酸性影响举例 例1
Cl2CHCOOH pKa 1.26 ClCH2COOH 2.86 CH3COOH 4.76 CH3CH2COOH 4.86
例2 CH3CHCOOH
上页 下页 返回 退出
(4) 由格氏试剂制备
例:
(CH3)3CBr
NaCN
(CH3)3CCN
(CH3)3CCOOH
而通过格氏试剂可实现这种转变,得到多一个 的羧酸 的羧酸: 而通过格氏试剂可实现这种转变,得到多一个C的羧酸
(CH3)3CBr Mg 干乙
Mg 干乙
(CH3)3CMgBr
CO (1) 2 (2)H3O
有机化学
10 羧酸及其衍生物 (Carboxylic Acids and Derivatives) )
下页 返回 退出
10 羧酸及其衍生物
10.1 羧酸 10.2 羧酸衍生物
上页 下页 返回 退出
10.1 羧 酸
10.1.1 羧酸的结构和命名 10.1.2 羧酸的制法 10.1.3 羧酸的物理性质 10.1.4 羧酸的化学性质 10.1.5 重要的羧酸 10.1.6 羟基酸的化学性质
叔
CH3CH CH3 Br NaCN CH3CH=CH2 + CH3CH CH3 CN
仲
产率不高
上页 下页 返回 退出
(3) 水解法 3)二元腈水解可得到二元羧酸: )二元腈水解可得到二元羧酸: 水解可得到二元羧酸 例: BrCH2CH2CH2Br
第十章 羧酸及其衍生物
第十章羧酸及其衍生物羧酸及其衍生物❖羧酸及其衍生物的结构特征;❖羧酸及其衍生物的物理和化学性质;❖乙酰乙酸乙酯和丙二酸酯的特性及其在有机合成上的应用;❖蜡和油脂,碳酸衍生物重点要求掌握羧酸及其衍生物的化学性质;乙酰乙酸乙酯在有机合成上的应用。
10.1 羧酸10.1.1 羧酸的构造、分类和命名1、羧酸的构造和分类分子中具有羧基的化合物,称为羧酸。
它的通式为 RCOOH。
2、命名由它的来源命名:甲酸最初是由蚂蚁蒸馏得到的,称为蚁酸。
乙酸最初是由食用的醋中得到,称为醋酸。
还有草酸、琥珀酸、苹果酸、柠檬酸。
系统命名:含羧基最长的碳链作为主链,根据主链上碳原子数目称为某酸.编号从羧基开始.3,4-二甲基戊酸3-甲基-2-丁烯酸芳香族羧酸可以作为脂肪酸的芳基取代物命名:羧酸常用希腊字母来标名位次,即与羧基直接相连的碳原子为α,其余位次为β、γ…,距羧基最远的为ω位。
二元酸命名:10.1.2 羧酸的物理性质在室温下10个碳原子以下的饱和一元羧酸是液体。
10个碳原子以上的羧酸为石蜡固体,挥发性很低,无气味。
4~9个碳原子的脂肪酸具有腐败恶臭、动物的汗液和奶油发酸变坏的气味。
饱和一元羧酸的沸点比相对分子质量相似的 醇还要高。
饱和一元羧酸的熔点随分子中碳原子数目的增加呈锯齿状的变化。
低级脂肪酸易溶于水,但随分子量的增高而降低。
甲酸与水通过氢键缔合在固态和液态,羧酸主要以二聚体形式存在。
低级的羧酸,在气相时仍以双分子缔合状态存在。
10.1.3 羧酸的化学性质OOH H HOH O HH HHOCRCOOHOORHO ORHCC2HOR H O HC Cα10.1.3.1 酸性羧酸具有弱酸性,在水溶液中存在着如下平衡:乙酸的离解常数K a 为1.75×10-5 甲酸的K a =2.1×10-4 , p Ka =3.75其他一元酸的K a 在1.1~1.8×10-5之间, p Ka 在4.7~5之间。
[精选]第十章羧酸及其衍生物资料PPT课件
C H3 H H 2 2 S O4 OH3 C
O C OH C H3
MgBr
+O C O
CO 2MgBr H+ H2O
COOH
02.11.2020
Organic Chemistry
13
§13.2 羧酸的制法
四、醇、醛的氧化
[ O ]
O [ O ] O
R O H
RH
R O H
如:
OH
K M n O 4 + H 2 S O 4
羰基的亲核加成,然 后再消除(表现为羟 基的取代)。
02.11.2020
Organic Chemistry
19
§13.4 羧酸的化学性质
一、酸性
1、酸性与成盐
羧酸衍生物
• §13.6 分类命名 • §13.7 制法 • §13.8 物理性质 • §13.9 化学性质 • §13.10 重要的衍生物
02.11.2020
Organic Chemistry
2
§13.1 羧酸的分类和命名
02.11.2020
Organic Chemistry
3
§13.1 羧酸的分类和命名
p-π共轭使羧酸
分子中既不存在
典型羰基,也不
存在典型羟基。
Organic Chemistry
18
§13.4 羧酸的化学性质
O
O C
形 式 上 看 羧 基 是 由 一 个 C和 一 个 O组 H 成
OH 实 质 上 并 非 两 者 的 简 单 组 合
酸性
O
R CCOH
H
-活泼H的反应
羰基的亲核加 成,还原。
H 2C CH COOH
